Перейти к:
Анализ и функциональная значимость белка TRAP1 при глиобластоме
https://doi.org/10.24060/2076-3093-2025-15-2-19-27
Аннотация
Введение. Глиобластома характеризуется высоким уровнем агрессивности и сложными механизмами формирования лекарственной резистентности. Белок 1, ассоциированный с рецептором TNF (TRAP1), задействован в регуляции метаболических процессов и устойчивости опухолевых клеток к апоптозу, однако его роль в глиобластоме остается недостаточно изученной. Материалы и методы. Использовали клеточные линии глиомы T98G и астроциты головного мозга человека (HBA) в качестве контроля. Подавление экспрессии TRAP1 осуществляли методом лентивирусной трансдукции короткой шпилечной РНК (кшРНК). Экзосомы выделяли ультрацентрифугированием из культуральной среды и подтверждали их идентификацию по типичным маркерам (TSG101, CD63 и ALIX). Уровень экспрессии TRAP1 на уровне белка и ключевых гликолитических ферментов анализировали методом вестерн-блот анализа. Оценку жизнеспособности опухолевых клеток проводили с помощью МТТ-теста, уровень апоптоза — с помощью аннексина V-FITC/PI и продукцию АТФ — методом биолюминесцентного анализа. Результаты и обсуждение. Показано, что в клетках T98G TRAP1 сверхэкспрессирован, в том числе и в экзосомах, тогда как в HBA уровень TRAP1 был умеренным или низким. Подавление TRAP1 у T98G приводило к снижению экспрессии гликолитических ферментов, росту уровня апоптоза и уменьшению жизнеспособности опухолевых клеток. Повышенная экспрессия TRAP1 усиливала метаболическое перепрограммирование опухолевых клеток в сторону аэробного гликолиза и снижала синтез АТФ. Экзосомальный TRAP1, вероятно, участвует в межклеточной коммуникации, способствуя адаптации опухоли к стрессовым условиям и формированию проопухолевого микроокружения. Заключение. Результаты исследования подтверждают важность TRAP1 в регуляции метаболического статуса глиобластомы и поддержании ее агрессивного фенотипа. Таргетное подавление TRAP1 может рассматриваться как перспективная стратегия терапии глиобластомы, направленная на снижение жизнеспособности опухолевых клеток и ограничение их метаболической гибкости.
Ключевые слова
Для цитирования:
Гареев И.Ф., Бейлерли О., Хонгли Ж., Румянцев С.А. Анализ и функциональная значимость белка TRAP1 при глиобластоме. Креативная хирургия и онкология. 2025;15(2):115-123. https://doi.org/10.24060/2076-3093-2025-15-2-19-27
For citation:
Gareev I.F., Beylerli O., Hongli Zh., Roumiantsev S.A. Analysis and Functional Significance of TRAP1 in Glioblastoma. Creative surgery and oncology. 2025;15(2):115-123. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-2-19-27
Аббревиатуры
- ALIX — ALG-2-Interacting Protein X
- ATP — Adenosine Triphosphate (аденозинтрифосфат)
- CD63 — Cluster of Differentiation 63 (кластер дифференцировки 63)
- ЦТК — Цикл трикарбоновых кислот (TCA cycle)
- DMEM — Dulbecco’s Modified Eagle Medium (модифицированная среда Дульбекко)
- FBS — Fetal Bovine Serum (фетальная бычья сыворотка)
- FITC — Fluorescein Isothiocyanate (флуоресцеин-изотиоцианат)
- ГБ (GB) — Глиобластома (Glioblastoma)
- HBA — Human Brain Astrocytes (линия астроцитов головного мозга человека)
- HK1/2 — Hexokinase 1/2 (гексокиназа 1/2)
- HSP90 — Heat Shock Protein 90 (белок теплового шока 90-го семейства)
- kшРНК (shRNA) — Короткая шпилечная РНК (short hairpin RNA)
- LDHA — Lactate Dehydrogenase A (лактатдегидрогеназа А)
- MTT — 3- (4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромид (тест для оценки жизнеспособности клеток)
- PBS — Phosphate-Buffered Saline (фосфатно-солевой буфер)
- PFKP — Phosphofructokinase, Platelet (фосфофруктокиназа тромбоцитов)
- PI — Propidium Iodide (пропидий йодид)
- PKM1/2 — Pyruvate Kinase M1/2 (пируваткиназа M1/M2)
- T98G — Линия клеток глиобластомы T98G
- TRAP1 — Tumor Necrosis Factor Receptor-Associated Protein 1 (белок 1, ассоциированный с рецептором TNF)
- TSG101 — Tumor Susceptibility Gene 101 (белок, связанный с геном предрасположенности к опухолям 101)
- ВВ — Внеклеточные везикулы (Extracellular Vesicles)
ВВЕДЕНИЕ
Глиобластома по-прежнему остается одной из наиболее злокачественных опухолей центральной нервной системы (ЦНС), характеризуясь крайне неблагоприятным прогнозом, несмотря на достижения в области диагностики и лечения [1][2]. Успехи в изучении молекулярной природы глиобластомы позволили выявить ряд ключевых сигнальных путей и генетических изменений, однако гетерогенность опухоли, а также сложность ее микроокружения затрудняют разработку универсальных и высокоэффективных терапевтических стратегий [3][4]. Ключевым аспектом прогрессирования глиобластомы является способность опухолевых клеток к быстрому метаболическому переориентированию и адаптации к изменяющимся условиям среды, в частности к гипоксии, характерной для обширных некротических зон внутри самой опухоли [5–7]. Такое перепрограммирование метаболизма обеспечивает интенсивный рост и пролиферацию клеток, а также нередко ведет к формированию лекарственной устойчивости. В контексте этих процессов возрастающий интерес вызывает семейство шаперонов HSP90, к которому относится белок 1, ассоциированный с рецептором TNF (TRAP1) [8–10]. TRAP1 изначально рассматривался как регулятор митохондриального гомеостаза и апоптоза, однако последующие исследования показали, что он обладает гораздо более широкими функциями, включая участие в процессах трансдукции сигнала, поддержании энергетического баланса, а также формировании резистентности опухолевых клеток к химио- и лучевой терапии [11][12]. Многие работы указывают на то, что TRAP1 может переключать метаболизм опухолевых клеток с окислительного фосфорилирования на аэробный гликолиз, давая опухоли дополнительные преимущества в условиях гипоксии и ограниченных энергетических ресурсов [13][14]. Особенно интересно, что данная перестройка метаболического статуса часто сопровождается повышением устойчивости к апоптотическим сигналам, что еще более усугубляет проблему лечения глиобластомы [11].
Экзосомы являются наиболее широко изученной группой среди двух основных подгрупп (экзосомы и микровезикулы) внеклеточных везикул (ВВ), высвобождаемых из клеток млекопитающих. Экзосомы возникают из мембран мультивезикулярных телец (МВТ) и имеют чашеобразную морфологию под электронным микроскопом с диаметром от 50 до 150 нм. Экзосомы широко изучались на предмет их роли во внутриклеточной коммуникации, особенно во время развития и прогрессирования опухоли. Ассоциированные с экзосомами РНК, некодирующие РНК, белки, ДНК и даже метаболиты могут изменять судьбу клеток-реципиентов посредством аутокринной и паракринной сигнализации. Доставляемые опухолевыми экзосомами биологические компоненты взаимодействуют со стромальными клетками в микроокружении опухоли, модулируют прогрессирование опухоли, ангиогенез, метастазирование и уклонение от иммунного ответа. Измененный метаболизм клеток является одним из признаков злокачественных новообразований, в том числе глиобластома. Экзогенные экзосомы могут вызывать метаболическое перепрограммирование и тем самым поддерживать рост опухоли. Экзосомальный TRAP1, модулирующий опухолевый метаболизм, представляет интерес как потенциальная терапевтическая мишень для изучения его роли в онкогенезе глиобластомы, а также для улучшения диагностики и терапии. Более того, повышенное содержание TRAP1 в экзосомах может служить маркером прогрессирования глиобластомы и коррелировать с неблагоприятным клиническим исходом. В этой связи блокирование TRAP1 или воздействие на механизмы экзосомального транспорта могут стать перспективными направлениями в создании новых противоопухолевых препаратов.
Настоящее исследование нацелено на углубленный анализ роли TRAP1 в метаболическом перепрограммировании клеток глиобластомы и изучение вклада экзосомального TRAP1 в агрессивность опухоли. Выявление ключевых молекулярных взаимодействий, лежащих в основе метаболической пластичности глиобластомы, может способствовать разработке новых методов терапии, направленных на снижение резистентности опухоли к лечению, а также на подавление межклеточных коммуникационных механизмов, способствующих прогрессированию глиобластомы.
МАТЕРИАЛЫ И МЕТОДЫ
Культивирование клеток
Клеточная линия глиом T98G и клеточная линия астроцитов головного мозга человека (HBA) были получены из Китайской национальной инфраструктуры ресурсов клеточных линий (http://www.cellresource.cn/, Китай). Клеточные линии хранили в Модифицированной среде Орла Дульбекко (DMEM) с высоким содержанием глюкозы, дополненной 10 % фетальной бычьей сывороткой (FBS) и 100 ЕД/мл пенициллина или 0,1 мг/мл стрептомицина, а также было подтверждено отсутствие контаминации микоплазмой. Клетки хранили во влажном инкубаторе, содержащем 5 % атмосферу CO2, при температуре 37 °C в колбе для культивирования клеток, стандартной для адгезивных клеток. Клетки обычно субкультивировали при достижении 80 %-го слияния с использованием 0,25 %-го раствора трипсина-ЭДТА. Образование сфероидов опухоли наблюдалось в течение 4 дней для T98G. Формирование опухолевых сфероидов ежедневно подтверждали визуально с помощью тринокулярного обратного микроскопа Optika XDS-2, оснащенного камерой ISH500, а их средние диаметры анализировали с помощью программного обеспечения «ImageJ версии 1.53.e».
Изоляция экзосом из клеток и их идентификация
Ультрацентрифугирование является «золотым стандартом» выделения экзосом из клеток. Основное преимущество этого современного метода заключается в том, что он производит высокообогащенные фракции экзосом, а также позволяет собирать дополнительные фракции ВВ, а затем супернатант, не содержащий экзосомы, который образуется после высокоскоростного отжима. Первые шаги предназначены для лизиса клеток и удаления мертвых клеток их остатков путем последовательного центрифугирования с возрастающей скоростью. На каждом из этих этапов осадок выбрасывают, а надосадочную жидкость используют на следующем этапе. Конечный супернатант затем подвергают ультрацентрифугированию при 100 000 × g для осаждения небольших везикул, соответствующих экзосомам. Осадок промывают большим объемом натрий-фосфатного буфера (PBS) для удаления примесей белков и центрифугируют последний раз на той же высокой скорости. Основная часть экзосом, полученных из T98G или HBA, имела размеры около 100 нм и морфологические особенности сферических, двухслойных, связанных с мембраной экзосом, что соответствует морфологическим характеристикам экзосом.
Экстракция белка из экзосом
Набор Total Exosome RNA & Protein Isolation Kit (Invitrogen), номер каталога 4478545, для экстракции тотальной РНК и белка из экзосом предназначен для выделения белков из одного обогащенного препарата экзосом. Процедура экстракция белка TRAP1 из экзосом, полученных из клеточной линии глиомы T98G или HBA, была проведена согласно инструкции Total Exosome RNA & Protein Isolation Kit (Invitrogen).
Анализ жизнеспособности клеток
Посев клеточной линии глиомы T98G подсчитывали через 2, 3 и 4 дня под инвертированным фазово-контрастным микроскопом. Для анализа 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромид (МТТ)-теста в каждую лунку добавляли реагент МТТ в дозе 5 мг/мл (Roche Diagnostics, Шанхай, Китай) и дополнительно инкубировали в течение 2 ч при 37 °C. Супернатант удаляли, и в лунки добавляли 200 мкл 0,1 % DMSO для растворения фиолетовых кристаллов формазана. Количественную оценку проводили путем измерения поглощения при 540 нм с помощью просвечивающей электронной микроскопии. Результаты представлены как средние значения из трех независимых экспериментов, проведенных в трех повторах.
Анализ гибели клеток с помощью аннексина V-FITC/PI
Набор для определения апоптоза клеток аннексин V-флуоресцеин-5-изотиоцианат (FITC) (5 мкл) и пропидий йодид (PI) (5 мкл) (KeyGen Biotech, Китай) был использован для измерения апоптоза клеточной линии глиом T98G. Опухолевые клетки с плотностью 3×10⁵ клеток были высеяны на 6-луночные планшеты в течение 24 ч. Как плавающие, так и адгезивные клетки собирали и дважды промывали холодным PBS. Затем клетки ресуспендировали в 500 мкл связывающего буфера и инкубировали с 5 мкл Annexin V-FITC и 5 мкл PI в течение 15 мин при комнатной температуре в темноте. Клетки анализировали с помощью проточной цитометрии (BD Biosciences, Сан-Хосе, Калифорния, США) и скорость апоптоза клеток анализировали с помощью пакета програмного обеспечения FLOWJO для анализа данных проточной цитометрии (v10; BD Biosciences).
АТФ-мониторинг
АТФ определяли с помощью набора ATP Bioluminescence Assay Kit HS II от компании Roshe в соответствии с инструкциями производителя и нормализовали уровень АТФ на микрограмм белка.
Вестерн-блот анализ
Для проведения вестерн-блот анализа использовали следующие антитела: 1) β-актин (1:1000; Zhongshan, Пекин, Китай); 2) первичное мышиное анти-TRAP1 (1:1000; OriGene Technologies Inc., Роквилл, Мэриленд, США), антитело против гена предрасположенности к опухолям 101 (англ. tumor susceptibility gene 101, TSG101) [ EPR7130 (B)] (1:1000); ab125011, Abcam), антитело против белка, взаимодействующее с ALG-2 (связанный с апоптозом ген 2) X (англ. ALG-2 (apoptosis-linked gene 2)-interacting protein X, ALIX)) [ EPR23653–32] (1:1000; ab275377, Abcam), антитело против CD63 [ EPR5702] (1:1000; ab134045, Abcam), моноклональные антитела к гексокиназе I (C35C4) кролика (1:1000; #2024, Cell Signaling Technology), кроличьи mAb к гексокиназе II (C64G5) (1:1000; #2867, Cell Signaling Technology), PKM1 и PKM2 (C103A3) кроличьи mAb (1: 1000; #3190, Cell Signaling Technology), PKM2 (D78A4) Кроличьи mAb XP® (1:1000; # 4053S, Cell Signaling Technology), кроличьи mAb LDHA (C4B5) (1:1000; #3582, Cell Signaling Technology), моноклональные антитела кролика фосфофруктокиназа, тромбоциты (англ. phosphofructokinase, platelet, PFKP) (D4B2) (1:1000; #8164, Cell Signaling Technology), кроличьи моноклональные антитела к пируватдегидрогеназе (C54G1) (1:1000; #3205, Cell Signaling Technology) и β-актин (1:1000; Zhongshan, Пекин, Китай). Количественную оценку полос вестерн-блот анализа проводили с использованием программного обеспечения Odyssey v1.2 (Gene Company Limited, Гонконг, Китай) путем измерения интенсивности полосы для каждой группы и нормализации ее по β-актину в качестве внутреннего контроля.
Лентивирусная трансдукция
Стабильное снижение экспрессии TRAP1 осуществляли с помощью лентивирусных частиц (pGFP-C-shLenti), содержащих гены, кодирующие короткую шпилечную РНК (кшРНК), нацеленные на TRAP1 (#1: 5′-CGACATGAAACCGTCCATGTT-3′; #2: 5′-AAACATGAGTTCCAGGCCGAG-3′) (GenePharma Co., Шанхай, Китай). Трансдукцию лентивирусных частиц проводили с клетками в среде, содержащей 8 мкг/мл полибрена (Solarbio). Через 18 часов эффективность трансдукции проверяли методом проточной цитометрии. Трансдуцированные клетки культивировали в среде, свободной от лентивирусных частиц, в течение еще 72 часов, а затем использовали 1 мкг/мл пуромицина (Solarbio) для отбора клонов со стабильной экспрессией кшРНК. Вестерн-блот использовали для подтверждения снижения экспрессии белка TRAP1.
Статистический анализ
Статистический анализ проводился с использованием программного обеспечения SPSS версии 22.0 и различных пакетов программного обеспечения R (версия v.3.6.1). Графики были построены с использованием программного обеспечения GraphPad Prism версии 8.0. При необходимости применяли t-критерий Стьюдента, ANOVA, анализ хи-квадрат или критерий Манна — Уитни. Вероятность p < 0,05 (*) или p < 0,001 (**) считалась статистически значимой.
РЕЗУЛЬТАТЫ
Изменение уровня экспрессии TRAP1 на уровне белка при глиобластоме
Чтобы изучить взаимосвязь между экспрессией эндогенного (клеточного) TRAP1 и экзосомальным TRAP1 на уровне белка, мы использовали клеточную линию глиомы T98G и HBA как негативный контроль с помощью вестерн-блот анализа. Стабильное снижение экспрессии TRAP1 осуществляли с помощью лентивирусных частиц, содержащих гены, кодирующие кшРНК, нацеленные на TRAP1 (кшРНК TRAP1). Экзосомы были очищены из супернатанта клеточной культуры T98G для наблюдения за морфологией с помощью трансмиссионной электронной микроскопии. Кроме того, вестерн-блот анализ был проведен для выявления экспрессии типичных поверхностных маркеров экзосом (кластер дифференцировки 63 (CD63), ALIX и TSG101) и выявления экспрессии TRAP1 на уровне белка. Результаты продемонстрировали, что в клеточной линии HBA (негативный контроль) TRAP1 имел умеренный уровень экспрессии, а экзосомы — cниженный уровень экспрессии TRAP1. Более того, применение кшTRAP1 по отношению к клеточной линии T98G продемонстрировало снижение экспрессии TRAP1 в клетках. Кроме того, экзосомы, изолированные из клеточной линии T98G, также содержали низкий уровень экспрессии TRAP1 после трансфекции кшTRAP1 (рис. 1). Данные результаты показывают, что нормальные клетки HBA демонстрируют умеренный уровень экспрессии или его практическое отсутствие в выделяемых ими экзосомах. Тем не менее использование кшTRAP1 практически полностью инактивирует TRAP1 как в опухолевых клетках, так и в выделяемых ими экзосомах. Это говорит о том, что TRAP1 сверхэкспрессирован.
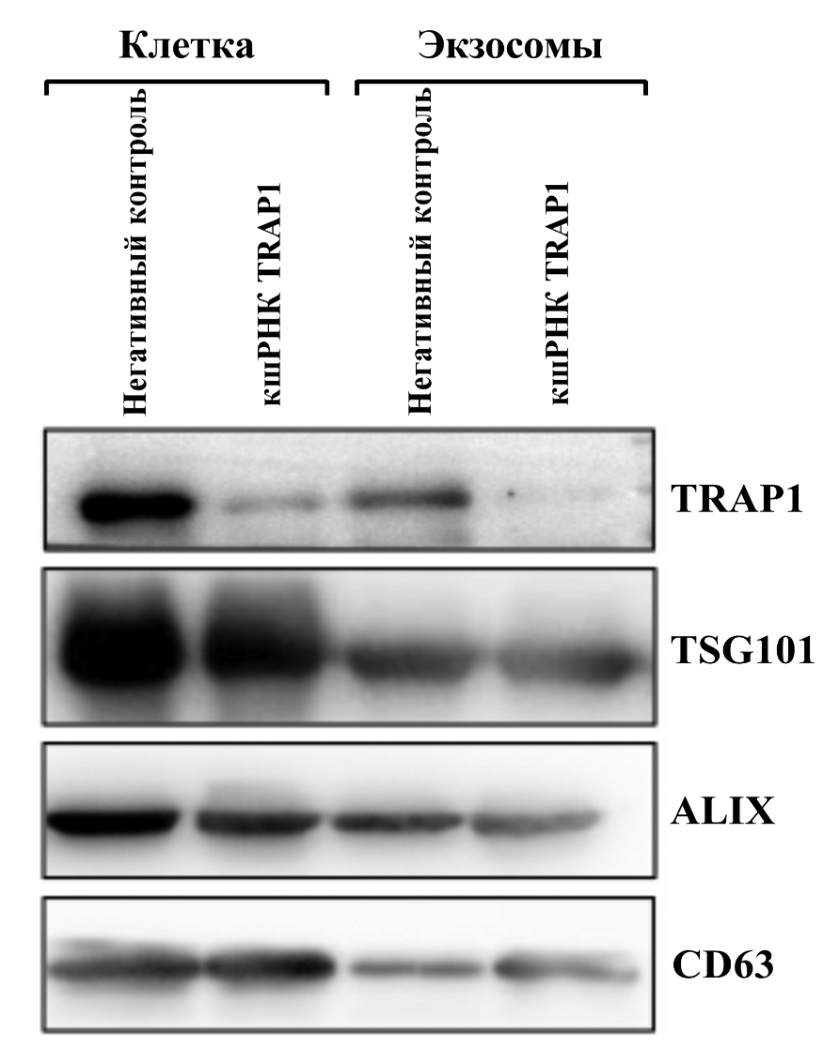
Рисунок 1. Вестерн-блот анализ изучения экспрессии эндогенного (клеточное) и экзосомального TRAP1 на уровне белка. Короткая шпилечная РНК (кшРНК), нацеленная на TRAP1, использовалась в клеточной культуре T98G как исследуемая группа; клеточная культура HBA использовалась как негативный контроль
Figure 1. Western blot analysis of endogenous (cellular) and exosomal TRAP1 protein expression. Short hairpin RNA (shRNA) targeting TRAP1 was used in T98G cell culture as the experimental group; HBA cell culture served as a negative control.
TRAP1 как потенциальный ключевой регулятор метаболического перепрограммирования при глиобластоме
Чтобы исследовать функцию экзосом с высокой экспрессией белка TRAP1, мы провели результаты вестерн-блот анализа для выбранных гликолитических ферментов. Экспрессия гексокиназы 1 (HK1/2), М1/2 пируваткиназы (PKM1/2), лактатдегидрогеназы А (ЛДГА), фосфофруктокиназы тромбоцитов (PFKP) и пируватдегидрогеназы в пути гликолиза была обнаружена с помощью вестерн-блот анализа (рис. 2). Результаты показали, что высокая экспрессия TRAP1 способствует экспрессии этих гликолитических ферментов, тогда как снижение экспрессии TRAP1 с помощью кшРНК TRAP1 снижает их экспрессию. Обработка клеток экзосомами с высокой экспрессией TRAP1 повышала экспрессию этих гликолитических ферментов (рис. 2).
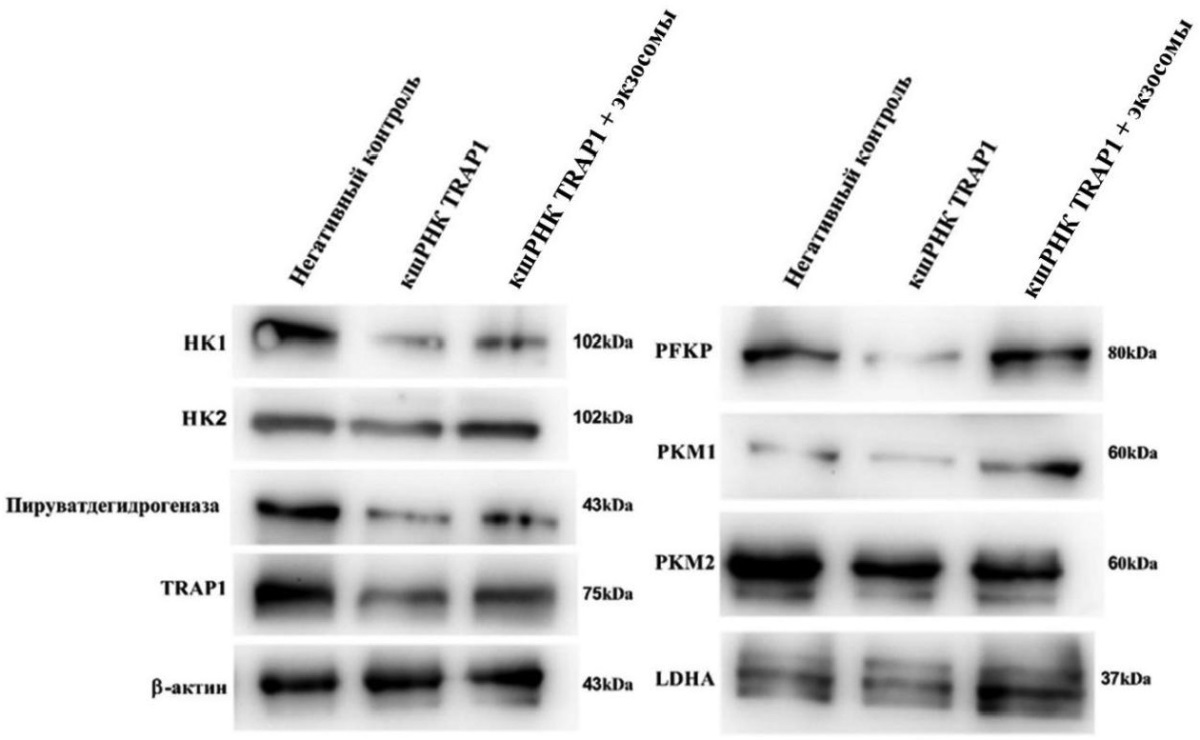
Рисунок 2. Вестерн-блот анализ изучения изменения экспрессии TRAP1 на уровне белка и гликолитических ферментов. Короткая шпилечная РНК (кшРНК), нацеленная на TRAP1, использовалась в клеточной культуре T98G как исследуемая группа, клеточная культура HBA использовалась как негативный контроль, в которой белок TRAP1 не экспрессируется или уровень экспрессии в норме
Figure 2. Western blot analysis of TRAP1 and glycolytic enzyme expression changes. TRAP1-targeting shRNA was applied to T98G cell culture as the experimental group; HBA cells were used as a negative control, showing normal or no TRAP1 expression
Следовательно, высокая экспрессия TRAP1 способствует гликолизу. Чтобы выяснить, входит ли пируват в результате гликолиза непосредственно в цикл трикарбоновых кислот (ЦТК) или катализируется лактатдегидрогеназой с образованием молочной кислоты, мы измерили АТФ, вырабатываемый этими клетками (рис. 3).
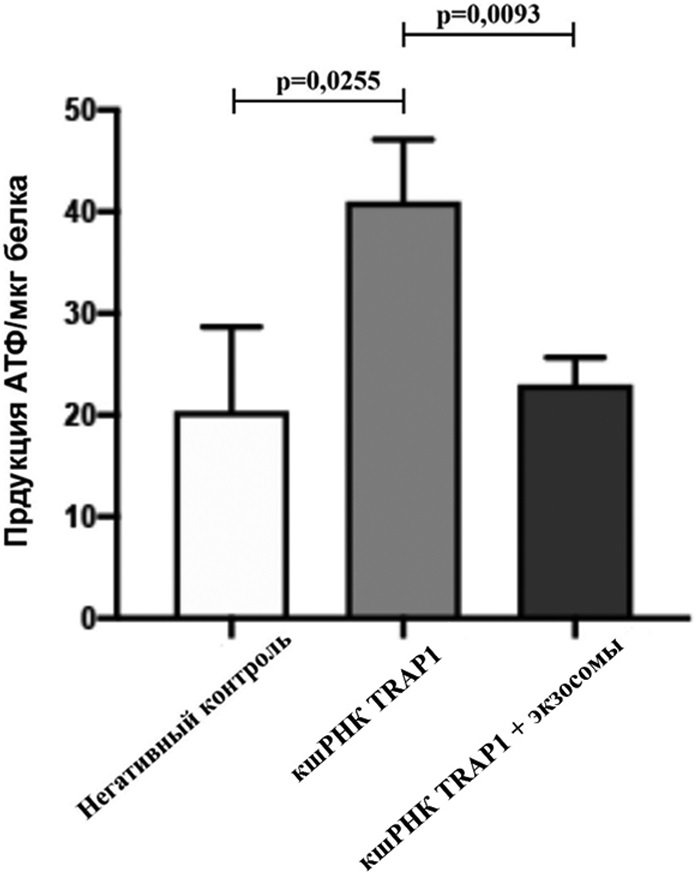
Рисунок 3. Продукция АТФ из клеток
Figure 3. ATP production in cells
Мы обнаружили, что высвобождение АТФ уменьшалось в клетках глиомы с высокой экспрессией TRAP1 и увеличивалось после снижения экспрессии TRAP1, а обработка клеток экзосомами с высокой экспрессией TRAP1 также снижала высвобождение АТФ. Таким образом, TRAP1 усиливает пути гликолиза в клетках глиобластомы.
Ингибирование TRAP1 и анализ жизнеспособности опухолевых клеток
С помощью MTT-анализа мы провели оценку влияния экспрессии эндогенного (клеточного) TRAP1 на жизнеспособность клеточной линии глиом T98G в течение 12, 24, 36 и 48 часов. Было выяснено, что по сравнению с HBA (негативный контроль) трансфекция клеток T98G кшРНК TRAP1 привела к значительному снижению жизнеспособности опухолевых клеток в районе 36 и 48 часов (рис. 4 А). Более того, понижение экспрессии TRAP1 в клетках T98G коррелировало с усилением апоптоза (рис. 4 Б). Мы считаем, что нарушение регуляции экспрессии TRAP1 является отличительной чертой глиобластомы, включая устойчивость опухолевых клеток к гибели и перепрогррамирование энергетического метаболизма. Это указывает на то, что возможно и эффективно регулировать развитие и прогрессирование глиобластомы путем ингибирования TRAP1.
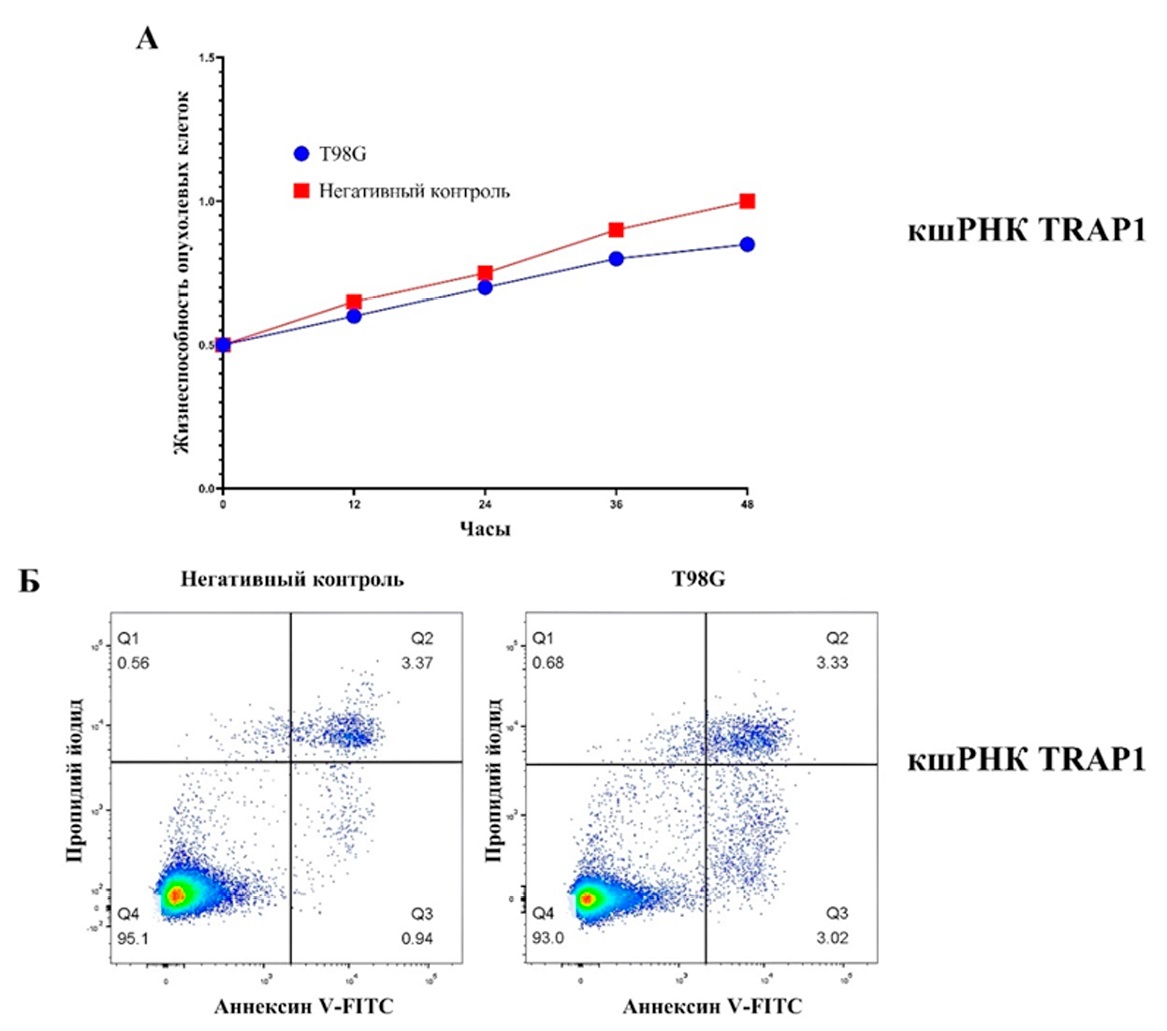
Рисунок 4. Ингибирование TRAP1 на уровне транскрипции и анализ жизнеспособности клеточной линии глиомы T98G (А и Б)
Figure 4. Transcriptional inhibition of TRAP1 and viability analysis in T98G glioma cell lines (A and B)
ОБСУЖДЕНИЕ
Полученные нами данные подтверждают ключевую роль белка TRAP1 в регуляции метаболических процессов и устойчивости клеток глиобластомы к индуцированному апоптозу. Во-первых, мы продемонстрировали, что в клеточной линии глиом T98G TRAP1 обладает выраженной сверхэкспрессией по сравнению с HBA, что согласуется с ранее опубликованными результатами, указывающими на тесную связь между высоким уровнем TRAP1 и агрессивным фенотипом опухоли [11][12]. Во-вторых, обнаружение TRAP1 в составе экзосом, выделяемых T98G, указывает на возможную вовлеченность этого белка в межклеточную коммуникацию, которая, согласно ряду работ, играет решающую роль в метаболической перестройке опухолевых клеток и их взаимодействии со стромальными элементами микроокружения [15–17].
Высокий уровень TRAP1 в сочетании с повышенной экспрессией гликолитических ферментов, таких как HK1/2, PKM1/2, LDHA и PFKP, и сниженным синтезом АТФ демонстрирует, что глиобластома активно переключается на аэробный гликолиз (эффект Варбурга), что обеспечивает быстрый рост и пролиферацию, а также формирует условия для развития лекарственной устойчивости [5][6][13][14]. При этом подавление экспрессии TRAP1 методами генетического нокдауна приводило к снижению жизнеспособности опухолевых клеток и к возрастанию уровня апоптоза, что отражает высокую зависимость глиобластомы от этого шаперона для поддержания энергетического баланса и выживания [7][11]. Данные результаты согласуются с утверждением, что TRAP1 способен регулировать митохондриальные функции и метаболические пути, влияя на баланс между окислительным фосфорилированием и гликолизом [8–10][12].
Присутствие TRAP1 в экзосомах согласуется с современными представлениями о том, что ВВ активно вовлечены в формирование опухолевого микроокружения и могут транспортировать широкий спектр белков, микроРНК и других сигнальных молекул [15][16][18]. Подобный перенос биоматериала через экзосомы способен усиливать проопухолевые сигналы и способствовать инвазии, ангиогенезу и развитию резистентности клеток к терапии [17][19]. Более того, ряд современных исследований подчеркивает растущую значимость экзосом в контексте таргетной терапии глиобластомы, включая использование ингибиторов Hsp90-семейства и подавление передачи различных метаболических факторов [20][21].
Наши данные свидетельствуют, что TRAP1 может быть одной из ключевых молекул в этих процессах, поскольку он непосредственно задействован в поддержании митохондриального гомеостаза и регуляции энергетического метаболизма [22–24]. Особо стоит отметить, что перекрестная регуляция TRAP1 и гликолитических ферментов не только формирует «быстрый» способ получения энергии в условиях гипоксии, но и обеспечивает опухолевым клеткам дополнительные строительные блоки для синтеза нуклеотидов, белков и липидов, необходимых для их активного размножения [13, 14]. Это объясняет, почему нарушение экспрессии TRAP1 может приводить к быстрому подавлению роста опухолевых клеток и усилению проапоптотических сигналов. С другой стороны, сверхэкспрессия TRAP1, вероятно, способствует поддержанию клеточного гомеостаза в условиях терапевтического воздействия, что может объяснять возникновение резистентности к химио- и лучевой терапии [11][25]. Современные работы подчеркивают, что модуляция активности TRAP1 способна влиять на ряд сигнальных каскадов, формирующих устойчивость опухоли и ее способность к быстрому метаболическому переключению [26]. Наконец, учитывая, что одна из возможных стратегий борьбы с глиобластомой — это подавление метаболических путей опухоли, блокирование функции TRAP1 или снижение его уровня экспрессии может рассматриваться как потенциально перспективный подход к терапии [5][23]. В ряде экспериментальных исследований показано, что ингибиторы Hsp90-семейства, а также вмешательства, влияющие на биогенез экзосом, способны снижать опухолевую агрессивность и уменьшать риск метастазирования ряда опухолей [15][16][18][24]. С учетом полученных нами результатов воздействие на активность TRAP1 может сочетаться с существующими методами лечения, повышая их эффективность за счет нарушения метаболической адаптации и межклеточной коммуникации [27][28].
Таким образом, результаты данного исследования подтверждают информацию о центральной роли белка TRAP1 в метаболическом перепрограммировании и устойчивости клеток глиобластомы. Обнаруженный нами факт участия TRAP1 в составе экзосом указывает на дополнительные механизмы поддержания про-опухолевого фенотипа, включающие межклеточный транспорт шаперона и модуляцию микроокружения. Углубленное понимание этих процессов может способствовать разработке новых таргетных препаратов, направленных на подавление TRAP1 и блокировку ключевых этапов межклеточной коммуникации в глиобластоме.
ЗАКЛЮЧЕНИЕ
Проведенное исследование демонстрирует, что белок TRAP1 играет значимую роль в развитии и прогрессировании глиобластомы за счет регуляции метаболического перепрограммирования и поддержания выживаемости опухолевых клеток. Сверхэкспрессия TRAP1 в клетках глиомы T98G сопровождается повышением уровня гликолитических ферментов, снижением синтеза АТФ и, как следствие, усилением «гликолитического» фенотипа. Подавление экспрессии TRAP1 с помощью кшРНК приводит к снижению выживаемости опухолевых клеток и активации апоптоза, что подтверждает важность данной мишени для роста и сохранения метаболического статуса глиобластомы. Дополнительно выявлено, что TRAP1 присутствует в экзосомах, что дает основания полагать, что экзосомальный TRAP1 вовлечен в межклеточную коммуникацию и может способствовать опухолевому метаболическому перепрограммированию в микроокружении. В нашем исследовании есть некоторые ограничения. В нашем будущем исследовании мы подтвердим эти результаты с помощью экспериментальных методов на животных моделях, других линиях клеток человека и тканях/жидкостях. Все полученные результаты указывают на потенциальную терапевтическую ценность ингибирования TRAP1 как стратегии борьбы с глиобластомой, позволяющей существенно снизить ее агрессивность и повысить эффективность существующих методов лечения. В дальнейшем изучение механизмов, посредством которых экзосомальный TRAP1 влияет на клетки-реципиенты, а также разработка специфических ингибиторов TRAP1 могут открыть новые подходы к диагностике и терапии данного заболевания.
Список литературы
1. Bush N.A., Chang S.M., Berger M.S. Current and future strategies for treatment of glioma. Neurosurg Rev. 2017;40(1):1–14. DOI: 10.1007/s10143-016-0709-8
2. Lim M., Xia Y., Bettegowda C., Weller M. Current state of immunotherapy for glioblastoma. Nat Rev Clin Oncol. 2018;15(7):422–42. DOI: 10.1038/s41571-018-0003-5
3. Brennan C.W., Verhaak R.G., McKenna A., Campos B., Noushmehr H., Salama S.R., et al. The somatic genomic landscape of glioblastoma. Cell. 2013;155(2):462–77. DOI: 10.1016/j.cell.2013.09.034
4. Tan A.C., Ashley D.M., López G.Y., Malinzak M., Friedman H.S., Khasraw M. Management of glioblastoma: state of the art and future directions. CA Cancer J Clin. 2020;70(4):299–312. DOI: 10.3322/caac.21613
5. Yilmaz S., Cizmecioglu O. PI3K signaling at the crossroads of lipid metabolism and cancer. Adv Exp Med Biol. 2025;1479:139–64. DOI: 10.1007/5584_2024_832
6. Chinopoulos C. Mitochondrial consumption of cytosolic ATP: not so fast. FEBS Lett. 2011;585(9):1255–9. DOI: 10.1016/j.febslet.2011.04.004
7. Wang S.F., Tseng L.M., Lee H.C. Role of mitochondrial alterations in human cancer progression and cancer immunity. J Biomed Sci. 2023;30(1):61. DOI: 10.1186/s12929-023-00956-w
8. Altieri D.C. Survivin and IAP proteins in cell-death mechanisms. Biochem J. 2010;430(2):199–205. DOI: 10.1042/BJ20100814
9. Hoter A., El-Sabban M.E., Naim H.Y. The HSP90 Family: structure, regulation, function, and implications in health and disease. Int J Mol Sci. 2018;19(9):2560. DOI: 10.3390/ijms19092560
10. Ramkumar B., Dharaskar S.P., Mounika G., Paithankar K., Sreedhar A.S. Mitochondrial chaperone, TRAP1 as a potential pharmacological target to combat cancer metabolism. Mitochondrion. 2020;50:42– 50. DOI: 10.1016/j.mito.2019.09.011.
11. Chae Y.C., Angelin A., Lisanti S., Kossenkov A.V., Speicher K.D., Wang H., et al. Landscape of the mitochondrial Hsp90 metabolome in tumours. Nat Commun. 2013;4:2139. DOI: 10.1038/ncomms3139
12. Masgras I., Sanchez-Martin C., Colombo G., Rasola A. The Chaperone TRAP1 as a modulator of the mitochondrial adaptations in cancer cells. Front Oncol. 2017;7:58. DOI: 10.3389/fonc.2017.00058
13. Matassa D.S., Agliarulo I., Avolio R., Landriscina M., Esposito F. TRAP1 Regulation of cancer metabolism: dual role as oncogene or tumor suppressor. Genes (Basel). 2018;9(4):195 DOI: 10.3390/genes9040195
14. Wengert L.A., Backe S.J., Bourboulia D., Mollapour M., Woodford M.R. TRAP1 chaperones the metabolic switch in cancer. Biomolecules. 2022;12(6):786. DOI: 10.3390/biom12060786
15. Kalluri R., McAndrews K.M. The role of extracellular vesicles in cancer. Cell. 2023;186(8):1610–26. DOI: 10.1016/j.cell.2023.03.010
16. Whiteside T.L. Exosome and mesenchymal stem cell cross-talk in the tumor microenvironment. Semin Immunol. 2018;35:69–79. DOI: 10.1016/j.smim.2017.12.003
17. Akers J.C., Gonda D., Kim R., Carter B.S., Chen C.C. Biogenesis of extracellular vesicles (EV): exosomes, microvesicles, retrovirus-like vesicles, and apoptotic bodies. J Neurooncol. 2013;113(1):1–11. DOI: 10.1007/s11060-013-1084-8
18. Kalluri R., LeBleu V.S. The biology, function, and biomedical applications of exosomes. Science. 2020;367(6478):eaau6977. DOI: 10.1126/science.aau6977
19. Fridman E.S., Ginini L., Gil Z. The role of extracellular vesicles in metabolic reprogramming of the tumor microenvironment. Cells. 2022;11(9):1433. DOI: 10.3390/cells11091433
20. Yang E., Wang X., Gong Z., Yu M., Wu H., Zhang D. Exosomemediated metabolic reprogramming: the emerging role in tumor microenvironment remodeling and its influence on cancer progression. Signal Transduct Target Ther. 2020;5(1):242. DOI: 10.1038/s41392-020-00359-5
21. van Ommeren R., Staudt M.D., Xu H., Hebb M.O. Advances in HSP27 and HSP90-targeting strategies for glioblastoma. J Neurooncol. 2016;127(2):209–19. DOI: 10.1007/s11060-016-2070-8
22. Li X., Jing Z., Li X., Liu L., Xiao X., Zhong Y., et al. The role of exosomes in cancer-related programmed cell death. Immunol Rev. 2024;321(1):169–80. DOI: 10.1111/imr.13286
23. Matassa D.S., Amoroso M.R., Lu H., Avolio R., Arzeni D., Procaccini C., et al. Oxidative metabolism drives inflammation-induced platinum resistance in human ovarian cancer. Cell Death Differ. 2016;23(9):1542–54. DOI: 10.1038/cdd.2016.39
24. Chen S., Cao G., Wu W., Lu Y., He X., Yang L., et al. Mining novel cell glycolysis related gene markers that can predict the survival of colon adenocarcinoma patients. Biosci Rep. 2020;40(8):BSR20201427. DOI: 10.1042/BSR20201427
25. Jhaveri K., Modi S. HSP90 inhibitors for cancer therapy and overcoming drug resistance. Adv Pharmacol. 2012;65:471–517. DOI: 10.1016/B978-0-12-397927-8.00015-4
26. Karami Fath M., Azami J., Masoudi A., Mosaddeghi Heris R., Rahmani E., Alavi F., et al. Exosome-based strategies for diagnosis and therapy of glioma cancer. Cancer Cell Int. 2022;22(1):262. DOI: 10.1186/s12935-022-02642-7
27. Porporato P.E., Filigheddu N., Pedro J.M.B., Kroemer G., Galluzzi L. Mitochondrial metabolism and cancer. Cell Res. 2018;28(3):265–80. DOI: 10.1038/cr.2017.155
28. Indira Chandran V., Gopala S., Venkat E.H., Kjolby M., Nejsum P. Extracellular vesicles in glioblastoma: a challenge and an opportunity. NPJ Precis Oncol. 2024;8(1):103. DOI: 10.1038/s41698-024-00600-2
Об авторах
И. Ф. ГареевРоссия
Гареев Ильгиз Фанилевич — к.м.н., старший научный сотрудник
Республика Башкортостан, Уфа; Москва
О. А. Бейлерли
Россия
Бейлерли Озал Арзуман оглы — к.м.н., старший научный сотрудник
Республика Башкортостан, Уфа; Москва
Жанг Хонгли
Китай
Жанг Хонгли — младший научный сотрудник, отделение нейрохирургии
Харбин
С. А. Румянцев
Россия
Румянцев Сергей Александрович — д.м.н., профессор, член-корр. РАН
Москва
Рецензия
Для цитирования:
Гареев И.Ф., Бейлерли О., Хонгли Ж., Румянцев С.А. Анализ и функциональная значимость белка TRAP1 при глиобластоме. Креативная хирургия и онкология. 2025;15(2):115-123. https://doi.org/10.24060/2076-3093-2025-15-2-19-27
For citation:
Gareev I.F., Beylerli O., Hongli Zh., Roumiantsev S.A. Analysis and Functional Significance of TRAP1 in Glioblastoma. Creative surgery and oncology. 2025;15(2):115-123. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-2-19-27


































