Перейти к:
Этаноловая склеротерапия с радиочастотной абляцией в лечении токсической аденомы (клинический случай)
https://doi.org/10.24060/2076-3093-2025-15-2-97-103
Аннотация
Введение. Тиреотоксические состояния обусловлены гиперпродукцией гормонов щитовидной железы. Согласно данным статистики на территории Российской Федерации выявлен рост случаев тиреотоксикоза, в 2018 году зафиксировано 132 на 100 тыс. населения. Диффузный токсический зоб является одним из наиболее часто встречаемых в структуре патологий, сопровождающихся тиреотоксикозом. Гипертиреоз может быть обусловлен также токсическими аденомами щитовидной железы. Встречаются поражения одной доли, с солитарным узлом, и множественные узловые образования как одной доли, так и обеих долей, относящиеся к токсическому многоузловому зобу. При описании клинических проявлений аденом выделяют следующие симптомы: местные, в виде косметических проблем, и тиреотоксикоз, которые определяют тактику дальнейшего ведения. Цель. Развитие персонализированных малоинвазивных подходов к лечению новообразований щитовидной железы обусловлено необходимостью сохранения объема функционирующей ткани органа. Материалы и методы. В статье изложен клинический случай лечения пациента с узловым зобом и признаками тиреотоксикоза. Проведено хирургическое лечение разработанным группой авторов комбинированным методом, включающим поэтапную подготовку этаноловой склеротерапией с последующей радиочастотной абляцией узла. Результаты и обсуждение. Продемонстрировано последствие малоинвазивной операции на щитовидной железе в виде нормализации гормонального фона, уменьшения узлового образования в 7 раз, улучшения качества жизни и восстановления естественных контуров шеи. Заключение. Описаны перспективы применения интервенционной эндокринной хирургии с возможностью органосохраняющего вмешательства у пациентов с токсическими узловыми образованиями.
Ключевые слова
Для цитирования:
Гумерова Г.Т., Макарьин В.А., Тушова А.Ф., Фазлыева А.Ф., Ишбулатова А.И., Климец С.П., Надеждина Е.А., Неряхин А.Д. Этаноловая склеротерапия с радиочастотной абляцией в лечении токсической аденомы (клинический случай). Креативная хирургия и онкология. 2025;15(2):193-199. https://doi.org/10.24060/2076-3093-2025-15-2-97-103
For citation:
Gumerova G.T., Makarin V.A., Tushova A.F., Fazlyeva A.F., Ishbulatova A.I., Klimets S.P., Nadezhdina E.A., Neryakhin A.D. Ethanol Sclerotherapy Combined with Radiofrequency Ablation in the Treatment of Toxic Adenoma: Clinical Case. Creative surgery and oncology. 2025;15(2):193-199. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-2-97-103
ВВЕДЕНИЕ
Тиреотоксические состояния обусловлены избыточной продукцией гормонов щитовидной железы (ЩЖ). Согласно данным официальной отчетности Российской Федерации, выявлен статистически значимый рост распространенности тиреотоксикоза (р < 0,001); по данным за 2018 год частота составляет 132 случая на 100 тыс. населения [1]. Гипертиреоз может быть обусловлен несколькими патологическими состояниями, такими как диффузный токсический зоб (ДТЗ), многоузловой токсический зоб или токсическая аденома (ТА) [2][3]. ДТЗ является одной из наиболее распространенных форм тиреотоксикоза, так как имеет аутоиммунную природу патологического процесса. ДТЗ занимает до 80 % случаев гиперфункции ЩЖ и характерен для возрастной группы от 20 до 40 лет. Для узловых форм различают варианты поражения одной доли, солитарный узел и сочетание образований в обеих долях щитовидной железы, в том числе множественные, относящиеся к токсическому многоузловому зобу [4]. ТА статистически чаще встречаются у пациентов женского пола. При описании клинических проявлений тиреотоксических аденом требуется уделить особое внимание следующим симптомам: гипертония, тахикардия, изменения кожных покровов, желудочно-кишечные проявления, мышечную слабость и другие, что также влияет на тактику хирургического вмешательства [5].
В зависимости от клинического течения заболевания проводится выбор метода терапии. При субклиническом тиреотоксикозе у пациентов с ТА ведущим методом является консервативная симптоматическая терапия. При тиреотоксических состояниях с изменениями в нескольких системах органов приоритетными являются хирургические методы или радиойодтерапия (РЙТ) [6]. Существенные риски развития интра- и послеоперационных осложнений, связанных с использованием данных методов лечения, ставят под сомнение необходимость их применения в отдельных клинических случаях. Консервативная терапия (в частности, гормонально активных узлов) предполагает длительный (в ряде случаев — пожизненный) прием тиреостатических препаратов, что оказывает влияние на качество жизни пациентов за счет побочных эффектов. Развитие интервенционной хирургии привело к выделению новых направлений малоинвазивных способов лечения узловых образований ЩЖ, в частности радиочастотной абляции (РЧА) и комбинации с этаноловой склеротерапией, что продемонстрировало значительную клиническую эффективность и малый риск осложнений в исходе пилотных исследований в сравнении с хирургическими методами и РЙТ.
МАТЕРИАЛЫ И МЕТОДЫ
Пациентка Н., 49 лет, обратилась в 2019 году к врачу-хирургу клиники Башкирского государственного медицинского университета (БГМУ, г. Уфа) с жалобами на тахикардию (ЧСС — 95–115 уд/мин), периодическое повышение артериального давления (141/105) в течение года, раздражительность, потливость, тремор рук, отсутствие регулярного менструального цикла, быструю утомляемость и общую слабость.
В течение двух лет, предшествующих настоящему обследованию, наблюдалась у эндокринолога по месту жительства с диагнозом «Диффузно-узловой зоб 1 степени по ВОЗ». По данным анамнеза: впервые диагноз «диффузно-узловой зоб» был установлен в 2017 году эндокринологом по месту жительства. В течение 2018–2019 годов, предшествующих обращению в клинику БГМУ, проведена терапия антитиреоидным препаратом — тирозол® в дозировке 5 мг один раз в сутки.
Результаты объективного обследования: состояние удовлетворительное, сознание ясное, положение активное. Дыхание везикулярное, проводится по всем легочным полям, частота дыхания — 18 в минуту. Тоны сердца ясные, ритм правильный, патологические шумы не выслушиваются, ЧСС — 112 ударов в минуту, АД — 137/101 мм рт. ст., симметричное на обеих руках.
Локально: при пальпации щитовидная железа справа неравномерно плотная, слева бугристая и мягкоэластичная, безболезненная, визуально отмечается несимметричная деформация шеи за счет увеличения правой доли ЩЖ.
При оценке гормональной функции щитовидной железы выявлены эпизоды подавления продукции тиреотропного гормона (ТТГ) и результат медикаментозной коррекции тирозолом® (рис. 1).
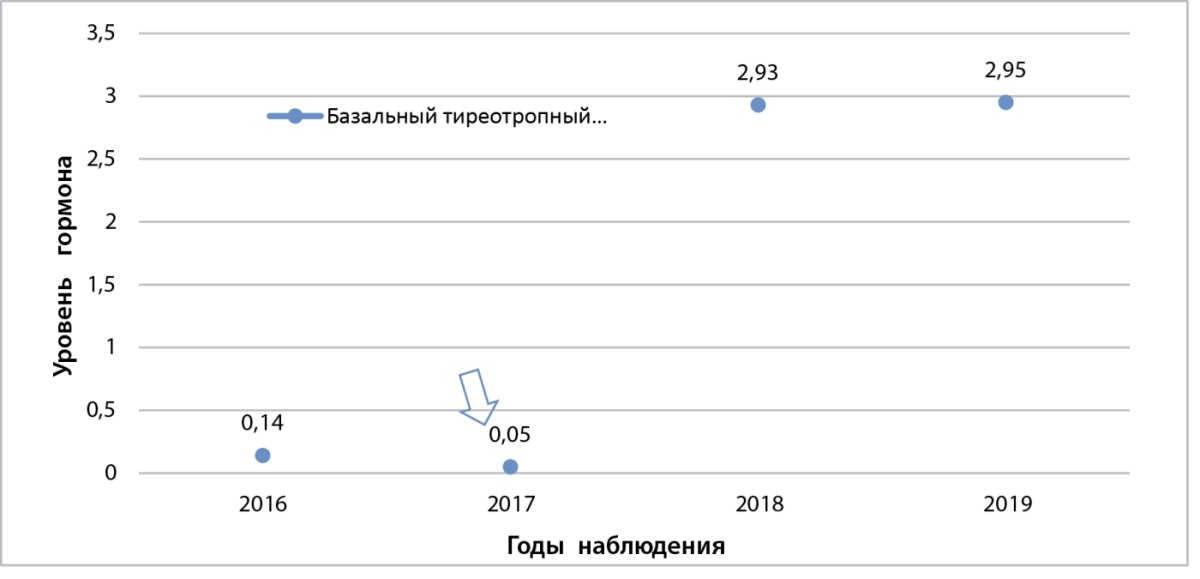
Рисунок 1. Уровень ТТГ до лечения (стрелкой указана дата начала консервативной терапии)
Figure 1. TSH levels before treatment (arrow indicates the onset of conservative therapy)
УЗИ щитовидной железы от 2019 года: форма железы треугольная за счет преобладания объема правой доли; размеры щитовидной железы увеличены за счет узлообразования; правая доля: 60×30×16 мм, V — 13,8 см³; левая доля: 42×18×15 мм, V — 5,4 см³; общий объем 19,2 см³.
Эхоструктура долей неоднородная. В правой доле определяется узловое образование размерами 33×18×38 мм (объем 11 см³) с четкими ровными контурами, несколько сниженной эхогенности, структура с наличием множественных тонких гиперэхогенных перегородок и жидкостного компонента, более 80 % объема. В режиме цветного доплеровского картирования (ЦДК) — интенсивная васкуляризация узла по смешанному типу. Регионарные лимфоузлы не увеличены.
На сцинтиграфии ЩЖ (рис. 2) с тестом на захват пертехнетата (Tc 99m) — признаки гиперфункционирующего узла правой доли. В среднем и нижнем сегментах правой доли отмечается округлое образование диаметром около 30 мм с гиперфиксацией радиофармпрепарата (РФП) — «горячий» узел, уровень захвата Tc 99m выше нормы (2,3 %).
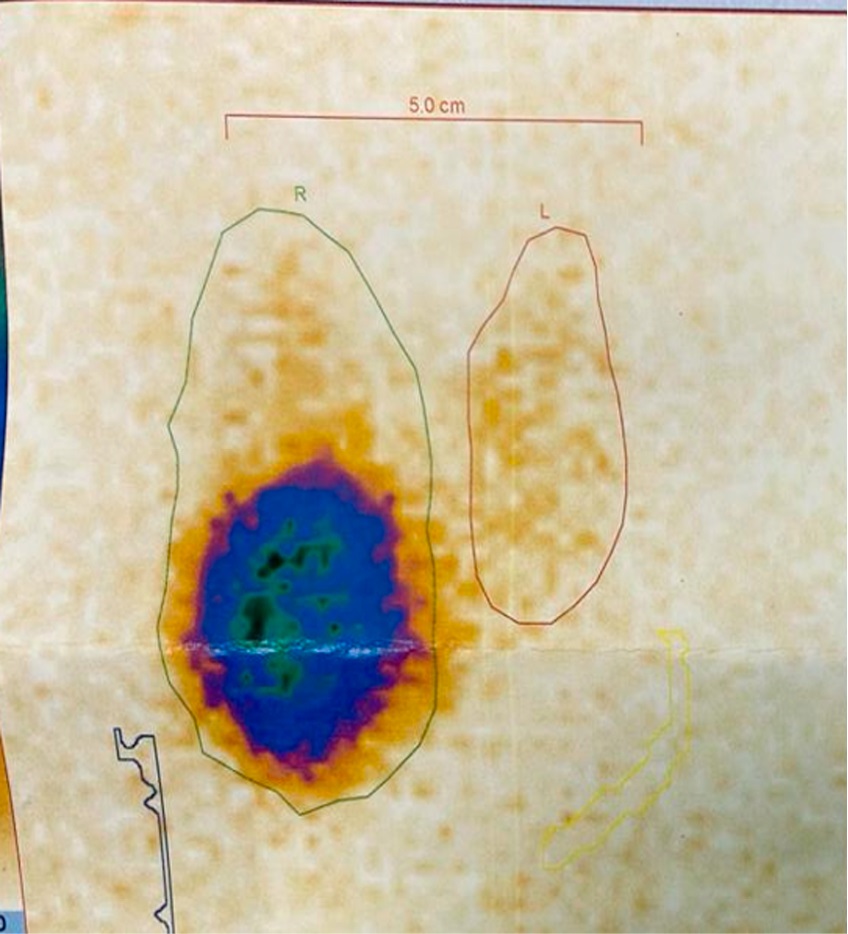
Рисунок 2. Сцинтиграфия токсической аденомы правой доли ЩЖ
Figure 2. Scintigraphy of a toxic adenoma in the right thyroid lobe
В 2018 году выполнена тонкоигольная аспирационная пункционная биопсия (ТАПБ) узлового образования правой доли по сцинтиграфической картине, соответствующей «горячему» узлу. По результатам цитологической картины образования правой доли: материал представлен коллоидом, элементами крови, гемосидерофагами, фолликулярными структурами из тироцитов и соответствует по цитологической классификации — Bethesda II.
С учетом полученных жалоб, объективного исследования, клинико-лабораторных показателей и дополнительных методов исследования и отсутствия эффекта от консервативного лечения пациенке было предложено проведение интервенционных методов лечения как альтернативы хирургического метода лечения согласно разработанной комбинированной методике с последовательным применением этаноловой склеротерапии и радиочастотной абляции [7].
Эффективность лечения оценивалась по следующим критериям:
- Динамика тиреоидных гормонов до/после лечения.
- УЗИ: оценка размеров и объема узлового образования, соотношение жидкостного и солидного компонентов, васкуляризации в режиме ЦДК в динамике.
- Клинические симптомы (деформация передней поверхности шеи, ЧСС и АД).
- Визуальная оценка размеров узлового образования по деформации передней поверхности шеи.
Протокол хирургического лечения:
В период с 12 ноября по 5 декабря 2019 года под УЗИ-навигацией (ультразвуковой аппарат «GE Logic 9E Expert») под местной анестезией 1 % лидокаином выполнено 2 сеанса этаноловой склеротерапии токсической аденомы правой доли ЩЖ.
Первый сеанс от 12 ноября 2019 года: в полость введено до 2 мл 95 % спирта.
Второй сеанс (рис. 3) склеротерапии выполнен 5 декабря 2019 года: размеры узла на момент проведения процедуры составили 27×16×32 мм (объем 7 см³). В полость введено до 1 мл 95 % спирта.
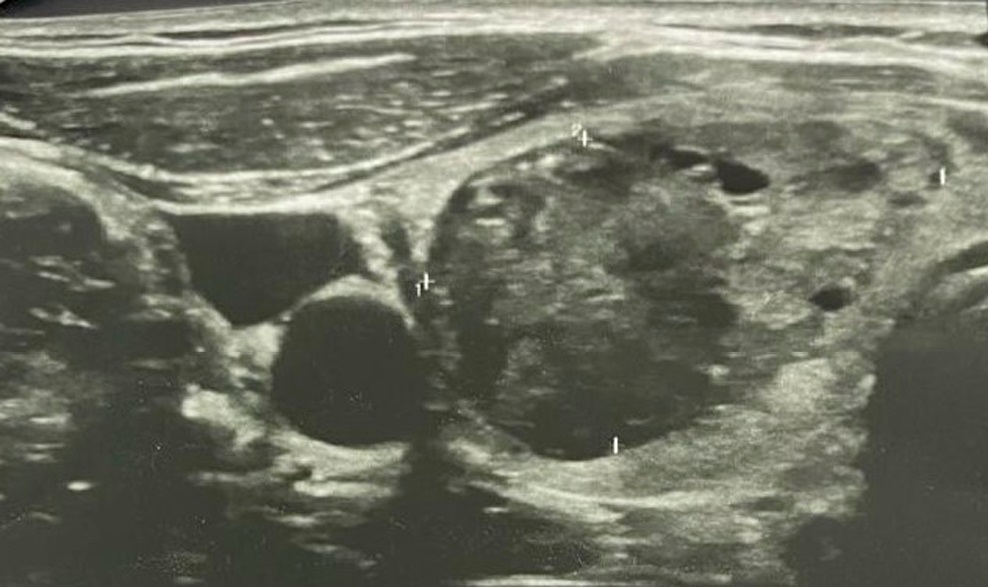
Рисунок 3. УЗ-картина токсической аденомы правой доли ЩЖ после второго сеанса этаноловой склеротерапии
Figure 3. Ultrasound image of the toxic adenoma in the right thyroid lobe following the second session of ethanol sclerotherapy
В период проведения сеансов этаноловой склеротерапии размеры и объем узлового образования уменьшились до 5,4 см³ (уменьшение почти вдвое от изначального объема). При ЦДК васкуляризация узла подверглась изменениям: кровоток с интенсивного смешанного снижен до умеренного смешанного, максимальные скоростные параметры сосудов образования сохранялись до 15 см/с.
Учитывая сохраненную гиперпродукцию гормонов щитовидной железы и данные УЗИ, принято решение о проведении радиочастотной абляции для вапоризации тканевого компонента и сосудов, питающих узловое образование, с целью предупреждения рецидива.
В декабре 2019 года, спустя 3 недели после последнего сеанса этаноловой склеротерапии, под контролем ультразвукового аппарата «GE Logic 9E Expert» под местной анестезией радиочастотным генератором «RFAblation System Mygen M-3004» произведена РЧА узлового образования электродом BT 1010, мощностью 65 Вт.
Интраоперационные осложнения не наблюдались, лечение пациентка перенесла хорошо (рис. 4).
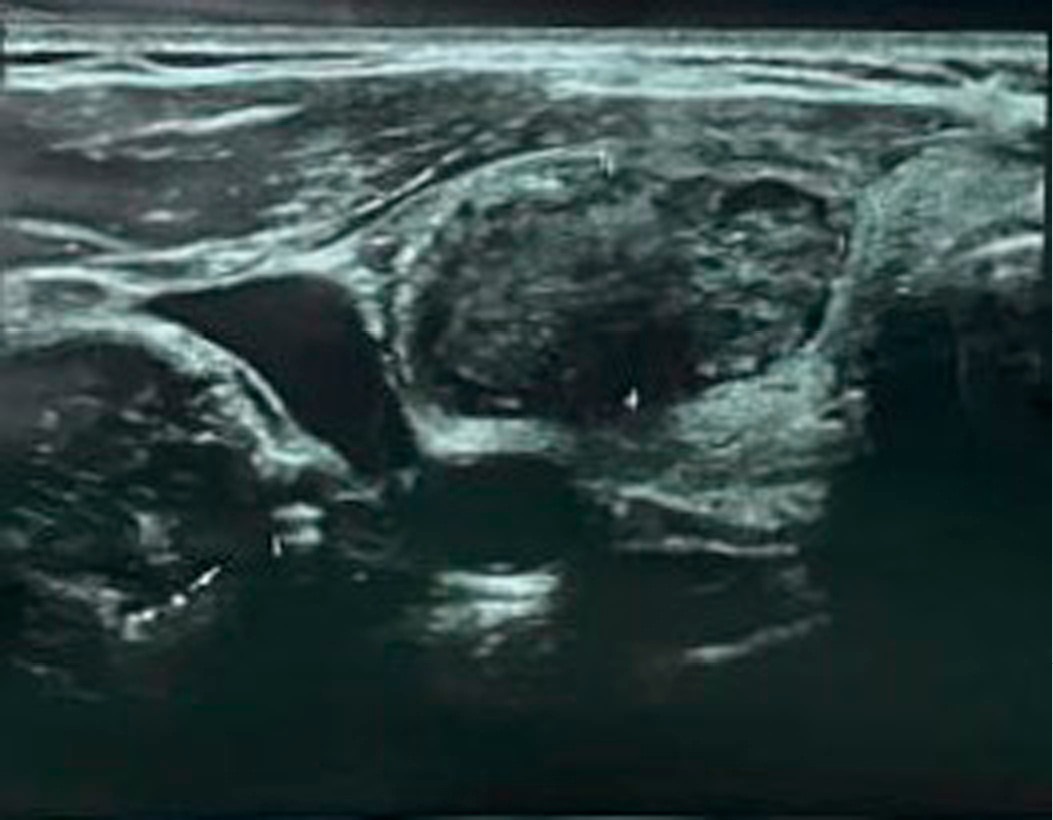
Рисунок 4. УЗ-картина токсической аденомы правой доли ЩЖ через месяц после РЧА
Figure 4. Ultrasound image of the toxic adenoma in the right thyroid lobe one month after radiofrequency ablation
После проведенного РЧА уменьшение размеров отмечалось в течение 12 месяцев, при УЗИ в декабре 2020 года объем узла равнялся 23×14×21 мм, или 3 см³ (рис. 5).
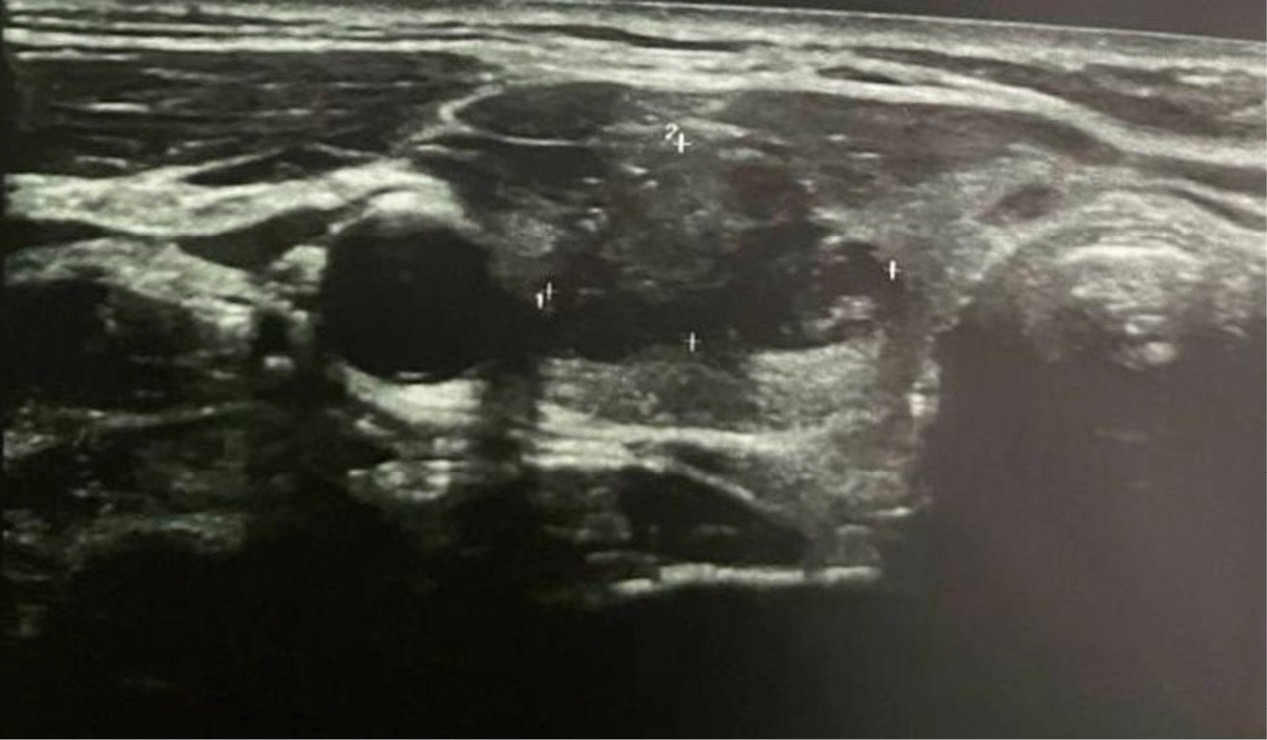
Рисунок 5. УЗ-картина токсической аденомы правой доли ЩЖ через год после РЧА
Figure 5. Ultrasound image of the toxic adenoma in the right thyroid lobe one year after radiofrequency ablation
На февраль 2024 года, спустя 4 года после проведенной РЧА, размеры образования составляли 16×8×14 мм (объем 1,5 см³), на ЦДК образование аваскулярного типа с признаками стойкого фиброза (рис. 6).
На протяжении лечения пациентка отмечала улучшение состояния. Объективные данные демонстрировали визуальное и пальпаторное уменьшение узлового образования. Гормональный статус пациентки через год после абляции достиг эутиреоза. Послеоперационный период протекал без осложнений, пациентка наблюдалась в клинике на протяжении трех лет.
Весь период лечения проходил без потери трудоспособности, в амбулаторных условиях.
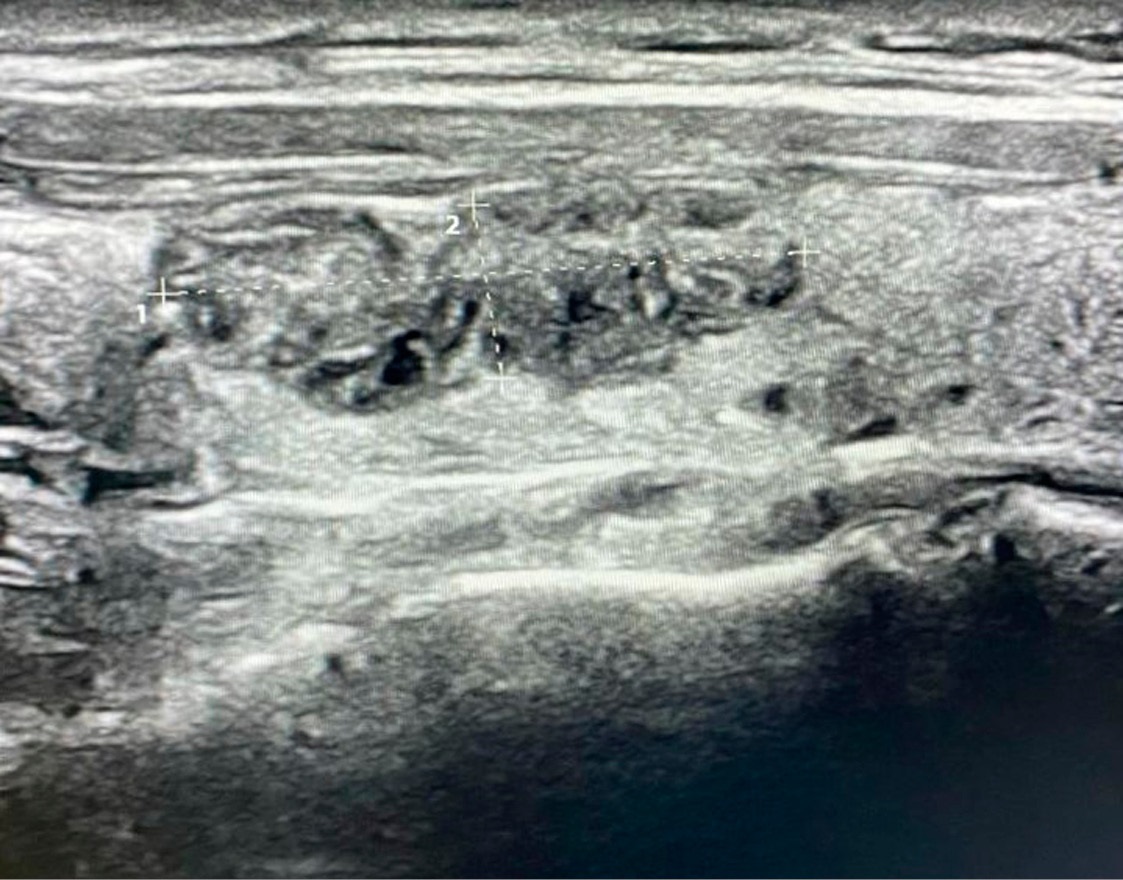
Рисунок 6. УЗ-картина токсической аденомы правой доли ЩЖ через 4 года после РЧА
Figure 6. Ultrasound image of the toxic adenoma in the right thyroid lobe four years after radiofrequency ablation
РЕЗУЛЬТАТЫ
Поэтапное лечение токсической аденомы правой доли щитовидной железы (склеротерапия с последующей РЧА) привело к устранению клинических симптомов и улучшению состояния пациентки за счет:
1) достижения эутиреоза без дополнительной медикаментозной коррекции тиреостатическими препаратами (табл. 1);
2) значительного уменьшения размеров узла — объем образования правой доли уменьшился до 1,5 см³, что в 7 раз меньше от изначального объема (исходный объем — 11 см³);
3) визуального и анатомического устранения деформации шеи;
4) улучшения качества жизни (устранение косметического дефекта шеи, нормализация артериального давления и сердцебиения, уменьшение общей тревожности, улучшение общего состояния, нормализация менструального цикла).
Дата | Базальный тиреотропный гормон, мкЕд/мл | Т4 свободный, пмоль/л | Т3 свободный, пмоль/л |
18.11.2019 | 0,0614 | 12,54 | 6,57 |
22.01.2020 | 0,634 | 9,18 | 4,67 |
13.03.2022 | 0,829 | 10,67 | 4,48 |
05.08.2023 | 0,803 | 12,78 | 4,97 |
08.02.2024 | 0,4527 | 10,9 | 4,19 |
Норма | 0,23–3,5 | 9–19,05 | 2,6–5,7 |
Таблица 1. Показатели гормональной функции щитовидной железы пациентки после лечения
Table 1. Post-treatment thyroid hormone levels in the patient
Данные за рецидив заболевания в течение трех лет отсутствуют, послеоперационный рубец стабильный.
ОБСУЖДЕНИЕ
Оперативное лечение — один из наиболее распространенных методов, применяемый в лечении токсических аденом, заключающийся в удалении гормонально активных узлов ЩЖ по принципу гемитиреоидэктомии, субтотальной или тотальной тиреоидэктомии [8][9]. Оперативная коррекция токсических аденом обладает значительными преимуществами, такими как возможность быстрого и эффективного контроля над гиперпродукцией гормонов путем радикального удаления активных узлов, проведение гистологического анализа операционного материала для подтверждения диагноза и минимальный риск возникновения рецидивов. Однако осложнения хирургического лечения, такие как парез возвратного гортанного нерва, гипопаратиреоз, транзиторная гипокальциемия, послеоперационное кровотечение, инфицирование раны и формирование келоидного рубца в месте послеоперационного шва, также встречаются у пациентов [10].
Помимо хирургических методов терапии, у пациентов с гормонально активными узлами применяется РЙТ, источником излучения при которой является радиоактивный йод (I-131). Преимуществами данного способа является минимальная частота развития нежелательных реакций и высокая эффективность в отношении достижения эутиреоидного статуса. Среди возможных осложнений применения радиоактивного йода в литературе отмечено вовлечение в деструкцию нормально функционирующей ткани ЩЖ, высокая частота развития гипотиреоза в долговременном исходе лечения и необходимость госпитализации пациента в среднем на 7–10 дней, что создает дополнительную нагрузку на систему здравоохранения [11–14].
Интервенционные методы хирургии, такие как РЧА, заключаются в воздействии тепловой энергии на гормонально активную ткань ЩЖ с целью уменьшения ее объема и улучшения клинических исходов заболевания. Преимущества метода подробно описаны в литературе. Отмечается уменьшение объема токсической аденомы на 50–90 % от исходного уровня, значительное влияние на качество жизни пациентов, а также низкая частота осложнений в результате вмешательства [15]. Изучение улучшения качества жизни и экономической эффективности РЧА выявило, что общее и психическое состояние пациентов, перенесших радиочастотную абляцию, было значительно лучше, чем при хирургической коррекции тиреотоксикоза, однако ее стоимость имела преимущество перед РЧА [16][17].
ЗАКЛЮЧЕНИЕ
Проведено хирургическое лечение комбинированным мини-инвазивным методом, включающим поэтапную подготовку этаноловой склеротерапией с последующей радиочастотной абляцией узла. Продемонстрирован ретроспективный анализ результатов малоинвазивной операции на щитовидной железе и описаны перспективы применения интервенционной эндокринной хирургии с возможностью органосохраняющего вмешательства у пациентов с функционально активными узлами щитовидной железы.
Список литературы
1. Трошина Е.А., Платонова Н.М., Панфилова Е.А. Аналитический обзор результатов мониторинга основных эпидемиологических характеристик йододефицитных заболеваний у населения Российской Федерации за период 2009–2018 гг. Проблемы эндокринологии. 2021;67(2):10–9. DOI: 10.14341/probl12433
2. Chaker L., Cooper D.S., Walsh J.P., Peeters R.P. Hyperthyroidism. Lancet. 2024;403(10428):768–80. DOI: 10.1016/S0140-6736(23)02016-0
3. Doubleday A.R., Sippel R.S. Hyperthyroidism. Gland Surg. 2020;9(1):124–35. DOI: 10.21037/gs.2019.11.01
4. Пашенцева А.В., Вербовой А.Ф. Диффузный токсический зоб. Клиническая медицина. 2017; 95(9):780–8. DOI: 10.18821/0023-2149-2017-95-9-780-788
5. Mulita F., Anjum F. Thyroid adenoma. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK562252/
6. do Prado Padovani R., Chablani S.V., Tuttle R.M. Radioactive iodine therapy: multiple faces of the same polyhedron. Arch Endocrinol Metab. 2022 May 13;66(3):393–406. DOI: 10.20945/2359-3997000000461
7. Гумерова Г.Т., Неряхин А.Д., Асфандиярова И.В., Ишбулатова А.И., Фазлыева А.Ф., Климец С.П. и др. Способ двухэтапного лечения узлового токсического зоба: патент 2820877, Российская Федерация. 16.11.2023.
8. Shahid M., Cetera B. Thyroid disease and thyroid surgery. Anaesth Intens Care Med. 2023;24:594–607. DOI: 10.1016/j.mpaic.2023.07.009
9. Grani G, Sponziello M, Pecce V, Ramundo V, Durante C. Contemporary Thyroid Nodule Evaluation and Management. J Clin Endocrinol Metab. 2020 Sep 1;105(9):2869–83. DOI: 10.1210/clinem/dgaa322
10. Sjölin G., Watt T., Byström K., Calissendorff J., Cramon P.K., Nyström H.F., et al. Long term outcome after toxic nodular goitre. Thyroid Res. 2022;15(1):20. DOI: 10.1186/s13044-022-00138-0
11. Chen S.Q., Gou R.Q., Zhang Q. The evolution and hotspots of radioactive iodine therapy in hyperthyroidism: a bibliometric analysis. Nucl Med Commun. 2025;46(3):204–17. DOI: 10.1097/MNM.0000000000001940
12. Bonnema S.J., Hegedüs L. Radioiodine therapy in benign thyroid diseases: effects, side effects, and factors affecting therapeutic outcome. Endocrine Rev. 2012;33:920–80. DOI: 10.1210/er.2012-1030
13. Riley A.S., McKenzie G.A.G., Green V., Schettino G., England R.J.A., Greenman J. The effect of radioiodine treatment on the diseased thyroid gland. Int J Radiat Biol. 2019;95(12):1718–27. DOI: 10.1080/09553002.2019.1665206
14. Donovan P.J., McLeod D.S., Little R., Gordon L. Cost-utility analysis comparing radioactive iodine, anti-thyroid drugs and total thyroidectomy for primary treatment of Graves’ disease. Eur J Endocrinol. 2016;175(6):595–603. DOI: 10.1530/EJE-16-0527
15. Papini E., Pacella C.M., Misischi I., Guglielmi R., Bizzarri G., Døssing H., et al. The advent of ultrasound-guided ablation techniques in nodular thyroid disease: towards a patient-tailored approach. Best Pract Res Clin Endocrinol Metab. 2014;28(4):601–18. DOI: 10.1016/j.beem.2014.02.004
16. Muhammad H., Tehreem A., Russell J.O., Tufano R.P. Radiofrequency ablation and autonomous functioning thyroid nodules: review of the current literature. Laryngoscope. 2022;132(4):906–14. DOI: 10.1002/lary.29811
17. Podrat J.L., Lee Y.K., Khadra H.S. Efficacy of radiofrequency ablation for treatment of toxic thyroid nodules-a narrative review. Gland Surg. 2024;13(1):70–6. DOI: 10.21037/gs-22-644
Об авторах
Г. Т. ГумероваРоссия
Гумерова Гульнара Тагировна — к.м.н, доцент, кафедра общей хирургии с курсами трансплантологии и лучевой диагностики
Республика Башкортостан, Уфа
В. А. Макарьин
Россия
Макарьин Виктор Алексеевич — к.м.н., хирургическое отделение № 2
Гатчина
А. Ф. Тушова
Россия
Тушова Айгуль Фанилевна — к.м.н.
Республика Башкортостан, Уфа
А. Ф. Фазлыева
Россия
Фазлыева Алия Фанисовна
Республика Башкортостан, Уфа
А. И. Ишбулатова
Россия
Ишбулатова Алия Исинтимировна
Республика Башкортостан, Уфа
С. П. Климец
Россия
Климец Софья Павловна
Республика Башкортостан, Уфа
Е. А. Надеждина
Россия
Надеждина Екатерина Андреевна — студентка 6-го курса, педиатрический факультет
Республика Башкортостан, Уфа
А. Д. Неряхин
Россия
Неряхин Александр Дмитриевич — студент 5-го курса, педиатрический факультет
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Гумерова Г.Т., Макарьин В.А., Тушова А.Ф., Фазлыева А.Ф., Ишбулатова А.И., Климец С.П., Надеждина Е.А., Неряхин А.Д. Этаноловая склеротерапия с радиочастотной абляцией в лечении токсической аденомы (клинический случай). Креативная хирургия и онкология. 2025;15(2):193-199. https://doi.org/10.24060/2076-3093-2025-15-2-97-103
For citation:
Gumerova G.T., Makarin V.A., Tushova A.F., Fazlyeva A.F., Ishbulatova A.I., Klimets S.P., Nadezhdina E.A., Neryakhin A.D. Ethanol Sclerotherapy Combined with Radiofrequency Ablation in the Treatment of Toxic Adenoma: Clinical Case. Creative surgery and oncology. 2025;15(2):193-199. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-2-97-103


































