Перейти к:
Гастростаз после гастропанкреатодуоденальной резекции: наш опыт
https://doi.org/10.24060/2076-3093-2025-15-3-251-258
Аннотация
Введение. Гастропанкреатодуоденальная резекция остается единственным радикальным методом лечения злокачественных опухолей билиопанкреатодуоденальной области. Однако данное вмешательство сопровождается высокой вероятностью развития послеоперационных осложнений. Наиболее часто среди них встречается гстростаз, причины возникновения которого до настоящего времени полностью не установлены. Хотя гастростаз не является жизнеугрожающим состоянием, он существенно увеличивает продолжительность госпитализации, затраты на лечение и откладывает начало адъювантной химиотерапии. Цель исследования: оценить эффективность методов коррекции и обобщить опыт ведения пациентов с гастростазом. Материалы и методы. Исследование проведено на базе клиники имени И.К. Ахунбаева Национального госпиталя Министерства здравоохранения Кыргызской Республики в городе Бишкек. В период с 2009 по 2023 год выполнено 85 гастропанкреатодуоденальных резекций по поводу злокачественных новообразований билиопанкреатодуоденальной зоны. В исследуемой группе находились 69 мужчин и 16 женщин со средним возрастом 57,5 ± 1,4 года. Результаты. При аденокарциноме ПЖЖ в 24% случаев отмечалось развитие гастростаза, при нейроэндокринной опухоли — 75%. У больных из группы с «мягкой» ПЖЖ в 28,6% отмечалось развитие гастростаза, из группы с «плотной» ПЖЖ — 19,2% случаев. При проведении корреляции между характером паренхимы ПЖЖ и развитием гастростаза критерий достоверности составил P ≤ 0,05. Обсуждение. По результатам лечения больных с опухолями периампулярной зоны количество развившихся гастростазов составляет 23,5%. Нами были определены следующие факторы риска развития гастростаза: характер паренхимы ПЖЖ, наличие механической желтухи, гистотип опухолей, возраст пациента. Оценка у больных наличия факторов риска развития гастростаза позволит заблаговременно проводить профилактику гастростаза в послеоперационном периоде. Профилактическое применение эритромицина, согласно рекомендациям рандомизированных исследований, ускоряет разрешение гастростаза, что подтверждается клиническими результатами. Заключение. Гастропанкреатодуоденальная резекция — одна из сложнейших операций в абдоминальной хирургии не только в техническом плане, но и в послеоперационном периоде. Данная операция сопряжена с высоким риском развития послеоперационных осложнений. Выявление факторов риска поможет дать разгадку в развитии таких осложнений, как гастростаз и панкреатические фистулы.
Ключевые слова
Для цитирования:
Рахимова Ф.С., Бебезов Б.Х., Мамашев Н.Д., Суров Э.А. Гастростаз после гастропанкреатодуоденальной резекции: наш опыт. Креативная хирургия и онкология. 2025;15(3):251-258. https://doi.org/10.24060/2076-3093-2025-15-3-251-258
For citation:
Rakhimova F.S., Bebezov B.Kh., Mamashev N.D., Surov E.A. Delayed Gastric Emptying after Gastropancreatoduodenal Resection: Our Experience. Creative surgery and oncology. 2025;15(3):251-258. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-3-251-258
ВВЕДЕНИЕ
Гастропанкреатодуоденальная резекция (ГПДР) занимает одно из ведущих мест среди наиболее технически сложных оперативных вмешательств в современной абдоминальной хирургии. Данная операция предусматривает удаление комплекса анатомически и функционально взаимосвязанных органов: дистального отдела желудка, двенадцатиперстной кишки, головки поджелудочной железы, а также части желчевыводящих путей. Основными показаниями к проведению ГПДР являются злокачественные опухоли билиопанкреатодуоденальной зоны, в частности периампулярные карциномы, которые отличаются крайне неблагоприятным прогнозом и занимают четвертое место среди причин смертности от онкологических заболеваний в мировом масштабе [1][2].
В Кыргызской Республике рак органов билиопанкреатодуоденальной зоны занимает 6 место среди заболеваемости новообразованиями. Поздняя обращаемость и запущенность процесса приводят к летальному исходу в среднем в течение 6–8 месяцев со дня постановки диагноза [3]. В Кыргызстане внедрение проведения ГПДР началось с 2009 года, когда нашей командой впервые в республике была проведена данная операция. По сегодняшний день продолжается работа по раннему выявлению опухолей билиопанкреатодуоденальной зоны и проведению радикального лечения, а именно выполнение операции ГПДР. Наша клиника является третичным звеном оказания помощи. Она малопотоковая и по настоящее время является единственным центром, выполняющим ГПДР в Кыргызской Республике.
Несмотря на значительный прогресс в области хирургических технологий, совершенствование методов анестезиологического обеспечения и послеоперационного ведения пациентов, гастропанкреатодуоденальная резекция остается вмешательством, сопряженным с высокой частотой развития послеоперационных осложнений. По различным данным, их суммарная частота составляет от 30 до 60 %, что объясняется как обширностью вмешательства, так и тяжестью исходного онкологического процесса. Вместе с тем за последние десять лет удалось достичь существенного снижения показателей послеоперационной летальности — с ранее фиксируемых 25 % до менее 5 % на современном этапе [4–7]. Тем не менее, несмотря на успехи в снижении хирургической смертности, долгосрочные онкологические результаты остаются относительно скромными: пятилетняя выживаемость пациентов после выполнения ГПДР варьирует в пределах лишь 10–20 %.
Одним из наиболее часто встречающихся осложнений после гастропанкреатодуоденальной резекции является гастростаз, частота возникновения которого, по данным различных авторов, колеблется в пределах от 5 до 61 % [8]. Гастростаз определяется как нарушение эвакуации содержимого желудка при отсутствии механического препятствия в просвете желудочно-кишечного тракта. Впервые это осложнение в контексте панкреатодуоденальной резекции с сохранением привратника описали A. Warshaw и D. Totchiana в 1985 году [8].
Следует отметить, что на сегодняшний день патогенез гастростаза после ГПДР остается предметом активного обсуждения и до конца не выяснен. В течение последних десятилетий было проведено множество клинических и экспериментальных исследований, в рамках которых предлагались различные гипотезы относительно механизмов его формирования. Среди вероятных патогенетических факторов рассматриваются снижение продукции гастроинтестинальных гормонов (мотилина, холецистокинина, панкреатического полипептида), нарушение иннервации желудка вследствие травматизации нерва Латарже, ишемические изменения в области желудка и двенадцатиперстной кишки, воспалительные процессы в зоне хирургических анастомозов, а также влияние системного воспалительного ответа [9].
Кроме того, согласно ряду публикаций, существует тесная взаимосвязь между развитием гастростаза и рядом других послеоперационных осложнений. Наиболее выраженная корреляция прослеживается между гастростазом и наличием ограниченных скоплений жидкости в брюшной полости, реактивным панкреатитом, холангитом, перенесенным в предоперационном периоде, а также сопутствующим сахарным диабетом [10–12]. Подобная взаимосвязь, по-видимому, обусловлена как местными воспалительными изменениями, так и общими нарушениями метаболизма, что негативно сказывается на моторной функции желудочно-кишечного тракта.
Хотя гастростаз, как правило, не представляет непосредственной угрозы жизни пациента, его развитие значительно осложняет течение послеоперационного периода. Данное состояние существенно снижает качество жизни больных, вызывает необходимость длительной зондовой декомпрессии желудка или парентерального питания, увеличивает продолжительность пребывания в стационаре, приводит к дополнительным экономическим затратам на лечение и, самое главное, нередко становится причиной задержки начала проведения адъювантной химиотерапии. Последнее обстоятельство может негативно сказываться на прогнозе течения онкологического заболевания и общей выживаемости пациентов. В связи с этим своевременное выявление гастростаза, уточнение его патогенеза и поиск эффективных методов профилактики и лечения остаются актуальными задачами современной хирургической онкологии.
В связи с вышеизложенным целью настоящего исследования явилась оценка частоты возникновения гастростаза у пациентов, перенесших гастропанкреатодуоденальную резекцию в Кыргызской Республике, а также анализ эффективности применяемых методов коррекции данного осложнения и обобщение клинического опыта ведения этой категории больных.
МАТЕРИАЛЫ И МЕТОДЫ
Работа была выполнена на базе клиники имени И. К. Ахунбаева Национального госпиталя Министерства здравоохранения Кыргызской Республики. В период с 2009 по 2023 год в отделении было проведено 85 гастропанкреатодуоденальных резекций у пациентов с подтвержденными злокачественными опухолями периампулярной зоны.
При анализе полового распределения установлено, что среди оперированных преобладали мужчины — 69 человек (80 %), в то время как число женщин составило 16 человек (20 %). Возрастной диапазон обследованных пациентов варьировал от 16 до 81 года, при этом средний возраст составил 57,8 ± 1,5 года. По предложенной классификации стадирования по системе TNM (8-е издание) больные распределились следующим образом: T2N0M0 (I стадия) — 10,6 % (9 больных), T2N1M0 (II стадия) — 23,5 % (20 больных), T3N2M0 (III стадия) — 65,9 % (56 больных).
Техника ГПДР являлась классической, реконструктивный этап заключался в формировании панкреатогастроанастомоза «конец в бок» — у 81 больного, гепатикоеюноанастомоза («конец в бок») и гастроэнтероанастомоза по типу «конец в бок» с межкишечным анастомозом по Брауну. Реконструктивный этап 4 больным заключался в последовательном формировании на одной кишечной петле панкреатоеюноанастомоза по типу «конец в конец», гепатикоеюноанастомоза и гастроэнтероанастомоза с межкишечным соустьем по Брауну. Среднее время операции гастропанкреатодуоденальной резекции составило 352,0 ± 43,2 мин.
В послеоперационном периоде на основании полученных данных патогистологического исследования больные по наличию образования распределились следующим образом: опухоль головки поджелудочной железы была поставлена 60 больным (70,6 %), опухоли большого дуоденального сосочка — 12 больным (14,1 %), опухоли дистального отдела общего желчного протока — 7 больным (8,2 %), опухоли двенадцатиперстной кишки — 5 больным (5,9 %), лимфосаркома забрюшинного пространства — 1 больной (1,2 %).
Послеоперационные осложнения были зафиксированы у 26 пациентов, что составило 32,9 % от общего числа прооперированных. Среди выявленных осложнений наиболее значимыми и тяжелыми оказались следующие: несостоятельность панкреатикогастроанастомоза, сопровождавшаяся формированием панкреатического свища, которая наблюдалась у 6 больных (7,1 %); несостоятельность билиодигестивного анастомоза, отмеченная в одном случае (1,2 %); гастростаз, диагностированный у 20 пациентов (23,5 %); несостоятельность гастроэнтероанастомоза зарегистрирована у 3 больных (3,5 %); а также тромбоэмболия легочной артерии (ТЭЛА), которая имела место в одном случае (1,2 %).
Летальные исходы в раннем послеоперационном периоде были отмечены у трех пациентов, что обусловило уровень послеоперационной летальности в 3,5 %. В одном случае причиной смерти явилась тромбоэмболия легочной артерии, тогда как в двух других случаях летальный исход наступил вследствие развития полиорганной недостаточности на фоне несостоятельности гастроэнтероанастомоза с последующим формированием перитонита.
РЕЗУЛЬТАТЫ
Гастростаз по нашим данным и данным многих исследований является осложнением, на которое приходится наибольший процент случаев. В 2007 г. International Study Group of Pancreas Surgery (ISGPS) предложила единое определение гастростаза. Согласно принятой классификации выделяют 3 степени гастростаза: A, B и C [13] (ниже в таблице приводится расшифровка данной классификации) (табл. 1).
Критерии оценки гастростаза | Нет | Степень А | Степень В | Степень С |
Желудочный зонд (удаление на какие сутки) | ≤3 сут. | 4–7 сут. | 8–14 сут. | ≥15 сут. |
Повторная установка желудочного зонда в послеоперационном периоде | нет | ≥3 дн. | ≥7 дн. | ≥14 дн. |
Невозможность употребления твердой пищи перорально в послеоперационном периоде | - | 7–13 дн. | 14–20 дн. | ≥21 дн. |
Тошнота, рвота | - | ± | + | + |
Применение прокинетиков | - | ± | + | + |
Нутритивная поддержка | - | ± | + | + |
Ассоциация с другими осложнениями | - | ± | + | + |
Диагностические методы (рентген верхних отделов ЖКТ с барием, УЗИ, КТ) | - | - | ± | + |
Таблица 1. Классификация гастростаза по ISGPS
Table 1. ISGPS classification of gastrostasis
На основании данных критериев степени гастростаза наши больные разделились следующим образом (табл. 2).
Степень | Количество больных | |
абс. число | % | |
Степень А | - | - |
Степень В | 17 | 85 |
Степень С | 3 | 15 |
ИТОГО | 20 | 100 |
Таблица 2. Распределение больных согласно классификации ISGPS
Table 2. Distribution of patients according to ISGPS classification
Гастростаз по нашей статистике развивался у больных с новообразованием головки поджелудочной железы (16 случаев), раком большого дуоденального сосочка (3 случая), раком дистального отдела холедоха (1 случай). Также мы проследили связь между гистологическим типом (табл. 3).
Локализация | ||||
Головка поджелудочной железы | c-r БДС | c-r дистального отдела холедоха | ||
Гистотип | Аденокарцинома | НЭО | Аденокарцинома | Аденокарцинома |
Абс. число | 13 | 3 | 3 | 1 |
% | 65 % | 15 % | 15 % | 5 % |
Таблица 3. Распределение больных с гастростазом в зависимости от гистотипа опухоли
Table 3. Distribution of patients with gastrostasis depending on the tumor histotype
Таким образом, в группе наших больных превалировали больные с гастростазом степени В, а именно в 85 %.
Как видно из таблицы, наибольшее количество гастростазов приходится на больных с аденокарциномой головки поджелудочной железы (65 % всех развившихся гастростазов). Однако учитывая тот факт, что нейроэндокринная опухоль диагностирована в 4 случаях из всех пациентов и у 3 из данных больных развился гастростаз, мы можем сделать предположение, что данный гистотип может быть предрасполагающим к развитию гастростаза.
Был проведен анализ развития послеоперационного гастростаза в зависимости от возраста пациентов (табл. 4).
Возраст | Количество больных | |
% | Абсолютное число | |
18–44 (молодой возраст) | - | - |
45–59 (средний возраст) | 70 | 14 |
60–74 (пожилой возраст) | 30 | 6 |
75–90 (старческий возраст) | - | - |
Всего | 100 | 20 |
Таблица 4. Распределение больных по возрасту и развитию гастростаза
Table 4. Distribution of patients by age and development of gastrostasis
Согласно полученным данным из 20 случаев развившегося гастростаза 14 (70 %) приходилось на средний возраст по классификации ВОЗ (45–59 лет).
Мы распределили больных с гастростазом в зависимости от состояния поджелудочной железы (рис.).
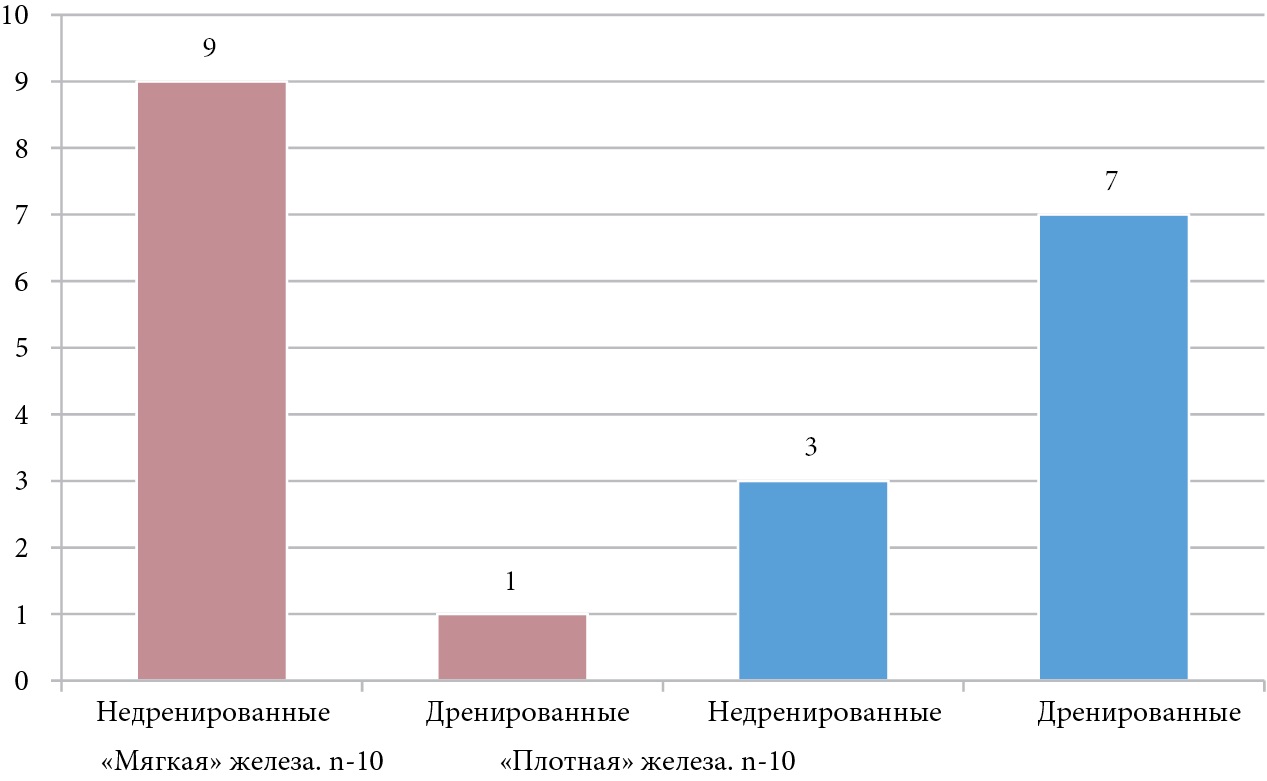
Рисунок 1. Распределение больных в зависимости от состояния поджелудочной железы
Figure 1. Distribution of patients depending on the state of the pancreas
По данным диаграммы мы видим, что наибольшее количество — 9 больных (45 %) с гастростазом приходится на «мягкую» поджелудочную железу, у которых не было признаков механической желтухи с последующим наружным дренированием холедоха.
Далее мы определили корреляцию между развитием гастростаза и состоянием поджелудочной железы. Полученные данные представлены в таблице 5.
Характеристики | «Мягкая» железа, n = 34 | «Плотная» железа, n = 62 | ||
Дренирование | Недренированные, n = 9 | Дренированные, n = 1 | Недренированные, n = 7 | Дренированные, n = 3 |
По нозологиям | ||||
Рак головки ПЖ | 5 | 1 | 7 | 3 |
Рак БДС | 3 | - | - | - |
Рак дистального отдела холедоха | 1 | - | - | - |
Таблица 5. Распределение больных гастростазом в зависимости от характера паренхимы поджелудочной железы
Table 5. Distribution of patients with gastrostasis depending on the nature of the pancreatic parenchyma
По полученным данным можем видеть, что наибольшее количество больных с гастростазом приходится на тех, у кого отмечается «мягкая» поджелудочная железа без наличия наружного дренирования. Проверили связь между развитием гастростаза и характером паренхимы поджелудочной железы, критерий достоверности P ≤ 0,05. Согласно этому можно сделать вывод, что предрасполагающим фактором развития гастростаза является отсутствие наружного желчного дренажа.
При оценке уровня амилазы больных гастростазом было отмечено, что только у 4 пациентов в послеоперационном периоде отмечается подъем уровня в 1,5 раза от нормы. Однако, в дооперационном периоде этим больным не был установлен наружный желчный дренаж. Должны сказать, что всем больным начиная с момента манипуляций на поджелудочной железе во время операции начинается подкожное введение Сандостатина 0,1 каждые 8 часов в течение 5 дней, что впоследствии может снижать достоверные показатели связи развития гастростаза с развитием послеоперационного панкреатита.
Также мы оценили уровень общего белка и альбумина данной группы больных. По нашему анализу выявили, что в послеоперационном периоде только у 2 больных отмечалось незначительное снижение уровня общего белка до 57–58 г/л. Однако, несмотря на то что у большей части больных показатели общего белка были в пределах референсных значений, уровень альбумина у 13 больных (65 %) был ниже референсных значений и был в пределах средних значений 27 ± 2 г/л.
Сопоставив количество гастростазов с группой крови пациентов, мы выявили, что наибольшее количество резвившихся гастростазов приходится на II (50 %) и III (35 %) группы крови.
Клинические проявления гастростаза начинали регистрироваться у пациентов преимущественно на вторые-третьи сутки после выполнения гастропанкреатодуоденальной резекции. У данной категории больных отмечалось существенное увеличение объема желудочного содержимого, эвакуируемого через ранее установленный назогастральный зонд, который в некоторых случаях достигал 1000–1500 мл в сутки. Несмотря на декомпрессию желудка посредством зондирования, пациенты продолжали предъявлять жалобы на ощущение тяжести в эпигастральной области, выраженную тошноту и эпизоды рвоты, что указывало на сохраняющиеся функциональные нарушения эвакуаторной способности желудка.
С целью исключения органических причин задержки пассажа, в частности высокой механической кишечной непроходимости, всем пациентам проводилась обзорная рентгенография органов брюшной полости. Данное исследование позволяло исключить острую кишечную непроходимость или наличие значительных скоплений газа, характерных для механической непроходимости.
Следующим этапом диагностики служило рентгеноконтрастное исследование желудочно-кишечного тракта с применением бариевой суспензии. Контраст вводился пациентам. Контроль за его продвижением проводился на протяжении 24 часов. Данное исследование позволяло определить как скорость эвакуации контраста из желудка, так и его дальнейшее прохождение по тонкому кишечнику. У всех обследованных пациентов выявлялась выраженная задержка эвакуации бария из полости желудка более чем на 24 часа, что объективно подтверждало наличие гастропареза.
Всем пациентам проводилась исключительно консервативная терапия, которая в большинстве случаев приводила к положительному результату. В нашем центре разработана и применялась пошаговая методика ведения больных с гастростазом, о которой мы хотели бы рассказать подробнее.
Основным принципом терапии являлось временное исключение энтерального питания на срок 5–7 суток. В этот период пациентам обеспечивалась адекватная парентеральная поддержка с целью компенсации водно-электролитных потерь, коррекции белкового, жирового и углеводного обмена. Объем инфузионной терапии рассчитывался исходя из массы тела пациента и составлял 30–40 мл/кг/сутки [14].
После стабилизации состояния и при снижении объема желудочного отделяемого начинали постепенное восстановление перорального питания. Стартовое питание включало исключительно жидкие блюда, такие как бульоны или протертые супы, поскольку жидкая пища быстрее эвакуируется из желудка и менее выраженно стимулирует его моторную функцию. Рекомендовалось избегать жирных блюд и пищи с высоким содержанием клетчатки, так как эти продукты увеличивают вязкость и замедляют эвакуацию содержимого. Также пациентам советовали избегать как слишком холодной, так и чрезмерно горячей пищи, отдавая предпочтение продуктам умеренной температуры. Кроме того, изотонические жидкости предпочтительнее гипертонических растворов, которые могут замедлять эвакуацию желудочного содержимого за счет осмотического эффекта.
Ключевым компонентом медикаментозной терапии являлось назначение прокинетических препаратов, направленных на стимуляцию моторики желудка и улучшение координации его эвакуаторной функции. В нашем центре применялись такие препараты, как метоклопрамид, домперидон и эритромицин.
Особое внимание уделялось эритромицину, который проявляет свою эффективность за счет стимуляции мотилиновых рецепторов. Он активирует так называемую третью фазу мигрирующего моторного комплекса, обеспечивая мощные перистальтические волны, способствующие продвижению содержимого по желудку и кишечнику. Однако длительное использование эритромицина сопряжено с риском побочных явлений, таких как боли в животе, тошнота, диарея и удлинение интервала QT на электрокардиограмме. Поэтому для терапии гастростаза рекомендуется низкая доза препарата — от 1 до 3 мг/кг/час [15].
Согласно данным литературы рандомизированные исследования показали, что профилактическое применение эритромицина после обширных абдоминальных операций существенно снижает частоту развития гастростаза. В нашей практике эритромицин назначался пациентам, у которых гастростаз уже развился. Препарат вводился внутривенно капельно в дозировке 1000 мг, разведенный в 200 мл физиологического раствора, дважды в сутки с интервалом в 12 часов. Продолжительность курса составляла в среднем 5–7 суток.
Метоклопрамид, единственный препарат, одобренный FDA для лечения гастропареза, также широко применялся в нашей клинике. Он блокирует дофаминовые D2-рецепторы и активирует 5-HT4-рецепторы, стимулируя выделение ацетилхолина, что приводит к усилению моторики желудка. Препарат также повышает тонус нижнего пищеводного сфинктера, ускоряет сократительную активность антрального отдела и способствует эффективной антродуоденальной координации. В нашем центре метоклопрамид назначался внутримышечно по 2,0 мл дважды в сутки с интервалом 12 часов на протяжении 10–12 суток [16][17].
Домперидон, который также относится к классу антагонистов дофаминовых D2-рецепторов, имеет механизм действия, аналогичный метоклопрамиду, но при этом отличается меньшей проникающей способностью через гематоэнцефалический барьер, что снижает риск центральных побочных эффектов. Согласно ряду исследований эффективность домперидона сопоставима с метоклопрамидом, а комбинированное применение обоих препаратов и противорвотных средств позволяет достичь более быстрого положительного эффекта [18].
На фоне проводимой терапии уже к 3–5-му дню у пациентов наблюдалось уменьшение объема желудочного содержимого, эвакуируемого через назогастральный зонд, что свидетельствовало о восстановлении моторной функции желудка. В среднем к 10–12-м суткам лечения удавалось добиться полного купирования признаков гастростаза и перехода пациентов на самостоятельное питание.
ОБСУЖДЕНИЕ
Послеоперационный гастростаз — одно из наиболее частых осложнений после гастропанкреатодуоденальной резекции. По данным разных авторов, не существует определенного метода профилактики гастростаза после ГПДР [19][20]. По результатам наблюдения в Кыргызской Республике наблюдается довольно небольшой процент развития гастростаза у больных (23,5 %). Имеется закономерность развития гастростаза у больных с отсутствием наружного желчного дренажа, что требует дальнейшего и более молекулярного разбора патогенеза данного наблюдения. Мы нашли достоверную связь между развитием гастростаза и консистенцией поджелудочной железы, наибольшее количество больных с гастростазом приходится на тех, у кого отмечается «мягкая» поджелудочная железа без наличия наружного дренирования. Проверили связь между развитием гастростаза и характером паренхимы поджелудочной железы, критерий достоверности P ≤ 0,05. Согласно этому можно сделать вывод, что предрасполагающим фактором развития гастростаза является отсутствие наружного желчного дренажа. Данный факт может дать разгадку в этиологии развития гастростаза у больных после операции.
В лечении данного состояния мы использовали современные рекомендации рандомизированных клинических исследований, где сообщается, что профилактическое введение эритромицина может способствовать быстрому разрешению гастростаза, что мы и наблюдали у наших больных [21]. Мы выделили некоторые критерии (консистенция поджелудочной железы, повышенный уровень амилазы крови, гипоальбуминемия), которые могут способствовать развитию гастростаза, и далее необходимо более детально разобрать и уменьшить влияние предрасполагающих факторов, которые, по нашему мнению, вызывают гастростаз после ГПДР.
ЗАКЛЮЧЕНИЕ
Гастропанкреатодуоденальная резекция является одной из сложнейших операций в абдоминальной хирургии не только в техническом плане, но и в послеоперационном периоде. Данная операция сопряжена с высоким риском развития послеоперационных осложнений. Выявление факторов риска поможет дать разгадку в развитии таких осложнений, как гастростаз и панкреатические фистулы.
Список литературы
1. McGuigan A., Kelly P., Turkington R.C., Jones C., Coleman H.G., McCain R.S. Pancreatic cancer: a review of clinical diagnosis, epidemiology, treatment and outcomes. World J Gastroenterol. 2018; 24:4846–61. DOI: 10.3748/wjg.v24.i43.4846
2. Changazi S.H., Ahmed Q., Bhatti S., Siddique S., Abdul Raffay E., Farooka M.W., et al. Whipple procedure: a five-year clinical experience in Tertiary care center. Cureus. 2020;12(11):e11466. DOI: 10.7759/cureus.11466
3. Qiu J., Li M., Du C. Antecolic reconstruction is associated with a lower incidence of delayed gastric emptying compared to retrocolic technique after Whipple or pylorus-preserving pancreaticoduodenectomy. Medicine (Baltimore). 2019;98(34):e16663. DOI: 10.1097/MD.0000000000016663
4. Futagawa Y., Kanehira M., Furukawa K., Kitamura H., Yoshida S., Usuba T., et al. Impact of delayed gastric emptying after pancreaticoduodenectomy on survival. J Hepatobiliary Pancreat Sci. 2017;24(8):466–74. DOI: 10.1002/jhbp.482
5. Varghese C., Bhat S., Wang T.H., O’Grady G., Pandana boyana S. Impact of gastric resection and enteric anastomotic configuration on delayed gastric emptying after pancreaticoduodenectomy: a network meta-analysis of randomized trials. BJS Open. 2021;5(3):zrab035. DOI: 10.1093/bjsopen/zrab035
6. Müller P.C., Ruzza C., Kuemmerli C., Steinemann D.C., Müller S.A., Kessler U., et al. 4/5 gastrectomy in patients undergoing pancreaticoduodenectomy reduces delayed gastric emptying. J Surg Res. 2020;249:180–5. DOI: 10.1016/j.jss.2019.12.028
7. Klaiber U., Probst P., Strobel O., Michalski C.W., Dörr- Harim C., Diener M.K., et al. Meta-analysis of delayed gastric emptying after pylorus-preserving versus pylorus-resecting pancreatoduodenectomy. Br J Surg. 2018;105(4):339–49. DOI: 10.1002/bjs.10771
8. Bell R., Pandanaboyana S., Shah N., Bartlett A., Windsor J.A., Smith A.M. Meta-analysis of antecolic versus retrocolic gastric reconstruction after a pylorus-preserving pancreatoduodenectomy. HPB (Oxford). 2015;17(3):202–8. DOI: 10.1111/hpb.12344
9. Zhou Y., Hu B., Wei K., Si X. Braun anastomosis lowers the incidence of delayed gastric emptying following pancreaticoduodenectomy: a meta-analysis. BMC Gastroenterol. 2018;18(1):176. DOI: 10.1186/s12876-018-0909-5
10. Hwang H.K., Lee S.H., Han D.H., Choi S.H., Kang C.M., Lee W.J. Impact of Braun anastomosis on reducing delayed gastric emptying following pancreaticoduodenectomy: a prospective, randomized controlled trial. J Hepatobiliary Pancreat Sci. 2016;23(6):364–72. DOI: 10.1002/jhbp.349
11. Fujieda H., Yokoyama Y., Hirata A., Usui H., Sakatoku Y., Fukaya M., et al. Does Braun anastomosis have an impact on the incidence of delayed gastric emptying and the extent of intragastric bile reflux following pancreatoduodenectomy? — A randomized controlled study. Dig Surg. 2017;34(6):462–8. DOI: 10.1159/000455334
12. Xiao Y., Hao X., Yang Q., Li M., Wen J., Jiang C. Effect of BillrothII versus Roux-en-Y reconstruction for gastrojejunostomy after pancreaticoduodenectomy on delayed gastric emptying: a metaanalysis of randomized controlled trials. J Hepatobiliary Pancreat Sci. 2021;28(5):397–408. DOI: 10.1002/jhbp.828
13. Busquets J., Martín S., Fabregat J., Secanella L., Pelaez N., Ramos E. Randomized trial of two types of gastrojejuno stomy after pancreatoduodenectomy and risk of delayed gastric emptying (PAUDA trial). Br J Surg. 2019;106(1):46–54. DOI: 10.1002/bjs.11023
14. Herrera Cabezón J., Sánchez Acedo P., TarifaCastilla A., ZazpeRipa C. Delayed gastric emptying following pancreatoduodenectomy: a Rouxen-Y gastrojejunostomy vs Billroth II gastrojejunostomy randomized study. Rev Esp Enferm Dig. 2019;111(1):34–9. DOI: 10.17235/reed.2018.5744/2018
15. Hayama S., Senmaru N., Hirano S. Delayed gastric emptying after pancreatoduodenectomy: comparison between invaginated pancreatogastrostomy and pancreatojejunostomy. BMC Surg. 2020;20(1):60. DOI: 10.1186/s12893-020-00707-w
16. Jin Y., Feng Y.Y., Qi X.G., Hao G., Yu Y.Q., Li J.T., et al. Pancreatogastrostomy vs pancreatojejunostomy after pancreaticoduodenectomy: an updated meta-analysis of RCTs and our experience. World J Gastrointest Surg. 2019;11(7):322–32. DOI: 10.4240/wjgs.v11.i7.322
17. van Hilst J., de Rooij T., Bosscha K., Brinkman D.J., van Dieren S., Dijkgraaf M.G., et al. Dutch Pancreatic Cancer Group. Laparoscopic versus open pancreatoduodenectomy for pancreatic or periampullary tumours (LEOPARD-2): a multicentre, patient-blinded, randomised controlled phase 2/3 trial. Lancet Gastroenterol Hepatol. 2019;4(3):199–207. DOI: 10.1016/S2468-1253(19)30004-4
18. Poves I., Burdío F., Morató O., Iglesias M., Radosevic A., Ilzarbe L., et al. Comparison of perioperative outcomes between laparoscopic and open approach for pancreatoduodenectomy: the PADULAP randomized controlled trial. Ann Surg. 2018;268(5):731–9. DOI: 10.1097/SLA.0000000000002893
19. Zhang H., Lan X., Peng B., Li B. Is total laparoscopic pancreaticoduodenectomy superior to open procedure? A meta-analysis. World J Gastroenterol. 2019;25(37):5711–31. DOI: 10.3748/wjg.v25.i37.5711
20. Ausania F., Landi F., Martínez-Pérez A., Fondevila C. A meta-analysis of randomized controlled trials comparing laparoscopic vs open pancreaticoduodenectomy. HPB (Oxford). 2019;21(12):1613–20. DOI: 10.1016/j.hpb.2019.05.017
21. Lin D., Yu Z., Chen X., Chen W., Zou Y., Hu J. Laparoscopic versus open pancreatoduodenectomy: a meta-analysis of randomized controlled trials. Rev Esp Enferm Dig. 2020;112(1):34–40. DOI: 10.17235/reed.2019.6343/2019
Об авторах
Ф. С. РахимоваРоссия
Рахимова Фарида Сулеймановна — аспирант, кафедра госпитальной хирургии
Кыргызская Республика, Бишкек
Б. Х. Бебезов
Россия
Бебезов Бахадыр Хакимович — д.м.н., профессор, кафедра инновационных хирургических технологий
Кыргызская Республика, Бишкек
Н. Д. Мамашев
Россия
Мамашев Нурлан Джурабаевич — к.м.н., доцент, кафедра инновационных хирургических технологий
Кыргызская Республика, Бишкек
Э. А. Суров
Россия
Суров Эдир Арбудуевич — к.м.н., доцент, кафедра госпитальной хирургии
Кыргызская Республика, Бишкек
Рецензия
Для цитирования:
Рахимова Ф.С., Бебезов Б.Х., Мамашев Н.Д., Суров Э.А. Гастростаз после гастропанкреатодуоденальной резекции: наш опыт. Креативная хирургия и онкология. 2025;15(3):251-258. https://doi.org/10.24060/2076-3093-2025-15-3-251-258
For citation:
Rakhimova F.S., Bebezov B.Kh., Mamashev N.D., Surov E.A. Delayed Gastric Emptying after Gastropancreatoduodenal Resection: Our Experience. Creative surgery and oncology. 2025;15(3):251-258. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-3-251-258


































