Перейти к:
Пункционная чрескожная криоабляция при метастатическом поражении ребер
https://doi.org/10.24060/2076-3093-2022-12-3-187-192
Аннотация
Введение. Мини-инвазивная чрескожная криоабляция применяется при опухолевом поражении костей с целью локального контроля и купирования болевого синдрома. Проведение подобных процедур при деструкции костей грудной клетки сопровождается риском повреждения органов грудной и брюшной полостей, а также крупных сосудов. В статье рассмотрены особенности проведения пункционной чрескожной криоабляции при метастатическом поражении ребер.
Целью работы является рассмотрение методологических аспектов проведения чрескожной криоабляции при метастатическом поражении ребер, уточнение пункционных стереотаксических доступов.
Материалы и методы. Процедура была выполнена 11 пациентам с олигометастатическим поражением костей. Размеры очагов в ребрах варьировали от 7 до 55 мм. Операции выполнялись в КТ-операционной под эндотрахеальным наркозом. При абляции применялась азотная криосистема с многоразовыми зондами диаметром от 1,5 до 3,0 мм. Криоабляция включала два цикла охлаждения до целевой температуры –190 °C с экспозицией 10 и 6 минут соответственно.
Результаты и обсуждение. Были предложены оптимальные пункционные доступы для установки криозондов при опухолевой деструкции ребер: тангенциальный и перпендикулярный. При тангенциальном доступе криозонд может устанавливаться как непосредственно в опухолевый очаг (интраоссальный вариант), так и в мягкие ткани вдоль кости на уровне очага поражения (параоссальный вариант). Период наблюдения после процедуры варьировал от 3 до 27 месяцев (11,4 ± 5,6 месяца). В 3 случаях зафиксировано формирование патологического перелома на уровне аблированного очага. Локальный контроль над опухолевым процессом был достигнут у 10 пациентов, рецидив в зоне абляции отмечен в одном случае через 3 месяца после процедуры.
Заключение. Использование описанных доступов, а также проведение мероприятий, направленных на предотвращение холодового повреждения кожи, во всех случаях позволили достичь цели вмешательства и избежать осложнений.
Ключевые слова
Для цитирования:
Буровик И.А., Прохоров Г.Г., Багненко С.С., Васильев А.В. Пункционная чрескожная криоабляция при метастатическом поражении ребер. Креативная хирургия и онкология. 2022;12(3):187-192. https://doi.org/10.24060/2076-3093-2022-12-3-187-192
For citation:
Burovik I.A., Prokhorov G.G., Bagnenko S.S., Vasilev A.V. Percutaneous Puncture Cryoablation in Patients with Rib Metastatic Lesions. Creative surgery and oncology. 2022;12(3):187-192. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-3-187-192
ВВЕДЕНИЕ
Скелет является третьей по частоте мишенью метастазирования при раке предстательной железы, легкого, почек, молочной и щитовидной желез. При этом до 85 % пациентов, умерших от рака молочной железы, легкого или предстательной железы, на момент смерти имели очаги вторичного поражения в костях [1].
Известен целый ряд осложнений, обусловленных опухолевой остеодеструкцией, таких как патологические переломы, гиперкальциемия, компрессия спинного мозга, миелосупрессия [2]. Подобные проявления метастатического процесса значительно ограничивают физическую активность пациентов, сопровождаются депрессией, что влияет на качество и продолжительность жизни больных [3]. В связи с этим одним из приоритетов лечения данной когорты пациентов является профилактика соответствующих осложнений, купирование боли и поддержание качества жизни.
Арсенал средств, используемых при терапии метастатического поражения костей и связанных с ним симптомов, достаточно широк и включает фармакотерапию (нестероидные противовоспалительные препараты и опиоидные анальгетики, остеомодифицирующие агенты, кортикостероиды, трициклические антидепрессанты), лучевую терапию, хирургическое пособие, мини-инвазивные и неинвазивные аблятивные технологии (радиочастотная, микроволновая, криоблация, воздействие высокоинтенсивным фокусированным ультразвуком, другие виды абляции) [4–6].
При лечении метастазов в кости на протяжении последних лет все большее клиническое применение находит методика пункционной чрескожной криоабляции (ЧКА) [7, 8]. Как правило, процедура выполняется под контролем компьютерной томографии, позволяющей как эффективно визуализировать зону костной деструкции и рядом расположенные органы и ткани, так и осуществлять мониторинг формирования ледяного шара. Помимо клинических данных на показания и противопоказания к операции влияют размеры и формы очага поражения, его локализация, возможность безопасного пункционного доступа. Специфика позиционирования инструментов, связанная с топографо-анатомическими особенностями некоторых сложных локализаций патологического процесса в костях, освещена в литературе [9]. Определенные затруднения может представлять проведение ЧКА при опухолевом поражении ребер, что, с одной стороны, вызвано специфической конфигурацией метастатических очагов, обусловленной соответствующей формой кости, а с другой — возможностью повреждения межреберных сосудов, травматизацией сосудов и нервов верхнего средостения и шеи при поражении 1–2 ребер, а также повреждением легких и других органов при проникновении криозонда или стилета в грудную полость.
Целью данной работы явилось рассмотрение методологических аспектов проведения чрескожной криоабляции при метастатическом поражении ребер, уточнение пункционных стереотаксических доступов.
МЕТОДЫ И МАТЕРИАЛЫ
В ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава России были проведены 11 процедур ЧКА у 11 пациентов с метастазами в ребрах. Исследуемая группа включала 6 (55 %) женщин и 5 (45 %) мужчин в возрасте от 32 до 74 лет (среднее значение 58,6 ± 10,2 года). Среди нозологических форм встречались рак молочной железы (4 случая), рак легкого (3 случая), рак предстательной железы (2 случая), рак шейки матки (1 случай), рак почки (1 случай). В 7 наблюдениях абляции подверглись литические очаги поражения, в 4 — метастазы имели бластический характер. Размеры очагов варьировали от 7 до 55 мм в большем измерении (среднее значение 28,3 ± 14,5 мм).
Показаниями к проведению операции служили олигометастатический характер опухолевого процесса (до 3 очагов поражения), наличие болевого синдрома равного 3 и более баллам по цифровой аналоговой шкале, не купирующегося ненаркотическими анальгетиками, размеры очагов деструкции до 6 см по оси ребра и до 3 см в поперечном измерении, удовлетворительное общесоматическое состояние пациентов.
Олигометастатичекий характер процесса подтверждался и предоперационное планирование выполнялось на основе данных ОФЭКТ-КТ или КТ.
Решение о проведении ЧКА принималось врачебным консилиумом в составе хирурга-онколога, радио- и химиотерапевта, рентгенолога (интервенционного радиолога).
В случаях, когда пациенты получали лекарственное противоопухолевое лечение, ЧКА планировалась между циклами химиотерапии после нормализации показателей анализов крови.
Процедура криоабляции выполнялась в КТ-операционной под эндотрахеальным наркозом. При абляции применялась азотная «Система медицинская криотерапевтическая (МКС)» с многоразовыми зондами диаметром от 1,5 до 3,0 мм. Положение пациента (на животе, боку или спине) выбирали исходя из удобства пункционного доступа к соответствующему участку ребра; пациента фиксировали на столе томографа с помощью вакуумного матраса. Введение инструментов выполняли под КТ-контролем в последовательном режиме, без применения дополнительного навигационного оборудования. При необходимости забора материала для патоморфологического исследования процедуре абляции предшествовала трепанобиопсия.
Выбор числа и диаметра устанавливаемых криозондов определялся размерами и формой очагов поражения, а также топографо-анатомическими особенностями области хирургических манипуляций. Вариант пункционного доступа выбирали с учетом требований к безопасности введения криозондов и на основе понимания особенностей формирования ледяного шара в каждом конкретном случае.
Процедура ЧКА включала два цикла охлаждения до целевой температуры –190 °C с экспозицией 10 и 6 минут соответственно. Между циклами и после окончания криовоздействия применяли пассивное оттаивание опухоли.
РЕЗУЛЬТАТЫ
Манипуляции хирургическим инструментарием при ЧКА метастазов в ребрах во многом ограничены в связи с возможностью повреждения близко расположенных органов грудной и брюшной полостей, а также крупных сосудов и нервов. Кроме того, на способ реализации процедуры накладывает отпечаток характерная вытянутая вдоль оси ребра форма большинства поражений. Тем не менее при всех операциях удалось достичь полного перекрытия метастатического очага ледяной сферой. Совокупность клинических наблюдений позволила выделить следующие варианты оптимальных пункционных доступов для ЧКА опухолевых поражений ребер.
- Тангенциальный
Тангенциальный пункционный доступ предполагает траекторию введения криозонда, направленную под острым углом к поверхности ребра, что позволяет расположить инструмент непосредственно по оси кости. Такой способ установки обеспечивает абляцию значительной по протяженности зоны поражения. При тангенциальном способе позиционирования возможны два варианта расположения криозонда:
– интраоссальный. При таком варианте криозонд вводится непосредственно в очаг остеодеструкции (рис. 1). Реализация интраоссального варианта оптимальна при литическом варианте опухолевого поражения, сопровождающегося вздутием ребра, разрушением его кортикального слоя и формированием значительного по объему мягкотканного опухолевого компонента;
– параоссальный. Этот вариант предполагает расположение криозонда в мягких тканях в непосредственной близости к кости; оптимально добиться контакта криокамеры зонда с измененным участком ребра на всем его протяжении (рис. 2). Параоссальный доступ применим при относительно небольших по толщине очагах поражения; размеры последнего определяют выбор криозонда необходимого диаметра. Также этот вариант доступа оптимален при бластическом характере поражения кости, когда попытка ее пенетрации стилетом или криозондом чревата соскальзыванием инструмента с поверхности кости и «проваливанием» в грудную или брюшную полость. Необходимо учитывать, что при параоссальном позиционировании криозонда на опухолевый очаг распространяется только половина ледяной сферы, что ограничивает возможность абляции крупных метастазов, так как в подобной ситуации сложно добиться полной девитализации части новообразования, обращенной к плевральной полости. Паренхима легкого выступает в этой ситуации естественным термопротектором и благодаря активной перфузии препятствует эффективному охлаждению опухолевой ткани. В связи с этим визуально определяемое вовлечение соответствующего участка легкого в ледяную сферу позволяет с большей уверенностью предполагать полноценную абляцию очага поражения (рис. 2 в).
- Перпендикулярный
При данном пункционном доступе инструмент вводится перпендикулярно оси ребра (рис. 3). Такой способ в основном применим на этапе биопсии, когда можно ограничиться прохождением иглой лишь наружной пластинки кости. При установке же криозонда оптимальным является прохождение инструментом очага деструкции насквозь, что создает высокие риски повреждения легкого и других внутренних органов. В связи с этим введение криозонда по перпендикулярной траектории может потребовать предварительного наложения искусственного пневмоторакса или пневмоперитонеума.
В связи с тем что зона абляции, как правило, располагалась достаточно поверхностно при любом способе установи криозондов, имелся риск вовлечения в ледяную сферу кожи. Особенно это было актуально для пациентов с дефицитом подкожно-жировой клетчатки. Это обуславливало необходимость термопротективных мероприятий, в частности инъекции в мягкие ткани грудной стенки физиологического раствора в объеме 50–120 мл и/или расположения на поверхности тела над ледяной сферой стерильной перчатки, заполненной горячим теплоносителем. Подобный подход во всех случаях позволил избежать термического повреждения кожного покрова.
При всех процедурах ЧКА не отмечалось значимых интра- и послеоперационных осложнений. У пациентов с предсуществующим болевым синдромом непосредственно после процедуры было установлено снижение боли до 1–2 баллов по цифровой аналоговой шкале, которое было стойким на протяжении дальнейшего периода наблюдения (минимально 3 месяца). Два пациента без предшествующего болевого синдрома в раннем послеоперационном периоде предъявляли жалобы на умеренную боль в области операции, которая полностью регрессировала в течение недели после процедуры.
После операции в рамках динамического наблюдения пациентам выполнялись контрольные КТ. Период наблюдения после процедуры варьировал от 3 до 27 месяцев (11,4 ± 5,6 месяца). В 3 случаях зафиксировано формирование патологического перелома на уровне аблированного очага. Локальный контроль над опухолевым процессом был достигнут у 10 пациентов, рецидив в зоне абляции отмечен в одном случае через 3 месяца после ЧКА.
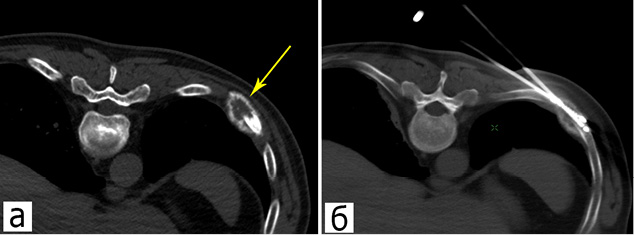
Рисунок 1. КТ-изображения пациента К., 64 года: а — метастаз в ребре рака легкого (стрелка); б — криозонды, установленные в очаг деструкции в ребре тангенциальным доступом (интраоссальный вариант)
Figure 1. CT-images of a male patient K., 64 years old: a — rib metastasis of the lung cancer (arrow); б — cryoprobes installed into the rib destruction lesion by the tangential access (intraosseous variant)
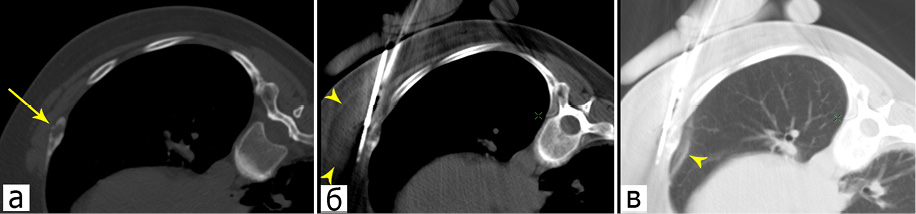
Рисунок 2. КТ-изображения пациентки Р., 54 года: а — метастаз в ребре рака молочной железы (стрелка); б, в — криозонды, установленные вдоль очага деструкции в ребре тангенциальным доступом (параоссальный вариант), видна ледяная сфера в мягких тканях грудной стенки и прилежащем отделе легкого (головки стрелок)
Figure 2. CT-images of a female patient R., 54 years old: a — rib metastasis of the breast cancer (arrow); б, в — cryoprobes installed along the rib destruction lesion in the rib by the tangential access (paraosseous variant) with the visible ice sphere in the soft tissues of the chest wall and adjacent lung (arrow heads)
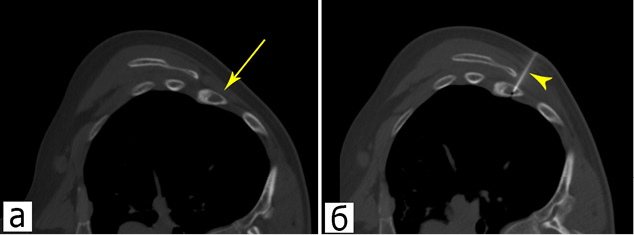
Рисунок 3. КТ изображения пациентки М., 52 года: а — метастаз в ребре рака легкого (стрелка); б — тонкоигольная аспирационная биопсия перед криоабляцией, биопсийная игла (головка стрелки)
Figure 3. CT-images of a female patient M., 52 years old: a — rib metastasis of the lung cancer (arrow); б — fine needle aspirate biopsy prior to the cryoablation, biopsy needle (arrow head)
ОБСУЖДЕНИЕ
За последние несколько десятилетий достижения в области лекарственного, лучевого и хирургического лечения оказали значительное влияние на подходы к терапии пациентов с метастатическим поражением костей. Выбор метода лечения зависит от ряда факторов, например, имеет ли место олигометастатическое или полиоссальное поражение, наличия экстраскелетных метастазов, вида рака и его особенностей, предшествующей терапии и ответа на нее, симптомов заболевания и общего состояния здоровья [3][10].
Прогноз в отношении продолжительности жизни и возможных осложнений является важным фактором выбора способа лечения [11]. Короткая ожидаемая продолжительность жизни предполагает приоритетность менее инвазивного способа лечения с коротким периодом реабилитации и меньшим количеством возможных осложнений [12].
У пациентов с выраженным болевым синдромом, обусловленным метастатическим поражением костей, дистанционная лучевая терапия остается стандартом лечения, наряду с опиоидными и неопиоидными анальгетиками [13][14]. Однако у данной когорты пациентов болевой синдром нередко сохраняется и после проведенного лучевого воздействия. Так, по данным R. Chow и соавт., наиболее часто применяемая доза в 8 Гр обеспечивает полный ответ только у 22 % и частичный ответ у 38 % пациентов; другие режимы лучевой терапии не дают адекватного противоболевого эффекта у большинства больных [15]. Для этих пациентов прием опиоидных анальгетиков нередко представляется единственным оставшимся вариантом [16].
Мини-инвазивные аблятивные технологии у ряда больных могут быть эффективной альтернативой лучевой терапии. Эта группа методов позволяет как добиться локального контроля над опухолевым процессом, так и купировать болевой синдром [17]. Более того, в отличие от лучевой терапии, при которой повторное применение может быть лимитировано достижением предельных доз облучения, методы локального воздействия подходят для многократного использования.
При диссеминации опухолевого процесса метастазы в ребрах выявляются достаточно часто. Так, исследование, проведенное V. R. Kakhki и соавт., показало, что частота вторичного поражения ребер уступает таковой только при деструкции позвонков [18]. Относительно неглубокое расположение ребер и, как правило, выраженный болевой синдром, связанный с вовлечением в опухолевый процесс межреберных нервов и раздражением надкостницы, определяют обоснованность использования мини-инвазивных технологий, в том числе криоабляции, в подобных клинических случаях.
Необходимо учитывать, что осуществление пункционных хирургических манипуляций в области грудной клетки требует от оператора хорошего пространственного представления, детальных знаний анатомических особенностей этой зоны, ориентации в лучевой анатомии. При пункционном введении инструментов в случае опухолевого поражения ребра значителен риск повреждения межреберных сосудов, проходящих в реберной борозде вдоль нижнего края кости, и легкого. Кроме того, при манипуляциях на уровне 1–2-го ребер следует учитывать близкое расположение подключичных сосудов, а на уровне нижних ребер — селезенки, печени и других органов полости живота. Особую сложность представляет собой трепанация кости в случае целостного кортикального слоя: при этом высок риск соскальзывания трепана и повреждения подлежащих структур как на этапе биопсии, так и при установке зонда. Однако если в случае забора материала для патоморфологического исследования введение биопсийной иглы в зону деструкции является необходимым, то установка зонда может быть выполнена параоссально.
Залогом эффективности ЧКА является полное перекрытие ледяной сферой очага деструкции и достижение целевых показателей температуры во всей опухолевой массе. При мониторинге ледяной сферы необходимо избегать вовлечения в зону абляции подключичных сосудов, сосудов шеи, плечевого сплетения при локализации патологического процесса в области 1–2-го ребер, а в случае абляции новообразований нижних ребер — полых и паренхиматозных органов брюшной полости. Промораживание структур межреберных промежутков и прилежащего к ребру участка легкого, как правило, является безопасным и не сопровождается какими-либо осложнениями.
ЗАКЛЮЧЕНИЕ
Оптимальным вариантом для позиционирования криозондов при абляции метастатических поражений ребер является тангенциальный пункционный доступ; в отдельных случаях возможно применение перпендикулярного доступа.
При бластических формах метастазов и небольших очагах поражения возможно применение параоссального варианта введения криозондов; при новообразованиях со значительным по размеру мягкотканным компонентом предпочтительна установка криозондов непосредственно в опухолевый очаг.
Близкое расположение криозондов к поверхности тела при проведении абляции требует термопротективных мероприятий, направленных на предотвращение холодового повреждения кожи.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of Interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Sponsorship Data. This work is not funded.
Список литературы
1. Macedo F., Ladeira K., Pinho F., Saraiva N., Bonito N., Pinto L., et al. Bone metastases: an overview. Oncol Rev. 2017;11(1):321. DOI: 10.4081/oncol.2017.321
2. Hernandez R.K., Wade S.W., Reich A., Pirolli M., Liede A., Lyman G.H. Incidence of bone metastases in patients with solid tumors: analysis of oncology electronic medical records in the United States. BMC Cancer. 2018;18(1):44. DOI: 10.1186/s12885-017-3922-0
3. Janssen S.J., Pereira N.R.P., Thio Q.C.B.S., Raskin K.A., Bramer J.A.M., Lozano-Calderon S.A., et al. Physical function and pain intensity in patients with metastatic bone disease. J Surg Oncol. 2019;120(3):376–81. DOI: 10.1002/jso.25510
4. Kurup A.N., Callstrom M.R. Image-guided percutaneous ablation of bone and soft tissue tumors. Semin Intervent Radiol. 2010;27(3):276–84. DOI: 10.1055/s-0030-1261786
5. Ahmad I., Ahmed M.M., Ahsraf M.F., Naeem A., Tasleem A., Ahmed M., et al. Pain management in metastatic bone disease: a literature review. Cureus. 2018;10(9):e3286. DOI: 10.7759/cureus.3286
6. Bennett M.I., Eisenberg E., Ahmedzai S.H., Bhaskar A., O’Brien T., Mercadante S., et al. Standards for the management of cancer-related pain across Europe-A position paper from the EFIC Task Force on Cancer Pain. Eur. J Pain. 2019;23(4):660–8. DOI: 10.1002/ejp.1346
7. Jennings J.W., Prologo J.D., Garnon J., Gangi A., Buy X., Palussière J., et al. Cryoablation for palliation of painful bone metastases: the MOTION multicenter study. Radiol Imaging Cancer. 2021;3(2):e200101. DOI: 10.1148/rycan.2021200101
8. Буровик И.А., Прохоров Г.Г., Багненко С.С., Шевкунов Л.Н., Мелдо А.А., Гильфанова Р.Р. и др. Пункционная чрескожная стереотаксическая криоаблация в купировании боли при метастатическом поражении костей. Онкологический журнал: лучевая диагностика, лучевая терапия. 2022;5(1):65–73. DOI: 10.37174/2587-7593-2022-5-1-65-73
9. Буровик И.А., Прохоров Г.Г., Оконечникова Д.В. Пункционные доступы для чрескожных миниинвазивных вмешательств под КТ контролем при опухолях костей таза. Диагностическая и интервенционная радиология. 2021;15(2):9–17. DOI: 10.25512/DIR.2021.15.2.01
10. Barzilai O., Versteeg A.L., Sahgal A., Rhines L.D., Bilsky M.H., Sciubba D.M., et al. Survival, local control, and health-related quality of life in patients with oligometastatic and polymetastatic spinal tumors: A multicenter, international study. Cancer. 2019;125(5):770–8. DOI: 10.1002/cncr.31870
11. Maisano R., Pergolizzi S., Cascinu S. Novel therapeutic approaches to cancer patients with bone metastasis. Crit Rev Oncol Hematol. 2001;40(3):239–50. DOI: 10.1016/s1040-8428(01)00092-0
12. Errani C., Mavrogenis A.F., Cevolani L., Spinelli S., Piccioli A., Maccauro G., et al. Treatment for long bone metastases based on a systematic literature review. Eur J Orthop Surg Traumatol. 2017;27(2):205–11. DOI: 10.1007/s00590-016-1857-9
13. Carlson C.L. Effectiveness of the World Health Organization cancer pain relief guidelines: an integrative review. J Pain Res. 2016;9:515–34. DOI: 10.2147/JPR.S97759
14. Fallon M., Giusti R., Aielli F., Hoskin P., Rolke R., Sharma M., et al. ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Management of cancer pain in adult patients: ESMO Clinical Practice Guidelines. Ann Oncol. 2018;29(4):iv166–91. DOI: 10.1093/annonc/mdy152
15. Chow R., Hoskin P., Hollenberg D., Lam M., Dennis K., Lutz S., et al. Efficacy of single fraction conventional radiation therapy for painful uncomplicated bone metastases: a systematic review and meta-analysis. Ann Palliat Med. 2017;6(2):125–42. DOI: 10.21037/apm.2016.12.04
16. von Moos R., Costa L., Ripamonti C.I., Niepel D., Santini D. Improving quality of life in patients with advanced cancer: Targeting metastatic bone pain. Eur J Cancer. 2017;71:80–94. DOI: 10.1016/j.ejca.2016.10.021
17. Gennaro N., Sconfienza L.M., Ambrogi F., Boveri S., Lanza E. Thermal ablation to relieve pain from metastatic bone disease: a systematic review. Skeletal Radiol. 2019;48(8):1161–9. DOI: 10.1007/s00256-018-3140-0
18. Kakhki V.R., Anvari K., Sadeghi R., Mahmoudian A.S., Torabian-Kakhki M. Pattern and distribution of bone metastases in common malignant tumors. Nucl Med Rev Cent East Eur. 2013;16(2):66–9. DOI: 10.5603/NMR.2013.0037
Об авторах
И. А. БуровикРоссия
к.м.н., научное отделение диагностической и интервенционной радиологии, кафедра онкологии
Санкт-Петербург
Г. Г. Прохоров
Россия
д.м.н., профессор, научное отделение общей онкологии и урологии
Санкт-Петербург
С. С. Багненко
Россия
д.м.н., доцент, кафедра современных методов диагностики и радиолучевой терапии
Санкт-Петербург
А. В. Васильев
Россия
отделение лучевой диагностики
Санкт-Петербург
Рецензия
Для цитирования:
Буровик И.А., Прохоров Г.Г., Багненко С.С., Васильев А.В. Пункционная чрескожная криоабляция при метастатическом поражении ребер. Креативная хирургия и онкология. 2022;12(3):187-192. https://doi.org/10.24060/2076-3093-2022-12-3-187-192
For citation:
Burovik I.A., Prokhorov G.G., Bagnenko S.S., Vasilev A.V. Percutaneous Puncture Cryoablation in Patients with Rib Metastatic Lesions. Creative surgery and oncology. 2022;12(3):187-192. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-3-187-192


































