Перейти к:
Радиомический анализ для объективизации диагностики и комплексного лечения глиобластомы
https://doi.org/10.24060/2076-3093-2022-12-3-237-243
Аннотация
Введение. Глиобластома – нейроэпителиальная злокачественная опухоль головного мозга преимущественно астроцитарного происхождения с агрессивным течением и крайне неблагоприятным прогнозом. Медиана общей выживаемости при глиобластоме составляет 14,6 месяца после комплексного лечения, включающего комбинацию хирургического лечения, лучевой терапии и химиотерапии, что диктует необходимость разработки персонализированного подхода в диагностике и лечении глиобластом.
Материалы и методы: МРТ-исследования пациента, проходившего химиолучевое лечение по поводу глиобластомы G4, выполнялись на аппаратах: магнитно-резонансный томограф Philips Ingenia 1.5T и Philips Ingeniа Аmbition 1,5 Т. Анализ МРТ-изображений осуществлен с использованием пакета прикладных программ Matlab 2021.
Результаты. Проанализированы МРТ-изображения до проведения хирургического вмешательства, после хирургического вмешательства и после курса химиолучевого лечения. В качестве информативных признаков очагов поражения на изображениях проанализированы статистические характеристики локального распределения яркости изображения очага поражения, которые описываются статистическими текстурными параметрами.
Обсуждение. Получено первичное подтверждение возможности объективизации процесса диагностики и лечения по указанным статистическим параметрам Т2 МРТ-изображений очагов поражения.
Заключение. Целью дальнейших исследований в данном направлении является применение радиомического анализа для планирования, мониторинга лечения глиом высокой степени злокачественности, для прогнозирования исходов заболевания, а также предиктивного анализа ответа на комплексное лечение.
Ключевые слова
Для цитирования:
Никульшина Я.О., Редькин А.Н., Колпаков А.В., Захаров М.А. Радиомический анализ для объективизации диагностики и комплексного лечения глиобластомы. Креативная хирургия и онкология. 2022;12(3):237-243. https://doi.org/10.24060/2076-3093-2022-12-3-237-243
For citation:
Nikulshina Ya.O., Redkin A.N., Kolpakov A.V., Zakharov M.A. Radiomic Study for Objectification of Diagnostics and Complex Treatment of Glioblastoma. Creative surgery and oncology. 2022;12(3):237-243. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-3-237-243
ВВЕДЕНИЕ
Глиобластома является нейроэпителиальной злокачественной опухолью головного мозга преимущественно астроцитарного, реже олигодендроглиального происхождения с агрессивным течением и крайне неблагоприятным прогнозом [1–3]. По данным Американского регистра опухолей нервной системы CBTRUS, частота встречаемости глиобластом составляет 14,7 % среди всех опухолей центральной нервной системы и 47,7 % среди всех злокачественных опухолей головного мозга [4]. Медиана общей выживаемости при глиобластоме составляет 14,6 месяца после стандартного лечения, включающего комбинацию хирургического лечения, лучевой терапии и химиотерапии [1][3][4]. Различные молекулярно-генетические характеристики глиобластомы у отдельных пациентов, а также внутриопухолевая гетерогенность объясняют сравнительно небольшую эффективность стандартных методов лечения [5–11], что создает проблему в оказании качественной онкологической помощи и диктует необходимость разработки персонализированного подхода в диагностике и лечении глиобластом [3][4][11–14].
Магнитно-резонансная томография (МРТ) с контрастным усилением является «золотым стандартом» диагностики глиобластом [4][7][12–16]. Из-за повышенной проницаемости сосудов незрелой опухоли происходит экстраваскулярное накопление контрастного вещества с укорочением времени Т1 и усилением сигнала на Т1-взвешенных изображениях [2][3][14][17]. Характерно, что на МРТ глиобластомы проявляются в виде образования с нечеткими контурами, неоднородной структуры, с зонами неравномерного накопления контрастного вещества, окружающими гипоинтенсивный на Т1-взвешенных изображениях некротический центр опухоли [2–4][13][14][17]. Появление некроза, отличительного признака глиобластомы, связано как с наличием тромбированных сосудов, так и с высокой скоростью пролиферации опухолевых клеток, что приводит к несоответствию между ускоренным потреблением кислорода и дефицитом кровоснабжения [7–11][13][15–17]. Также отмечается перифокальный вазогенный отек, признаки включения гемосидерина (кровоизлияния в структуре опухоли), масс-эффект (деформация или смещение соседних структур). Эти характеристики МР-визуализации отражают особенности строения самой опухоли, а также ее микроокружение [4][5][8][16–18].
Поскольку МР-изображения отражают структурные изменения в опухоли, неразрывно связанные с нарушением метаболизма нормальных тканей, их количественная оценка и разработка информативных параметров МР-изображений могут повысить точность определения внутриопухолевой гетерогенности и помочь в изучении патофизиологических и молекулярно-генетических механизмов конкретной опухоли, установить связь с тем или иным клиническим исходом [5, 13–19].
Радиомика — это многоэтапный процесс, включающий получение и предварительную обработку изображений, сегментацию, извлечение и выбор признаков, а также расширенную статистику с использованием алгоритмов машинного обучения [5–12, 17–20]. Существует множество методов описания и анализа признаков объектов на радиомических изображениях: анализ геометрических характеристик объектов, анализ характерных особенностей локальных перепадов яркостей, анализ статистических характеристик текстур и др. В результате из одного изображения извлекается до сотен признаков. Наконец, выделенные информативные признаки вместе с клиническими исходами используются как исходные данные для построения классификационных или прогностических моделей [5, 8, 10, 17–19].
Цель: исследование возможности объективного численного контроля динамики патологического процесса и контроля эффективности комплексного лечения глиобластомы у конкретного пациента по информативным параметрам МРТ-изображений.
МАТЕРИАЛЫ И МЕТОДЫ
Использовались клинические данные пациента, проходившего химиолучевое лечение по поводу глиобластомы G4 в радиотерапевтическом отделении БУЗ ВО ВОКОД в 2021 г. Представленные МРТ-исследования выполнялись в отделении лучевой диагностики БУЗ ВО «ВОКОД» на аппаратах: магнитно-резонансный томограф Philips Ingenia 1.5T и Philips Ingeniа Аmbition 1,5 Т. Анализ МРТ-изображений осуществлен на базе МГТУ им. Н. Э. Баумана с использованием пакета прикладных программ Matlab 2021.
Пациент С., 1986 г. р., с диагнозом: глиобластома G4 правой лобной доли. Гистологическое заключение № 22854 от 20.09.2021: Глиобластома G4.
МРТ от 12.09.2021 (до оперативного лечения) (рис. 1):
В правой лобной доле определяется крупное кистозно-солидное образование с выраженным масс-эффектом, распространяющимся до височной доли. Общими размерами 8,7×6,7×7,8 см. Образование компремирует желудочковую систему головного мозга, задний рог левого бокового желудочка расширен. Определяется дислокация срединных структур влево на 1,7 см. Мозолистое тело несколько оттеснено кзади, компремировано в области колена. Средний мозг тоже несколько компремирован. Борозды сужены в правом полушарии головного мозга. Заключение: признаки объемного образования правой лобной доли (более вероятно, олигодендроглиома).
Находился на лечении в отделении «Нейрохирургическое» ВОКБ № 1 с 13.09.2021 по 29.09.2021 с диагнозом: объемное внутримозговое кистозно-солидное образование правой лобной доли. Отек, дислокация структур головного мозга. 15.09.2021 оперативное лечение: микрохирургическое удаление внутримозгового объемного образования правой лобной области с интраоперационным УЗ-сканированием.
В раннем послеоперационном периоде при выполнении контрольной КТ головного мозга выявлена острая эпидуральная гематома справа. В экстренном порядке выполнена операция 16.09.2021 — удаление острой эпидуральной гематомы справа.
ГД № 22854 от 20.09.2021: глиобластома G4.
МРТ от 20.10.2021 (после оперативного лечения) (рис. 2):
В правой лобной доле с распространением на левую лобную долю определяется послеоперационная полость с отложениями гемосидерина размерами 51×49×28 мм. Стенки п/о полости неравномерно накапливают контрастное вещетво. Вокруг зона перифокального отека на участке размерами 53×68×40 мм. Парасагиттально по заднему и нижнему контурам п/о полости в правой лобной доле зона измененного МР-сигнала по FLAIR размерами 17×36×33 мм, оттесняющая левую лобную долю.
Заключение: глиобластома G4, состояние после оперативного лечения. МР-картина остаточной опухоли.
В радиотерапевтическом отделении проведено химиолучевое лечение с 01.11.2021 по 17.12.2021 (рис. 3): курс дистанционной IMRT лучевой терапии на остаточную ткань опухоли правой лобной доли на линейном ускорителе Varian Halcyon. РОД 1.8 Гр. СОД 59.4 Гр. Нагрузка на критические структуры в пределах допустимой толерантности в соответствии с Quanteq. Объемная визуализация мишени выполнена в системе MB CVCT. Лекарственная терапия: Caps. Temozolomidi 140 mg/сут. внутрь в дни проведения ДЛТ, суммарно 4620 мг за весь период лечения; Sol. Dexamethazoni 12 mg в/м ежедневно.
МРТ от 21.01.2022 (после комплексного лечения) (рис. 4):
В ранее определяемой локализации в правой лобной доле с распространением на левую лобную долю определяется п/о полость с отложениями гемосидерина размерами 48×45 мм (ранее 52×52 мм). Отмечается менее выраженное гетерогенное накопление КВ. Вокруг сохраняется зона перифокальных изменений на участке 59×54 мм (ранее 62×51 мм). Парасагиттально по заднему и нижнему контурам п/о полости в правой лобной доле сохраняется зона измененного МР-сигнала по FLAIR размерами 24×11 мм (ранее 26×17 мм), оттесняющая левую лобную долю.
Заключение: состояние после оперативного лечения, химиолучевого лечения. МР-картина остаточной опухоли в правой лобной доле, в сравнении с исследованием от 20.10.2021 — небольшое уменьшение размеров всех ранее определяемых изменений.
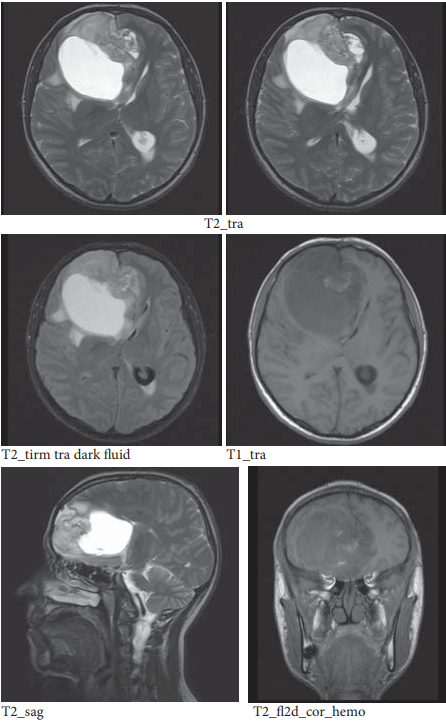
Рисунок 1. МРТ до оперативного лечения
Figure 1. MRI before surgery
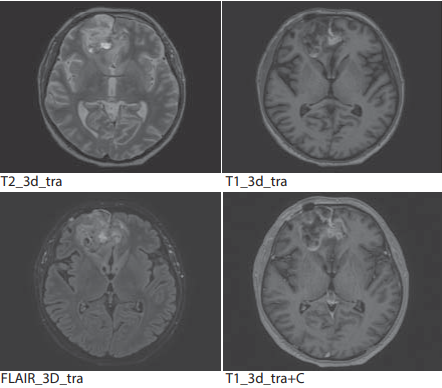
Рисунок 2. МРТ после оперативного лечения
Figure 2. MRI after surgery
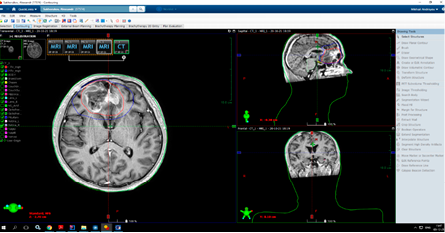
Рисунок 3. Планирование лучевой терапии: оконтуривание целевого, клинического объемов облучения (CTV и PTV) и критических структур на совмещенных КТ- и МРТ-изображениях
Figure 3. Radiation therapy planning: Delineation of target, clinical exposure volumes (CTV and PTV) and critical structures on combined CT and MR images
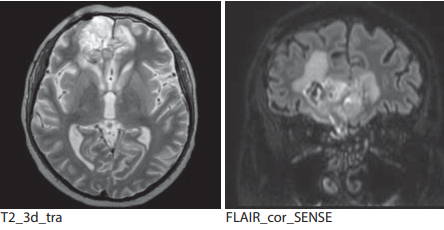
Рисунок 4. МРТ после комплексного лечения
Figure 4. MRI after complex treatment
РЕЗУЛЬТАТЫ
В качестве начального этапа исследований проанализированы МРТ-изображения пациента С., зарегистрированные в режиме T2 до проведения хирургического вмешательства, после хирургического вмешательства и после проведенного курса лечения.
В качестве информативных признаков очагов поражения на изображениях проанализированы статистические характеристики локального распределения яркости изображения очага поражения, которые описываются статистическими текстурными параметрами [20]:
- среднее значение интенсивности по области (далее — среднее значение);
- стандартное отклонение интенсивности по области (далее — стандартное отклонение);
- гладкость текстуры;
- третий момент, характеризующий асимметрию гистограммы интенсивности;
- энтропия [20].
На рисунке 5 представлены примеры проанализированных изображений. Красным цветом выделены пораженные участки, синим — переходные области, зеленым — участки здоровой ткани. На рисунке 6 текстурные параметры очагов поражения проанализированных МРТ изображений представлены в виде гистограмм.
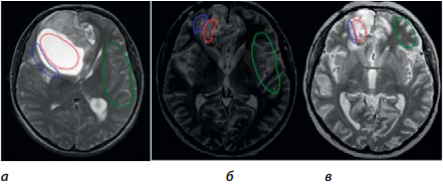
Рисунок 5. Примеры проанализированных МРТ изображений: а) до операции; б) сразу после операции; в) после комплексного лечения
Figure 5. Examples of MR images analyzed: (a) before surgery; б) immediately after surgery; в) after complex treatment
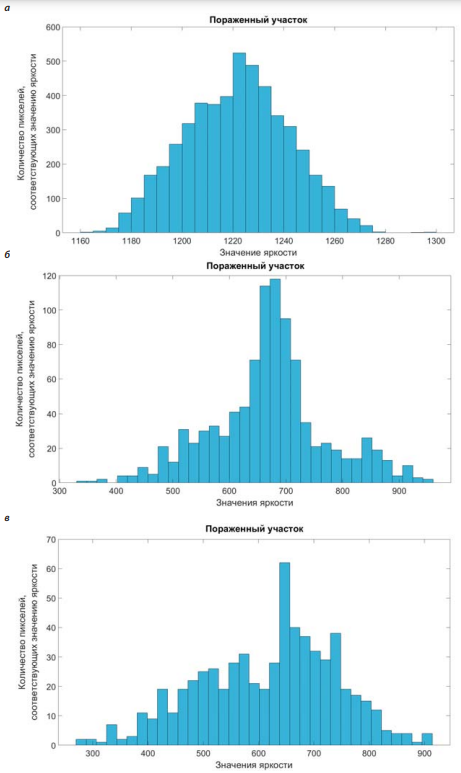
Рисунок 6. Гистограммы пораженных участков, проанализированных МРТ изображений: а) до операции; б) после операции; в) после комплексного лечения
Figure 6. Histograms of the affected areas in the analyzed MR images: a) before surgery; б) after surgery; в) after complex treatment
Результаты расчета текстурных параметров представлены в таблицах 1–3.
Параметр | До операции | После операции | После комплексного лечения |
Среднее значение | 1218,3 ± 37,4 | 641,2 ± 52,2 | 631,3 ± 47,4 |
Стандартное отклонение | 33,8 ± 21,3 | 106,3 ± 21,2 | 84,2 ± 23,0 |
Гладкость (×10–6) | 0,37 ± 0,49 | 2,73 ± 1,01 | 1,78 ± 1,02 |
Третий момент (×10–4) | -1,10 ± 2,44 | -0,23 ± 1,15 | -0,27 ± 0,74 |
Однородность | 0,017 ± 0,004 | 0,005 ± 0,001 | 0,006 ± 0,001 |
Энтропия | 6,24 ± 0,42 | 7,91 ± 0,31 | 7,65 ± 0,24 |
Таблица 1. Статистические текстурные параметры однородных областей пораженных участков
Table 1. Statistical texture parameters of homogeneous segments of the affected areas
Параметр | До операции | После операции | После комплексного лечения |
Среднее значение | 826,2 ± 65,5 | 527,4 ± 51,0 | 484,3 ± 23,4 |
Стандартное отклонение | 301,9 ± 61,8 | 119,9 ± 15,8 | 112,3 ± 17,3 |
Гладкость (×10–6) | 22,1 ± 9,0 | 3,4 ± 0,9 | 3,0 ± 0,9 |
Третий момент (×10–4) | 4,73 ± 2,01 | 0,62 ± 1,83 | -0,07 ± 1,19 |
Однородность | 0,0027 ± 0,0008 | 0,0039 ± 0,0007 | 0,0040 ± 0,0005 |
Энтропия | 8,97 ± 0,35 | 8,25 ± 0,24 | 8,18 ± 0,14 |
Таблица 2. Статистические текстурные параметры переходных областей
Table 2. Statistical texture parameters of transitional areas
Параметр | До операции | После операции | После комплексного лечения |
Среднее значение | 303,6 ± 24,9 | 327,9 ± 30,7 | 298,1 ± 29,9 |
Стандартное отклонение | 49,6 ± 12,8 | 71,0 ± 21,9 | 62,9 ± 21,9 |
Гладкость (×10–6) | 0,81 ± 0,23 | 1,28 ± 0,64 | 1,03 ± 0,58 |
Третий момент (×10–4) | 0,46 ± 0,49 | 1,19 ± 0,84 | 0,73 ± 0,75 |
Однородность | 0,0081 ± 0,0026 | 0,0066 ± 0,0026 | 0.0081 ± 0.0032 |
Энтропия | 7,28 ± 0,39 | 7,63 ± 0,49 | 7,37 ± 0,52 |
Таблица 3. Статистические текстурные параметры здоровых участков
Table 3. Statistical texture parameters of healthy areas
ОБСУЖДЕНИЕ
Высокая частота рецидивов, неврологические осложнения, невозможность радикального хирургического лечения в отдельных случаях, отсутствие учета взаимосвязи различных структурных и молекулярно-генетических характеристик опухоли с течением заболевания объясняют сравнительно небольшую эффективность существующих методов лечения [1, 3, 4, 16], что определяет необходимость разработки персонализированного подхода к выбору тактики лечения глиобластом и прочих глиом высокой степени злокачественности.
Текстура опухоли является основным радиологическим признаком, используемым исследователями для фенотипирования глиобластомы [7, 8, 13]. Данные, полученные при МРТ головного мозга со стандартным набором импульсных последовательностей, такие как размер опухоли, локализация, характер контрастного усиления, связаны также с различными гистологическими подтипами глиобластомы [12–17, 19]. Поскольку МР-изображения отражают структурные изменения в опухоли, анализ текстурных характеристик опухолевого очага с помощью радиомического анализа может послужить основой для последующей стратификации глиобластом в соответствии с клинико-морфологическими особенностями и установить взаимосвязь с тем или иным молекулярно-генетическим подтипом и клиническим исходом [5, 8, 14–19].
Включение радиомических характеристик в прогностические модели ответа на лечение создает потенциал для прогнозирования выживаемости, дифференциальной диагностики глиобластом и других внутричерепных образований, определения степени дифференцировки опухоли глиального ряда, прогнозирования ответа на химиолучевое лечение [7, 8–11, 19].
В результате анализа значений текстурных параметров в ходе проведенной работы установлена статистическая значимость различий стандартного отклонения, гладкости и третьего момента интенсивности переходных областей пораженных и здоровых участков тканей на T2-взвешенных МРТ-изображениях, зарегистрированных до оперативного лечения, после оперативного лечения и после полного курса химиолучевого лечения. Таким образом, в результате анализа клинического случая получено первичное подтверждение возможности объективизации процесса диагностики и лечения по указанным статистическим параметрам Т2 МРТ-изображений очагов поражения, что является инициальным этапом исследования радиомики глиобластом, проводимого авторами. Дальнейшее наблюдение за пациентами с данным диагнозом и последующий радиомический анализ МР-изображений, объединение данных молекулярно-генетических исследований, данных неврологического осмотра с радиомическими характеристиками опухоли на всех этапах лечения и контроля эффективности лечебных мероприятий будут использованы для создания прогностических моделей ответа на терапию, что в конечном счете позволит сформировать персонализированный подход к выбору тактики лечения глиом высокой степени злокачественности и в частности глиобластом.
ЗАКЛЮЧЕНИЕ
Целью дальнейших исследований в данном направлении является применение радиомического анализа для планирования, мониторинга лечения глиобластомы, для прогнозировании различных исходов заболевания, а также предиктивного анализа ответа на комплексное лечение, что поможет открыть для исследователей перспективы применения радиомики для развития прецизионной (персонифицированной) онкологической помощи при глиомах высокой степени злокачественности.
Информированное согласие. Информированное согласие пациента на публикацию своих данных получено.
Statement of informed consent. Written informed consent was obtained from the patient for publication of this case report and accompanying materials.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Sponsorship data. This work is not funded.
Список литературы
1. Яковленко Ю.Г. Глиобластомы: современное состояние проблемы. Медицинский вестник Юга России. 2019;10(4):28–35.
2. Золотова С.В., Хохлова Е.В., Беляшова А.С., Николаева А.А., Старовойтов Д.В., Игошина Е.Н. и др. Исследование метаболических особенностей первичных глиобластом методом ОФЭКТ-КТ с Tc-МИБИ с оценкой их влияния на прогноз заболевания. Вопросы нейрохирургии им. Н.Н. Бурденко. 2019;83(2):17–26. DOI: 10.17116/neiro20198302117
3. Beig N., Bera K., Prasanna P., Antunes J., Correa R., Singh S., et al. Radiogenomic-based survival risk stratification of tumor habitat on Gd-T1w MRI is associated with biological processes in glioblastoma. Clin Cancer Res. 2020;26(8):1866–76. DOI: 10.1158/1078-0432.ccr-19-2556
4. Ostrom Q.T., Gittleman H., Truitt G., Boscia A., Kruchko C., Barnholtz-Sloan J.S. CBTRUS Statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2011–2015. Neuro Oncol. 2018;20(suppl_4):iv1–86. DOI: 10.1093/neuonc/noy131
5. Incoronato M., Aiello M., Infante T., Cavaliere C., Grimaldi A., Mirabelli P., et al. Radiogenomic analysis of oncological data: a technical survey. Int J Mol Sci. 2017;24(3):14–21. DOI: 10.3390/ijms18040805
6. Zanfardino M., Franzese M., Pane K., Cavaliere C., Monti S., Esposito G., et al. Bringing radiomics into a multi-omics framework for a comprehensive genotype–phenotype characterization of oncological diseases. J Transl Med. 2019;34(3):26–38. DOI: 10.1186/s12967-019-2073-2
7. Mazurowski M.A., Clark K., Czarnek N.M., Shamsesfandabadi P., Peters K.B., Saha A. Radiogenomics of lower-grade glioma: algorithmically-assessed tumor shape is associated with tumor genomic subtypes and patient outcomes in a multiinstitutional study with The Cancer Genome Atlas data. J Neurooncol. 2017;133(1):27–35. DOI: 10.1007/s11060-017-2420-1
8. Boxerman J.L., Quarles C.C., Hu L.S., Erickson B., J., Gerstner E.R., Smits M., et al. Consensus recommendations for a dynamic susceptibility contrast MRI protocol for use in high-grade gliomas. Neuro Oncol. 2020;22(9):1262–75. DOI: 10.1093/neuonc/noaa141
9. Shenouda G., Souhami L., Petrecca K., Owen S., Panet-Raymond V., Guiot M.-C., et al. A phase 2 trial of neoadjuvant temozolomide followed by hypofractionated accelerated radiation therapy with concurrent and adjuvant temozolomide for patients with glioblastoma. Int J Radiat Oncol Biol Phys. 2017;97(3):487–94. DOI: 10.1016/j.ijrobp.2016.11.006
10. Oh S., Yeom J., Cho H.J., Kim J., Yoon S.-J., Kim H., et al. Integrated pharmaco-proteogenomics defines two subgroups in isocitrate dehydrogenase wild-type glioblastoma with prognostic and therapeutic opportunities. Nat Commun. 2020;11(1):3288. DOI: 10.1038/s41467-020-17139-y
11. Moradmand H., Aghamiri S.M.R., Ghaderi R. Impact of image preprocessing methods on reproducibility of radiomic features in multimodal magnetic resonance imaging in glioblastoma. J Appl Clin Med Phys. 2020;21(1):179–90. DOI: 10.1002/acm2.12795
12. Lotan E., Jain R., Razavian N., Fatterpekar G.M., Lui Y.W. State of the art: machine learning applications in glioma imaging. Am J Roentgenol. 2019;212(1):26–37. DOI: 10.2214/ajr.18.20218
13. Akbari H., Bakas S., Pisapia J.M., Nasrallah M.P., Rozycki M., Martinez-Lage M., et al. In vivo evaluation of EGFRvIII mutation in primary glioblastoma patients via complex multiparametric MRI signature. Neuro Oncol. 2018;20(8):1068–79. DOI: 10.1093/neuonc/noy033
14. Kickingereder P., Neuberger U., Bonekamp D., Piechotta P.L., Götz M., Wicket A., et al. Radiomic subtyping improves disease stratification beyond key molecular, clinical, and standard imaging characteristics in patients with glioblastoma. Neuro Oncol. 2018;0(6):848–57. DOI: 10.1093/neuonc/nox188
15. Bae S., Choi Y.S., Ahn S.S., Chang J.H., Kang S.-G., Kim E.H., et al. Radiomic MRI phenotyping of glioblastoma: Improving survival prediction. Radiology. 2018;289(3):797–806. DOI: 10.1148/radiol.2018180200
16. Rathore S., Mohan S., Bakas S., Sako C., Badve C., Pati S., et al. Multi-institutional noninvasive in vivo characterization of IDH, 1p/19q, and EGFRvIII in glioma using neuro-Cancer Imaging Phenomics Toolkit (neuro-CaPTk). Neuro Oncol Adv. 2020;2(suppl_4):iv22–34. DOI: 10.1093/noajnl/vdaa128
17. Rathore S., Akbari H., Doshi J. Radiomic signature of infiltration in peritumoral edema predicts subsequent recurrence in glioblastoma: implications for personalized radiotherapy planning. J Med Imaging. 2018;5(02):1. DOI: 10.1117/1.jmi.5.2.021219
18. Guo G., Sun Y., Hong R., Xiong J., Lu Y., Liu Y., et al. IKBKE enhances TMZchemoresistance through up regulations of MGMT expression in glioblastoma. Clin Trans Oncol. 2019;22(8):1252–62. DOI: 10.1007/s12094-019-02251-3
19. Strauss S.B., Meng A., Ebani E.J., Chiang G.C. Imaging glioblastoma posttreatment: Progression, pseudoprogression, pseudoresponse, radiation necrosis. Neuroimaging Clin. 2021;31(1):103–20. DOI: 10.1016/j.nic.2020.09.010
20. Гонсалес Р., Вудс Р. Цифровая обработка изображений. М.: Техносфера; 2012. 1104 c.
Об авторах
Я. О. НикульшинаРоссия
аспирант, кафедра онкологии
Воронеж
А. Н. Редькин
Россия
д.м.н., профессор, кафедра онкологии
Воронеж
А. В. Колпаков
Россия
к.т.н., доцент, кафедра «Биомедицинские технические системы»
Москва
М. А. Захаров
Россия
студент магистратуры, кафедра «Биомедицинские технические системы»
Москва
Рецензия
Для цитирования:
Никульшина Я.О., Редькин А.Н., Колпаков А.В., Захаров М.А. Радиомический анализ для объективизации диагностики и комплексного лечения глиобластомы. Креативная хирургия и онкология. 2022;12(3):237-243. https://doi.org/10.24060/2076-3093-2022-12-3-237-243
For citation:
Nikulshina Ya.O., Redkin A.N., Kolpakov A.V., Zakharov M.A. Radiomic Study for Objectification of Diagnostics and Complex Treatment of Glioblastoma. Creative surgery and oncology. 2022;12(3):237-243. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-3-237-243


































