Перейти к:
Клинический опыт успешного хирургического лечения гигантской метастатической саркомы легкого
https://doi.org/10.24060/2076-3093-2022-12-3-250-255
Аннотация
Введение. Саркомы – группа гетерогенных неэпителиальных злокачественных опухолей, происходящих из соединительной ткани. Данные опухоли характеризуются крайне агрессивным местным ростом, относительно малой частотой лимфогенных метастазов, преимущественной и ранней гематогенной генерализацией. Наиболее часто эти опухоли метастазируют в легкие.
Материалы и методы. В статье описан случай успешного хирургического лечения гигантского метастаза фибросаркомы забрюшинного пространства в легкое.
Результаты. Успех лечения больных саркомами зависит прежде всего от глобального понимания врачами-онкологами сложных вопросов патогенеза, гистологических форм и принципов комплексной терапии этой сложной, полиморфной группы злокачественной патологии. Чем более рано диагностирован первичный очаг, чем скорее и радикальнее выполнено хирургическое лечение и чем более верно проведена лекарственная терапия, тем лучше результат комплексного лечебного подхода. Аналогичным образом следует действовать и при вторичных очагах саркомы, не дожидаясь момента, когда их размеры и местное распространение будут являться противопоказанием к хирургическому лечению.
Заключение. Запущенные случаи сарком диктуют необходимость комбинированных и расширенных хирургических вмешательств, один из успешных примеров которых описан в данной статье.
Ключевые слова
Для цитирования:
Баксиян Г.А., Степанянц Н.Г., Астахов Д.Н., Аксененко А.В., Завьялов А.А. Клинический опыт успешного хирургического лечения гигантской метастатической саркомы легкого. Креативная хирургия и онкология. 2022;12(3):250-255. https://doi.org/10.24060/2076-3093-2022-12-3-250-255
For citation:
Baksiyan G.A., Stepanyants N.G., Astakhov D.N., Aksenenko A.V., Zavyalov A.A. Clinical Case of Successful Surgical Treatment for Giant Cell Metastatic Lung Sarcoma. Creative surgery and oncology. 2022;12(3):250-255. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-3-250-255
ВВЕДЕНИЕ
Саркомы — гетерогенные неэпителиальные злокачественные опухоли, происходящие из соединительной ткани. В зависимости от патологического морфологического начала эти опухоли подразделяют на две основные группы: остеосаркомы и саркомы мягких тканей (хондросаркомы, миосаркомы, липосаркомы, фибросаркомы, ангиосаркомы и их смешанные формы, а также наиболее агрессивные недифференцированные плеоморфные саркомы).
В России частота сарком не превышает 0,7 % от всех злокачественных опухолей, что в абсолютном выражении составляет 3250 новых случаев ежегодно [1].
Саркомы характеризуются крайне агрессивным местным ростом с быстрым темпом увеличения объема патологической ткани, относительно незначительной частотой лимфогенных метастазов (на начальных стадиях заболевания), преимущественной и ранней гематогенной генерализацией. Вне зависимости от локализации и гистогенеза первичной опухоли наиболее частой локализацией реализации метастатического потенциала являются легкие (солитарное, множественное, одно- и двусторонние поражения). Саркомы относятся к группе опухолей с одной из самих высоких частот метастазирования в легкие — 70 % и более [2]
Среди больных с первичной остеосаркомой и метастазами в легкие 6-месячная, 1-, 2- и 3-летняя выживаемость составили 97, 93, 62 и 42 % соответственно. При наличии внелегочных метастазов и при множественных метастазах в легкие наблюдаются худшие прогнозы выживаемости [3][4].
Факторами, ухудшающими прогноз, являются гистологически смешанные формы опухолей, множественность метастатического поражения легких на момент первичного лечения, резистентность к химиотерапии первичной опухоли, а также отсутствие хирургического компонента (метастазэктомия) в комплексном лечении. Напротив, хирургическая резекция в сочетании с химиотерапией может эффективно улучшить выживаемость больных [5].
Наиболее важным прогностическим фактором является размер первичной опухоли. При опухолях до 3 см в наибольшем измерении более 3 лет прожили 88,3 % пациентов, более 5 лет — 86,4 %, при размерах опухоли 3,1–6 см эти показатели составили 52,3 и 37,3 %, а при размере более 6 см — 30,8 и 24,2 % соответственно. Возраст старше 30 лет и размеры опухоли (более 6 см, особенно более 10 см) являются факторами неблагоприятного прогноза — наблюдается значительное увеличение частоты метастазирования в легкие [6].
В большинстве исследований подчеркивается факт, что чем больше размер опухоли, тем хуже прогноз заболевания. Пациенты с размером опухоли менее 5 см, от 5 до 10 см и более 10 см имели статистически значимые различия в показателях 15-летней выживаемости — 75, 55 и 36 % соответственно [7].
Следующими факторами, имеющими прогностическое значение, являются морфологическая структура, степень дифференцировки опухоли и реализация потенциала лимфогенного метастазирования. Самая высокая частота поражения регионарных лимфоузлов наблюдается при рабдомиосаркоме (26,7 %), светлоклеточной саркоме (18,8 %), эпителиоидной саркоме (14,5 %), ангиосаркоме (8,1 %), веретеноклеточной саркоме (5,0 %) и синовиальной саркоме (3,2 %). 5-летняя выживаемость без метастазов в лимфоузлы составляет 69 %, в то время как при поражении регионарного лимфоколлектора снижается до 26 % [8].
При прогрессировании болезни в виде метастазирования в регионарные лимфоузлы лимфаденэктомия не оказывает существенного влияния на выживаемость больных [9][10].
Наиболее агрессивными из сарком являются недифференцированные плеоморфные формы, составляющие 5–10 % из их общего числа. Эти крайне агрессивные опухоли обладают самым быстрым темпом роста и наивысшим метастатическим потенциалом, а также самой низкой чувствительностью к различным видам лечебного воздействия, что определяет наиболее драматичный прогноз у заболевших [11]. При первичном обращении более чем у половины больных плеоморфными саркомами диагностируется III стадия заболевания, у 20 % — метастазы в легких. Несмотря на применение комбинированной терапии, пятилетняя выживаемость в этой группе больных не превышает 29–63 % [12].
Лечение сарком практически во всех случаях комплексное. Хирургический компонент лечения в подавляющем большинстве случаев является обязательным и наиболее существенным по своему вкладу в общий успех терапии. Хирургическая тактика должна быть крайне агрессивной как в отношении первичной опухоли, так и в отношении метастатических очагов. Именно хирургический радикализм по отношению к первичной опухоли и оптимальная циторедукция по отношению ко вторичным опухолевым очагам на фоне комплексной терапии дает шанс больным на увеличение как общей, так и безрецидивной выживаемости, также улучшая качество их жизни.
Агрессивная хирургическая тактика при метастазах сарком в легкие оправдана, поскольку позволяет существенно продлить жизнь этому сложному контингенту больных, а радикальность выполненной операции является наиболее значимым фактором прогноза [13].
Хирургический метод можно рассматривать как этап комплексного лечения как при прогрессировании заболевания в легких, так и при синхронном выявлении первичной опухоли и метастазов при первичном обращении. При внутрилегочном рецидивировании процесса и возможности выполнения операции оправданы повторные хирургические вмешательства [14].
МАТЕРИАЛЫ И МЕТОДЫ (описание клинического случая)
Больной К. 43 лет госпитализирован в отделение онкохирургии ФМБЦ 10 декабря 2019 г. с жалобами на приступообразный малопродуктивный кашель, кровохарканье, выраженную боль в левой половине грудной клетки, требующую частого применения НПВС, невозможность сгибания шеи ввиду наступления резкого удушья, тяжелые нарушения сна.
Из анамнеза: хирургическое лечение в 2017 г. по поводу саркомы забрюшинного пространства pT2bN0M0 G1 в объеме удаления опухоли с нефрэктомией слева, лимфодиссекцией. Гистологически по месту жительства диагностирована ангиолейомиосаркома, однако при пересмотре гистологических препаратов и иммуногистохимическом исследовании удаленной опухоли левого легкого специалистами ФМБЦ им. А. И. Бурназяна была верифицирована фибросаркома. Адъювантная терапия по месту жительства не проводилась.
Прогрессирование онкопроцесса отмечено в октябре 2019 г.: появление солитарного метастаза в верхней доле левого легкого. Выполнена трепанбиопсия — морфологически подтвержден метастаз удаленной ранее саркомы забрюшинного пространства. Учитывая распространение онкопроцесса, в ряде специализированных клиник в хирургическом лечении больному было отказано, по решению онкосовета по месту жительства назначена химиотерапия. Там же проведен 1 курс ПХТ (схема терапии в предоставленной больным медицинской документации не указана). По данным ПЭТ-КТ от ноября 2019 г. отмечено увеличение размеров опухоли.
В декабре 2019 г. больной госпитализирован в онкохирургическое отделение ФМБЦ.
ФБС (12.12.19): деформация и сужение верхне- и среднегрудного отдела трахеи за счет сдавления извне, сужение верхнедолевого бронха справа за счет сдавления извне, декомпенсированный стеноз В8 слева с сужением просвета бронхов В9 и В10.
КТ ОГК и ОБП с контрастным усилением (13.12.2019 г.): в левом гемитораксе определяется крупное кистозно-солидное образование (рис. 1–3) размером 140×142 мм (отмечается значительное увеличение объема опухолевой ткани по сравнению с исследованием от ноября 2019 г.). Опухоль распространяется от грудной стенки до средостения, оттесняя его структуры вправо. Дуга аорты смещена и несколько поддавлена. Внутригрудные лимфатические узлы не увеличены.
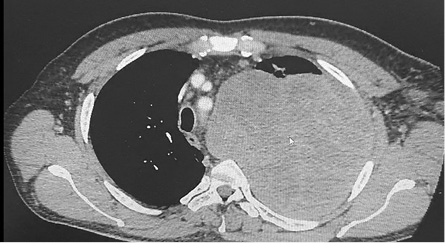
Рисунок 1. КТ грудной клетки — массив опухоли с распространением в средостение
Figure 1. CT scan of chest — mass of tumor spreading to mediastinum
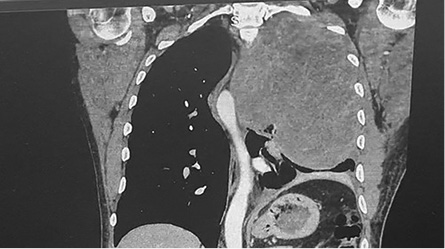
Рисунок 2. КТ грудной клетки (фронтальная проекция) — гигантская опухоль распространяется на средостение, отдавливает аорту, распространяется в мягкие ткани грудной клетки, сдавливает нижней долевой бронх с развитием частичного ателектаза нижней доли
Figure 2. CT scan of chest (frontal view) — giant cell tumor extending to mediastinum, compressing aorta, spreading to soft tissue of chest, compressing the inferior lobe bronchus with development of partial atelectasis of the lower lobe
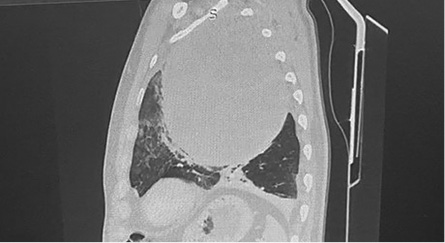
Рисунок 3. КТ грудной клетки — сагиттальная проекция
Figure 3. Chest CT (sagittal view)
На основании данных клинического обследования, учитывая молодой возраст больного, отсутствие признаков нерезектабельности (данные КТ) и абсолютных противопоказаний, по витальным показаниям 19.12.2019 пациенту выполнено хирургическое лечение в объеме: Широкая торакотомия слева с резекцией 4-го и 5-го ребер. Экстраплевральная комбинированная пневмонэктомия слева с субтотальной плеврэктомией, резекцией перикарда, трансперикардиальной сосудистой изоляцией легкого. Торакорафия с фиксацией резецированных ребер.
Ход операции (кратко)
Выполнена торакотомия в 5-м межреберье слева. Опухолевые массы плотно прилежат к ране. Для адекватной экспозиции и продолжения мобилизации резецированы 4–5-го ребра (рис. 4).
Отмечается тотальная адгезия (местами инвазия) опухоли, занимающей весь объем верхней доли, к париетальной плевре, перикарду. Выполнен технически сложный экстраплевральный пневмолиз, с резекцией перикарда, внутриперикардиальным швом сосудов корня легкого. Главный бронх прошит по бескультевой методике (рис. 6). Культя бронха плевризирована. Дренирование 1 дренажем в реберно-диафрагмальном синусе. Рана ушита с восстановлением целостности ранее резецированных ребер.
Удаленный препарат представлен левым легким с массивным разрастанием в нем опухолевой ткани, а также со следами вдавлений от ребер на плащевой поверхности органа (рис. 5).
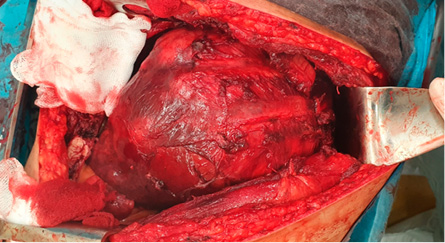
Рисунок 4. Интраоперационная картина — мобилизация опухоли, видны концы резецированных ребер
Figure 4. Intraoperative view — tumor mobilization, ends of resected ribs are visible
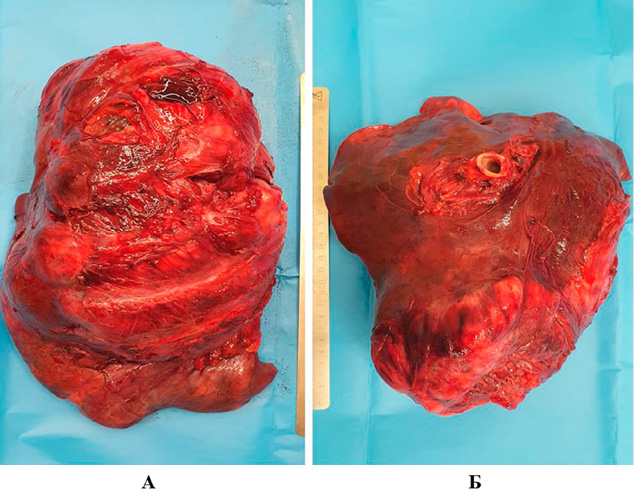
Рисунок 5. А — удаленное левое легкое (латеральная часть); Б — удаленное левое легкое (медиальная часть)
Figure 5. A) Removed left lung (lateral part) Б) Removed left lung (medial part)
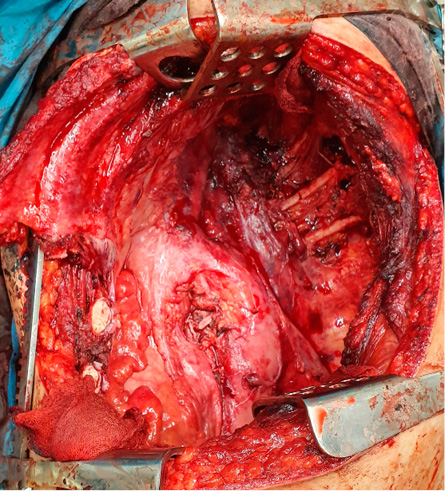
Рисунок 6. Интраоперационная картина (левое легкое удалено вместе с регионарной клетчаткой), этап перед плевризацией культи левого главного бронха
Figure 6. Intraoperative view (removed left lung along with regional fibres), stage before pleuralization of the left main bronchus stump
Диагноз заключительный
Основной: Фибросаркома забрюшинного пространства слева pT2bN0M0G1 стадия I В. Хирургическое лечение (27.11.2017 г.): комбинированное удаление забрюшинной опухоли с нефрэктомией слева, лимфодиссекцией. Прогрессирование (09.2019 г.): массивный метастаз в верхнюю долю левого легкого. 1 курс ПХТ (10.2019 г.). Прогрессирование (10.2019 г.): продолженный рост опухоли. Хирургическое лечение (19.12.2019 г.): Широкая торакотомия слева с резекцией 4-го и 5-го ребер. Экстраплевральная комбинированная пневмонэктомия слева с субтотальной плеврэктомией, резекцией перикарда, трансперикардиальной сосудистой изоляцией легкого. Торакорафия с фиксацией резецированных ребер.
Осложнения основного заболевания: Компрессионный медиастинальный синдром. Субкритический стеноз трахеи. Дыхательная недостаточность 2–3-й степени. Синдром верхней полой вены. Окклюзирующий тромбоз яремной вены слева. Хронический болевой синдром.
Сопутствующие: Гипертоническая болезнь I стадии, 1-й степени. Грыжа пищеводного отверстия диафрагмы. Хронический гастрит, ремиссия.
Больной выписан в удовлетворительном состоянии, жалоб не предъявляет, не температурит. ECOG1. Лабораторные показатели в норме. Дренаж из левой плевральной полости удален на 4-е сутки послеоперационного периода (рис. 7).
Шов раны внутрикожный, заживление первичным натяжением. Послеоперационный период без осложнений. Проведен онкоконсилиум — рекомендована ПХТ по месту жительства. Выписан на амбулаторное лечение 30 декабря 2019 г. на 11-е сутки после операции.
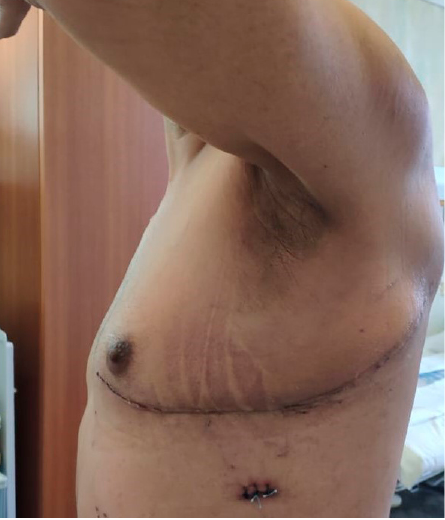
Рисунок 7. Вид раны на 10-е сутки послеоперационного периода
Figure 7. View of the wound on the 10th postoperative day
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Случай, описанный нами, является нередким, но исключительным в плане показательности и возможности хирургического лечения при гигантском солитарном метастазе в легком.
Необходимость комплексного подхода в лечении больных саркомой — давно и прочно утвердившийся факт, равно как и агрессивный подход хирургического пособия при лечении любого из проявлений данного заболевания. Однако значительные трудности в диагностике (в том числе гистологической) этой гетерогенной группы злокачественных образований, ранняя пульмональная диссеминация, неудовлетворительные результаты лечения и быстрое прогрессирование онкопроцесса даже на фоне комплексной терапии диктуют необходимость индивидуального подхода в лечении практически каждого больного, а также поиска новых лекарственных схем лечения.
ЗАКЛЮЧЕНИЕ
Подводя итоги, хочется еще раз подчеркнуть — нет никаких сомнений в том, что обязательным и важнейшим условием успешного лечения больных саркомами должно быть их нахождение в специализированных онкологических стационарах, обладающих как техническими условиями, так и кадровым потенциалом, для проведения комплексного лечения этой сложной категории больных.
Информированное согласие. Информированное согласие пациента на публикацию своих данных получено.
Statement of informed consent. Written informed consent was obtained from the patient for publication of this case report and accompanying materials.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Sponsorship data. This work is not funded.
Список литературы
1. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2017 г. Москва: МНИОИ им. П.А. Герцена, филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2018. 250 с.
2. Arora R.D., Shaikh H. Osteogenic Sarcoma. 2022 Jun 28. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan. PMID: 33085324
3. Ye C., Dai M., Zhang B. Risk factors for metastasis at initial diagnosis with Ewing sarcoma. Front Oncol. 2019;9:1043. DOI: 10.3389/fonc.2019.01043
4. Sasi A., Ganguly S., Biswas B., Pushpam D., Kumar A., Agarwala S., et al. Development and validation of a prognostic score at baseline diagnosis for Ewing sarcoma family of tumors: a retrospective single institution analysis of 860 patients. Am J Transl Res. 2022;14(2):927–41. PMID: 35273696
5. Li W., Zhang S. Survival of patients with primary osteosarcoma and lung metastases. J Buon. 2018;23(5):1500–4. PMID: 30570878
6. Huang X., Zhao J., Bai J., Shen H., Zhang B., Deng L., et al. Risk and clinicopathological features of osteosarcoma metastasis to the lung: A population-base d study. J Bone Oncol. 2019;16:100230. DOI: 10.1016/j.jbo.2019.100230
7. Wan L., Tu C., Qi L., Li Z. Survivorship and prognostic factors for pleomorphic liposarcoma: a population-based study. J Orthop Surg Res. 2021;16(1):175. DOI: 10.1186/s13018-021-02327-3
8. Gusho C.A., Fice M.P., O’Donoghue C.M., Gitelis S., Blank A.T. A Population-based analysis of lymph node metastasis in extremity soft tissue sarcoma: an update. J Surg Res. 2021;262:121–9. DOI: 10.1016/j.jss.2021.01.005
9. Outani H., Imura Y., Tanaka T., Takenaka S., Oshima K., Hamada K., et al. Clinical outcomes of patients with epithelioid sarcomas: impact and management of nodal metastasis. Int J Clin Oncol. 2018;23(1):181–8. DOI: 10.1007/s10147-017-1179-x
10. Stork T., Boemans R., Hardes J., Streitbürger A., Dirksen U., Pöttgen C., et al. Number of metastases and their response to chemotherapy impact survival of patients with isolated lung metastases from bone-derived sarcoma. BMC Cancer. 2021;21(1):375. DOI: 10.1186/s12885-021-08073-3
11. Knebel C., Lenze U., Pohlig F., Lenze F., Harrasser N., Suren C., et al. Prognostic factors and outcome of Liposarcoma patients: a retrospective evaluation over 15 years. BMC Cancer. 2017;17(1):410. DOI: 10.1186/s12885-017-3398-y
12. Wan L., Tu C., Qi L., Li Z. Survivorship and prognostic factors for pleomorphic liposarcoma: a population-based study. J Orthop Surg Res. 2021;16(1):175. DOI: 10.1186/s13018-021-02327-3
13. Чиссов В.И., Трахтенберг А.Х., Паршин В.Д. Пикин О.В. Хирургия метастазов сарком в легких. Российский онкологический журнал. 2005;5:4–7.
14. Смоленов Е.И., Рагулин Ю.А., Стародубцев А.Л., Курильчик А.А. и др. Хирургический метод в лечении множественных метастазов в легких при саркомах костей и мягких тканей. Сибирский онкологический журнал. 2015;1(3):45–50.
Об авторах
Г. А. БаксиянРоссия
онкологическое отделение хирургических методов лечения, кафедра онкологии и радиационной медицины с курсом медицинской физики
Москва
Н. Г. Степанянц
Россия
к.м.н., онкологическое отделение хирургических методов лечения, кафедра онкологии и радиационной медицины с курсом медицинской физики
Москва
Д. Н. Астахов
Россия
к.м.н., онкологическое отделение хирургических методов лечения, кафедра онкологии и радиационной медицины с курсом медицинской физики
Москва
А. В. Аксененко
Россия
к.м.н, онкологическое отделение хирургических методов лечения
Москва
А. А. Завьялов
Россия
д.м.н., профессор, онкологический центр, кафедра онкологии
и радиационной медицины с курсом медицинской физики
Москва
Рецензия
Для цитирования:
Баксиян Г.А., Степанянц Н.Г., Астахов Д.Н., Аксененко А.В., Завьялов А.А. Клинический опыт успешного хирургического лечения гигантской метастатической саркомы легкого. Креативная хирургия и онкология. 2022;12(3):250-255. https://doi.org/10.24060/2076-3093-2022-12-3-250-255
For citation:
Baksiyan G.A., Stepanyants N.G., Astakhov D.N., Aksenenko A.V., Zavyalov A.A. Clinical Case of Successful Surgical Treatment for Giant Cell Metastatic Lung Sarcoma. Creative surgery and oncology. 2022;12(3):250-255. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-3-250-255


































