Перейти к:
Бессимптомный гепатоцеллюлярный рак (клинический случай)
https://doi.org/10.24060/2076-3093-2022-12-3-256-260
Аннотация
Введение. Гепатоцеллюлярный рак часто имеет бессимптомное течение лишь на ранних стадиях развития и при малых размерах опухоли. Метастазирование в легкие часто сопровождает данный вид опухоли, но у пациента, описанного в статье, обе патологии явились результатом случайной находки при рентгенографии органов грудной клетки. Из анамнеза стало известно, что последний раз ультразвуковое исследование органов брюшной полости пациент проходил три года назад. Целью представления данного клинического случая является демонстрация возможности бессимптомного протекания первичного рака с метастазами в легочную ткань, а также диагностической роли рентгенологических методов исследования.
Материалы и методы. Во время рентгенографии органов грудной клетки у пенсионера К., 65 лет, в IV сегменте правого легкого была обнаружена круглая тень диаметром 2,5 см. На амбулаторном этапе пациенту проведена клинико-лабораторная диагностика и УЗИ щитовидной железы, органов брюшной полости, забрюшинного пространства и малого таза.
Результаты и обсуждение. На основе данных гистологического и иммуногистохимического обследования поставлен диагноз «низкодифференцированная гепатоцеллюлярная карцинома». В статье представлен клинический случай гепатоцеллюлярного рака как случайной находки на фоне отсутствия жалоб, клинической картины и характерных изменений при клинико-лабораторной диагностике. Подчеркнута важность первичного (амбулаторного) звена здравоохранения в деятельности, направленной на работу с населением пенсионного возраста для раннего выявления злокачественной патологии, в том числе ГЦР.
Заключение. Пациенту назначено хирургическое вмешательство и химиотерапия. Динамическое наблюдение показало положительный результат.
Ключевые слова
Для цитирования:
Шкарабуров А.С., Руденко Д.Н., Вайман Е.Ф., Соболева О.М., Захарова Ю.В. Бессимптомный гепатоцеллюлярный рак (клинический случай). Креативная хирургия и онкология. 2022;12(3):256-260. https://doi.org/10.24060/2076-3093-2022-12-3-256-260
For citation:
Shkaraburov A.S., Rudenko D.N., Vaiman E.F., Soboleva O.M., Zakharova Yu.V. Asymptomatic Hepatocellular Carcinoma (Clinical Case). Creative surgery and oncology. 2022;12(3):256-260. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-3-256-260
ВВЕДЕНИЕ
Гепатоцеллюлярный рак (ГЦР) — наиболее часто встречающаяся эпителиальная злокачественная опухоль печени [1]. ГЦР чаще поражает мужчин и составляет 85 % всех первичных злокачественных новообразований этого органа у людей обоих полов. Наиболее поражаемая возрастная группа — 40–50 лет.
ГЦР занимает второе место по причинам смертности от рака в мире и шестое место — по распространенности [2], однако в определении конкретного места ГЦР в структуре онкозаболеваемости и онкосмертности в общемировом масштабе исследователи не всегда единогласны [3]. Вместе с тем ни у кого не вызывает сомнений факт необходимости ранней диагностики данного заболевания в связи с возможностью назначения эффективных методов лечения и долгосрочного благоприятного прогноза для пациента [4]. В настоящее время этот прогноз не слишком оптимистичен: 5-летняя выживаемость составляет менее 20 % [5]. Рак печени является опухолью с высокой летальностью, большинство случаев выявляются на поздних стадиях, а соотношение заболеваемости и смертности приближается к 1 [6].
За последние десятилетия во многих странах выросли показатели данной заболеваемости [7], и, по прогнозам к 2025 году заболеваемость ГЦР составит более 1 миллиона случаев [8]. Вместе с тем отдельные исследователи отмечают положительные тенденции в диагностике и лечении гепатоцеллюлярного рака [9]. За последние три года был достигнут значительный прогресс в понимании предрасполагающих факторов и совершенствовании доступного арсенала лечения ГЦР [10]. Доказан существенный вклад эпигенетических факторов в злокачественное перерождение печени. Учитывая потенциальную обратимость, эти изменения широко используются для разработки чувствительных биомаркеров. Глубокое понимание эпигенетики ГЦР имеет решающее значение для разработки рациональных клинических стратегий, которые могут обеспечить значительное улучшение общей выживаемости и прогнозирование терапевтических исходов [11].
Солидные опухоли, такие как ГЦР, являются сложными и имеют гетерогенные геномные профили, что существенно усложняет диагностику и лечение [12]. Это самый гетерогенный вид рака [13]. Считается, что развитие ГЦР представляет собой многоступенчатый процесс, при котором диспластические макроузлы трансформируются в ранние, а затем и в более агрессивные опухоли (цит. по [14]).
По экспертной оценке ВОЗ, ежегодно в мире от ГЦР погибает более 1,3 млн человек. В России в целом заболеваемость раком печени относительно невысока, однако отмечается выраженная региональная вариабельность. Очень высокие показатели зарегистрированы в республиках Саха (Якутия), Тыва, Калмыкия, Бурятия, Алтай, в Чукотском автономном округе, а также в Томской области. Кроме этого, имеются статистические данные, что по большинству административных территорий России смертность от рака печени превышает уровень заболеваемости, что свидетельствует о существенном недоучете первичных больных: за 2020 г. показатель заболеваемости обоих полов составил 6,12, в то время как уровень смертности — 7,25 («грубые» показатели на 100 000 населения) [15]. С 2010 по 2020 г. прирост заболеваемости населения России раком печени превалировал над всеми остальными регистрируемыми видами рака и составлял 49,99 %, а отдельно для мужского пола — 61,69 % («грубые» показатели на 100 000 населения). Подобная тенденция к увеличению отмечается и для смертности — прирост за 10 лет составил 23,18 %.
Целью представления данного клинического случая является демонстрация возможности бессимптомного протекания первичного рака с метастазами в легочную ткань, а также диагностической роли лучевых методов исследования.
МАТЕРИАЛЫ И МЕТОДЫ
Клинический случай
Во время проведения ежегодной профилактической рентгенографии органов грудной клетки у пенсионера К., 65 лет, в IV сегменте правого легкого была обнаружена круглая тень диаметром 2,5 см. На амбулаторном этапе пациенту проведена клинико-лабораторная диагностика и УЗИ щитовидной железы, органов брюшной полости, забрюшинного пространства и малого таза.
ОАК: гематокрит — 41,3 %, гемоглобин — 13,3 г/дл, эритроциты — 124×10 9/л, лейкоциты — 4,29×10 12/л. Биохимия крови: АЛТ — 44 МЕ/л, АСТ — 40 МЕ/л, билирубин общий — 13,8 мкмоль/л, билирубин прямой — 4,9 мкмоль/л, железо — 16 мкмоль/л, глюкоза — 5,26 ммоль/л, холестерин — 4,55 ммоль/л. При УЗИ печени в сегменте SVI — кальцинаты, в сегменте SII определялось единичное образование без четких контуров с умеренно пониженной эхогенностью, размерами приблизительно 7×6 см. При цветном допплеровском картировании (ЦДК) кровоток повышен по злокачественному типу, скорость кровотока 20 м/с. Для уточнения распространенности и инвазии опухоли дано направление на мультиспиральную компьютерную томографию (МСКТ) органов брюшной полости с болюсным контрастированием.
При нативном сканировании (рис. 1) печень в размере не увеличена (краниокаудальный размер правой доли 13,7 см), плотность паренхимы не изменена (+59 HU). Контуры ровные и четкие. Структура однородная. В проекции сегмента SVI–SVII отмечаются единичные глыбчатые кальцинаты, в сегменте SII отмечается очаговое образование пониженной плотности (+47HU), гомогенной структуры, диффузно накапливающее контрастный препарат в артериальную фазу (+60 HU), в венозную (+87 HU), в отсроченную (7 мин) (+71 HU), размером 6,5×4,9 см (рис. 2, 3). Других образований и участков патологической плотности и патологического накопления контрастного препарата не выявлено. Внутрипеченочные протоки и сосуды не расширены.
Воротная вена — 1,2 см, селезеночная вена — 0,6 см. ОЖП — 0,5 см.
Желчный пузырь проникает через мягкие ткани передней брюшной стенки и подпаен к кожным покровам, гомогенной структуры, стенки уплотнены, контрастных конкрементов не выявлено, в размерах не увеличен.
Селезенка обычной формы, контуры ровные и четкие, не увеличена в размере (индекс — 265). Структурных изменений не выявлено.
Поджелудочная железа расположена обычно, в размере не изменена, паренхима неоднородной структуры. В проекции проксимальных отделов хвоста по задней поверхности отмечается очаговое образование жировой плотности размером до 4 мм. Других участков и образований патологической плотности и патологического накопления контрастного вещества не выявлено. Панкреатический проток визуализируется на уровне проксимальных отделов хвоста, тела, размером до 1–2 мм. Парапанкреатическая клетчатка не изменена. Заключение: КТ-признаки единичных кальцинатов в паренхиме печени, очаговое контрастпозитивное образование левой доли (предположительно ГЦР).
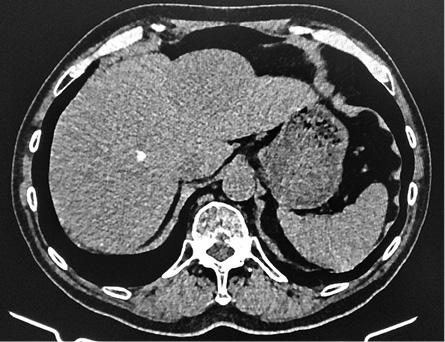
Рисунок 1. Нативная КТ
Figure 1. Native CT
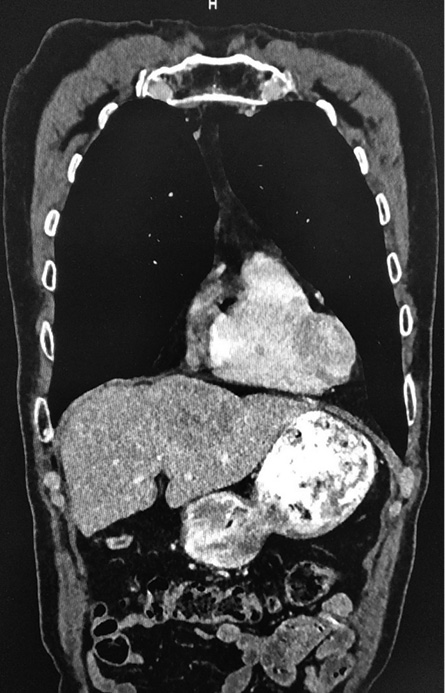
Рисунок 2. КТ, отсроченная фаза с фронтальной реконструкцией
Figure 2. CT scan, delayed phase with anterior reconstruction
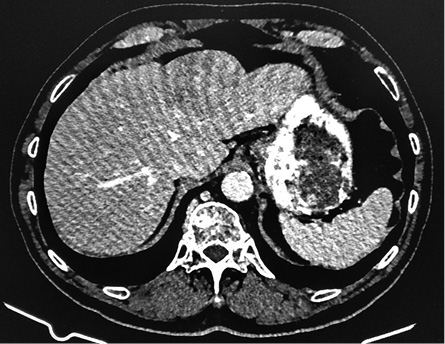
Рисунок 3. Портальная фаза КТ
Figure 3. CT portal phase
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После проведенного на базе онкологического диспансера гистологического и иммуногистохимического обследования (диагноз: «низкодифференцированная гепатоцеллюлярная карцинома») случай был «разобран» на врачебной конференции в диагностическом центре с привлечением врачей поликлиники. Акцент был сделан на отсутствие жалоб и клиники при значительном размере объемного образования в печени и метастазировании в легкое. В качестве дополнительного примера был разобран случай выявленного при профилактической рентгенографии легких объемного образования заднего отрезка второго ребра справа. Пациент, 58 лет, учитель, в течение двух лет лечился у мануального терапевта с диагнозом «поясничный остеохондроз». При ультразвуковом исследовании брюшной полости и последующей МСКТ выявлен рак правой почки и метастазы в ребро, позвоночник и кости таза. Таким образом, при общем организационном подходе и «онкологической настороженности» для раннего выявления злокачественной патологии мы сталкиваемся со случаями запущенных процессов III–IV стадии рака. Имея все возможности своевременного применения ультразвуковой и рентгеновской диагностики для выявления скрытых процессов, необходимо внедрять эти комплексы с профилактической целью, в том числе ввести общее ультразвуковое обследование при проведении периодических профосмотров как для работающего населения, так и для пенсионеров. На вторую категорию граждан заведующим амбулаторным звеном здравоохранения следует обратить внимание как на лиц, в категории которых риск злокачественных заболеваний из года в год нарастает. Таким образом, амбулаторный этап необходим для более активного привлечения пенсионеров к диспансеризации, и среди этого контингента крайне важно проводить разъяснительную работу в плане профилактики злокачественной патологии всех органов и систем.
Известно, что гепатоцеллюлярный рак признается клиницистами как сложный случай из-за низкой выживаемости и ограниченных эффективных методов лечения [3].
Примеры бессимптомного течения ГЦР с метастазами в легкие в литературе описываются достаточно редко [16, 17], при этом данные рентгенографии, как и в нашем случае, четко указывают на имеющуюся патологию. Между тем известно, что при выявлении ранних бессимптомных видов рака этим пациентам доступно несколько вариантов эффективного лечения. Эти методы включают резекцию, трансплантацию и радиочастотную абляцию, каждый из которых может обеспечить 5-летнюю выживаемость около 70 % при небольших поражениях, <2,5 см в диаметре [18]. Рецидивирующий ГЦР часто наблюдается после резекции и абляции печени, поскольку развитие ГЦР связано с основным циррозом, который практически не поддается лечению. Трансплантация печени предлагает реальную перспективу излечения для этих пациентов; однако на практике этот вариант ограничен в применимости из-за сопутствующей патологии и ограничен в доступности из-за нехватки донорских органов.
Гепатоцеллюлярный рак является распространенным онкологическим заболеванием с плохим прогнозом, связанным с высокими экономическими затратами и значительным бременем заболевания. Хотя на ранних стадиях оно часто протекает бессимптомно [19], в дальнейшем пациенты могут испытывать сильный дискомфорт из-за прогрессирования заболевания, побочных эффектов лечения или декомпенсации основного заболевания — цирроза [20].
ЗАКЛЮЧЕНИЕ
Пациенту назначено хирургическое вмешательство и химиотерапия. Динамическое наблюдение показало положительный результат.
Информированное согласие. Информированное согласие пациента на публикацию своих данных получено.
Statement of informed consent. Written informed consent was obtained from the patient for publication of this case report and accompanying materials.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Sponsorship data. This work is not funded.
Список литературы
1. Harris P.S., Hansen R.M., Gray M.E., Massoud O.I., McGuire B.M., Shoreibah M.G. Hepatocellular carcinoma surveillance: an evidence-based approach. World J Gastroenterol. 2019;25(13):1550. DOI: 10.3748/wjg.v25.i13.1550
2. Liu F., Hou W., Liang J., Zhu L., Luo C. LRP1B mutation: a novel independent prognostic factor and a predictive tumor mutation burden in hepatocellular carcinoma. J Cancer. 2021;12(13):4039–48. DOI: 10.7150/jca.53124
3. Sperandio R.C., Pestana R.C., Miyamura B.V., Kaseb A.O. Hepatocellular carcinoma immunotherapy. Annu Rev Med. 2022;73:267–78. DOI: 10.1146/annurev-med-042220-021121
4. Debes J.D., Romagnoli P.A., Prieto J., Arrese M., Mattos A.Z., Boonstra A., et al. Serum biomarkers for the prediction of hepatocellular carcinoma. Cancers (Basel). 2021;13(7):1681. DOI: 10.3390/cancers13071681
5. Singal A.G., Lok A.S., Feng Z., Kanwal F., Parikh N.D. Conceptual model for the hepatocellular carcinoma screening continuum: current status and research agenda. Clin Gastroenterol Hepatol. 2022;20(1):9–18. DOI: 10.1016/j.cgh.2020.09.036
6. Singal A.G., Lampertico P., Nahon P. Epidemiology and surveillance for hepatocellular carcinoma: New trends. J Hepatol. 2020;72(2):250–61. DOI: 10.1016/j.jhep.2019.08.025
7. McGlynn K.A., Petrick J.L., El-Serag H.B. epidemiology of hepatocellular carcinoma. Hepatology. 2021;73 Suppl 1(Suppl 1):4–13. DOI: 10.1002/hep.31288
8. Llovet J.M., Kelley R.K., Villanueva A., Singal A.G., Pikarsky E., Roayaie S., et al. Hepatocellular carcinoma. Nat Rev Dis Primers. 2021;7(1):6. DOI: 10.1038/s41572-020-00240-3
9. Yang J.D., Heimbach J.K. New advances in the diagnosis and management of hepatocellular carcinoma. BMJ. 2020;371:m3544. DOI: 10.1136/bmj.m3544
10. Koulouris A., Tsagkaris C., Spyrou V., Pappa E., Troullinou A., Nikolaou M. Hepatocellular carcinoma: an overview of the changing landscape of treatment options. J Hepatocell Carcinoma. 2021;8:387–401. DOI: 10.2147/JHC.S300182
11. Nagaraju G.P., Dariya B., Kasa P., Peela S., El-Rayes B.F. Epigenetics in hepatocellular carcinoma. Semin Cancer Biol. 2021:S1044-579X(21)00211-X. DOI: 10.1016/j.semcancer.2021.07.017
12. Torbenson M.S. Hepatocellular carcinoma: making sense of morphological heterogeneity, growth patterns, and subtypes. Hum Pathol. 2021;112:86–101. DOI: 10.1016/j.humpath.2020.12.009
13. Craig A.J., von Felden J., Garcia-Lezana T., Sarcognato S., Villanueva A. Tumour evolution in hepatocellular carcinoma. Nat Rev Gastroenterol Hepatol. 2020;17(3):139–52. DOI: 10.1038/s41575-019-0229-4
14. Singh G., Yoshida E.M., Rathi S., Marquez V., Kim P., Erb S.R., et al. Biomarkers for hepatocellular cancer. World J Hepatol. 2020;12(9):558–73. DOI: 10.4254/wjh.v12.i9.558
15. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2021. 252 с.
16. Wu C., Ren X., Zhang Q. Incidence, risk factors, and prognosis in patients with primary hepatocellular carcinoma and lung metastasis: a population-based study. Cancer Manag Res. 2019;11:2759–68. DOI: 10.2147/CMAR.S192896
17. Nhu Q.M., Knowles H., Pockros P.J., Frenette C.T. Pulmonary complications of transcatheter arterial chemoembolization for hepatocellular carcinoma. World J Respirol. 2016;6(3):69–75. DOI: 10.5320/WJR.v6.i3.69
18. Roskilly A., Rowe I.A. Surveillance for hepatocellular cancer. Clin Med (Lond). 2018;18(Suppl 2):s66–9. DOI: 10.7861/clinmedicine.18-2-s66
19. Гусейнов А.З., Гусейнов Т.А. Современная диагностика опухолей печени (обзор литературы). Вестник новых медицинских технологий. 2016;10(4):359–77. DOI: 10.12737/23515
20. Laube R., Sabih A. H., Strasser S. I., Lim L., Cigolini M., Liu, K. Palliative care in hepatocellular carcinoma. J Gastroenterol Hepatol. 2021;36(3):618–28. DOI: 10.1111/jgh.15169
Об авторах
А. С. ШкарабуровРоссия
отделение лучевой диагностики
Кемерово
Д. Н. Руденко
Россия
отделение лучевой диагностики
Кемерово
Е. Ф. Вайман
Россия
к.м.н., кафедра лучевой диагностики, лучевой терапии и онкологии
Кемерово
О. М. Соболева
Россия
к.б.н., кафедра микробиологии и вирусологии
Кемерово
Ю. В. Захарова
Россия
д.м.н., кафедра микробиологии и вирусологии
Кемерово
Рецензия
Для цитирования:
Шкарабуров А.С., Руденко Д.Н., Вайман Е.Ф., Соболева О.М., Захарова Ю.В. Бессимптомный гепатоцеллюлярный рак (клинический случай). Креативная хирургия и онкология. 2022;12(3):256-260. https://doi.org/10.24060/2076-3093-2022-12-3-256-260
For citation:
Shkaraburov A.S., Rudenko D.N., Vaiman E.F., Soboleva O.M., Zakharova Yu.V. Asymptomatic Hepatocellular Carcinoma (Clinical Case). Creative surgery and oncology. 2022;12(3):256-260. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-3-256-260
JATS XML


































