Перейти к:
Возможности применения комбинации ленватиниба и пембролизумаба при распространенной эндометриальной карциноме
https://doi.org/10.24060/2076-3093-2022-12-4-309-319
Аннотация
Рак эндометрия является одним из наиболее распространенных видов гинекологического рака как в Соединенных Штатах, так и в Российской Федерации, и этот показатель продолжает расти. Несмотря на то что ранние стадии рака эндометрия ассоциируются с благоприятной 5-летней выживаемостью (96 %), у пациенток с отдаленными метастазами этот показатель составляет всего лишь 18 %. Комбинация паклитаксела и карбоплатина является стандартным режимом первой линии для лечения прогрессирующей, рецидивирующей и метастатической карциномы эндометрия. Пембролизумаб, моноклональное антитело, нацеленное на рецептор запрограммированной смерти-1, одобрен для терапии метастатических солидных опухолей с высокой микросателлитной нестабильностью, которые прогрессировали после предшествующей терапии и не имели альтернативных вариантов лечения. Ленватиниб является пероральным мультикиназным ингибитором, который нацелен на рецепторы фактора роста эндотелия сосудов 1–3, рецепторы фактора роста фибробластов 1–4, рецептор фактора роста тромбоцитов-a, RET и KIT. Исследования II и III фазы (KEYNOTE-146/Study111 и KEYNOTE-775), посвященные комбинации ленватиниба и пембролизумаба при распространенной эндометриальной карциноме вне зависимости от статуса MMR и MSI, продемонстрировали новые возможности в лечении этой патологии. Полученные результаты, в том числе и выживаемость без прогрессирования и общая выживаемость, позволяют рассматривать комбинацию ленватиниба и пембролизумаба как новый стандарт в лечении данной патологии.
Ключевые слова
Для цитирования:
Меньшиков К.В., Султанбаев А.В., Мусин Ш.И., Меньшикова И.А., Султанбаева Н.И., Измайлов А.А., Фатихова А.А., Липатов Д.О., Серебренников Г.А. Возможности применения комбинации ленватиниба и пембролизумаба при распространенной эндометриальной карциноме. Креативная хирургия и онкология. 2022;12(4):309-319. https://doi.org/10.24060/2076-3093-2022-12-4-309-319
For citation:
Menshikov K.V., Sultanbaev A.V., Musin Sh.I., Menshikova I.A., Sultanbaeva N.I., Izmailov A.A., Fatikhova A.A., Lipatov D.O., Serebrennikov G.A. Possible applications for combined lenvatinib and pembrolizumab in advanced endometrial carcinoma. Creative surgery and oncology. 2022;12(4):309-319. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-4-309-319
ВВЕДЕНИЕ
Рак эндометрия является одним из наиболее распространенных видов гинекологического рака как в Соединенных Штатах, так и в Российской Федерации, и этот показатель продолжает расти [1–4]. Несмотря на то что ранние стадии рака эндометрия ассоциируются с благоприятной 5-летней выживаемостью (96 %), у пациенток с отдаленными метастазами этот показатель составляет всего лишь 18 % [5]. Комбинация паклитаксела и карбоплатина является стандартным режимом первой линии для лечения прогрессирующей, рецидивирующей и метастатической карциномы эндометрия [6–8]. До недавнего времени только два других метода лечения были специально одобрены для лечения метастатической эндометриальной карциномы во второй линии [9]. Мегестрола ацетат одобрен для паллиативного лечения прогрессирующей карциномы эндометрия, независимо от ранее проведенной терапии препаратами платины [10]. Пембролизумаб, моноклональное антитело, нацеленное на рецептор запрограммированной смерти-1 (PD-1), одобрен для терапии метастатических солидных опухолей с высокой микросателлитной нестабильностью (MSI-H), которые прогрессировали после предшествующей терапии и не имели альтернативных вариантов лечения [11]. Соответственно, пембролизумаб используется при метастатической карциноме эндометрия с наличием MSI-H после прогрессирования на фоне химиотерапии первой линии.
Опухоли MSI-H с высокой мутационной нагрузкой более восприимчивы к ингибиторам контрольных точек, и мутационная нагрузка при раке эндометрия MSI-H особенно высока [12][13]. Пембролизумаб продемонстрировал эффективность у пациенток с раком эндометрия MSI-H. В исследовании II фазы монотерапии пембролизумабом у пациенток с ранее леченной прогрессирующей MSI-H/dMMR эндометриальной карциномы в данной когорте (n = 49) результаты продемонстрировали объективную частоту ответа (ЧОО) 57,1 % (95 % ДИ 42,2–71,2), с медианой выживаемости без прогрессирования (ВБП) 25,7 месяца (95 % ДИ 4,9 месяца до не достигнуто) [14][15]. Тем не менее частота микросателлитной нестабильности при прогрессирующей эндометриальной карциноме составляет лишь 16 % [16].
ИССЛЕДОВАНИЕ I ФАЗЫ
В исследовании фазы Ib пембролизумаба для лечения рака эндометрия, позитивного по лиганду запрограммированной смерти-1 (PD-L1) (у пациенток, у которых заболевание прогрессировало после стандартной терапии или для которых стандартная терапия не подходила), у 18 из 19 пациенток с поддающимися оценке образцами опухоли был обнаружен микросателлитно-стабильный рак (MSS) [17]. Для всех пациенток, участвовавших в анализе эффективности (n = 23), ЧОО составила 13 % (95 % ДИ 2,8–33,6), при медиане ВБП 1,8 месяца (95 % ДИ 1,6–2,7), что позволяет предположить, что монотерапия пембролизумабом может быть менее эффективной у пациенток с опухолями MSS.
Ленватиниб является пероральным мультикиназным ингибитором, который нацелен на рецепторы фактора роста эндотелия сосудов 1–3, рецепторы фактора роста фибробластов 1–4, рецептор фактора роста тромбоцитов-a, RET и KIT [18–20]. В исследовании II фазы монотерапии ленватинибом при прогрессирующем, ранее леченом раке эндометрия ЧОО составила 14,3 % (согласно независимой оценке в соответствии с версией RECIST 1.1), а медиана ВБП составила 5,4 месяца [21][22]. Комбинация ингибиторов иммунных контрольных точек с ленватинибом была оценена в доклинических исследованиях ксенотрансплантата мыши [23–25]. В этих исследованиях ленватиниб в комбинации с ингибиторами контрольных точек продемонстрировал более мощную противоопухолевую активность, чем любой из препаратов по отдельности [23–25]. Исследование KEYNOTE-146/Study111 (исследование Ib/II фазы) оценивало эту комбинацию у пациенток с распространенными опухолями [26]. В промежуточном групповом анализе (отсечение данных 15 декабря 2017 г.; медиана наблюдения за исследованием 13 месяцев) пациенток с прогрессирующим раком эндометрия, которые были отобраны независимо от статуса PD-L1, гистологии или статуса MSI опухоли, ленватиниб плюс пембролизумаб продемонстрировали многообещающую эффективность: объективный ответ на 24-й неделе, оцененный с использованием критериев iRECIST, был достигнут у 39,6 % из 53 пациенток (оценка исследователя; 45,3 % по независимой оценке) [27].
ИССЛЕДОВАНИЕ II ФАЗЫ
KEYNOTE-146/Study111 — это многонациональное открытое исследование комбинации ленватиниба плюс пембролизумаб у пациентов с отдельными солидными опухолями (т.е. немелкоклеточным раком легкого, почечно-клеточной карциномой, раком эндометрия, уротелиальной карциномой, плоскоклеточным раком головы и шеи и меланомой). В период с 10 сентября 2015 по 1 июля 2018 года было включено 125 пациенток. Анализ первичной конечной точки был проведен на108 пациентках с раком эндометрия, которые были включены до 1 июля 2018 года и ранее получали системную терапию. Медиана наблюдения за этими пациентками составила 18,7 месяца (95 % ДИ 13,1–20,3), и 29 (26,9 %) пациенток получали непрерывное лечение в рамках исследования по крайней мере 1 исследуемым препаратом на момент среза базы данных. Наиболее распространенными гистологическими подтипами заболевания были эндометриоидная аденокарцинома (50,9 %; поFIGO 1-я или 2-я стадии 28,7 %; по FIGO 3-я стадия 22,2 %) и серозная карцинома (32,4 %). Почти половина (49,1 %) пациенток имели позитивный статус по PD-L1. 94 (87,0 %) и 11 (10,2 %) пациенток имели MSS или MMR (pMMR).
Первичная конечная точка, ЧОО на 24-й неделе лечения, составила 38,0 % (41/108 пациенток; 95 % ДИ 28,8–47,8). У 102 пациенток с возможностью оценки опухоли по критериям irRECIST, по мнению исследователей, уменьшение суммы диаметров таргетных очагов по сравнению с исходным уровнем отмечалось у 86 (84,3%) пациенток (рис. 1.)
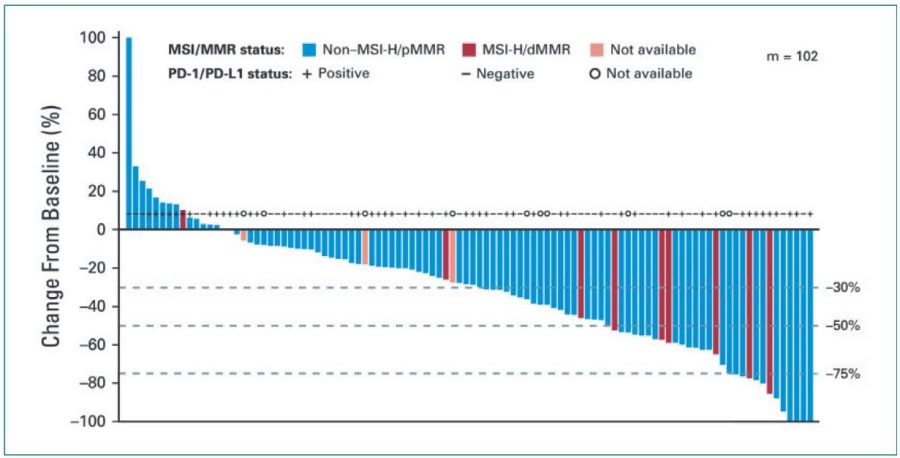
Рисунок 1. Процентное изменение суммы размеров таргетных очагов от исходного уровня до надира после базового уровня при наличии микросателлитной нестабильности (MSI/MMR) [28]
Figure 1. Percentage change in sum of target foci sizes from baseline to post-baseline nadir in microsatellite instability (MSI/MMR) [28]
Что касается вторичных конечных точек, ЧОО у пациенток, ранее получавших терапию по поводу рака эндометрия, составила 38,9 % (42/108, 95 % ДИ 29,7–48,7; CR, 8/108, 7,4 %, 95 % ДИ 3,3–14,1; PR 34/108, 31,5 %, 95 % ДИ 22,9–41,1). Медиана ВБП составила 7,4 месяца (95 % ДИ 5,3–8,7; медиана наблюдения 11,9 месяца; 95 % ДИ 9,9–18,4), а медиана ОВ составила 16,7 месяца (95 % ДИ 15,0 до н.э.).
Средняя продолжительность лечения ленватинибом в сочетании с пембролизумабом составила 8,5 месяца (ленватиниб — 8,2 месяца, пембролизумаб — 7,3 месяца). Нежелательные явления любой степени тяжести, связанные с лечением, наблюдались у 120 (96,8 %) пациенток. Нежелательные явления 3 или 4 степени, связанные с лечением, имели место у 83 (66,9 %) пациенток. В целом, 22 (17,7 %) пациента прекратили прием одного или обоих исследуемых препаратов из-за связанных с лечением нежелательных явлений, 19 (15,3 %) прекратили прием ленватиниба, 15 (12,1 %) прекратили прием пембролизумаба и 11 (8,9 %) прекратили прием обоих исследуемых препаратов. Связанные с лечением нежелательные явления привели к прекращению приема ленватиниба и/или пембролизумаба у 87 (70,2 %) пациенток и снижению дозы ленватиниба у 78 (62,9 %) пациенток. Средняя интенсивность дозы ленватиниба составила 14,4 мг/сутки, а средняя доза ленватиниба, полученная в процентах от запланированной дозы, составила 71,9 %.
У 71 пациента (57,3 %) наблюдались ожидаемые заранее нежелательные явления, связанные с терапией пембролизумабом. Гипотиреоз был наиболее частым из этих нежелательных явлений и встречался у 59 (47,6 %) пациенток. Во время этого исследования 51 пациентка умерла: 16 во время терапии исследуемыми препаратами и 35 во время последующего наблюдения со средним временем от последней дозы до смерти 171 день (29/35 пациенток прекратили лечение из-за радиологического прогрессирования; причина смерти во время наблюдения не была зарегистрирована). Следует отметить, что 4 смерти были признаны вызванными неотложными состояниями (по 1 из-за перфорации желудочно-кишечного тракта, кишечной непроходимости, общего ухудшения физического состояния и метаболической энцефалопатии), в которых не была признана связь с проводимой терапией. Два случая смерти связаны с проводимым лечением (1 из-за сепсиса, вызванного инфекцией кишечной палочки, и 1 вследствие внутричерепного кровоизлияния).
Хотя пембролизумаб эффективен при наличии в опухоли микросателлитной нестабильности MSI-H (ЧОО, 28/49 [ 57,1 %] пациенток), он менее эффективен при отсутствии микросталлитной нестабильности (наилучший ответ был частичный, 2/18 пациенток) [14–17]. Аналогичным образом при прогрессирующей/рецидивирующей предварительно пролеченной карциноме эндометрия исследуемое анти PD-1 моноклональное антитело достарлимаб (ранее TSR-042) обладало большей эффективностью у пациенток с опухолями MSI-H по сравнению с пациентками с опухолями MSS (ЧОО [подтвержденные и неподтвержденные ответы] 50,0 и 19,1 % соответственно) [29]. ЧОО, наблюдаемые при применении других исследуемых моноклональных антител к PD-L1, имели аналогичные результаты при ранее леченном раке эндометрия (авелумаб: 27 %, пациенты с опухолями dMMR; 6 %, пациенты с опухолями pMMR; дурвалумаб: 43 %, пациенты с опухолями dMMR; 3 %, пациенты с опухолями pMMR) [30][31]. В исследовании KEYNOTE-146/Study111 были получены сопоставимые результаты (ЧОО на 24-й неделе 38,0 %; ЧОО, 38,9 %; медиана ВБП 7,4 месяца у пациенток с ранее леченным раком эндометрия). Эти данные свидетельствуют о том, что комбинация ленватиниба и пембролизумаба демонстрирует эффективность по сравнению с ранее описанными методами лечения в аналогичных популяциях [32][33]. Следует отметить, что ЧОО в исследовании KEYNOTE-146/Study111 была схожей независимо от используемых критериев ответа опухоли и от того, оценивались ли они исследователем или независимой командой. Ленватиниб в сочетании с пембролизумабом также продемонстрировал надежную глубину ответа; у 84 % пациенток с поддающимися оценке опухолевыми поражениями наблюдалось уменьшение опухолевых поражений (любого размера) по сравнению с исходным уровнем и 30 % имели максимальное уменьшение на 50 %. Также ЧОО у пациенток с карциномой эндометрия без микросателлитной нестабильности составила 37,2 %. Профиль безопасности ленватиниба и пембролизумаба в целом был аналогичен ранее описанным профилям безопасности каждого из них при проведении монотерапии (ленватиниб, 24 мг/сут; пембролизумаб, 10 мг/кг каждые 2 или 3 недели) [14][15][17][22][34–36]. Хотя гипотиреоз наблюдался у большей части пациентов, участвовавших в исследовании, в сравнении с ранее опубликованными данными при монотерапии (48% [ связанные с лечением, 43%] против 37% соответственно), зарегистрирован только 1 случай гипотиреоза 3-й степени [34][35]. В целом частота нежелательных явлений 3–4-й степени, связанных с лечением, в исследовании была аналогична промежуточному анализу комбинации ленватиниба с пембролизумабом при раке эндометрия (67 и 68 % соответственно) [27]. Своевременное выявление связанных с лечением нежелательных явлений и их ведение на протяжении всего исследования с перерывами и снижением дозы, возможно, способствовали продолжению лечения, поскольку только 17,7 % пациенток отказались от продолжения терапии из-за связанных с лечением нежелательных явлений. В среднем пациенты получили 11 курсов лечения пембролизумабом, при этом только 4 пациента достигли максимального количества допустимых доз.
Данные, полученные в этом исследовании, неполные. К предварительным анализам, касающимся статуса PD-L1, следует относиться с осторожностью, поскольку порог положительного PD-L1 не является окончательным и неизвестно, является ли положительный статус PD-L1 прогностическим показателем при раке эндометрия. Дополнительные ограничения включают отсутствие анализа качества жизни, а также отсутствие оценок биомаркеров для характеристики пациенток, восприимчивых к ингибиторам контрольных точек (т.е. бремя опухолевых мутаций и ассоциированные с мутациями неоантигены); однако планируется проведение анализа биомаркеров. Следует отметить, что, хотя это исследование можно считать небольшим, его размер (ключевой анализ эффективности, n = 108; общая популяция, n = 124) сопоставим с общим объемом исследований, которые привели к одобрению пембролизумаба у пациенток со злокачественными новообразованиями с микросателлитной нестабильностью (n = 149) [37]. В целом результаты этого исследования обнадеживают и показывают убедительную эффективность и приемлемый профиль безопасности у пациенток с прогрессирующей карциномой эндометрия.
В результате этого исследования ленватиниб плюс пембролизумаб получили ускоренное одобрение для лечения пациенток с прогрессирующей карциномой эндометрия, которая не является MSI-H или dMMR, у которых наблюдается прогрессирование заболевания после предшествующей системной терапии и которые не являются кандидатами на хирургическое или лучевое лечение.
ИССЛЕДОВАНИЕ III ФАЗЫ
Исследование III фазы KEYNOTE-775 посвящено лечению прогрессирующей эндометриальной карциномы после первой линии терапии. В исследование были включены женщины в возрасте 18 лет и старше с подтвержденным прогрессирующим, рецидивирующим или метастатическим раком эндометрия любого гистологического подтипа, кроме карциносаркомы и саркомы. Пациентки включались с прогрессированием заболевания после одной предыдущей линии химиотерапии на основе препаратов платины [38]. Дизайн исследования представлен на рисунке 2.
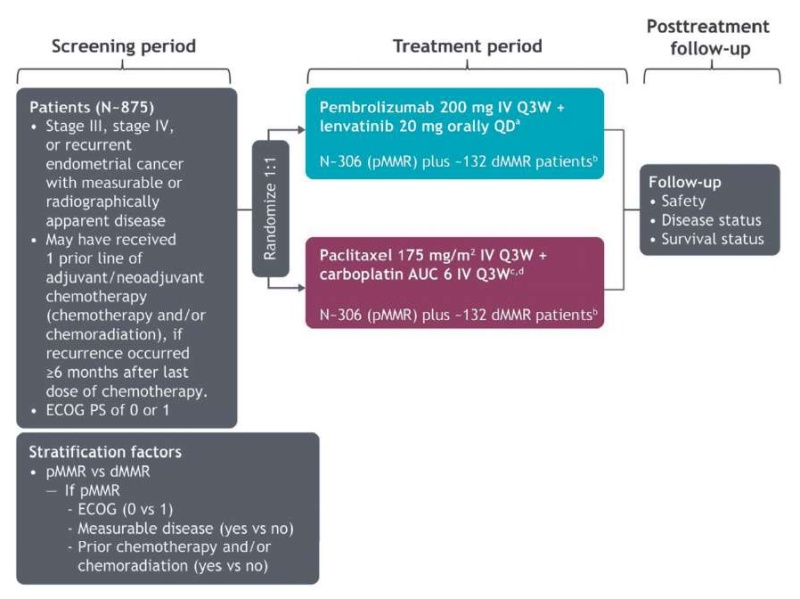
Рисунок 2. Дизайн исследования ENGOT-en9/LEAP-001
Figure 2. ENGOT-en9/LEAP-001 study design
Лечение предполагалось до прогрессирования заболевания или неприемлемой токсичности. Терапию пембролизумабом необходимо прекратить после 35 циклов, но прием ленватиниба может продолжаться и после прекращения терапии пембролизумабом. Набор планировалось прекратить, когда будут набраны 612 пациенток с опухолями pMMR и 263 пациентки с опухолями с dMMR.
Пациенткам с риском развития токсических явлений, вызванных предшествующим облучением органов малого таза/позвоночника, могут быть назначены более низкие начальные дозы паклитаксела (135 мг/м2) и карбоплатина (AUC 5) [38].
В 167 центрах в 21 стране включено 827 пациенток (697 в популяции pMMR и 130 в популяции dMMR). Рандомизация произведена в период с 11 июня 2018 по 3 февраля 2020 года. Срез данных проведен 26 октября 2020 года для окончательного анализа ВБП и первого промежуточного анализа ОВ. Медиана наблюдения составила 12,2 месяца в группе ленватиниба+пембролизумаба и 10,7 месяца в группе химиотерапии. На дату среза данных лечение продолжается у 27,8 % пациенток в рММР и у 30,5 % всех пациенток, начавших лечение в группе ленватиниба+пембролизумаба, и у 2,8 и 2,6 % соответственно в группе стандартной химиотерапии. Основной причиной прекращения лечения у всех пациенток во всех группах было прогрессирование заболевания. Демографические данные и характеристики заболевания пациенток на исходном этапе были сбалансированы между группами лечения как в целом, так и в популяции pMMR. Среди всех больных 84,2 % пациенток в группе ленватиниба+пембролизумаба и 84,4 % пациенток в группе химиотерапии имели подтвержденный статус pMMR, а 35,0 и 38,2 % пациенток соответственно ранее получали системное лечение только в качестве неоадъювантной терапии. Сообщалось о лечении одной линией терапии с включением препарата платины у 79,3 % пациенток в группе ленватиниба+пембролизумаба и у 75,7 % пациенток в группе химиотерапии; 20,2 и 24,3 % пациенток соответственно ранее получали две линии терапии на основе платины; 8,8 и 10,6 % ранее получали паллиативную гормональную терапию и 46,0 и 47,8 % ранее получали лучевую терапию [29].
В популяции pMMR ВБП, по данным независимой оценки в соответствии с RECIST, версия 1.1, была значительно более продолжительной при применении ленватиниба+пембролизумаба (медиана 6,6 месяца; 95 % ДИ 5,6–7,4), чем в группе химиотерапии (медиана 3,8 месяца; 95 % ДИ 3,6–5,0) (отношение рисков прогрессирования или смерти 0,60; 95 % ДИ 0,50–0,72; p < 0,001). Аналогичные результаты были получены в общей популяции участников исследования; медиана выживаемости без прогрессирования составила 7,2 месяца (95 % ДИ 5,7–7,6) при применении ленватиниба+пембролизумаба по сравнению с 3,8 месяца (95 % ДИ 3,6–4,2) при проведении химиотерапии (отношение рисков 0,56; 95 % ДИ 0,47–0,66; p < 0,001). Общая выживаемость в популяции с рММР была значительно выше при применении ленватиниба в сочетании с пембролизумабом (медиана 17,4 месяца; 95 % ДИ 14,2–19,9), чем при химиотерапии (медиана 12,0 месяца; 95 % ДИ 10,8–13,3) (коэффициент риска смерти 0,68; 95 % ДИ 0,5–0,84; p < 0,001) (рис. 3А). Аналогичные результаты были получены в общей популяции участников исследования; медиана общей выживаемости составила 18,3 месяца (95 % ДИ 15,2–20,5) при применении ленватиниб+пембролизумаб по сравнению с 11,4 месяца (95 % ДИ 10,5–12,9) с химиотерапией (отношение рисков 0,62; 95 % ДИ 0,51–0,75; p < 0,001) (рис. 3B).
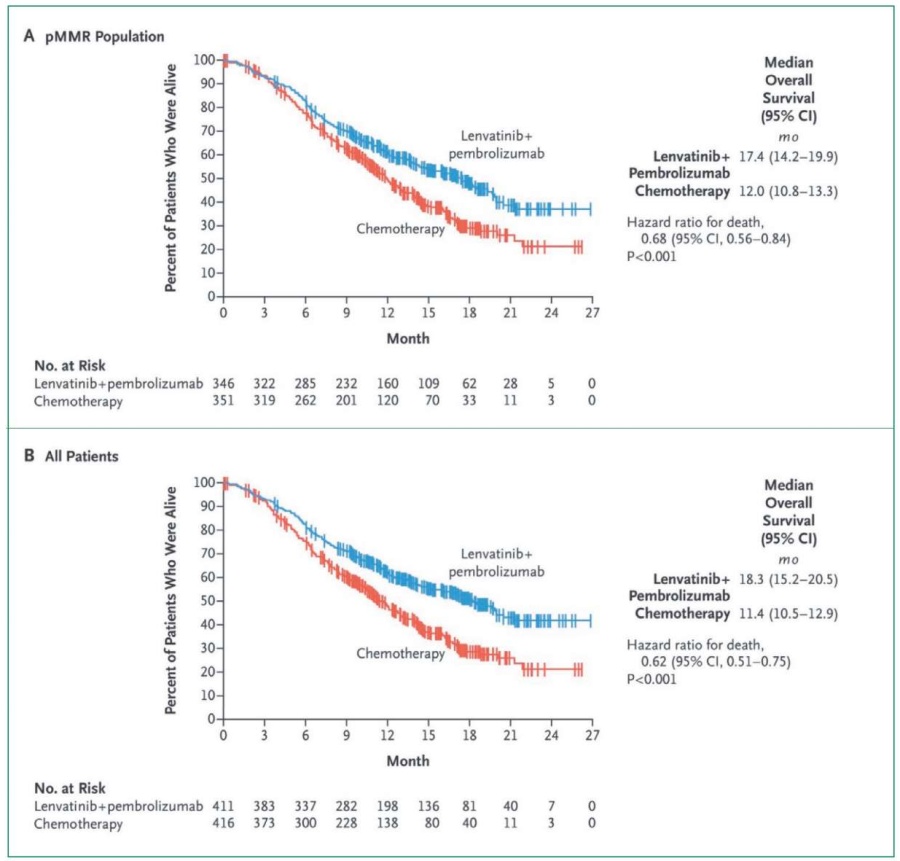
Рисунок 3 А, B. Результаты общей выживаемости в исследовании KEYNOTE-775 [39]
Figure 3 A, B. Overall survival results in KEYNOTE-775 study [39]
В популяции pMMR процент пациенток с подтвержденным объективным ответом, оцененным в независимом комитете в соответствии с RECIST, версия 1.1, был выше при применении ленватиниба+пембролизумаба (30,3 %), чем прихимиотерапии (15,1 %); в общей популяции исследования процент составил 31,9 и 14,7 % соответственно. Среди пациенток при наличии ответа средняя продолжительность ответа в популяции pMMR составила 9,2 месяца (диапазон от 1,6 до 23,7) при применении ленватиниба+пембролизумаба и 5,7 месяца (диапазон от 0,0 до 24,2) при химиотерапии; среди пациенток с ответом средняя продолжительность ответа в общей популяции исследования составила 14,4 месяца (диапазон, 1,6–23,7) и 5,7 месяца (95 % ДИ 0,0–24.2) соответственно. В целом у большего числа пациенток в группе ленватиниба+пембролизумаба, чем в группе химиотерапии, наблюдалось уменьшение опухоли.
В популяции, подвергшейся анализу безопасности, средняя продолжительность лечения составила 231 день (диапазон от 1 до 817) в группе ленватиниба+пембролизумаба и 104,5 дня (диапазон от 1 до 785) в контрольной группе — химиотерапии. Среди пациенток, получавших ленватиниб в сочетании с пембролизумабом, средняя интенсивность дозы ленватиниба составляла 13,8 мг в сутки, а среднее число циклов терапии пембролизумабом составляло 10. Среди пациенток, получавших химиотерапию, среднее количество циклов доксорубицина составило 5 и 6 для паклитаксела. Больше пациенток в группе ленватиниб+пембролизумаб, чем в группе химиотерапии, имели продолжительность воздействия не менее 6 месяцев, не менее 12 месяцев и не менее 18 месяцев. Медиана времени до первого снижения дозы ленватиниба составила 1,9 месяца (диапазон от 0,1 до 22,8); у 45,6 % пациенток в группе ленватиниба+пембролизумаба было два или более снижения дозы ленватиниба. Почти все пациентки в двух лечебных группах (>99 %) имели нежелательные явления во время лечения, причем наиболее распространенными были гипертония (у 64,0 % пациенток) при применении ленватиниба в комбинации с пембролизумабом и анемия (у 48,7 %) в группе химиотерапии. Случаи нежелательных явлений 3-й степени или выше имели место у 88,9 % пациенток, получавших ленватиниб+пембролизумаб, и у 72,7 % в группе химиотерапии. Наиболее частыми серьезными нежелательными явлениями были гипертензия (у 4,2 % пациенток) при применении ленватиниба+пембролизумаба и фебрильная нейтропения (у 4,1 %) при химиотерапии.
Неблагоприятный 5-й класс событий (независимо от оценки исследователем связи с лечением) произошел у 5,7 % пациенток, получавших ленватиниб+пембролизумаб, и у 4,9 % пациенток, получавших химиотерапию. Среди пациенток, получавших ленватиниб в сочетании с пембролизумабом, нежелательные явления любой степени тяжести привели к снижению дозы ленватиниба у 66,5 %, к прерыванию приема (ленватиниба, пембролизумаба или обоих) у 69,2 % и к прекращению приема исследуемого препарата в 33,0 % случаев (прекращение приема ленватиниба в 30,8 %, пембролизумаба в 18,7 % и обоих препаратов в 14,0 %). Среди пациенток, получавших химиотерапию, нежелательные явления любой степени тяжести привели к снижению дозы у 12,9 %, к прерыванию лечения у 27,1 % и к прекращению терапии у 8,0 %. Нежелательные явления, представляющие интерес в отношении пембролизумаба, произошли у 67,2 % пациенток; наиболее распространенным был гипотиреоз, частота которого составила 57,6 % (1-я степень у 17,2 % и 2-я степень у 38,9 %) среди пациенток, получавших ленватиниб и пембролизумаб. Серьезные нежелательные явления произошли по крайней мере у 1 % всех пролеченных пациентов. Качество жизни, связанное со здоровьем, по данным опросника QLQ-C30 было оценено более чем у 95 % пациентов в двух группах лечения на начальном этапе; результаты через 12 недель после рандомизации были доступны для 80 % пациентов в группе ленватиниба+пембролизумаба и для 62 % из тех, кто находился в группе химиотерапии. Не наблюдалось существенных различий между группами в показателях качества жизни по шкале QLQ-C30 global health status со временем.
Последующая терапия: в популяции, планирующей лечение, 28,0 % пациенток в группе ленватиниба+пембролизумаба и 48,1 % пациенток в группе химиотерапии получали последующие системные противоопухолевые препараты. В группе химиотерапии 9,1 % пациенток в популяции pMMR получали ленватиниб и пембролизумаб в качестве последующей терапии, а 16,9 % пациенток в dMMR получали монотерапию анти PD-1 препаратами или комбинированные схемы в качестве последующей терапии.
В этом исследовании III фазы проведено сравнение комбинации ленватиниба и пембролизумаба с химиотерапией по выбору врача у пациенток с распространенным раком эндометрия, у которых заболевание прогрессировало или рецидивировало после получения, по крайней мере, одного предыдущего режима химиотерапии на основе платины. Что касается двух основных конечных точек эффективности, то как выживаемость без прогрессирования, так и общая выживаемость были значительно дольше при применении ленватиниба+пембролизумаба, чем при химиотерапии, как в популяции с pMMR, так и среди всех пациенток. Кривые эффективности разделились в начале курса исследуемой терапии и оставались последовательно разделенными в течение всего периода оценки. Эти преимущества в ВБП и ОВ были отмечены во всех оцененных подгруппах, включая подгруппы, определенные в соответствии с менее распространенными, ноагрессивными гистологическими подтипами, наличием в анамнезе лучевой терапии органов малого таза и предыдущими линиями терапии.
Пациентки в группе ленватиниба+пембролизумаба имели лучшие исходы, включая более длительную ОВ, по сравнению с пациентками в группе химиотерапии, несмотря на то что 9,1 % пациенток в популяции pMMR, которые были рандомизированы в группу химиотерапии, получали комбинацию ленватиниба и пембролизумаба в качестве последующей линии терапии. 16,9 % пациенток в популяции dMMR, которые были рандомизированы в группу химиотерапии, получали монотерапию ингибиторами контрольных точек или комбинированную терапию в качестве последующих линий. Процент пациенток с объективным ответом, связанным с приемом ленватиниба в сочетании с пембролизумабом, соответствовал предыдущим результатам исследования II фазы KEYNOTE-146/Study111 и был выше, чем процент, наблюдаемый в группе химиотерапии. Результаты эффективности химиотерапии соответствовали результатам исследований IIIфазы в контексте терапии второй линии или последующих линий [40][41].
Наиболее частыми нежелательными явлениями (частота ≥30 % в соответствующих группах лечения) были артериальная гипертензия, гипотиреоз, диарея, тошнота, снижение аппетита, рвота, снижение массы тела, усталость и артралгия среди пациенток в группе комбинации ленватиниба и пембролизумаба и анемия, тошнота, нейтропения и алопеция у пациенток в группе химиотерапии. Данные о безопасности комбинированной терапии в исследовании в целом соответствовали результатам, наблюдаемым в исследовании KEYNOTE-146/Study111, и известным профилям побочных эффектов каждого препарата. Частота гипотиреоза (нежелательного явления, которое было связано с лечением как ленватинибом, так и пембролизумабом) была хотя и выше, чем при химиотерапии в этом исследовании или монотерапии в более ранних исследованиях, легко корректировалась пероральными препаратами, и большинство случаев были 1-й или 2-й степени тяжести [11][34][42][43]. Стратегия назначения терапии ленватинибом начиная с установленной дозы и снижая ее по мере необходимости ранее была успешной [28]. Хотя небольшое ретроспективное исследование показало, что начальная доза 14 мг в день не снижает эффективность, в этом исследовании участвовало небольшое число пациентов (70 человек, из которых только 16 получали лечение в дозе 20 мг в день) [44]. В проспективных исследованиях (с более крупными популяциями) были задействованы пациенты с другими типами опухолей. Исследования показали, что более низкие начальные дозы не были ниже одобренной начальной дозы ленватиниба для лечения почечно-клеточной карциномы и дифференцированного рака щитовидной железы [45][46]. Более того, профиль безопасности не был заметно улучшен при более низких начальных дозах [45][46]. В приведенном выше исследовании нежелательные явления любой причины приводили к снижению дозы у 66,5 % пациентов, получавших ленватиниб и пембролизумаб. Несмотря на то что установленные протоколом критерии для анализа эффективности были соблюдены, мониторинг безопасности и эффективности продолжается. Это исследование показало, что терапия ленватинибом в сочетании с пембролизумабом приводит к значительно более лучшим показателям ВБП и ОВ, чем химиотерапия по выбору лечащего врача, как в популяции pMMR, так и в общей популяции пациенток с распространенным раком эндометрия, у которых прогрессирование заболевания наблюдалось после получения предыдущей системной терапии препаратами платины.
ЗАКЛЮЧЕНИЕ
Актуальность второй и последующих линий терапии распространенной эндометриальной карциномы не вызывает сомнений. До недавнего времени только два других метода лечения были специально одобрены для лечения метастатической эндометриальной карциномы во второй линии. Одним из препаратов выбора является пембролизумаб для опухолей с наличием микросателлитной нестабильности. Следует отметить, что только 16 % всех распространенных эндометриальных карцином имеют микросателлитную нестабильность и являются кандидатами на монотерапию пембролизумабом.
Исследования II и III фазы (KEYNOTE-146/Study111 и KEYNOTE-775), посвященные комбинации ленватиниба и пембролизумаба при распространенной эндометриальной карциноме вне зависимости от статуса MMR и MSI, продемонстрировали новые возможности в лечении этой патологии.
Полученные результаты, в том числе и выживаемость без прогрессирования и общая выживаемость, позволяют рассматривать комбинацию ленватиниба и пембролизумаба как новый стандарт в лечении данной патологии.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Sponsorship data. This work is not funded.
Список литературы
1. Сote M.L., Ruterbusch J.J., Olson S.H., Lu K., Ali-Fehmi R. The growing burden of endometrial cancer: a major racial disparity affecting black women. Cancer Epidemiol Biomarkers Prev. 2015;24(9):1407–15. DOI: 10.1158/1055-9965.EPI-15-0316
2. Constantine G.D., Kessler G., Graham S., Goldstein S.R. Increased incidence of endometrial cancer following the women’s health initiative: an assessment of risk factors. J Womens Health (Larchmt). 2019;28(2):237–43. DOI: 10.1089/jwh.2018.6956
3. Rahib L., Smith B.D., Aizenberg R., Rosenzweig A.B., Fleshman J.M., Matrisian L.M. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res. 2014;74(11):2913–21. DOI: 10.1158/0008-5472. CAN-14-0155
4. Key statistics for endometrial cancer. American Cancer Society: [cited 2022 Oct 21]. Available from: https://www.cancer.org/cancer/endometrial-cancer/about/key-statistics.html.
5. Endometrial cancer survival rates, by stage. American Cancer Society: [cited 2022 Oct 21]. Available from: https://www.cancer.org/cancer/endometrial-cancer/detection-diagnosis-staging/survival-rates.html.
6. National Comprehensive Cancer Network: Clinical Practice Guidelines in Oncology: Uterine Neoplasms. Version 3.2019. Available from: https://www.nccn.org/professionals/physician_gls/pdf/uterine.pdf.
7. Miller D.S., Filiaci V.L., Mannel R.S., Cohn D.E., Matsumoto T., Tewari K.S., et al. Carboplatin and paclitaxel for advanced endometrial cancer: final overall survival and adverse event analysis of a Phase III Trial (NRG Oncology/GOG0209). J Clin Oncol. 2020;38(33):3841–50. DOI: 10.1200/JCO.20.01076
8. Меньшиков К.В., Султанбаев А.В., Мусин Ш.И., Меньшикова И.А., Липатов Д.О., Султанбаева Н.И. и др. Системная терапия распространенного рака эндометрия. Обзор литературы. Поволжский онкологический вестник. 2021;12(1):31–43.
9. Makker V., Green A.K., Wenham R.M., Mutch D., Davidson B., Miller D.S. New therapies for advanced, recurrent, and metastatic endometrial cancers. Gynecol Oncol Res Pract. 2017;4:19. DOI: 10.1186/s40661-017-0056-7
10. Lentz S.S., Brady M.F., Major F.J., Reid G.C., Soper J.T. High-dose megestrol acetate in advanced or recurrent endometrial carcinoma: a Gynecologic Oncology Group Study. J Clin Oncol. 1996;14(2):357–61. DOI: 10.1200/JCO.1996.14.2.357
11. Keytruda (pembrolizumab). Whitehouse Station, NJ: Merck Sharp & Dohme; 2018.
12. Arora E., Masab M., Mittar P., Jindal V., Gupta S., Dourado C. Role of immune checkpoint inhibitors in advanced or recurrent endometrial cancer. Cureus. 2018;10(4):e2521. DOI: 10.7759/cureus.2521
13. Bell D.W., Ellenson L.H. Molecular genetics of endometrial carcinoma. Annu Rev Pathol. 2019;14:339–67. DOI: 10.1146/annurevpathol-020117-043609
14. O’Malley D.M., Bariani G.M., Cassier P.A., Marabelle A., Hansen A.R., De Jesus Acosta A., et al. Pembrolizumab in patients with microsatellite instability-high advanced endometrial cancer: results from the KEYNOTE-158 study. J Clin Oncol. 2022;40(7):752–61. DOI: 10.1200/JCO.21.01874
15. Marabelle A., Le D.T., Ascierto P.A., Di Giacomo A.M., De JesusAcosta A., Delord J.P., et al. Efficacy of pembrolizumab in patients with noncolorectal high microsatellite instability/mismatch repair-deficient cancer: results from the phase II KEYNOTE-158 study. J Clin Oncol. 2020;38(1):1–10. DOI: 10.1200/JCO.19.02105
16. Soumerai T.E., Donoghue M.T.A., Bandlamudi C., Srinivasan P., Chang M.T., Zamarin D., et al. Clinical utility of prospective molecular characterization in advanced endometrial cancer. Clin Cancer Res. 2018;24(23):5939–47. DOI: 10.1158/1078-0432.CCR-18-0412
17. Ott P.A., Bang Y.J., Berton-Rigaud D., Elez E., Pishvaian M.J., Rugo H.S., et al. Safety and antitumor activity of pembrolizumab in advanced programmed death ligand 1-positive endometrial cancer: results from the KEYNOTE-028 study. J Clin Oncol. 2017;35(22):2535–41. DOI: 10.1200/JCO.2017.72.5952
18. Suyama K., Iwase H. Lenvatinib: a promising molecular targeted agent for multiple cancers. Cancer Control. 2018;25(1):1073274818789361. DOI: 10.1177/1073274818789361
19. Okamoto K., Kodama K., Takase K., Sugi N.H., Yamamoto Y., Iwata M., et al. Antitumor activities of the targeted multi-tyrosine kinase inhibitor lenvatinib (E7080) against RET gene fusion-driven tumor models. Cancer Lett. 2013;340(1):97–103. DOI: 10.1016/j.canlet.2013.07.007
20. Ferrari S.M., Ruffilli I., Centanni M., Virili C., Materazzi G., Alexopoulou M., et al. Lenvatinib in the therapy of aggressive thyroid cancer: state of the art and new perspectives with patents recently applied. Recent Pat Anticancer Drug Discov. 2018;13(2):201–8. DOI: 10.2174/1574892813666180220110729
21. Eisenhauer E.A., Therasse P., Bogaerts J., Schwartz L.H., Sargent D., Ford R., et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45(2):228–47. DOI: 10.1016/j.ejca.2008.10.026
22. Vergote I., Powell M.A., Teneriello M.G., Miller D.S., Garcia A.A., Mikheeva O.N., et al. Second-line lenvatinib in patients with recurrent endometrial cancer. Gynecol Oncol. 2020;156(3):575–82. DOI: 10.1016/j.ygyno.2019.12.039
23. Kato Y., Tabata K., Kimura T., Yachie-Kinoshita A., Ozawa Y., Yamada K., et al. Lenvatinib plus anti-PD-1 antibody combination treatment activates CD8+ T cells through reduction of tumor-associated macrophage and activation of the interferon pathway. PLoS One. 2019;14(2):e0212513. DOI: 10.1371/journal.pone.0212513
24. Kato Y., Bao X., Macgrath S., Tabata K., Hori Y., Tachino S., et al. Lenvatinib mesilate (LEN) enhanced antitumor activity of a PD-1 blockade agent by potentiating Th1 immune response. Ann Oncol. 2016;27(suppl 6): abstr 2PD. DOI: 10.1093/annonc/mdw362.02
25. Kimura T., Kato Y., Ozawa Y., Kodama K., Ito J., Ichikawa K., et al. Immunomodulatory activity of lenvatinib contributes to antitumor activity in the Hepa1-6 hepatocellular carcinoma model. Cancer Sci. 2018;109(12):3993–4002. DOI: 10.1111/cas.13806
26. Taylor M., Dutcus C.E., Schmidt E., Bagulho T., Li D., Shumaker R., et al. A phase 1b trial of lenvatinib (LEN) plus pembrolizumab (PEM) in patients with selected solid tumors. Ann Oncol. 2016;27(suppl 6): abstr 776PD. DOI: 10.1093/annonc/mdw373.04
27. Makker V., Rasco D., Vogelzang N.J., Brose M.S., Cohn A.L., Mier J., et al. Lenvatinib plus pembrolizumab in patients with advanced endometrial cancer: an interim analysis of a multicentre, open-label, single-arm, phase 2 trial. Lancet Oncol. 2019;20(5):711–8. DOI: 10.1016/S1470-2045(19)30020-8
28. Makker V., Taylor M.H., Aghajanian C., Oaknin A., Mier J., Cohn A.L., et al. Lenvatinib plus pembrolizumab in patients with advanced endometrial cancer. J Clin Oncol. 2020;38(26):2981–92. DOI: 10.1200/JCO.19.02627
29. Oaknin A., Duska L.R., Sullivan R.J., Pothuri B., Ellard S.L., Leath C.A. III, et al. Preliminary safety, efficacy, and pharmacokinetic/pharmacodynamic characterization from GARNET, a phase I/II clinical trial of the anti–PD-1 monoclonal antibody, TSR-042, in patients with recurrent or advanced MSI-h and MSS endometrial cancer. Gynecol Oncol. 2019;154(suppl 1): abstr 33. DOI:10.1016/j.ygyno.2019.04.044
30. Konstantinopoulos P.A., Luo W., Liu J.F., Gulhan D.C., Krasner C., Ishizuka J.J., et al. Phase II study of avelumab in patients with mismatch repair deficient and mismatch repair proficient recurrent/persistent endometrial cancer. J Clin Oncol. 2019;37(30):2786–94. DOI: 10.1200/JCO.19.01021
31. Antill Y., Kok P.S., Robledo K., Yip S., Cummins M., Smith D., et al. Clinical activity of durvalumab for patients with advanced mismatch repair-deficient and repair-proficient endometrial cancer. A nonrandomized phase 2 clinical trial. J Immunother Cancer. 2021;9(6):e002255. DOI: 10.1136/jitc-2020-002255
32. Aghajanian C., Sill M.W., Darcy K.M., Greer B., McMeekin D.S., Rose P.G., et al. Phase II trial of bevacizumab in recurrent or persistent endometrial cancer: a Gynecologic Oncology Group study. J Clin Oncol. 2011;29(16):2259–65. DOI: 10.1200/JCO.2010.32.6397
33. Spirtos N.M., Enserro D., Homesley H.D., Gibbons S.K., Cella D., Morris R.T., et al. The addition of paclitaxel to doxorubicin and cisplatin and volume-directed radiation does not improve overall survival (OS) or long-term recurrence-free survival (RFS) in advanced endometrial cancer (EC): A randomized phase III NRG/Gynecologic Oncology Group (GOG) study. Gynecol Oncol. 2019 Jul;154(1):13–21. doi: 10.1016/j.ygyno.2019.03.240
34. Motzer R.J., Hutson T.E., Glen H., Michaelson M.D., Molina A., Eisen T., et al. Lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma: a randomised, phase 2, open-label, multicentre trial. Lancet Oncol. 2015;16(15):1473–82. DOI: 10.1016/S1470-2045(15)00290-9
35. Robert C., Schachter J., Long G.V., Arance A., Grob J.J., Mortier L., et al. Pembrolizumab versus ipilimumab in advanced melanoma. N Engl J Med. 2015;372(26):2521–32. DOI: 10.1056/NEJMoa1503093
36. Schlumberger M., Tahara M., Wirth L.J., Robinson B., Brose M.S., Elisei R., et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med. 2015;372(7):621–30. DOI: 10.1056/NEJMoa1406470
37. Marcus L., Lemery S.J., Keegan P., Pazdur R. FDA approval summary: pembrolizumab for the treatment of microsatellite instability-high solid tumors. Clin Cancer Res. 2019;25(13):3753–8. DOI: 10.1158/1078-0432.CCR-18-4070
38. Marth C., Tarnawski R., Tyulyandina A., Pignata S., Gilbert L., Kaen D., et al. Phase 3, randomized, open-label study of pembrolizumab plus lenvatinib versus chemotherapy for first-line treatment of advanced or recurrent endometrial cancer: ENGOT-en9/LEAP-001. Int J Gynecol Cancer. 2022;32(1):93–100. DOI: 10.1136/ijgc-2021-003017
39. Makker V., Colombo N., Casado Herráez A., Santin A.D., Colomba E., Miller D.S., et al. Lenvatinib plus pembrolizumab for advanced endometrial cancer. N Engl J Med. 2022;386(5):437–48. DOI: 10.1056/NEJMoa2108330
40. McMeekin S., Dizon D., Barter J., Scambia G., Manzyuk L., Lisyanskaya A., et al. Phase III randomized trial of second-line ixabepilone versus paclitaxel or doxorubicin in women with advanced endometrial cancer. Gynecol Oncol. 2015;138(1):18–23. DOI: 10.1016/j.ygyno.2015.04.026
41. Miller D.S., Scambia G., Bondarenko I., Westermann A.M., Oaknin A., Oza A.M., et al. ZoptEC: phase III randomized controlled study comparing zoptarelin with doxorubicin as second line therapy for locally advanced, recurrent, or metastatic endometrial cancer. J Clin Oncol. 2018;36(Suppl 15):5503. DOI: 10.1200/JCO.2018.36.15_suppl.5503
42. Fala L. Lenvima (Lenvatinib), a multireceptor tyrosine kinase inhibitor, approved by the FDA for the treatment of patients with differentiated thyroid cancer. Am Health Drug Benefits. 2015;8(Spec Feature):176–9. PMID: 26629286
43. Robert C., Ribas A., Schachter J., Arance A., Grob J.J., Mortier L., et al. Pembrolizumab versus ipilimumab in advanced melanoma (KEYNOTE-006): post-hoc 5-year results from an open-label, multicentre, randomised, controlled, phase 3 study. Lancet Oncol. 2019;20(9):1239–51. DOI: 10.1016/S1470-2045(19)30388-2
44. How J.A., Patel S., Fellman B., Lu K.H., Hwu P., Ramondetta L.M., et al. Toxicity and efficacy of the combination of pembrolizumab with recommended or reduced starting doses of lenvatinib for treatment of recurrent endometrial cancer. Gynecol Oncol. 2021;162(1):24–31. DOI: 10.1016/j.ygyno.2021.04.034
45. Pal S.K., Puente J., Chin Heng D.Y., Glen H., Koralewski P., Stroyakovskiy D., et al. Phase 2 trial of lenvatinib at 2 starting doses + everolimus in renal cell carcinoma (RCC). Kidney Cancer J. 2020;18(Suppl 4):34–5. DOI: 10.1200/JCO.2021.39.6_suppl.307
46. Brose M.S., Panaseykin Y., Konda B., de la Fouchardiere C., Hughes B.G.M., Gianoukakis A.G., et al. A randomized study of lenvatinib 18 mg vs 24 mg in patients with radioiodine-refractory differentiated thyroid cancer. J Clin Endocrinol Metab. 2022;107(3):776–87. DOI: 10.1210/clinem/dgab731
Об авторах
К. В. МеньшиковРоссия
Меньшиков Константин Викторович — к.м.н., доцент, кафедра онкологии с курсами онкологии и патологической анатомии ИДПО, отдел химиотерапии
Республика Башкортостан, Уфа
А. В. Султанбаев
Россия
Султанбаев Александр Валерьевич — к.м.н., отдел противоопухолевой лекарственной терапии
Республика Башкортостан, Уфа
Ш. И. Мусин
Россия
Мусин Шамиль Исмагилович — к.м.н., хирургическое отделение № 6
Республика Башкортостан, Уфа
И. А. Меньшикова
Россия
Меньшикова Ирина Асхатовна — к.м.н., доцент, кафедра биологической химии
Республика Башкортостан, Уфа
Н. И. Султанбаева
Россия
Султанбаева Надежда Ивановна — отделение противоопухолевой лекарственной терапии № 1
Республика Башкортостан, Уфа
А. А. Измайлов
Россия
Измайлов Адель Альбертович — д.м.н., доцент, кафедра урологии с курсом ИДПО
Республика Башкортостан, Уфа
А. А. Фатихова
Россия
Фатихова Альфия Азатовна — хирургическое отделение № 8
Республика Башкортостан, Уфа
Д. О. Липатов
Россия
Липатов Данила Олегович
Республика Башкортостан, Уфа
Г. А. Серебренников
Россия
Серебренников Григорий Андреевич — отделение противоопухолевой лекарственной терапии № 2
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Меньшиков К.В., Султанбаев А.В., Мусин Ш.И., Меньшикова И.А., Султанбаева Н.И., Измайлов А.А., Фатихова А.А., Липатов Д.О., Серебренников Г.А. Возможности применения комбинации ленватиниба и пембролизумаба при распространенной эндометриальной карциноме. Креативная хирургия и онкология. 2022;12(4):309-319. https://doi.org/10.24060/2076-3093-2022-12-4-309-319
For citation:
Menshikov K.V., Sultanbaev A.V., Musin Sh.I., Menshikova I.A., Sultanbaeva N.I., Izmailov A.A., Fatikhova A.A., Lipatov D.O., Serebrennikov G.A. Possible applications for combined lenvatinib and pembrolizumab in advanced endometrial carcinoma. Creative surgery and oncology. 2022;12(4):309-319. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-4-309-319


































