Перейти к:
ВИЧ-ассоциированные лимфомы
https://doi.org/10.24060/2076-3093-2022-12-4-320-327
Аннотация
Стабильный рост в мире числа людей, живущих с вирусом иммунодефицита человека (ЛЖВИЧ), и методов диагностики требует отдельного разбора специфических для указанной категории пациентов нозологий, в том числе лимфопролиферативных заболеваний, развитие части которых непосредственно ассоциировано с вирусом в связи с его онкогенным действием, и тех, что не относятся к непосредственно к ВИЧ-связанным, но вносящих нюансы в диагностические и терапевтические подходы при наличии у пациента ВИЧ-положительного статуса. С этой целью в статье рассмотрены лимфомы у ЛЖВИЧ, приведена классификация ВИЧ-ассоциированных лимфом Всемирной организации здравоохранения (ВОЗ), описаны современные представления об известных механизмах патогенеза, в том числе о роли оппортунистических инфекций, и общие принципы диагностической и терапевтической тактики, приведены рекомендации по модификации доз химиопрепаратов в зависимости от иммунного статуса и по профилактике поражения центральной нервной системы. Отдельно рассмотрены конкретные типы лимфом (лимфома Беркитта, диффузная В-крупноклеточная лимфома), в том числе наиболее часто сопровождающие пациентов, живущих с ВИЧ (первичная выпотная лимфома, плазмобластная лимфома, первичная лимфома центральной нервной системы), но редкие в неинфицированной популяции.
Ключевые слова
Для цитирования:
Дудина Г.А., Мабудзаде Ч.К., Оганнисян А.А., Немыкин В.Н. ВИЧ-ассоциированные лимфомы. Креативная хирургия и онкология. 2022;12(4):320-327. https://doi.org/10.24060/2076-3093-2022-12-4-320-327
For citation:
Dudina G.A., Mabudzada Ch.K., Ogannisyan A.A., Nemikin V.N. HIV-associated lymphomas. Creative surgery and oncology. 2022;12(4):320-327. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-4-320-327
ВВЕДЕНИЕ
Инфицирование ВИЧ является фактором повышения риска онкологических в общем и онкогематологических заболеваний в частности. Так, риск развития лимфомы у ВИЧ-положительного пациента в 30–900 раз выше по сравнению с неинфицированной популяцией [1]. Данный риск сохраняется, правда, в меньшей мере, даже не фоне антиретровирусной терапии (АРТ). При этом прекращение терапии на несколько месяцев, приводящее к падению CD4+ клеток и к повышению вирусной нагрузки, увеличивает риск развития лимфомы. Диффузная В-крупноклеточная лимфома (ДБККЛ), лимфома Беркитта (ЛБ) и первичная лимфома центральной нервной системы (ПЛЦНС) являются наиболее частыми онкогематологическими нозологическими единицами у людей с ВИЧ. Распространенность лимфомы Ходжкина (ЛХ), индолентной (ИЛ), плазмобластной лимфом (ПБЛ) и первичной выпотной лимфомы (ПВЛ) также выше у ВИЧ-положительных людей, однако встречается реже, чем упомянутые выше нозологии. При этом ПЛЦНС, ПВЛ и ПБЛ ассоциированы с более низким содержанием CD4+ клеток в момент диагноза в сравнении с другими СПИД-ассоциированными лимфомами [1][2].
С наступлением эры АРТ частота лимфом и особенно ПБЛ значительно снизилась, однако до сих пор лимфомы остаются одной из основных причин смертности у ВИЧ-инфицированных даже в развитых странах [3]. При этом пожилой возраст, развитие лимфомы на фоне АРТ, низкое количество CD4+ клеток в момент установки диагноза лимфомы, высокая вирусная нагрузка, а также более агрессивная гистологическая картина являются факторами повышенной смертности среди ВИЧ-инфицированных пациентов с лимфомой [4–6].
МЕХАНИЗМЫ ПАТОГЕНЕЗА
Патогенез лимфомы на фоне ВИЧ до сих пор считается многогранным и не до конца изученным процессом (рис. 1).

Рисунок 1. Предполагаемый патогенез лимфомы при ВИЧ-инфекции
Figure 1. Presumptive pathogenesis of lymphoma in HIV infection
Среди факторов патогенеза можно выделить:
1) иммуносупрессию, приводящую к снижению мониторинговой активности иммунитета в виде выявления и уничтожения клеток с измененным генотипом. Исследования демонстрируют обратную связь риска лимфомы с количеством CD4+лимфоцитов. Silverberg et al. приводят данные о шестикратном увеличении риска активации канцерогенеза и 4-кратном увеличении риска развития лимфомы на фоне падения количества CD4+ клеток в связи с прерыванием АРТ;
2) онкогенное действие самого ВИЧ [7]. Установлена прямая связь между риском лимфомогенеза и уровнем вирусной нагрузки у пациентов. Прямое онкогенное действие ВИЧ предполагается через следующие механизмы: матричный белок ВИЧ p17, обнаруживаемый в герминативных центрах, посредством активации Akt-сигнального пути стимулирует пролиферацию В-клеток, а также потенциально синтез EBV-ассоциированного LMP-1 в EBV+ B-лимфоцитах. Немаловажная роль отводится другому вирусному белку — Tat-протеину. Данный белок с помощью плейотропного эффекта вызывает дерегуляцию экспрессии гена цитидиндезаминазы, участвующей в процессе переключения экспрессии с генов иммуноглобулинов М на другие классы в В-лимфоцитах; опосредованное повреждение ДНК через RAG1-ген с последующей транслокацией MYC и дерегуляцию экспрессии генов онкосупрессоров;
3) коинфекцию ВИЧ с другими онкогенными вирусами [8–12]. Важное место в патогенезе отводят коинфицированности вирусом Эпштейна — Барр (EBV) (рис. 2).
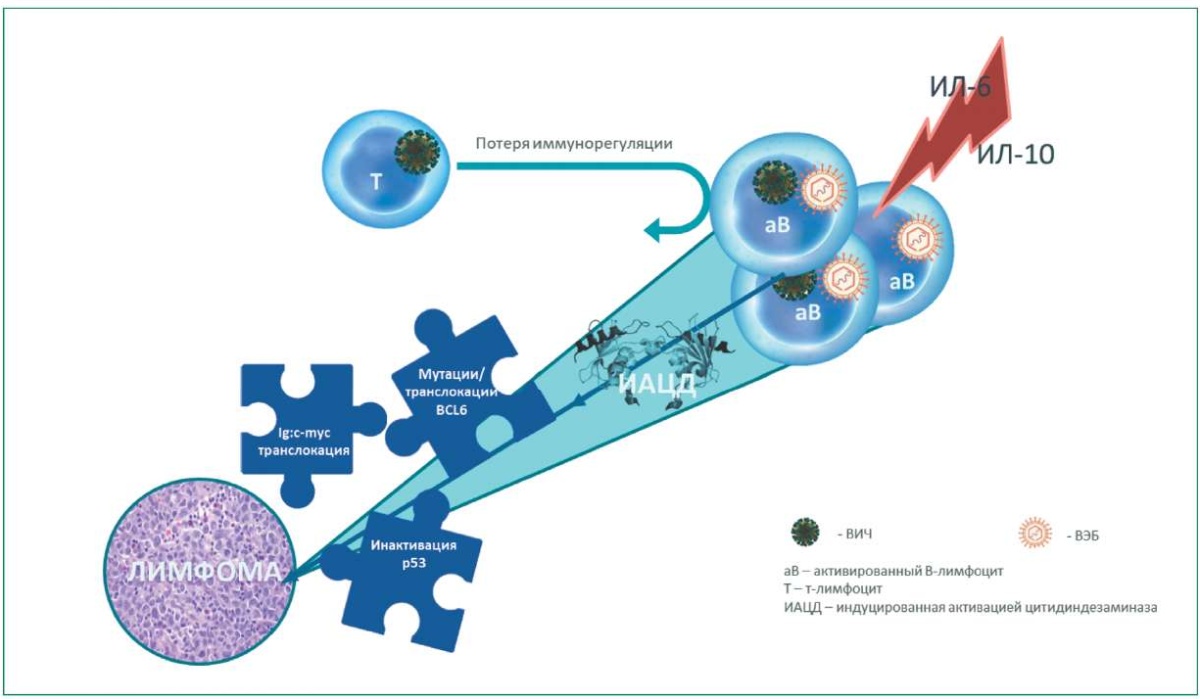
Рисунок 2. Роль ВЭБ и ВИЧ в патогенезе лимфомы
Figure 2. Role of EBV and HIV in pathogenesis of lymphoma
Учитывая доказанную онкогенность последнего, особенно в развитии лимфом, данный тандем может играть потенциальную роль в оценке общего риска развития онкологического состояния. При этом, согласно данным L.C. Huysentruyt et al.,по результатам биопсий СПИД-ассоциированных лимфом 23% (11 из 60) из исследуемого материала были HIV+/EBV−, что говорит о независимом от статуса EBV риске онкогенеза у ВИЧ-инфицированных пациентов. ПЛЦНС практически всегда ассоциирована с положительным статусом EBV, а ВИЧ-ассоциированная лимфома Беркитта положительна в 40% случаев по данному показателю. Вирус герпеса человека 8-го типа также играет роль и очень часто ассоциирован с первичной выпотной лимфомой. Учитывая иммуносупрессию, а также потенциальное пермиссивное онкогенное действие данных вирусов при инфицированности ВИЧ, можно сделать вывод о значительной важности коинфицированности в онкогенезе;
4) дерегуляция В-лимфоцитов. ВИЧ-ассоциированное нарушение регуляции В-клеток может годами предшествовать лимфоме. Критерием данной дерегуляции, в частности, выступает повышенное содержание свободных легких цепей в сыворотке крови, что ассоциировано с 8-кратным риском развития неходжкинских лимфом (НХЛ), тогда как соотношение свободных легких цепей в сыворотке, общего иммуноглобулина и иммунофиксации не является предиктором лимфомогенеза. Интерлейкины (ИЛ), включая ИЛ-10 и ИЛ-6, также увеличиваются до постановки диагноза ВИЧ-ассоциированной лимфомы;
5) генетические особенности инфицированного. Гетерозиготный статус CCR5-D32 — корецептора, необходимого для проникновения в клетку ВИЧ 1-го типа, обнаруживает меньший риск развития лимфомы, а мутация в факторе стромальных клеток 1 (SDF-1), наоборот, является риск-повышающим фактором лимфомогенеза [13–17].
ДИАГНОСТИКА
Согласно Российским клиническим рекомендациям по диагностике и лечению лимфопролиферативных заболеваний диагноз лимфомы у ВИЧ-инфицированных пациентов устанавливается согласно тем же критериям, что и у ВИЧ-отрицательных больных. Диагноз лимфопролиферативного заболевания у всех пациентов верифицируется по результатам морфологического и иммуногистохимического исследований. Для проведения данных исследований используют ткани, полученные избиопсированного лимфоузла, удаленной селезенки, экстранодальной опухолевой ткани, трепанобиоптата. Биопсия лимфатического узла у ВИЧ-инфицированных пациентов имеет не только основное диагностическое значение, но и выступает весомым фактором в дифференциальной диагностике, что может в корне изменить диагностическую картину исследуемого заболевания. Так, А.В. Пивник и соавт. показали, что при биопсиях лимфатических узлов у 80 первичных пациентов с лимфаденопатией (ЛАП) при ВИЧ/СПИДе диагностированы: туберкулез у 33 (41 %) больных, лимфомы — у 23 (29 %), лимфома Ходжкина — у 5 (6 %), реактивная лимфаденопатия (ЛАП) — у 15 (19 %), герминогенные опухоли — у 3 (4 %), саркоидоз — у 1 (1 %). ЛАП при ВИЧ необходимо дифференцировать также с поражением лимфатических узлов при метастазах солидных опухолей. В случае, когда опухоль локализована в средостении, используется cor-биопсия илиторакотомия, а при обнаружении в брюшной полости — лапароскопия или лапаротомия. При объемном образовании центральной нервной системы (ЦНС) обязательна стереотаксическая биопсия с последующими морфологическим и иммуногистохимическим исследованиями. Выполняется люмбальная пункция для цитологического, микробиологического исследования ликвора после консультации пациента неврологом и окулистом. При подозрении на лимфому Беркитта производится FISH-исследование на ген cMYC.
Стадирование лимфопролиферативного опухолевого процесса выполняют, основываясь на принятой для данного варианта лимфомы системе стадирования (Ann Arbor для ДВКЛ, ЛХ, плазмобластной лимфомы, S.B. Murphy для лимфомы Беркитта и т.д.).
При формулировке диагноза, кроме стандартного развернутого диагноза лимфомы, должен быть сформулирован диагноз ВИЧ-инфекции, включая указание на стадию и фазу ВИЧ-инфекции, вторичные и сопутствующие заболевания в соответствии с действующими рекомендациями по диагностике и лечению ВИЧ-инфекции. Рекомендуется также указать последние результаты исследований количества CD4+ лимфоцитов, вирусной нагрузки, проводится ли АРТ, и если «да»,то по какой схеме. Всем пациентам с подозрением на лимфому с установленным ВИЧ-статусом необходимо проведение люмбальной пункции и определение количества СД4+ лимфоцитов и актуальной вирусной нагрузки.
Классификация лимфопролиферативных заболеваний при ВИЧ-инфекции
Отдельная подгруппа «Лимфопролиферативные заболевания, ассоциированные с иммунодефицитом» выделена в новой классификации опухолей лимфоидной ткани (ВОЗ 2008). Классификация была несколько изменена и дополнена в 2016 году.
Классификация ВОЗ лимфоидных новообразований, ассоциированных с ВИЧ, от 2016 г.
- Диффузная В-крупноклеточная лимфома
- Центробластная
- Иммунобластная (включая первичную лимфому ЦНС)
- Лимфома Беркитта
- Экстранодальная MALT лимфома (редко)
- Периферическая Т-клеточная лимфома (редко)
Лимфомы, более специфичные для ВИЧ+ пациентов
- Первичная выпотная лимфома
- Плазмобластная лимфома ротовой полости
Лимфомы, встречающиеся при других иммунодефицитных состояниях
ОБЩИЕ ПРИНЦИПЫ ТЕРАПИИ
История лечения СПИД-ассоциированных лимфом четко разграничена 1996 годом. С 1981 по 1996 г. общая выживаемость больных ВИЧ-ассоциированными лимфомами, которым проводились общепринятые курсы химиотерапии какв стандартных, так и редуцированных дозах, была невысокой, хотя кратковременные ремиссии изредка достигались. Этот период обозначен как пре-АРТ эра. В 1996 г. в практическую медицину внедрена антиретровирусная терапия (АРТ), что произвело настоящую революцию в лечении ВИЧ-инфекции: резко снизилась заболеваемость агрессивными лимфомами, включая ПЛЦНС, ПБЛ, а также саркомой Капоши. Кроме того, увеличился срок до развития вторичных заболеваний. Показатели ВИЧ-инфекции — уровень CD4+ и вирусной нагрузки (ВН) — улучшались, что изменяло как общее состояние больного, так и статус иммунитета. Это позволило использовать полные дозы химиопрепаратов, увеличились количество ремиссий и общая 5-летняя выживаемость ВИЧ-пациентов [18].
Согласно современным рекомендациям, одновременное проведение АРТ и курсов химиотерапии признано безопасным. Более того, такая тактика демонстрирует более высокие показатели полной ремиссии [19]. Однако во избежание возможных лекарственных взаимодействий рекомендуется дополнительная консультация клинического фармаколога. Учитывая широкий набор современных антиретровирусных препаратов, желательно избегать одновременного использования в схемах АРТ, параллельно с ПХТ, таких препаратов, как зидовудин, кобисистат и ритонавир.
ОТДЕЛЬНЫЕ НОЗОЛОГИИ
Диффузная В-крупноклеточная лимфома
Диффузная В-крупноклеточная лимфома (ДБККЛ) является агрессивной формой лимфомы, которая в том числе относится к категории СПИД-ассоциированных. Около половины (45%) всех лимфом у ВИЧ-положительных пациентов приходится именно на данный вид.
Прогноз, эффективность лечения напрямую зависят от уровня СD4-клеток и вирусной нагрузки. Независимо от степени распространенности химиотерапию необходимо начинать с предфазы на фоне полноценной симптоматической терапии: профилактики синдрома лизиса опухоли и обострения оппортунистических инфекций. Далее, при отсутствии высокой коморбидности, лечение по стандартам ДБКЛ.
Первичная выпотная лимфома
Первичная выпотная лимфома (ПВЛ) — редкий тип В-клеточной лимфомы, чаще всего встречающийся у иммунокомпрометированных пациентов, таких как ВИЧ-инфицированные и пациенты на иммуносупрессивной терапии в посттранплантационный период. Основная характеристика ПВЛ — опухолевые выпоты в полостях тела без обнаруживаемых опухолевых масс.
Для данных нозологических лимфом Национальная всеобщая онкологическая сеть (NCCN, США) рекомендует общий терапевтический подход (R-EPOCH, R-CHOP) с профилактикой поражения ЦНС метотрексатом и цитарабином с активным наблюдением на момент развития инфекционных осложнений [20][22–26].
Лимфома Беркитта
Лимфома Беркитта (ЛБ) является высокопролиферативной НХЛ, происходящей из B-клеток герминативного центра с характерными онкогенными путями. Транслокация в гене MYC, а также генетические события в пути фосфатидилинозитид-3-киназы и циклин-зависимых киназ приводят к высокой экспрессии MYC, повышенной пролиферации и росту клеток. ЛБ отличается скоростью пролиферации, индексом Ki67 95 % или выше.
По сравнению с общей популяцией, в которой ЛБ составляет 1–2 % НХЛ у взрослых пациентов, ЛБ у ВИЧ-положительных больных составляет 10–35 % по различным литературным данным. Данная лимфома ассоциирована с более высоким уровнем СД4 лимфоцитов в момент диагноза по сравнению с ДБККЛ. Применяемые курсы химиотерапии: R+CODOX-M/R+IVAC, DA-EPOCH-R, R-Hyper-CVAD/R-MA [27–32].
Первичная лимфома ЦНС
Первичная лимфома ЦНС (ПЛЦНС) — редкая форма экстранодальной неходжкинской лимфомы, обычно ограничивающаяся поражением головного мозга, глаз и спинномозговой жидкости без признаков системного распространения. Около 15 % неходжкинских лимфом у пациентов с ВИЧ составляет данный тип лимфомы. Прогноз в данном случае неблагоприятный — медиана выживания 2–4 месяца, однако данный показатель выше у пациентов на фоне проведения химиотерапии метотрексатом и тимодалом (18 месяцев) при адекватном эндолюмбальном введении цитостатиков.
Наличие ВИЧ является фактором обязательной профилактики поражения ЦНС при наличии экстранодальных очагов поражения, а также необходимо учитывать прогноз риска поражения ЦНС при ВИЧ-ассоциированных лимфопролиферативных заболеваниях (табл. 1).
Таблица 1. Прогностическая модель оценки риска поражения ЦНС у больных с ДБККЛ [21]
Table 1. Prognostic model for assessing risk of CNS involvement in patients with DLBCL [21]
Факторы: | ||
• Возраст > 60 лет • Уровень сывороточной ЛДГ — выше референсных значений • Статус больного по шкале ECOG > 1 • Стадия заболевания III и IV • Экстранодальное поражение > 1 локации • Поражение почек или надпочечников | ||
Наличие каждого фактора оценивается в 1 балл | ||
Низкий риск | Средний риск | Высокий риск |
0–1 | 2–3 | 4–6 или наличие поражения почек или надпочечников |
Дополнительные показания к профилактике поражения ЦНС независимо от приведенной прогностической модели
- Наличие ВИЧ
- Тестикулярная лимфома
- High-grade лимфома с транслокация в гене MYC и BCL2 и/или BCL6
- Первичная кожная ДБКЛ, leg type
- Стадия IE ДББКЛ груди
Основные принципы:
- для ВИЧ-положительных пациентов с ПЦНС, не получающих АРТ, рекомендуется ее инициация до начала терапии по поводу лимфомы;
- даже при плохом соматическом статусе пациента и плохо контролируемом течении ВИЧ-инфекции рекомендуется рассмотрение возможности начала лечения стандартными курсами программной химиотерапии высокоагрессивных лимфом;
- для пациентов с плохим соматическим статусом и не являющихся в связи с этим кандидатами для начала химиотерапии рекомендуется только лучевая терапия в качестве инициальной терапии [33–37].
Лучевая терапия
В качестве лучевой терапии при ПЛЦНС рекомендуется облучение всего мозга в дозе ≥30 Гр. Данный подход предпочтительнее фокальной лучевой терапии в силу мультифокальности поражения и ее инфильтративного характера. Тем не менее лучевая терапия имеет крайне скромный куративный эффект. В литературе приводятся данные об увеличении медианы выживаемости от 19–33 дней для не подвергавшихся лучевой терапии до 132–170 дней для пациентов, перенесших радиотерапию. В то же время в ретроспективном анализе Nagai et al. у 64 % (общая группа в 21 человек) пациентов была продемонстрирована нетипичная для ПЛЦНС трехлетняя общая выживаемость на фоне проводимой АРТ [38][39].
Плазмобластная лимфома
Плазмобластная лимфома (ПБЛ) первоначально была описана в 1997 году как отдельная нозология, но в настоящее время считается агрессивным подтипом ДБККЛ, не экспрессирующим CD20, но с плазмоцитарными признаками, такими какэкспрессия CD38, CD138, MUM1/ IRF4, PCM. Вовлечение ротовой полости, связь с ВЭБ, перестройки MYC и уровень Ki67 > 80 % являются общими признаками ВИЧ-ассоциированной ПБЛ, которая составляет примерно 3–12% всех связанных с ВИЧ лимфом. Из-за очень агрессивного клинического течения ассоциирована с неблагоприятным прогнозом.
Химиотерапия CHOP или CHOP-подобными схемами показала неутешительные результаты общей выживаемости. Исследования с более интенсивными схемами терапии, например протоколом B-ALL/NHL, CODOX-M/IVAC или консолидацией с высокодозной химиотерапией и трансплантацией аутологичных стволовых клеток, также не оправдали надежд. Медиана ОВ составляет 11 месяцев независимо от интенсивности применяемой химиотерапии. В настоящее время применение препаратов для множественной миеломы, таких как бортезомиб (бортезомиб отдельно или в сочетании с химиотерапией) или леналидомид, показали свою высокую эффективность. Схемы химиотерапии: EPOCH (предпочтительный, с модификацией доз в зависимости от количества CD4+ клеток), Hyper-CVAD/MA на фоне сопроводительной терапии, включающей в себя в том числе профилактику поражения ЦНС [40–42].
ЗАКЛЮЧЕНИЕ
Знание и выделение ВИЧ-инфицированных пациентов в отдельную группу риска позволяет своевременно диагностировать лимфопролиферативные заболевания у данной когорты. Расширение знаний патогенеза и насторожéнности в плане риска развития онкогематологических заболеваний данных пациентов, а также активная профилактическая работа, заключающаяся в объяснении важности приема антиретровирусной терапии не только в рамках контроля самой ВИЧ-инфекции, но и снижения риска развития лимфом, должна быть важным компонентом стратегии ведения пациентов с ВИЧ. Диагностика и стадирование ВИЧ-ассоциированной лимфомы аналогичны той, что проводится у пациентов без ВИЧ-инфекции. При этом, учитывая типичную для ВИЧ-инфекции лимфаденопатию, биопсия является важным дифференциально-диагностическим инструментом, позволяющим своевременно установить диагноз и в первую очередь исключить туберкулез и другие оппортунистические инфекции. Следует иметь в виду также клинические особенности лимфом на фоне инфекции ВИЧ. Так, треть всех новообразований, диагностируемых у ВИЧ-положительных пациентов, приходится на гастроинтестинальный тракт, при этом данная система является наиболее частой экстранодальной областью поражения лимфомой и составляет 30–50 % всех неходжкинских лимфом. Чаще всего это диффузная В-крупноклеточная лимфома и лимфома Беркитта.
Наличие ВИЧ-инфекции накладывает определенные ограничения на терапевтическую тактику. Например, требуется модификация дозы циклофосфамида — одного из наиболее часто применимых в схемах химиотерапии лимфом препарата, в зависимости от количества CD4+ лимфоцитов пациента (табл. 2).
Таблица 2. Модификация дозы циклофосфамида в зависимости от CD4+ клеток
Table 2. Modification of cyclophosphamide dose depending on CD4+ cells
Количество CD4+клеток | Дозировка циклофосфамида |
200 кл/мм3 | 750 мг/м2 |
50–200 кл/мм3 | 375 мг/м2 |
<50 кл/мм3 | 187,5 мг/м2 |
Успехи АРТ в последние несколько лет дополнительно подчеркивают важность антиретровирусной терапии, позволяющей проводить химиотерапию в оптимальных дозировках и минимизировать инфекционные осложнения на фоне противоопухолевого лечения у ВИЧ-инфицированных пациентов, изначально рассматриваемых с учетом степени выраженности иммунокомпрометации.
Своевременная диагностика, высокая приверженность пациента антиретровирусной терапии и использование современных терапевтических химиотерапевтических опций позволяют достигать высокой частоты ремиссии лимфомы у ВИЧ-инфицированных пациентов. Важен учет специфических для ВИЧ сопутствующих клинических обстоятельств с определением наиболее оптимальной тактики лечения и получением высоких терапевтических результатов.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Sponsorship data. This work is not funded.
Список литературы
1. Lamers S.L., Fogel G.B., Huysentruyt L.C., McGrath M.S. HIV-1 nef protein visits B-cells via macrophage nanotubes: a mechanism for AIDS-related lymphoma pathogenesis? Curr HIV Res. 2010;8(8):638–40. DOI: 10.2174/157016210794088209
2. Noy A. HIV Lymphoma and Burkitts Lymphoma. Cancer J. 2020;26(3):260–8. DOI: 10.1097/PPO.0000000000000448
3. Siangphoe U., Archer K.J., Nguyen C., Lee K.R. Associations of antiretroviral therapy and comorbidities with neurocognitive outcomes in HIV-1-infected patients. AIDS. 2020;34(6):893–902. DOI: 10.1097/QAD.0000000000002491
4. Wang Z., Zhang R., Liu L., Shen Y., Chen J., Qi T., et al. Incidence and spectrum of infections among HIV/AIDS patients with lymphoma during chemotherapy. J Infect Chemother. 2021;27(10):1459–64. DOI: 10.1016/j.jiac.2021.06.012
5. Khan A., Brahim A., Ruiz M., Nagovski N. Relapsed/refractory Burkitt lymphoma and HIV infection. Int J STD AIDS. 2018;29(7):695–703. DOI: 10.1177/0956462417748239
6. Collaboration of Observational HIV Epidemiological Research Europe (COHERE) Study Group, Bohlius J., Schmidlin K., Costagliola D., Fätkenheuer G., et al. Incidence and risk factors of HIV-related nonHodgkin’s lymphoma in the era of combination antiretroviral therapy: a European multicohort study. Antivir Ther. 2009;14(8):1065–74. DOI: 10.3851/IMP1462
7. Borges Á.H., Neuhaus J., Sharma S., Neaton J.D., Henry K., Anagnostou O., et al. The effect of interrupted/deferred antiretroviral therapy on disease risk: a SMART and START combined analysis. J Infect Dis. 2019;219(2):254–63. DOI: 10.1093/infdis/jiy442
8. Shepherd L., Borges Á.H., Harvey R., Bower M., Grulich A., Silverberg M., et al. The extent of B-cell activation and dysfunction preceding lymphoma development in HIV-positive people. HIV Med. 2018;19(2):90–101. DOI: 10.1111/hiv.12546
9. Breen E.C., Hussain S.K., Magpantay L., Jacobson L.P., Detels R., Rabkin C.S., et al. B-cell stimulatory cytokines and markers of immune activation are elevated several years prior to the diagnosis of systemic AIDS-associated non-Hodgkin B-cell lymphoma. Cancer Epidemiol Biomarkers Prev. 2011;20(7):1303–14. DOI: 10.1158/1055-9965.EPI-11-0037
10. Peckham-Gregory E.C., Thapa D.R., Martinson J., Duggal P., Penugonda S., Bream J.H., et al. MicroRNA-related polymorphisms and non-Hodgkin lymphoma susceptibility in the Multicenter AIDS Cohort Study. Cancer Epidemiol. 2016;45:47–57. DOI: 10.1016/j.canep.2016.09.007
11. Martorelli D., Muraro E., Mastorci K., Dal Col J., Faè D.A., Furlan C., et al. A natural HIV p17 protein variant up-regulates the LMP-1 EBV oncoprotein and promotes the growth of EBV-infected B-lymphocytes: implications for EBV-driven lymphomagenesis in the HIV setting. Int J Cancer. 2015;137(6):1374–85. DOI: 10.1002/ijc.29494
12. Sall F.B., El Amine R., Markozashvili D., Tsfasman T., Oksenhendler E., Lipinski M., et al. HIV-1 Tat protein induces aberrant activation of AICDA in human B-lymphocytes from peripheral blood. J Cell Physiol. 2019 Jan 31. DOI: 10.1002/jcp.28219
13. Germini D., Tsfasman T., Klibi M., El-Amine R., Pichugin A., Iarovaia O.V., et al. HIV Tat induces a prolonged MYC relocalization next to IGH in circulating B-cells. Leukemia. 2017;31(11):2515–22. DOI: 10.1038/leu.2017.106
14. El-Amine R., Germini D., Zakharova V.V., Tsfasman T., Sheval E.V., Louzada R.A.N., et al. HIV-1 Tat protein induces DNA damage in human peripheral blood B-lymphocytes via mitochondrial ROS production. Redox Biol. 2018;15:97–108. DOI: 10.1016/j.redox.2017.11.024
15. Isaguliants M., Bayurova E., Avdoshina D., Kondrashova A., Chiodi F., Palefsky J.M. Oncogenic Effects of HIV-1 Proteins, Mechanisms Behind. Cancers (Basel). 2021;13(2):305. DOI: 10.3390/cancers13020305
16. Samson M., Libert F., Doranz B.J., Rucker J., Liesnard C., Farber C.M., et al. Resistance to HIV-1 infection in caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene. Nature. 1996;382(6593):722–5. DOI: 10.1038/382722a0
17. Thorball C.W., Oudot-Mellakh T., Ehsan N., Hammer C., Santoni F.A., Niay J., et al. Genetic variation near CXCL12 is associated with susceptibility to HIV-related non-Hodgkin lymphoma. Haematologica. 2021;106(8):2233–41. DOI: 10.3324/haematol.2020.247023
18. Besson C., Goubar A., Gabarre J., Rozenbaum W., Pialoux G., Châtelet F.P., et al. Changes in AIDS-related lymphoma since the era of highly active antiretroviral therapy. Blood. 2001;98(8):2339–44. DOI: 10.1182/blood.v98.8.2339
19. Barta S.K., Xue X., Wang D., Tamari R., Lee J.Y., Mounier N., et al. Treatment factors affecting outcomes in HIV-associated nonHodgkin lymphomas: a pooled analysis of 1546 patients. Blood. 2013;122(19):3251–62. DOI: 10.1182/blood-2013-04-498964
20. Schmitz N., Zeynalova S., Nickelsen M., Kansara R., Villa D., Sehn L.H., et al. CNS International Prognostic Index: A risk model for CNS relapse in patients with diffuse large B-Cell lymphoma treated with R-CHOP. J Clin Oncol. 2016;34(26):3150–6. DOI: 10.1200/ JCO.2015.65.6520
21. B-cell Lymphomas. — National Comprehensive Cancer Network; [cited 2021 Oct 23]. Available from: www.nccn.org/guidelines/guidelines-detail?category=1&id=1480
22. Sparano J.A., Lee J.Y., Kaplan L.D., Ramos J.C., Ambinder R.F., Wachsman W., et al. Response-adapted therapy with infusional EPOCH chemotherapy plus rituximab in HIV-associated, B-cell non-Hodgkin’s lymphoma. Haematologica. 2021;106(3):730–5. DOI: 10.3324/haematol.2019.243386
23. Lyman G.H.. Evaluation and regulation of oncology drug approval: finding the right balance. JAMA Oncol. 2016;2(6):728–9. DOI: 10.1001/jamaoncol.2015.6477
24. Barta S.K., Lee J.Y., Kaplan L.D., Noy A., Sparano J.A. Pooled analysis of AIDS malignancy consortium trials evaluating rituximab plus CHOP or infusional EPOCH chemotherapy in HIV-associated nonHodgkin lymphoma. Cancer. 2012;118(16):3977–83. DOI: 10.1002/cncr.26723
25. Boué F., Gabarre J., Gisselbrecht C., Reynes J., Cheret A., Bonnet F., et al. Phase II trial of CHOP plus rituximab in patients with HIV-associated non-Hodgkin’s lymphoma. J Clin Oncol. 2006;24(25):4123–8. DOI: 10.1200/JCO.2005.05.4684
26. Habbous S., Guo H., Beca J., Dai W.F., Isaranuwatchai W., Cheung M., et al. The effectiveness of rituximab and HIV on the survival of Ontario patients with diffuse large B-cell lymphoma. Cancer Med. 2020;9(19):7072–82. DOI: 10.1002/cam4.3362
27. Noy A., Lee J.Y., Cesarman E., Ambinder R., Baiocchi R., Reid E., et al. AMC 048: modified CODOX-M/IVAC-rituximab is safe and effective for HIV-associated Burkitt lymphoma. Blood. 2015;126(2):160–6. DOI: 10.1182/blood-2015-01-623900
28. Kassam S., Bower M., Lee S.M., de Vos J., Fields P., Gandhi S., et al. A retrospective, multi-center analysis of treatment intensification for human immunodeficiency virus-positive patients with high-risk diffuse large B-cell lymphoma. Leuk Lymphoma. 2013;54(9):1921–7. DOI: 10.3109/10428194.2012.754024
29. Barnes J.A., Lacasce A.S., Feng Y., Toomey C.E., Neuberg D., Michaelson J.S., et al. Evaluation of the addition of rituximab to CODOX-M/ IVAC for Burkitt’s lymphoma: a retrospective analysis. Ann Oncol. 2011;22(8):1859–64. DOI: 10.1093/annonc/mdq677
30. Zhu K.Y., Song K.W., Connors J.M., Leitch H., Barnett M.J., Ramadan K., et al. Excellent real-world outcomes of adults with Burkitt lymphoma treated with CODOX-M/IVAC plus or minus rituximab. Br J Haematol. 2018;181(6):782–90. DOI: 10.1111/bjh.15262
31. Chen M., Wang Z., Fang X., Yao Y., Ren Q., Chen Z., et al. Modified R-CODOX-M/IVAC chemotherapy regimens in Chinese patients with untreated sporadic Burkitt lymphoma. Cancer Biol Med. 2021;18(3):833–40. DOI: 10.20892/j.issn.2095-3941.2020.0314
32. Thomas D.A., Faderl S., O’Brien S., Bueso-Ramos C., Cortes J., Garcia-Manero G., et al. Chemoimmunotherapy with hyper-CVAD plus rituximab for the treatment of adult Burkitt and Burkitt-type lymphoma or acute lymphoblastic leukemia. Cancer. 2006;106(7):1569–80. DOI: 10.1002/cncr.21776
33. Holte H., Leppä S., Björkholm M., Fluge O., Jyrkkiö S., Delabie J., et al. Dose-densified chemoimmunotherapy followed by systemic central nervous system prophylaxis for younger high-risk diffuse large B-cell/ follicular grade 3 lymphoma patients: results of a phase II Nordic Lymphoma Group study. Ann Oncol. 2013;24(5):1385–92. DOI: 10.1093/annonc/mds621
34. Gupta N.K., Nolan A., Omuro A., Reid E.G., Wang C.C., Mannis G., et al. Long-term survival in AIDS-related primary central nervous system lymphoma. Neuro Oncol. 2017;19(1):99–108. DOI: 10.1093/neuonc/now155
35. Gijs P.J., Clerc O. Long-term remission of AIDS-related primary central nervous system lymphoma in a patient under antiretroviral therapy: a case report and review of the literature. AIDS Res Ther. 2021;18(1):76. DOI: 10.1186/s12981-021-00403-6
36. Jin M., Yang Z., Li J., Liu X., Wu Z. Factors Influencing Survival Status of HIV/AIDS after HAART in Huzhou City, Eastern China. Can J Infect Dis Med Microbiol. 2022;2022:2787731. DOI: 10.1155/2022/2787731
37. Epeldegui M., Martínez-Maza O. Immune ACTIVATION: CONTRIBUTION to AIDS-associated Non-Hodgkin lymphoma. For Immunopathol Dis Therap. 2015;6(1–2):79–90. DOI: 10.1615/ForumImmunDisTher.2016014177
38. Nagai H., Odawara T., Ajisawa A., Tanuma J., Hagiwara S., Watanabe T., et al. Whole brain radiation alone produces favourable outcomes for AIDS-related primary central nervous system lymphoma in the HAART era. Eur J Haematol. 2010;84(6):499–505. DOI: 10.1111/j.1600-0609.2010.01424.x
39. Brandsma D., Bromberg J.E.C. Primary CNS lymphoma in HIV infection. Handb Clin Neurol. 2018;152:177–86. DOI: 10.1016/B978-0-444-63849-6.00014-1
40. Wong, A.B., Tseng A.D. HIV oncology handbook. Antiretroviral interactions with chemotherapy regimens. Toronto; 2014.
41. Major A., Smith S.M. DA-R-EPOCH vs R-CHOP in DLBCL: How do we choose? Clin Adv Hematol Oncol. 2021;19(11):698–709. PMID: 34807015
42. Mead G.M., Barrans S.L., Qian W., Walewski J., Radford J.A., Wolf M., et al. A prospective clinicopathologic study of dose-modified CODOXM/IVAC in patients with sporadic Burkitt lymphoma defined using cytogenetic and immunophenotypic criteria (MRC/NCRI LY10 trial). Blood. 2008;112(6):2248–60. DOI: 10.1182/blood-2008-03-145128
Об авторах
Г. А. ДудинаРоссия
Дудина Галина Анатольевна — д.м.н., профессор, кафедра онкологии, гематологии и лучевой
терапии педиатрического факультета, отделение гематологии и химиотерапии гемобластозов, научный
отдел онкогематологии и вторичных иммунодефицитных заболеваний
Москва
Ч. К. Мабудзаде
Россия
Мабудзаде Чингиз Камран оглы — младший научный сотрудник, научный отдел онкогематологии и вторичных иммунодефицитных заболеваний
Москва
А. А. Оганнисян
Россия
Оганнисян Арман Андраникович — отделение гематологии и химиотерапии гемобластозов
Москва
В. Н. Немыкин
Россия
Немыкин Вадим Николаевич — отделение гематологии и химиотерапии гемобластозов
Москва
Рецензия
Для цитирования:
Дудина Г.А., Мабудзаде Ч.К., Оганнисян А.А., Немыкин В.Н. ВИЧ-ассоциированные лимфомы. Креативная хирургия и онкология. 2022;12(4):320-327. https://doi.org/10.24060/2076-3093-2022-12-4-320-327
For citation:
Dudina G.A., Mabudzada Ch.K., Ogannisyan A.A., Nemikin V.N. HIV-associated lymphomas. Creative surgery and oncology. 2022;12(4):320-327. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-4-320-327


































