Перейти к:
Островки поджелудочной железы человека как одна из мишеней SARS-CoV-2
https://doi.org/10.24060/2076-3093-2022-12-4-350-355
Аннотация
Цель исследования — описание островков поджелудочной железы человека как одной из мишеней SARS-CoV-2.
Материалы и методы. Объектом исследования явилась поджелудочная железа. Была проведена гистологическая окраска.
Результаты и обсуждение. При секционном исследовании выявлялись признаки, характерные для двусторонней вирусной интерстициальной пневмонии. При гистологическом исследовании в легких выявлены альвеолы с дисателектазом, отмечался внутриальвеолярный отек, гиалиновые мембраны в части альвеол. В поджелудочной железе при гистологическом исследовании выявлялись кровоизлияния, некротические участки островков железы. Выявлялись признаки ДВС-синдрома: в полостях сердца и крупных сосудах определялись мелкие гиалиновые тромбы, петехиальные кровоизлияния во внутренние органы, в надпочечники, очаги некроза коркового слоя с перифокальной инфильтрацией (синдром Уотерхауса — Фридериксена); признаки некронефроза, с фибриноидными участками некроза в капиллярной сети клубочков и периваскулярными лимфоидными инфильтратами.
Заключение. Выявлено, что островки поджелудочной железы человека являются мишенью SARS-CoV-2 с развитием некротических участков в них.
Ключевые слова
Для цитирования:
Воробьева О.В. Островки поджелудочной железы человека как одна из мишеней SARS-CoV-2. Креативная хирургия и онкология. 2022;12(4):350-355. https://doi.org/10.24060/2076-3093-2022-12-4-350-355
For citation:
Vorobеva O.V. Pancreatic islets as a SARS-CoV-2 target. Creative surgery and oncology. 2022;12(4):350-355. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-4-350-355
ВВЕДЕНИЕ
В настоящее время COVID-19 считается системным заболеванием, способным поражать все органы с возможным развитием системного процесса [1–5]. В нескольких источниках сообщается о метаболических и нарушениях в эндокринной системе, которые могут рассматриваться как факторы риска при заражении SARS-CoV-2. В одном из исследований, куда входили 52 пациента с COVID-19, повреждение поджелудочной железы было выявлено у 17 % больных (данные оценивали по уровню отклонений липазы/амилазы) [6]. Описано, что некоторые эндокринные органы могут быть мишенью для COVID-19 — поджелудочная, щитовидная железа, яички, яичники, надпочечники и гипофиз, — так как эпителий экспрессирует АСЕ2. Патогенез до конца не известен, но патология поджелудочной железы после инфицирования SARS-CoV-2 может обостриться вследствие прямого цитопатического влияния локальной репликации вируса либо опосредованно через повреждающее воздействие иммунного ответа, индуцированного вирусом. Кроме прямого повреждения β-клеток могут быть вовлечены изменения в аутоантигенах и последующее иммуноопосредованное разрушение β-клеток [7][8]. В связи с актуальностью проблемы цель исследования — описание островков поджелудочной железы человека как одной из мишеней SARS-CoV-2.
МАТЕРИАЛ И МЕТОДЫ
Объектом исследования явилась поджелудочная железа у пациента, инфицированного SARS-CoV-2. Проведена гистологическая окраска. Образцы поджелудочной железы фиксировали в 10 % кислом формалине сутки, затем переносили в первую порцию абсолютного ацетона на 1,5–2 часа, затем во вторую порцию абсолютного ацетона на такой же срок, после этого на 30–40 минут в парафин-ацетон (1:1) при 38–40 °С, затем в первый парафин при температуре 55–60 °С на 1,5 часа, во второй парафин на 1 час при той же температуре. После этого производили заливку в парафиновые блоки и их резку на микротоме по стандартной методике. Проводилась окраска гематоксилином и эозином.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Больной Л.К., 64 лет, бригадой скорой медицинской помощи 05.09.2022 г. доставлен в приемный покой хирургического отделения БУ «Новочебоксарская городская больница» с жалобами на острую опоясывающую боль с иррадиацией в левую половину живота, рвоту, субфебрильную температуру. Из анамнеза известно, что в течение недели температура тела была 37,5–38,3 °С, отмечал боли в левой половине живота, отсутствие аппетита, принимал двухкратно мезим. За медицинской помощью не обращался, при высокой температуре принимал жаропонижающие средства.
Анамнез заболевания: В течение 15 лет наблюдался по поводу хронического панкреатита. Из данных амбулаторной карты от 16.05.2015 г. по данным УЗИ: контуры железы неровные, границы прерывистые, размеры головки (норма до 35 мм) составляют 28,1 мм, тело (норма до 25 мм) — 14,8 мм, хвост (норма до 20 мм) — 16,9 мм. Структура железы неоднородная, эхогенность диффузно повышена. Вирсунгов проток не расширен. Заключение: Признаки хронического панкреатита. Пациенту было назначено лечение: полиферментные препараты (мезим форте, креон, микразим по 1 табл. 3 раза в день во время приема пищи — курсами). При болях прием дротаверина по 1 табл. 3 раза в день. При вздутии — эспумизан по1 капсуле 3 раза в день. Периодически проходил лечение.
05.09.2022 г с утра почувствовал резкую боль в эпигастральной области преимущественно в левой половине, была однократная рвота, не принесшая облегчения. Болевой синдром купировал приемом димедрола (принял 5 таблеток) и кеторола. В течение дня была ноющая боль. К вечеру боль была нестерпимая, была вновь рвота, температура тела 37,9 °С. В связи с этим была вызвана бригада скорой медицинской помощи. С аналогичными жалобами обращался в 2019 г., после этого был госпитализирован и прошел стационарное лечение с положительной динамикой. Из выписки амбулаторной карты выявлены изменения в анализах крови: альфа-амилаза составляла 203 ед/л, липаза — 198 ед/л, С-реактивный белок — 46 мг/л, глюкоза — 5,3 ммоль/л. После выписки из стационара периодически принимал полиферментные средства.
Результаты физикального, лабораторного и инструментального исследования
При поступлении температура тела составляла 37,9 °С. Органы дыхания: при пальпации грудной клетки болезненность не определялась. При аускультации дыхание жесткое, в нижних отделах ослаблено, выслушивались мелкопузырчатые хрипы, число дыхательных движений — 34 в минуту, SaО2 — 56 %. Сердечно-сосудистая система: тоны сердца приглушены, глухие, ЧСС — 58 в минуту. АД — 80/60 мм рт. ст. При глубокой пальпации отмечалась болезненность в эпигастральной области и левом подреберье.
По данным КТ ОГК выявлены КТ-признаки двусторонней вирусной интерстициальной пневмонии, признаки отека легких. Тяжесть КТ — 70 % поражения легких. Диагноз COVID-19 был поставлен на основании положительного теста ПЦР в мазках из носоглотки. По данным УЗИ органов брюшной полости выявлялась неоднородность структуры поджелудочной железы, неровность контуров органа, анэхогенные некротические очаги в области тела и хвоста.
Заключение электрокардиографии: Синусовая тахикардия с ЧСС — 58 уд/мин. Вертикальное положение ЭОС. Укороченный интервал PQ. Нарушение процессов реполяризации в миокарде.
Общий анализ крови от 05.09.2022: лейкоциты 16,52×109/л; эритроциты 5,23×1012/л; гемоглобин 182 г/л; цветной показатель 0.87; гематокрит 53,4 %; тромбоциты 236×109/л; сегментоядерные нейтрофилы 83,8 %; лимфоциты 19,4 %; моноциты 2,8 %; СОЭ 94 мм/ч. Анализ крови на RW (экспресс). Результат: отрицательно.
В биохимическом анализе крови от 05.09.2022 г.: мочевина 10,1 ммоль/л, креатинин 273,1 мкмоль/л, билирубин прямой 39,6 мкмоль/л, АСТ 107,0 ед/л, альфа-амилаза 906 ед/л, липаза 657 ед/л, С-реактивный белок 86 мг/л. В коагулограмме: АЧТВ: 39 сек, протромбиновый индекс 127,4 %, МНО 2,78, D-димер 786 нг/мл.
CKD-EPI: 26 мл/мин/1,73 м2. Кокрофт — Голт: 38 мл/мин (35 мл/мин/1,73 м2). Индекс массы тела: 25,7 кг/м2. Выраженное снижение СКФ.
Было начато лечение, однако через 1 час после поступления в стационар у пациента внезапно начался кашель с выделением розоватой мокроты, клокочущее дыхание и наступил летальный исход. Реанимационные мероприятия были неэффективны, наступила биологическая смерть. Выставлен посмертный клинический диагноз. Основное заболевание: Коронавирусная инфекция, вирус идентифицирован, тяжелая форма. Конкурирующее заболевание: Острый панкреонекроз. Осложнения основного заболевания: Двусторонняя вирусная интерстициальная пневмония (по КТ ОГП процент поражения легочной паренхимы — 70 %). ОРДС. Отек легких. Выраженное снижение СКФ (CKD-EPI: 26 мл/мин/1,73 м2).
Был направлен на патолого-анатомическое исследование в межрайонное патолого-анатомическое отделение.
При секционном исследовании выявлялись признаки, характерные для двусторонней вирусной интерстициальной пневмонии. При макроскопическом исследовании — легкие были уплотненные, тяжелые, на разрезах розово-красные, при надавливании с поверхности разрезов в большом количестве стекала темно-красная, пенистая жидкость. При гистологическом исследовании: альвеолы были неравномерно расширены, местами с разрывом межальвеолярных перегородок, отмечался внутриальвеолярный отек, десквамативные альвеолоциты, гиалиновые мембраны в части альвеол, в просветах альвеол определялись скопления макрофагов и моноцитов, участки кровоизлияний (рис. 1). Выявлялись фибриновые (гиалиновые) тромбы в просветах капилляров и очаговые внутриальвеолярные кровоизлияния.
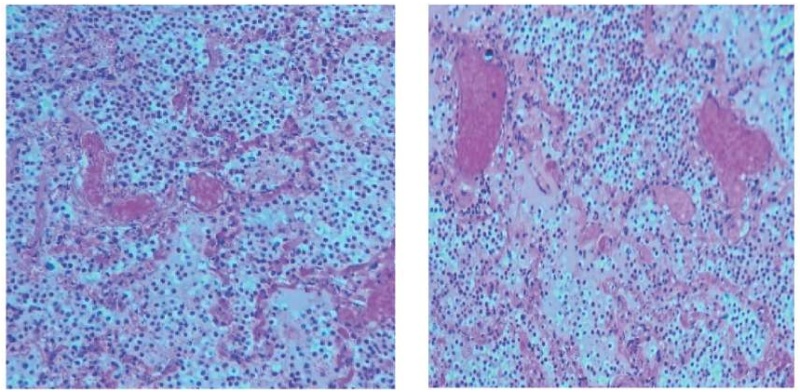
Рисунок 1. Микроскопическая картина внутриальвеолярного отека, десквамации альвеолоцитов, лейкоцитарной инфильтрации, полнокровия сосудов. Окраска гематоксилином и эозином, ×900
Figure 1. Microscopic appearance of intra-alveolar edema, desquamation of pneumocytes, leukocytic infiltration, vascular congestion. Staining with hematoxylin and eosin, ×900
При макроскопическом исследовании поджелудочная железа была увеличена, тело и хвост имели багрово-черный оттенок, с участками распада ткани. Сохраненный участок головки поджелудочной железы определялся плотным, отечным. При гистологическом исследовании наблюдалось нарушение структуры поджелудочной железы: отсутствие долек, соединительнотканных перегородок; внутритканевый отек, геморрагии, обширные некротические участки вещества поджелудочной железы, жировой ткани с нейтрофильной инфильтрацией, фиброзом и липоматозом (рис. 2).
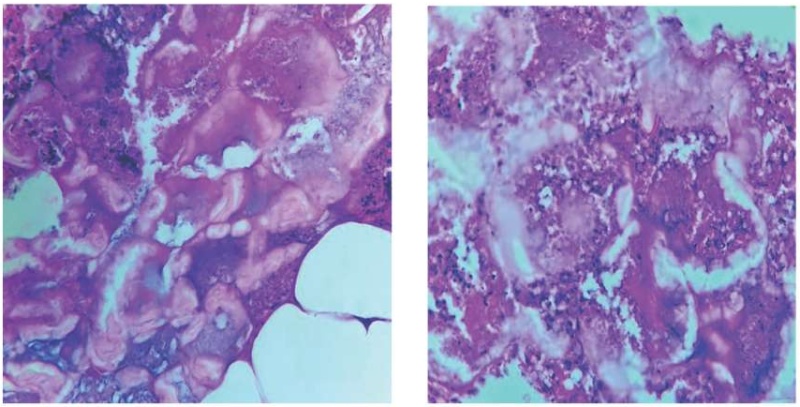
Рисунок 2. Микроскопическая картина некротических участков с лимфогистиоцитарной инфильтрацией в поджелудочной железе. Окраска гематоксилином и эозином, ×900
Figure 2. Microscopic appearance of necrotic areas with lymphohistiocytic infiltration in the pancreas. Staining with hematoxylin and eosin, ×900
В некоторых участках эпителиальные клетки подвергались трансдифференцировке, которая формировала внутри дольки трубчатые и глобулярные структуры, имеющие сходство с мелкими выводными протоками («очаговая пролиферация выводных протоков»). Также выявлялись деструктивные изменения сосудистых стенок: некрозы эндотелиоцитов, перицитов, гладкомышечных клеток и внутрисосудистые реологические расстройства в виде сладжа форменных элементов крови и тромбоз.
Определялись признаки ДВС-синдрома: в полостях сердца и крупных сосудах была жидкая кровь и мелкие гиалиновые тромбы. Выявлялись генерализованные гемореологические расстройства: многочисленные мелкие петехиальные кровоизлияния во внутренние органы, преимущественно в надпочечники, очаги некроза коркового слоя с перифокальной инфильтрацией и кровоизлияниями (рис. 3) (синдром Уотерхауса — Фридериксена), сладж-феномен в сосудах микроциркуляторного русла печени, легких, селезенки, почек; признаки некронефроза, где определялись участки фибриноидного некроза капилляров клубочков, периваскулярные лимфоидные инфильтраты.
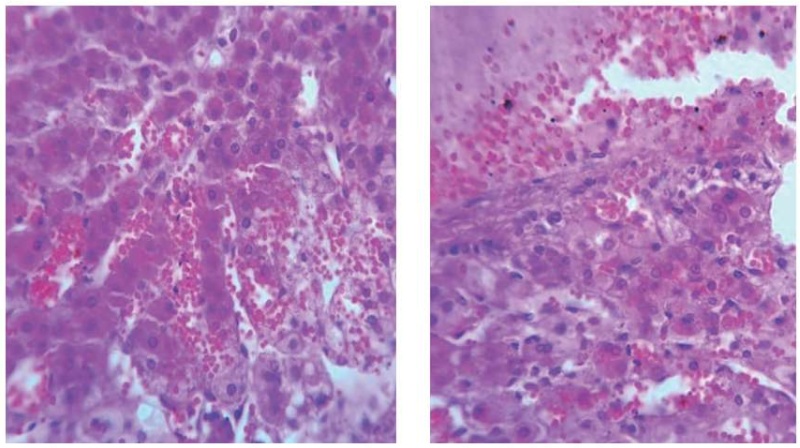
Рисунок 3. Синдром Уотерхауса — Фридериксена: кровоизлияния, очаги некроза коркового слоя надпочечников с выраженной перифокальной инфильтрацией. Окраска гематоксилином и эозином, ×900
Figure 3. Waterhouse—Friderichsen syndrome: haemorrhages, foci of adrenal cortex necrosis with extensive perifocal infiltration. Staining with hematoxylin and eosin, ×900
Результат вирусологического исследования секционного материала: РНК коронавируса SARS-CoV-2 в ткани легкого, поджелудочной железы обнаружена.
Выставлен патолого-анатомический диагноз. Основное заболевание: Коронавирусная инфекция COVID-19 (Результат вирусологического исследования биоматериала: РНК коронавируса SARS-CoV-2 обнаружена.) Конкурирующее заболевание: Субтотальный смешанный панкреонекроз. Осложнения основного заболевания: Двусторонняя вирусная интерстициальная пневмония. Острый респираторный дистресс синдром взрослых. Отек легких. ДВС-синдром. Кровоизлияния и очаги некроза коркового слоя надпочечников с выраженной перифокальной инфильтрацией. Двусторонний очаговый некронефроз.
По данным F. Wang и соавторов, у 52 пациентов с пневмонией COVID-19 17 % имели признаки повреждения поджелудочной железы, определяемые повышением концентрации амилазы или липазы крови. Однако у них не было клинических симптомов тяжелого панкреатита [9]. Однако E. De-Madaria и соавторы, комментируя данные, полученные F. Wang и соавторами, утверждают, что увеличение амилазы и липазы у пациентов с COVID-19 может быть связано с ацидозом, почечной недостаточностью и гастроэнтеритом, особенно если визуализация дала отрицательный результат для повреждения поджелудочной железы [10]. В своей работе L. Dioscoridi также соглашается с тем, что гиперамилаземия и гиперлипаземия не означают панкреатит при отсутствии симптомов и корреляции изображений [11]. Рецептор ACE2 высоко экспрессируется также в островковых клетках поджелудочной железы, поэтому инфекция SARS-CoV-2 теоретически может вызвать повреждение островков. Согласно F. Wang и соавторам, из девяти пациентов с повреждением поджелудочной железы у шести было повышение уровня глюкозы в крови [9]. Механизмы, по которым может происходить повреждение поджелудочной железы, включают прямые цитопатические эффекты SARS-CoV-2 или косвенные системные воспалительные и иммуноопосредованные клеточные ответы, приводящие к повреждению органов или вторичному повышению ферментов [9][12]. Жаропонижающие препараты, которые большинство пациентов в этом исследовании принимали до поступления, также могут вызывать связанные с препаратом повреждения поджелудочной железы [13][14].
В представленном случае после инфицировании SARS-CoV-2 развилась вирусная интерстициальная пневмония с развитием диффузного альвеолярного повреждения, с выраженным альвеолярно-геморрагическим синдромом и генерализованным тромбозом микроциркуляторного русла, которое привело к тяжелому течению процесса, гипоксии и респираторной недостаточности. Следует отметить, что внедрение SARS-CoV-2 и взаимодействие его с АСЕ2 индуцирует чрезмерную реакцию с выбросом большого количества провоспалительных цитокинов, что вызывает повреждение органов. Вероятно, что на фоне вирусной интерстициальной пневмонии мог возникнуть иммуноопосредованный воспалительный процесс с реакцией в поджелудочной железе и активацией панкреатических ферментов, с развитием некротических участков железы и поступлению в кровь протеолитических ферментов. Основная опасность именно в ферментах, находящихся в железе. Поскольку это чрезвычайно активные вещества, растворяющие белки и биологические полимеры до простейших субстанций, они могут вызвать системную воспалительную реакцию. Несомненное значение для неблагоприятного течения имело повреждение эндотелия сосудов и внутрисосудистые реологические расстройства. Таким образом, сочетание патоморфологических изменений в островках поджелудочной железы с полиорганным поражением при COVID-19 позволяет предположить следующие патогенетические механизмы его развития: прямое опосредованное цитопатическое влияние SARS-CoV-2; реакция поджелудочной железы на системный воспалительный процесс; реакция на системную гипоксию вследствие дыхательной недостаточности [15]. Выявлено, что островки поджелудочной железы человека являются мишенью SARS-CoV-2 с развитием некротических участков в них.
ЗАКЛЮЧЕНИЕ
После инфицирования SARS-CoV-2 у пациента развилась вирусная интерстициальная пневмония и реакция в поджелудочной железе с развитием внутритканевого отека, геморрагий, обширных некротических участков с нейтрофильной инфильтрацией, деструктивных изменений сосудистых стенок, реологических расстройств. Таким образом, островки поджелудочной железы явились мишенью SARS-CoV-2.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Sponsorship data. This work is not funded.
Список литературы
1. Воробьева О.В., Ласточкин А.В. Клинико-морфологический случай сахарного диабета, осложненного инфарктом миокарда. Профилактическая медицина. 2020;23(3):104–7. DOI: 10.17116/profmed202023031104
2. Воробьева О.В. Изменения в органах при инфицировании COVID-19 с развитием септикопиемии. Профилактическая медицина. 2021;24(10):89–93. DOI: 10.17116/profmed20212410189
3. Dambrauskas Z., Gulbinas A., Pundzius J. Meta-analysis of prophylactic parenteral antibiotic use in acute necrotizing pancreatitis. Medicina (Kaunas, Lithuania). 2007;43(4):291–300.
4. Juhász M.F., Ocskay K., Kiss S., Hegyi P., Párniczky A. Insufficient etiological workup of COVID-19-associated acute pancreatitis: A systematic review. World J Gastroenterol. 2020;26(40):6270–8. DOI: 10.3748/wjg.v26.i40.6270
5. Bradley E.L. 3rd, Howard T.J., van Sonnenberg E., Fotoohi M. Intervention in necrotizing pancreatitis: an evidence-based review of surgical and percutaneous alternatives. J Gastrointest Surg. 2008;12(4):634–9. DOI: 10.1007/s11605-007-0445-z
6. Fox C.J., Hammerman P.S., Thompson C.B. Fuel feeds function: energy metabolism and the T-cell response. Nat Rev Immunol. 2005;5(11):844–52. DOI: 10.1038/nri1710
7. Gross V., Leser H.G., Heinisch A. Inflammatory mediators and cytokines — new aspects of the pathophysiology and assessment of severity of acute pancreatitis. Hepatogastroenterology. 1993;40(3):530–52. PMID: 7509768
8. Samanta J., Gupta R., Singh M.P., Patnaik I., Kumar A., Kochhar R. Coronavirus disease 2019 and the pancreas. Pancreatology. 2020;20(8):1567–75. DOI: 10.1016/j.pan.2020.10.035
9. Wang F., Wang H., Fan J., Zhang Y., Wang H., Zhao Q. Pancreatic injury patterns in patients with coronavirus disease 19 pneumonia. Gastroenterology. 2020;159(1):367–70. DOI: 10.1053/j.gastro.2020.03.055
10. De-Madaria E., Siau K., Cardenas-Jaen K. Increased amylase and lipase in patients with COVID-19 pneumonia: don’t blame the pancreas just yet! Gastroenterology. 2020;S0016-5085(20)30561-8. DOI: 10.1053/j.gastro.2020.04.044
11. Dioscoridi L. Pancreas and coronavirus disease-2019. Pancreas Open J. 2020;4(1):1–2. DOI: 10.17140/POJ-4-111
12. Liu F., Long X., Zhang B., Zhang W., Chen X., Zhang Z. ACE2 expression in pancreas may cause pancreatic damage after SARS-CoV-2 infection. Clin Gastroenterol Hepatol. 2020;18(9):2128–2130.e2. DOI: 10.1016/j.cgh.2020.04.040
13. Abramczyk U., Nowaczyński M., Słomczyński A., Wojnicz P., Zatyka P., Kuzan A. Consequences of COVID-19 for the Pancreas. Int J Mol Sci. 2022;23(2):864. DOI: 10.3390/ijms23020864.
14. Hadi A., Werge M., Kristiansen K.T., Pedersen U.G., Karstensen J.G., Novovic S., et al. Coronavirus disease-19 (COVID-19) associated with severe acute pancreatitis: Case report on three family members. Pancreatology. 2020;20(4):665–7. DOI: 10.1016/j.pan.2020.04.021
15. Щикота А.М., Погонченкова И.В., Турова Е.А., Рассулов М.А., Филиппов М.С. Поражение желудочно-кишечного тракта, печени и поджелудочной железы при COVID-19. Доказательная гастроэнтерология. 2021;10(1):30–7. DOI: 10.17116/dokgastro20211001130
Об авторе
О. В. ВоробьеваРоссия
Воробьева Ольга Васильевна — к.м.н., кафедра общей и клинической морфологии и судебной медицины
Чебоксары
Рецензия
Для цитирования:
Воробьева О.В. Островки поджелудочной железы человека как одна из мишеней SARS-CoV-2. Креативная хирургия и онкология. 2022;12(4):350-355. https://doi.org/10.24060/2076-3093-2022-12-4-350-355
For citation:
Vorobеva O.V. Pancreatic islets as a SARS-CoV-2 target. Creative surgery and oncology. 2022;12(4):350-355. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-4-350-355


































