Перейти к:
Российское рандомизированное исследование по выбору оптимального режима антибиотикопрофилактики при радикальной цистэктомии: первые результаты MACS-TRIAL (NCT05392634)
https://doi.org/10.24060/2076-3093-2023-2
Аннотация
Введение. Ключевым методом лечения инвазивного уротелиального рака или неинвазивной опухоли мочевого пузыря высокого риска остается радикальная цистэктомия (РЦЭ), которая обеспечивает наилучшие показатели выживаемости. При этом инфекционные осложнения, по данным ряда исследований, достигают 33 % от общего числа осложнений, и они в большинстве случаев являются причиной повторной госпитализации и нарушают реализацию протокола Раннего послеоперационного восстановления (ERAS). Поэтому исследования в области эффективных схем антибиотикопрофилактики остаются актуальными.
Материалы и методы. Исследование MACS — российское исследование 3-й фазы с проспективным рандомизированным набором участников для оценки частоты инфекционных осложнений после РЦЭ в условиях протокола ERAS (промежуточный срез данных после включения 39 %). Подробно критерии включения и исключения опубликованы на сайте ClinicalTrials.gov, идентификатор NCT05392634. Работа получила одобрение Локального этического комитета № 1/129 от 28.04.2022 г. Статистическая обработка данных выполнена в пакете StatPlus: Mac LE.
Результаты и обсуждение. За период с 30.05.2022 по 01.02.2023 г. включены 36 пациентов (39 % от предполагаемой выборки). В 83,3 % (30/36) случаев выполнено интракорпоральное формирование гетеротопического резервуара по Bricker, в 13,8 % сформирован ортотопический резервуар типа J-pouch (5/36) и в 2,9 % (1/36) этап уродеривации завершен клипированием мочеточников. Значимых различий по бактериальной контаминации мочи до операции не выявлено, однако в группе А частота положительного бактериального посева при удалении мочеточниковых интубаторов была выше в 2 раза по сравнению с группой пролонгированной антибиотикотерапии: 7/14 случаев (50,0 %) и 3/12 случаев (25,0 %) соответственно. Снижение риска наступления осложнений в группе пролонгированной антибиотикотерапии в период 30 дней после РЦЭ на 47 % выявлено в группе В (ОР 0,53 (95 ДИ %: 0,21–1,32).
Заключение. В результате промежуточного среза базы данных исследования MACS было установлено, что РЦЭ ассоциирована с высоким риском развития ранних послеоперационных инфекционных осложнений. При наборе оставшихся 61 % случаев планируется оценка прогностической значимости индексов системного воспаления как предикторов развития инфекционных осложнений.
Ключевые слова
Для цитирования:
Носов А.К., Беркут М.В., Мамижев Э.М., Галунова Т.Ю., Румянцева Д.И., Семейко Д.П., Рева С.А., Коняшкина С.Ю. Российское рандомизированное исследование по выбору оптимального режима антибиотикопрофилактики при радикальной цистэктомии: первые результаты MACS-TRIAL (NCT05392634). Креативная хирургия и онкология. 2023;13(1):13-20. https://doi.org/10.24060/2076-3093-2023-2
For citation:
Nosov A.K., Berkut M.V., Mamizhev E.M., Galunova T.Yu., Rumyantseva D.I., Semeyko D.P., Reva S.A., Konyashkina S.Yu. Russian Randomized Trial to Select Optimal Antibiotic Prophylaxis in Radical Cystectomy: Initial Results of MACS-TRIAL (NCT05392634). Creative surgery and oncology. 2023;13(1):13-20. (In Russ.) https://doi.org/10.24060/2076-3093-2023-2
ВВЕДЕНИЕ
По данным Национального канцер-регистра, в Российской Федерации только за 2021 г. зарегистрировано 580 415 новых случаев злокачественных новообразований, из которых на долю рака мочевого пузыря приходится 14 857 случаев (2,56 %) [1]. По оценкам эпидемиологов, число больных раком мочевого пузыря во всем мире к 2030 году увеличится почти вдвое в сравнении с 2012 годом, поэтому разработка терапевтических, лекарственных опций, в том числе улучшающих качество хирургического лечения, становится актуальным вопросом [2].
Радикальная цистэктомия (РЦЭ) с кишечной деривацией мочи является стандартным методом лечения мышечно-инвазивного рака мочевого пузыря или немышечно-инвазивного рака мочевого пузыря с высоким риском, однако связана с высокой частотой послеоперационных осложнений. В настоящее время частота осложнений во время госпитализации или в течение 30 дней после операции колеблется в пределах 28–60 %. Инфекционные осложнения (ИО) наряду с осложнениями со стороны желудочно-кишечного тракта занимают главное место в послеоперационной заболеваемости и смертности [3].
Согласно рекомендациям Центра по контролю заболеваний (Centers for Disease Control and Prevention) показано внутривенное введение антибиотиков до операции и в течение суток после вмешательства, которые снижают частоту возникновения инфекционных хирургических осложнений на 40 % [4]. В соответствии с действующими Клиническими рекомендациями «Профилактика инфекций области хирургического вмешательства» (2018) с учетом условно-контаминированного профиля при РЦЭ регламентировано введение цефалоспоринов 2–3-го поколения или защищенных пенициллинов [5]. Однако анализ действующей клинической практики указывает на наличие множества нестандартизированных протоколов антибиотикопрофилактики (АП) во всем мире. По данным Kransnow et al. (2017) – при исследовании протокола АП во время выполнения 8351 цистэктомий из 353 больниц в США установлено, что в день операции было назначено 579 уникальных режимов АП [6]. Кроме того, только 15 % пациентов получали АП в соответствии с рекомендациями, а 51 % случаев в день операции вводили 2 или более антибиотика.
Российским исследованием, посвященным оценке роли бактериальной контаминации, является работа В. А. Атдуева и соавт. (2019), в которой интраоперационное инфицирование брюшной полости стало значимым предиктором развития пареза кишечника и инфекционных осложнений в послеоперационном периоде (ОР 3,4; 95 % ДИ: 1,742–6,637, p < 0,001). Полученные данные демонстрируют, что цистэктомия относится к контаминированным и «грязным» операциям, и в эксперименте (n = 32) показана эффективность карбапенемов в отношении частоты осложнений 3–4 ст. (не выявлено ни одного случая). В то времякак в ранние сроки после операции в группах защищенных пенициллинов (40,2 %), фторхинолонов 3-го поколения (32,2 %) достаточно часто возникала необходимость смены антибиотика из-за его клинической неэффективности [7].
Таким образом, актуальность данной работы обусловлена отсутствием единого стандартизированного подхода к антибиотикопрофилактике у пациентов, подвергающихся выполнению РЦЭ с различными вариантами уродеривации мочи в условиях работы по протоколу ERAS. Данное исследование является первым в России рандомизированным проспективным многоцентровым исследованием, посвященным сравнению стандартного режима АП и пролонгированной превентивной АП, с применением карбапенемов в течение 5 суток.
МАТЕРИАЛЫ И МЕТОДЫ
MACS протокол — российское исследование 3 фазы с проспективным рандомизированным набором участников для оценки частоты инфекционных осложнений после РЦЭ в условиях протокола ERAS в период 30–90 дней после выполненной минимально-инвазивной радикальной цистэктомии. Протокол данного клинического исследования одобрен Локальным этическим комитетом ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава России № 1/129 от 28.04.2022 г. Критерии включения и исключения, конечные точки исследования опубликованы на сайте ClinicalTrials.gov, идентификатор NCT05392634.
За период с 30.05.2022 по 01.02.2023 г. включены 36 пациентов (39 % от предполагаемой выборки), получивших специализированное лечение на базе двух включенных центров: НМИЦ онкологии им. Н. Н. Петрова и НИЦ урологии ПСПбГМУ им. И. П. Павлова. Промежуточный срез данных выполнен 01.02.2023 г. после включения 39 % пациентов от предполагаемого набора. Распределение по полу: 34 мужчины (94,4 %), 2 женщины (5,6 %). Средний ИМТ составил 25,21 ± 3,17. Средний возраст включенных пациентов 65,53 ± 8,74 года (42–82).
Рандомизация происходила 1:1 в две группы лечения: группу А (n = 19) стандартной антибиотикопрофилактики, где назначение антибактериального препарата (АБП) выполняется в соответствии с внутренним приказом по организации и проведению периоперационной АП (цефуроксим 1,5 г или амоксиклав 1,2 г за 30 минут до разреза). При продолжительности операции более 4 часов или интраоперационной кровопотере более 1,5 л выполнялось интраоперационное введение дополнительной дозы АБП. Длительность периоперационной АП составляет не более 24 часов для пациентов данной группы. Продление терапии в данной группе не допускается. В группе В превентивной антибиотикопрофилактики (n = 17) в качестве АБП использовался cинтетический антибиотик из группы карбапенемов (меропенем 1 г каждые 8 часов в течение 5 суток).
Для всех пациентов выполнялся посев мочи на микрофлору и при необходимости определение чувствительности к антимикробным препаратам, интраоперационно до разреза кожи и введения антимикробного препарата (БП1) и второй раз (БП2) после удаления мочеточниковых интубаторов/уретрального катетера (при ортотопической пластике). В последнее время уделяется значительное внимание маркерам системного воспаления и их влиянию на прогноз онкологических заболеваний. Для определения изменений системного иммуновоспалительного ответа, который развивается после РЦЭ, выполнялся контроль показателей общего анализа крови перед операцией и на момент выписки пациента из стационара (лейкоциты, нейтрофилы, лимфоциты, моноциты и тромбоциты, 10 9/л), контроль С-реактивного белка на 1, 3 и 9-е сутки после операции. Расчет показателей иммуновоспалительного индекса происходил по следующим формулам:NLR (нейтрофильно-лимфоцитарный индекс) = число нейтрофилов × 10 9/л ÷ число лимфоцитов × 10 9/л; dNLR — соотношение нейтрофилов и разницы между лейкоцитами и нейтрофилами (т. е. фактически к мононуклеарам периферической крови) = число нейтрофилов × 10 9/л ÷ (число лейкоцитов — числонейтрофилов) × 10 9/л; PLR (тромбоцитарно-лимфоцитарный индекс) = число тромбоцитов × 10 9/л ÷ число лимфоцитов × 10 9/л; LMR (лимфоцитарно-моноцитарный индекс) = число лимфоцитов × 10 9/л ÷ число моноцитов × 10 9/л; SSI (системный иммунно-воспалительный индекс) = число тромбоцитов × 10 9/л × (число нейтрофилов × 10 9/л ÷ число лимфоцитов × 10 9/л).
Расчет статистической выборки осуществлен через онлайн калькулятор за счет снижения риска развития событий, представляющих клинический интерес в группе А RR = 0.63 до RR = 0.32 в группе В (“Sample Size Calculators UCSF CTSI”, M. A. Kohn J. Senyak, https://www.sample-size.net/[Accessed 03 February 2022]),N = 92 пациента. Статистическая обработка данных на момент промежуточного среза выполнена в пакете StatPlus: Mac LE.
РЕЗУЛЬТАТЫ
Стадирование до и после операции выполнено по системе TNM (AJCC 8th), распределение больных подробно представлено в таблице 1. Показанием к выполнению РЦЭ (во всех случаях использован лапароскопический доступ) в 22,2 % случаев (8/28) был мышечно-неинвазивный уротелиальный рак, в 77,8 % случаев (28/36) — мышечно-инвазивный рак мочевого пузыря. Местно-распространенный рак мочевого пузыря с поражением регионарных лимфатических узлов до операции составил 13,8 % случаев (5/36), после операции выявлено 7 случаев (19,44 %). Проведение неоадъювантной лекарственной терапии использовалоськак фактор стратификации пациентов и выполнялось большинству пациентов в обеих группах: в группе А в 12/19 случаев (63,16 %), в группе В — 11/17 случаев (64,71 %). Подавляющее число пациентов получили цисплатин-содержащую химиотерапию: 57,9 и 58,8 % соответственно, что демонстрирует достаточный уровень скорости клубочковой фильтрации в обеих группах. По одному случаю неоадъювантной терапии в каждой из подгрупп представлено иммунотерапией, которая выполнена в рамках клинических исследований в локальных центрах.
Таблица 1. Базовая характеристика пациентов
Table 1. Baseline patient characteristics
Характеристика | Группа А (n = 19) | Группа В (n = 17) | |||
cTNM | pTNM | cTNM | pTNM | ||
Стадирование по TNM (AJCC 8th) | T0 | 0 | 4 | 0 | 5 |
Tis | 1 | 1 | 1 | 1 | |
T1 | 2 | 2 | 4 | 1 | |
T2 | 6 | 5 | 8 | 3 | |
T3 | 8 | 3 | 3 | 4 | |
T4 | 2 | 4 | 1 | 3 | |
No | 17 | 15 | 14 | 14 | |
N1–2 | 2 | 4 | 3 | 3 | |
Mo | 17 | 17 | 16 | 16 | |
M1 | 0 | 0 | 1 | 1 | |
Проведение неоадъювантной терапии | Нет | 7 (36,84 %) | 6 (35,29 %) | ||
Да | 12 (63,16 %) | 11 (64,71 %) | |||
GP | 10 | 10 | |||
MVAC | 1 | 0 | |||
Иммунотерапия | 1 | 1 | |||
Вариант уродеривации | ГТ* | 15 (78,94 %) | 15 (88,23 %) | ||
ОТ** | 3 | 2 | |||
Другое | 1 | 0 | |||
В качестве второго стратификационного фактора использован предполагаемый тип уродеривации: в 83,3 % (30/36) случаев пациентам выполнено интракорпоральное формирование гетеротопического резервуара по Bricker, в 13,8 % сформирован ортотопический резервуар типа J-pouch (5/36) и в 2,9 % (1/36) этап уродеривации на операции завершен клипированием мочеточников и отведением мочи по нефростомам в связи с выраженным местно-распространенным онкологическим процессом.
В рамках плана мероприятий при проведении исследования всем пациентам интраоперационно в стерильных условиях до введения антибактериального препарата выполнялся бактериальный посев мочи (на момент промежуточного среза внесены данные по 26 пациентам, в группе А 14 результатов, в группе В 12 результатов). По результатам микробиологического анализа у 8/26 (30,8 %) пациентов в посевах предоперационной мочи была выявлена различная микрофлора (рис. 1 А). Наиболее частыми возбудителями инфекции мочевых путей были Escherichia coli — 11,5 % (3/26) случаев, Klebsiella oxy. — 11,5 % и по 1 случаю (3,8 %) Klebsiella pneum. и Enteroc. Faecalis. Значимых различий по частоте бактериального инфицирования между группами не получено.
При оценке результатов бактериального посева, выполняемого при удалении последнего мочеточникового интубатора или уретрального катетера (в случае ортотопической уродеривации), роста микроорганизмов или грибов не получено в 57,7 % случаев (рис. 1 Б). Однако при подгрупповом анализе в группе А частота положительного бактериального посева была выше в 2 раза по сравнению с группой пролонгированной антибиотикотерапии: 7/14 случаев (50,0 %) и 3/12 случаев (25,0 %) соответственно. В 1 случае контроль бактериального посева не выполнен по причине миграции мочеточниковых интубаторов на 7-е сутки.
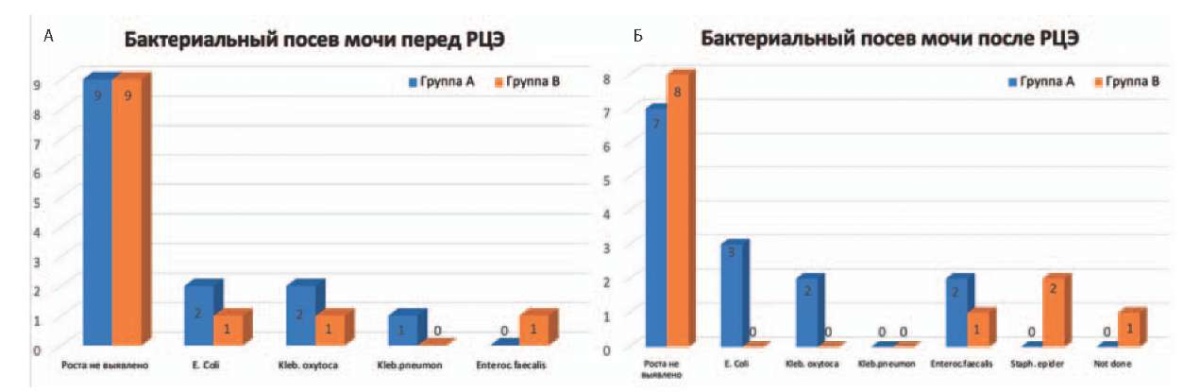
Рисунок 1. Бактериальный посев мочи: А — выполнен в стерильных условиях, интраоперационно до разреза кожи и введения антимикробного препарата; Б — посев мочи на микрофлору, определение чувствительности к антимикробным препаратам, выполняемый после операции в момент удаления мочеточниковых интубаторов/уретрального катетера
Figure 1. Urine bacterial culture: A — performed under sterile conditions, intraoperatively prior to skin incision and antimicrobial administration; Б — urine culture for microflora, antimicrobial susceptibility test, performed after surgery at the time of removal of ureteral intubators/urethral catheter
Для определения изменений системного иммуновоспалительного ответа в послеоперационном периоде выполнялся контроль уровня С-реактивного белка на 1, 3 и 9-е сутки после радикальной цистэктомии. Было установлено, что уровень подъема маркера был ниже в группе пролонгированной антибиотикотерапии во всех 3-х контрольных точках в среднем на 24,73 мг/л, однако разница статистически была не достоверна: на 1-е сутки 102,5 мг/л vs. 80,89 мг/л (р = 0,44); на 3-и сутки 208,57 мг/л vs. 171,61 мг/л (р = 0,39); на 9-е сутки 77,41 мг/л vs. 61,78 мг/л (р = 0,58).
Результаты статистического анализа индексов системного воспаления на фоне проводимой периоперационной АБП представлены в таблице 2.
Таблица 2. Динамика индексов системного воспаления на фоне проводимой периоперационной антибиотикопрофилактики в группах
Table 2. Dynamics of systemic inflammation indices against the background of perioperative antibiotic prophylaxis in groups
Показатель общего анализа крови | Группа А | Группа В | ||
До операции | По завершении лечения | До операции | По завершении лечения | |
NLR | 2,85 ± 3,28 | 4,84 ± 3,81 | 2,63 ± 2,26 | 3,08 ± 1,55 |
dNLR (10^9/l) | 1,66 ± 1,39 | 2,95 ± 2,68 | 1,52 ± 0,81 | 1,63 ± 0,79 |
PLR | 199,85 ± 161,22 | 242,08 ± 119,32 | 120,40 ± 60,00 | 237,33 ± 98,83 |
LMR | 4,52 ± 2,57 | 2,53 ± 1,18 | 3,82 ± 1,67 | 2,26 ± 0,91 |
SSI (10^9/l) | 945,64 ± 296,00 | 1354,52 ± 855,00 | 517,23 ± 376,10 | 1143,65 ± 667,20 |
Статистически значимых отличий в динамике индексов NLR, dNLR, PLR, LMR не получено, однако отмечено, что на фоне пролонгированной антибиотикотерапии на момент выписки пациента сохраняется высокий системный иммуновоспалительный индекс: рост показателя с 517,23 ± 376,1 × 10 9/л до 1143,65 ± 667,20 × 10 9/л (t-критерий для двух зависимых выборок: для группы В составил р = 0,00267).
В рамках промежуточного анализа (набор 39 % участников от предполагаемого объема выборки) впервые выполнена оценка времени до развития событий, представляющих клинический интерес, в период 30 дней после РЦЭ (рис. 2). Число событий, представляющих клинический интерес, ≥1 выявлено у 19 из 36 пациентов в обеих группах (52,78 % случаев); ≥2 событий за 30-дневный период наблюдения отмечено у каждого четвертого (9 пациентов); ≥3 событий на одного пациента выявлено только в 3 случаях (8,3 %). Нежелательные явления III–IV степени по классификации Clavien-Dindo, потребовавшие повторного хирургического вмешательства или проведения интенсивной терапии, отмечены у 8/36 пациентов (22,2 % случаев). Медиана времени до развития событий, представляющих клинический интерес, в период 30 дней после РЦЭ составила 14 дней, при этом Log-rank тест значимых различий между группами стандартной и пролонгированной антибиотикотерапии не выявил (р = 0,189). Тем не менее отношение риска развития инфекционного осложнения в определенный момент времени t в одной группе по сравнению с другой группой позволило выявить снижение риска в группе пролонгированной антибиотикотерапии на 47 % (HR 0,53 (95 ДИ %: 0,21–1,32).
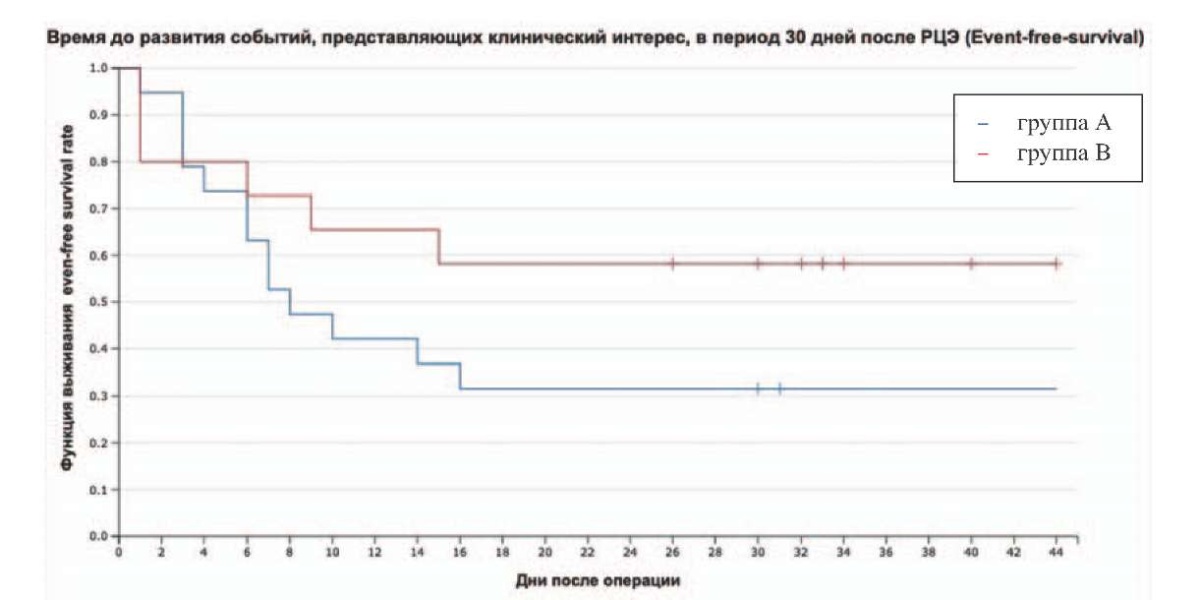
Рисунок 2. Оценка время до развития событий, представляющих клинический интерес, в период 30 дней после РЦЭ (event-free survival)
Figure 2. Estimated time to clinical events within 30 days after RCE (event-free survival)
ОБСУЖДЕНИЕ
РЦЭ с деривацией мочи в сегмент кишечного тракта является стандартизированной хирургической операцией, однако она сопряжена с достаточно высоким уровнем развития периоперационных и отдаленных осложнений, среди которых можно выделить 3 основные группы: 1) послеоперационные осложнения, связанные с физическим статусом пациента и его сопутствующими заболеваниями; 2) осложнения, связанные непосредственно с удалением мочевого пузыря и соседних органов; 3) осложнения со стороны желудочно-кишечного тракта, связанные с использованием того или иного сегмента кишечника для последующего отведения мочи [8][9]. До 1990-х годов в крупных сериях при выполнении РЦЭ периоперационная летальность составляла до 15 %, а частота ранних осложнений колебалась от 28 до 42 % [10]. В настоящее время послеоперационная летальность относительно низка, 0–3,9 %, а уровень ранних послеоперационных осложнений остается по-прежнему высоким и варьирует почти до 63 %. Подобная статистика осложнений представляет собой практический интерес для выявления и детального изучения факторов риска ранних послеоперационных осложнений.
Ключ к успешной цистэктомии, по мнению многих хирургов: U. Studer, А. К. Носова, С. Б. Петрова, Д. В. Перлина — может быть реализован за счет синергизма двух направлений [10–13]: качественного отбора пациентов, включающего гистологическое типирование, клиническое стадирование, группу прогноза, молекулярное типирование, оценку функционального и соматического статуса, и за счет реализации принципов ускоренной послеоперационной реабилитации (внедрения протокола ERAS), включающего в себя не только использование минимально инвазивной хирургии, отказ от рутинного дренирования, назогастральной интубации, раннее энтеральное питание, но осознанное использование принципов антибиотикопрофилактики, основанное на проспективных доказательствах [14]. Так, по данным систематического обзора М. Peerbocus (2021), выполненного по протоколу PICO, при сравнении результатов 12 исследований, использовавших принципы ERAS, было установлено отсутствие снижения риска развития общей частоты осложнений в группах стандартного ведения пациента и по протоколу ERAS: 44,8 % против 44,3 % соответственно (ОР 0,98; ДИ 95 % 0,88–1,09). При более детальном изучении исследований, которые были включены в данный анализ, в 40 % случаев (5/15 исследований) вовсе не оценивалось влияние АП на результаты исследований [15]. Дополнительно смущает качество проведенных исследований, ограниченное число проспективных рандомизированных исследований.
Эффективность АП наименее изучена среди пациентов старшего возраста (>65 лет), при этом 90 % мышечно-инвазивного рака мочевого пузыря выявляется именно у пациентов старше 55 лет. Систематический обзор трех клинических исследований по пролонгированной АБП показал снижение риска рецидивирующей ИМВП на 24 % (ОР = 0,76; 95 % ДИ 0,61–0,95, в 8,5 законченного случая требовалось проведение АБП для предотвращения 1 случая инфекции), при этом статистически значимого увеличения риска нежелательных явлений отмечено не было (ОР 1,52; 95 % ДИ 0,76–3,03) [16]. Средний возраст включенных в MACS-исследование пациентов составил 65,53–8,74 года, максимальный возраст, при котором проводилась цистэктомия, — 82 года. При погрупповом анализе в группе А частота положительного бактериального посева была выше в 2 раза по сравнению с группой пролонгированной антибиотикотерапии: 7/14 случаев (50,0 %) и 3/12 случаев (25,0 %) соответственно, на что опосредованно может влиять и продолжительность режима терапии (5 суток), и фармакологическая группа антибиотика широкого спектра — карбапенемы. Примечательным является анализ времени до развития событий, представляющих клинический интерес, в период 30 дней после РЦЭ (event-free survival), который выявил снижение риска наступления осложнений в группе пролонгированной антибиотикотерапии на 47 % (ОР 0,53 (95 ДИ %: 0,21–1,32), что позволяет нам продолжить набор пациентов для исследования и оценку результатов на более значимой выборке пациентов.
ЗАКЛЮЧЕНИЕ
В результате промежуточного среза базы данных исследования MACS было установлено, что РЦЭ ассоциирована с высоким риском развития ранних послеоперационных инфекционных осложнений. Полученные данные по снижению риска развития инфекционных осложнений почти в два раза в сравнении со стандартным подходом антибиотикопрофилактики позволяют продолжить набор пациентов для исследования, а также в проспективном порядке оценить прогностическую значимость индексов системного воспаления как предикторов развития инфекционных осложнений.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Исследование было поддержано совместным грантом Фонда поддержки научных исследований в онкологии (РакФонд) и Российским обществом клинической онкологии (договор № 3/2022 от 26.05.2022 г).
Funding. The study was supported by a joint grant from the Foundation for Cancer Research Support (RakFond) and the Russian Society of Clinical Oncology (Agreement No. 3/2022 of May 26, 2022).
Статья написана к II Евразийскому конгрессу урологов 16–18 марта 2023 г., Уфа.
This article was prepared for the 2nd Eurasian Congress of Urologists, March 16–18, 2023, Ufa, Russia.
Список литературы
1. Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.) Состояние онкологической помощи в России в 2021 году. М.; 2020.
2. Cai Q., Chen Y., Xin S., Zhang D., Pan J., Xie Z., et al. Temporal trends of bladder cancer incidence and mortality from 1990 to 2016 and projections to 2030. Transl Androl Urol. 2020;9(2):153–65. DOI: 10.21037/tau.2020.02.24
3. Hautmann R.E., de Petriconi R.C., Volkmer B.G. Lessons learned from 1,000 neobladders: the 90-day complication rate. J Urol. 2010;184(3):990–1235. DOI: 10.1016/j.juro.2010.05.037
4. Mangram A.J., Horan T.C., Pearson M.L., Silver L.C., Jarvis W.R. Guideline for prevention of surgical site infection, 1999. Am J Infect Control. 1999;27(2):97–132; quiz 133–4; discussion 96. PMID: 10196487
5. Брико Н.И., Божкова С.А., Брусина Е.Б., Жедаева М.В., Зубарева Н.А., Зуева Л.П. и др. Профилактика инфекций области хирургического вмешательства. Клинические рекомендации. Н. Новгород: Ремедиум Приволжье; 2018.
6. Krasnow R.E., Mossanen M., Koo S., Kubiak D.W., Preston M.A., Chung B.I., et al. Prophylactic antibiotics and postoperative complications of radical cystectomy: a population based analysis in the United States. J Urol. 2017;198(2):297–304. DOI: 10.1016/j.juro.2017.02.3340
7. Атдуев В.А., Гасраталиев В.Э., Ледяев Д.С., Шевелев И.С., Бельский В.А. Предикторы послеоперационных осложнений радикальной цистэктомии. Онкология. Журнал им. П.А. Герцена. 2019;8(5):348–57. DOI: 10-17116/onkolog20198051348
8. Lawrentschuk N., Colombo R., Hakenberg O.W., Lerner S.P., Månsson W., Sagalowsky A., et al. Prevention and management of complications following radical cystectomy for bladder cancer. Eur Urol. 2010;57(6):983–1001. DOI: 10.1016/j.eururo.2010.02.024
9. Hollenbeck B.K., Miller D.C., Taub D., Dunn R.L., Khuri S.F., Henderson W.G., et al. Identifying risk factors for potentially avoidable complications following radical cystectomy. J Urol. 2005;174(4 Pt 1):1231–7; discussion 1237. DOI: 10.1097/01.ju.0000173923.35338.99
10. Носов А.К., Рева С.А., Джалилов И.Б., Петров С.Б. Радикальная цистэктомия при раке мочевого пузыря: сравнение ранних хирургических осложнений при лапароскопической, открытой и видеоассистированной операции. Онкоурология. 2015;11(3):71–8. DOI: 10.17650/1726-9776-2015-11-3-71-78
11. Studer U.E. Keys to successful orthotopic bladder substitution. Cham: Switzerland Springer International Publishing; 2015.
12. Петров С.Б., Левковский Н.С., Король В.Д., Паршин А.Г. Радикальная цистэктомия как основной метод лечения мышечноинвазивного рака мочевого пузыря (показания, особенности техники, профилактика осложнений). Практическая онкология. 2003;4(4):225–30.
13. Перлин Д.В., Александров И.В., Зипунников В.П., Шманев А.О. Лапароскопическая радикальная цистэктомия: ключевые моменты. Онкоурология. 2018;14(1):136–43. DOI: 10.17650/1726-9776-2018-14-1-136-143
14. Cerantola Y., Valerio M., Persson B., Jichlinski P., Ljungqvist O., Hubner M., et al. Guidelines for perioperative care after radical cystectomy for bladder cancer: Enhanced Recovery After Surgery (ERAS(®)) society recommendations. Clin Nutr. 2013;32(6):879–87. DOI: 10.1016/j.clnu.2013.09.014
15. Peerbocus M., Wang Z.J. Enhanced recovery after surgery and radical cystectomy: a systematic review and meta-analysis. Res Rep Urol. 2021;13:535–47. DOI: 10.2147/RRU.S307385
16. Ahmed H., Davies F., Francis N., Farewell D., Butler C., Paranjothy S. Long-term antibiotics for prevention of recurrent urinary tract infection in older adults: systematic review and meta-analysis of randomised trials. BMJ Open. 2017;7(5):e015233. DOI: 10.1136/bmjopen-2016-015233
Об авторах
А. К. НосовРоссия
Носов Александр Константинович — д.м.н., отделение онкоурологии
Санкт-Петербург
М. В. Беркут
Россия
Беркут Мария Владимировна — к.м.н., отделение
онкоурологии
Санкт-Петербург
Э. М. Мамижев
Россия
Мамижев Эльдар Мухамедович — к.м.н., отделение онкоурологии
Санкт-Петербург
Т. Ю. Галунова
Россия
Галунова Татьяна Юрьевна — отделение лабораторной диагностики
Санкт-Петербург
Д. И. Румянцева
Россия
Румянцева Дарья Игоревна — научное отделение
общей онкологии и урологии
Санкт-Петербург
Д. П. Семейко
Россия
Семейко Дмитрий Павлович — отделение онкоурологии
Санкт-Петербург
С. А. Рева
Россия
Рева Сергей Александрович — к.м.н., онкологическое отделение (андрологии и онкоурологии)
Санкт-Петербург
С. Ю. Коняшкина
Россия
Коняшкина Светлана Юрьевна — онкологическое отделение (андрологии и онкоурологии)
Санкт-Петербург
Рецензия
Для цитирования:
Носов А.К., Беркут М.В., Мамижев Э.М., Галунова Т.Ю., Румянцева Д.И., Семейко Д.П., Рева С.А., Коняшкина С.Ю. Российское рандомизированное исследование по выбору оптимального режима антибиотикопрофилактики при радикальной цистэктомии: первые результаты MACS-TRIAL (NCT05392634). Креативная хирургия и онкология. 2023;13(1):13-20. https://doi.org/10.24060/2076-3093-2023-2
For citation:
Nosov A.K., Berkut M.V., Mamizhev E.M., Galunova T.Yu., Rumyantseva D.I., Semeyko D.P., Reva S.A., Konyashkina S.Yu. Russian Randomized Trial to Select Optimal Antibiotic Prophylaxis in Radical Cystectomy: Initial Results of MACS-TRIAL (NCT05392634). Creative surgery and oncology. 2023;13(1):13-20. (In Russ.) https://doi.org/10.24060/2076-3093-2023-2


































