Перейти к:
Стриктура уретры и способы ее коррекции
https://doi.org/10.24060/2076-3093-2023-13-1-58-67
Аннотация
Сужение просвета передней уретры называют стриктурой, и она может быть вызвана самыми разными причинами. Кроме того, стриктуры уретры вызывают широкий спектр симптомов, и, прежде чем переходить к какому-либо методу лечения, требуется специальное диагностическое обследование. Лечение стриктуры уретры остается сложной задачей на протяжении многих лет, и на сегодня рецидив стриктуры является серьезной проблемой в реконструктивной урологии. Во второй половине ХХ века урологи пытались найти решения для лечения как простых, так и сложных стриктур уретры, и за последние несколько десятилетий исследования в основном были сосредоточены на совершенствовании существующих процедур для смягчения негативных послеоперационных последствий. Несмотря на значительный научный прогресс в этой области, многочисленные исследования выявили недостаточные знания о хирургии стриктуры уретры среди урологов и показали, что пациентам со стриктурами уретры, как правило, предлагается неадекватный вариант лечения. В настоящее время существует множество хирургических вмешательств для лечения этого заболевания. Однако разнообразие методов лечения отражает нехватку оптимальной техники. В данном литературном обзоре представлены данные об эффективности малоинвазивных (эндоскопических) и различных вариантов уретропластики в урологической практике.
Ключевые слова
Для цитирования:
Казихинуров Р.А., Шамсов Б.И., Казихинуров А.А., Казихинуров Р.Р., Хасанов А.И. Стриктура уретры и способы ее коррекции. Креативная хирургия и онкология. 2023;13(1):58-67. https://doi.org/10.24060/2076-3093-2023-13-1-58-67
For citation:
Kazikhinurov R.А., Shamsov B.I., Kazikhinurov A.A., Kazikhinurov R.R., Hasanov A.I. Urethral Stricture and Methods for its Correction. Creative surgery and oncology. 2023;13(1):58-67. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-1-58-67
ВВЕДЕНИЕ
Стриктура уретры — сужение переднего отдела мочеиспускательного канала вследствие рубцового поражения уретральной слизистой с различной степенью спонгиофиброза [1][2]. Больные со стриктурой уретры могут предъявлять следующие жалобы: чувство неполного опорожнения мочевого пузыря, боль и жжение во время мочеиспускания, частые позывы к мочеиспусканию, слабый напор струи и уменьшение объема выделяемой мочи, болевой синдром в области таза и в нижней части живота, боль в области полового члена, в ряде случаев невозможность мочеиспускания, приводящая к развитию острой задержки мочи [1][3][4].
Патогенез заболевания обусловлен многоступенчатым фиброзным процессом, который инициируется нарушением целостности слизистой оболочки и/или нарушением кровообращения в этой зоне. Причиной возникновения, образования и развития заболевания является дефект эпителия мочеиспускательного канала и прилегающей части пещеристого (спонгиозного) тела, а также дальнейшее замещение многорядного цилиндрического эпителия передней уретры плоскоклеточной метаплазией с дальнейшим преобразованием межклеточного вещества спонгиозной ткани. Перечисленные изменения в будущем могут способствовать образованию спонгиофиброза.
На сегодня актуальных сведений о заболеваемости стриктурой уретры не имеется. В России статистические данные о распространенности стриктуры уретры у мужчин точно не известны [1]. Значительный подъем заболевания наблюдается у мужчин после 55 лет, что связано с увеличением доли эндоуретральных манипуляций [5]. Встречаемость стриктур уретры составляет 229–627 на 100 000 мужчин [5]. Наиболее часто выявляются стриктуры передней уретры, в частности бульбозного отдела (56,2 %) [6]. У трансмужчин частота возникновения стриктуры уретры составляет около 51 % [7].
Стриктура уретры остается актуальной проблемой в реконструктивной урологии. В связи с ростом эндоскопических вмешательств в развитых странах наиболее частым этиологическим фактором является ятрогенный, что составляет 61,1 % [8]. Одна из ятрогенных причин, приводящая к развитию стриктуры уретры, — это повреждение мочеиспускательного канала во время катетеризации. При проведении данной манипуляции за счет формирования ложного хода уретра повреждается в 29,7 %, а при раздутии баллона в просвете уретры — в 70,3 % [9], также высока доля идиопатических стриктур, их частота в пенильном отделе уретры составляет до 34 %, в бульбозном — до 63 % [10]. Наиболее частой причиной развития стриктур и стенозов уретры является травма мочеиспускательного канала. Чаще всего при тупой травме поражается бульбозный отдел уретры, как показывает практика, в результате травмы «всадника» или удара в промежность. В 15 % случаев повреждение уретры возникает при переломе полового члена [11]. Одной из основных причин тупых травм задней уретры являются дорожно-транспортные происшествия, которые связаны с дистракционным переломом костей таза [12]. В гражданских условиях проникающие ранения уретры встречаются редко, более частой причиной стриктур воспалительной этиологии является склероатрофический лишай, который может быть этиологическим фактором стриктур передней уретры в 20 % случаев [13]. Этиология склероатрофического лишая до конца не изучена, но, вероятно, он имеет аутоиммунную природу или может быть связан с факторами окружающей среды и многими другими сопутствующими заболеваниями (высоким индексом массы тела (ИМТ), сахарным диабетом, ишемической болезнью сердца, курением табака, гиперлипидемией и артериальной гипертензией). У мужчин, которым не выполнялось обрезание, отмечается более высокий риск развития данной патологии.
Стриктуры и стенозы уретры по локализации делятся на головчатую (ладьевидная ямка, наружное отверстие уретры), пенильную, бульбозную, мембранозную, простатическую. По протяженности стриктура делится на короткую (≤2 см), длинную (≥ 2 см), субтотальную губчатую (поражение более 75–90 % губчатой уретры), тотальную губчатую (поражение всей губчатой уретры) и тотальную (поражение всей уретры) [3].
Одна из самых сложных и нерешенных проблем современной урологии — лечение стриктур уретры. При стриктуре уретры проводятся следующие виды оперативных вмешательств: малоинвазивные/эндоскопические и различные варианты уретропластики. Отдельно выделяют методики оперативного лечения приповреждении уретры, возникающие вследствие перелома костей таза. Необходимость проведения перинеостомии или деривации мочи (континентной или инконтинентной) возникает при невозможности восстановления проходимости уретры по тем или иным причинам [1]. Хирургическая тактика зависит от этиологии, локализации, протяженности поражения, фиброзных изменений периуретральных тканей [14]. Важными факторами для выбора хирургической техники являются длина и сложность стриктуры [15]. Для достижения успешных результатов необходима адекватная предоперационная подготовка пациента и наблюдение после операции [16].
Целью данной работы является изучение эффективности различных вариантов оперативных вмешательств при стриктурах уретры.
Малоинвазивные методы оперативного лечения стриктур уретры
К малоинвазивным (в том числе эндоскопическим) методам оперативного лечения стриктур уретры относятся: бужирование уретры, внутренняя оптическая уретротомия, уретральные стенты.
Бужирование уретры. При бужировании уретры происходит пошаговое слепое прогрессивное растяжение и разрыв зоны сужения уретры. При расширении просвета измененной части уретры происходят надрывы эпителиального слоя и рубца, что зачастую приводит к усугублению спонгиофиброза и протяженности стриктуры по сравнению с исходными данными. Перечисленные изменения определяются во время проведения различных вариантов уретропластики. Наблюдаемый эффект будет временным, рецидив стриктуры наступает чаще всего через 4–6 недель [17].
Надо отметить, что бужирование уретры является возможным вариантом лечения больных с тяжелыми сопутствующими патологиями, которым противопоказано проведение других вариантов оперативных методов, таких как внутренняя оптическая уретротомия, установка уретральных стентов, различные варианты уретропластики или проведение анестезиологических пособий [1].
Внутренняя оптическая уретротомия (ВОУТ) — самый распространенный малоинвазивный метод лечения стриктуры мочеиспускательного канала у мужчин. Интраоперационно, под оптическим контролем проводится рассечение рубца на 12, 5 и 7 часах условного циферблата используя «холодный» нож илиэнергию лазера. После проведения ВОУТ часто развивается рецидив, особенно после повторных вмешательств, причиной которого являются расхождения краев стриктуры с последующим их заживлением посредством вторичного натяжения. ВОУТ по сравнению с другими малоинвазивными методами является часто используемым вариантом при лечении непротяженных стриктур уретры ввиду простоты исполнения и быстрой реабилитации.
Эффективность данной методики во многом зависит от строгого соблюдения показаний и противопоказаний для этого метода (протяженности стриктуры, наличия просвета, количества, этиологии, локализации, выраженности спонгиофиброза и других факторов).
При проведении исследований было показано важное прогностическое значение длины стриктуры в отношении риска рецидива. По данным Pansadoro и соавт., показатели анатомической проходимости при длине стриктуры бульбозного отдела уретры <1 и ≥1 см составили 71 и 18 % соответственно (p < 0,001) [18]. В исследовании Al Taweel и соавт. у всех пациентов с длиной стриктуры >1 см развился рецидив, а при стриктурах длиной <1 см частота рецидива составила 27 % (p < 0,001) [19]. В публикации Barbagli и соавт. представлены пятилетние показатели анатомической проходимости уретры при стриктурах длиной 1–2, 2–3 и 3–4 см: 71, 51 и 39 % соответственно (p < 0,00001) [20].
Harraz и соавт. показали, что идиопатические стриктуры являются независимым фактором риска неэффективности ВОУТ (отношение рисков 3,11; p = 0,035), хотя, с другой стороны, во многих других исследованиях этиология стриктур не была достоверным прогностическим фактором [18].
В ходе исследований описаны более высокие показатели анатомической проходимости при стриктурах бульбозного отдела по сравнению с пенильным или пенильно-бульбозным отделом [18][19].
По данным Pansаdoro и соавт. [18] и Al Taweel и соавт. [19], после двух и более неудачных ВОУТ всегда развивается рецидив. Другие авторы подчеркивают, что повторные вмешательства на уретре (ВОУТ и/или бужирование) приводят к увеличению сложности стриктуры и интервала времени до уретропластики [21].
По данным Moynihan и соавт., из-за частых рецидивов за последнее десятилетие количество эндоскопических процедур сократилось [22]. Mariyanovski и соавт. считают, что ранняя уретропластика является разумным решением проблемы стриктур уретры, поскольку осложнений от этой операции немного, а функциональные результаты удовлетворительные [23].
Уретральные стенты используются с целью препятствия рубцовому стягиванию краев раны после проведения малоинвазивных операций — бужирования или ВОУТ. Уретральные стенты бывают металлические и неметаллические. В свою очередь, металлические делятся на постоянные (эпителизирующие): Urolume Wallstent, Memotherm и временные (неэпителизирующие): Urethrospiral, UroCoil, Memokath, Allium. Неметаллические стенты биодеградируемые, покрыты лекарствами [24]. Схематическое расположение стента задней уретры представлено на рисунках 1 и 2.
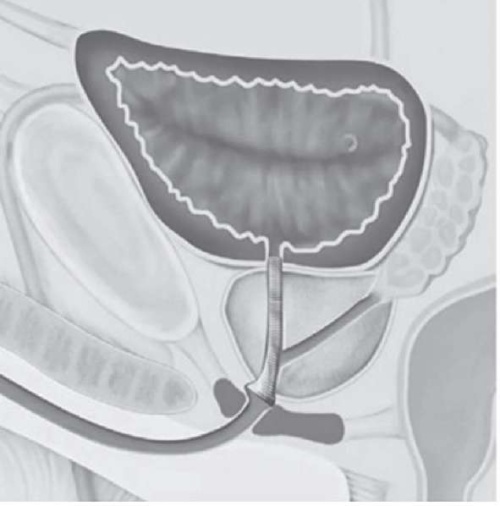
Рисунок 1. Схематическое расположение стента задней уретры
Figure 1. Schematic illustration of posterior urethral stent positioning

Рисунок 2. Рентгенограмма пациента со стентом задней уретры
Figure 2. X-ray of patient with posterior urethral stent
По данным клинических рекомендаций EAU 2022 г., установка уретральных стентов при стриктурах пенильного отдела уретры противопоказана. Установка временного стента при рецидивной стриктуре бульбозного отдела уретры после ВОУТ с целью увеличения интервала времени до следующего рецидива показана только в случаях, когда нельзя выполнить уретропластику. После повторной стриктуры или других осложнений у пациентов с временным уретральным стентом уретропластика является основным методом при лечении [25]. Другие авторы считают, что уретропластика является жизнеспособным вариантом реконструкции с высокой вероятностью успеха [26]. Angulo и соавт. при неэффективности стента рекомендовали проведение уретропластики с удалением стента [27].
Среди вариантов уретропластики выделяют: анастомотические, аугментационные и заместительные (этапная уретропластика).
Анастомотическая уретропластика «конец в конец». При стриктурах бульбозного отдела уретры, особенно травматического генеза, протяженностью не более 3 см методом выбора оперативного лечения является операция — пластика уретры «конец в конец». В литературе встречаются другие названия данной операции: «анастомотическая уретропластика», «резекция уретры с концевым анастомозом», «операция Хольцова», а в иностранных источниках чаще используется термин: excision and primary anastomosis (EPA).
Анастомотическая уретропластика с пересечением спонгиозного тела проводится по следующей методике (этапы оперативного лечения представлены на рисунке 3): пациент укладывается в позу Тренделенбурга. Далее проводится разрез промежности срединным доступом, после рассечения бульбоспонгиозной мышцы выполняется доступ к бульбозному отделу уретры. Затем мобилизуется бульбозный отдел уретры, в уретру вводится уретральный катетер Фолея 20 Ch до дистального отдела стриктуры. Ориентируясь на введенный катетер, уретра поперечно пересекается. После чего пораженный участок уретры резецируется до проксимального конца стриктуры и появления кровоточащей ткани спонгиозного тела. Выполняется спатуляция здоровых краев на протяжении 0,5–1,0 см. Далее выполняется анастомоз между здоровыми концами уретры монофиламентной абсорбируемой нитью, чаще 3/0–4/0, колющей иглой. По вентральной поверхности уретру рекомендуется ушивать в 2 ряда с последующим восстановлением целостности бульбоспонгиозной мышцы и послойным ушиванием раны.
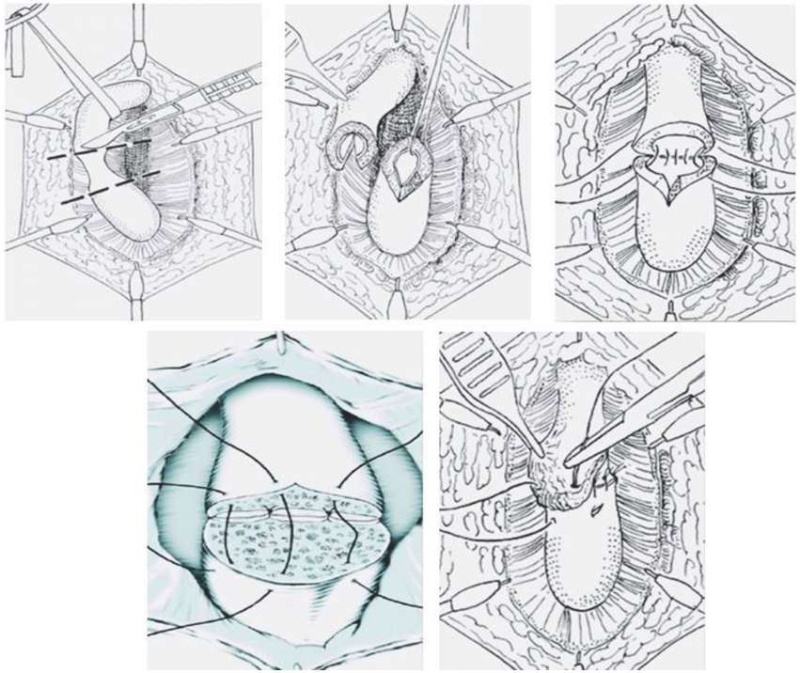
Рисунок 3. Основные этапы анастомотической уретропластики
Figure 3. Main stages of anastomotic urethroplasty
В 2005 году Mundy и соавт. опубликовали методику проведения анастомотической уретропластики, эффективность которой при невоспалительных стриктурах доходила до 95 % [28][29]. По ряду исследований показатели анатомической проходимости после резекции уретры с концевым анастомозом составили 76–97 % [30–35], а в других исследованиях — 85,5–97 % [34][36]. По данным Horiguchi и соавт., показатели анатомической проходимости после анастомотической уретропластики составляют 98,5 % [37].
В 2011 году A. Mandy предложил метод «Анастомотическая уретропластика без пересечения спонгиозного тела». Преимуществами данной методики над стандартной анастомотической уретропластикой являются быстрое заживление за счет сохранения антеградного кровотока по спонгиозному телу в зонеоперации и дистальнее и короткий срок дренирования мочевого пузыря уретральным катетером. Операция проводится по следующей методике (этапы оперативного лечения представлены на рисунке 4): пациент укладывается в позу Тренделенбурга. Далее проводится разрез промежности срединным доступом, после рассечения бульбоспонгиозной мышцы выполняется доступ к бульбозному отделу уретры. Затем мобилизуется бульбозный отдел уретры, в уретру вводится уретральный катетер Фолея размером 20 Ch. Ориентируясь на введенный катетер, уретра продольно рассекается в проксимальном направлении по дорсальной поверхности. Далее иссекается рубцово измененный участок слизистой уретры. Выполняется анастомоз между здоровыми концами слизистой внутри просвета уретры монофиламентной абсорбируемой нитью, чаще 4/0, колющей иглой. Затем по принципу Гейнеке — Микулича, 5–7 швами продольный разрез уретры ушивается поперечно. Для проверки герметичности ретроградно можно использовать раствор индигокармина (4 мг/мл). Далее устанавливается уретральный катетер 14 Сh с последующим восстановлением целостности бульбоспонгиозной мышцы и послойным ушиванием раны. Послеоперационная рана дренируется при необходимости.
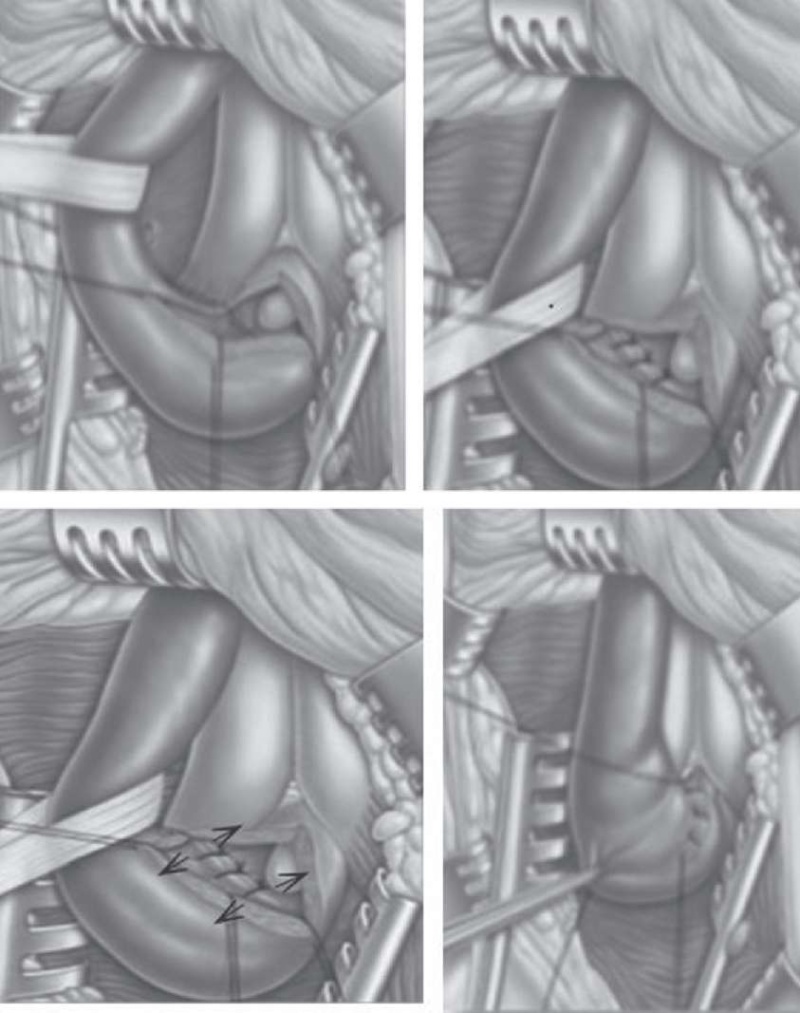
Рисунок 4. Основные этапы анастомотической уретропластики без пересечения спонгиозного тела
Figure 4. Main stages of anastomotic urethroplasty without transection of the corpus spongiosum
Показатели анатомической проходимости после проведения анастомотической уретропластики без пересечения спонгиозного тела при медиане наблюдения от 17,6 до 37,1 месяца составляют 93,2–99,0 % [35].
Аугментационная уретропластика. Увеличительная (аугментационная) уретропластика — операция, при которой просвет уретры увеличивается за счет вставки свободного тканевого лоскута («графт/graft») или участка ткани с сохраненным собственным кровоснабжением («флэп/flap») [1].
Среди аугментационных уретропластик выделяют: 1) использование лоскута на питающей ножке (флэп) — методики Orandi, McAninch, Querty; 2) использование трансплантата (графта): а) без пересечения спонгиозного тела — методики onlay-ventral, dorsal (операция Barbagli), dorso-lateral (операция Kulkarni), операции Аsopa (inlay), Palmintery, Kodama, b) с пересечением спонгиозного тела — аугментационный анастомоз [1].
Операция Orandi на сегодня является одним из наиболее актуальных методов при аугментации пенильного отдела уретры, при котором пенильный кожно-фасциальный лоскут перемещается в вентральную стенку зоны стриктуры уретры. Данная методика является менее популярной по сравнению с дорсальной аугментацией уретры буккальным трансплантатом из-за риска образования послеоперационных свищей. На сегодня операция Kulkarni является наиболее эффективным методом оперативного лечении стриктур уретры. В 2001 году H. S. Asopa предложил метод дорсальной аугментационной уретропластики; в отличие от других методов доступ осуществляется сагиттально через вентральную стенку уретры. Преимущество операций Kulkarni и H. S. Asopa — отсутствие необходимости мобилизации дорсальной части уретры и, как следствие, нарушения сосудистой связи уретры и кавернозного тела. Наиболее актуальным методом при лечении стриктур передней уретры у мужчин является аугментационная уретропластика по Barbagli (dorsal onlay), данную операцию в 2006 г. предложил итальянский ученный Г. Барбали.
Vasudeva и соавт. сравнивали в рамках РКИ вентральную (n = 40) и дорсальную (n = 40) уретропластику слизистой щеки. При длительности наблюдения 12 месяцев показатели анатомической проходимости составили 90 и 92,5 % соответственно (p = 0,51) [38]. В нерандомизированных сравнительных исследованиях не выявлено различий в показателях анатомической проходимости между дорсальной и вентральной пластикой «onlay», дорсальной и вентральной пластикой «inlay», дорсальной, вентральной или дорсолатеральной пластикой «onlay». В сериях наблюдений показатели анатомической проходимости длядорсальной и вентральной пластики «onlay» и дорсальной пластики «inlay» составили 62,1–98,3, 74,3–94,4 и 78,4–92 % соответственно. По данным различных авторов, показатели анатомической проходимости по методике Kodama составили 88,2 % [39]. В своем проспективном рандомизированном исследовании в течение 18 месяцев Tyagi и соавт. показали, что эффективность аугментационной уретропластики с использованием слизистой щеки составила 91 % [40]. Современные методы хирургического лечения стриктур и облитераций уретры (как анастомотическая так и увеличительная пластика уретры) являются эффективными и надежными методами [41].
При невозможности выполнения аугментационной уретропластики проводят заместительную (этапную) уретропластику.
На первом этапе пораженный участок уретры иссекается полностью и на его место укладывается слизистая щеки максимальной ширины (операция Брака), либо укладывают кожный сетчатый свободный лоскут (операция Шрейтера), или уретра рассекается вдоль и к ее краям пришиваются кожные края (операция Йохансона). До проведения второго этапа операции мочеиспускание осуществляется через артифициальное отверстие уретры либо через перинеостому. Через 6–9 месяцев проводится второй этап операции — тубуляризация уретральной площадки из приживленного графта, которая замещает пораженный участок уретры [1].
Показатели анатомической проходимости после заместительной уретропластики с использованием слизистой ротовой полости варьируют в пределах 98,6 % [42], в некоторых исследованиях этот показатель составил 71–95 % [43–45].
В задней уретре, простирающейся от шейки мочевого пузыря до мембранозного отдела, сужение просвета обозначается термином «стеноз», поскольку в этом сегменте отсутствует спонгиозная ткань.
Стеноз задней уретры может возникать ятрогенно, в первую очередь как осложнение трансуретрального хирургического лечения доброкачественной гиперплазии предстательной железы и лучевой терапии рака предстательной железы [46][47]. Повреждения уретры, возникающие вследствие перелома костей таза, называют «дистракционный дефект уретры при переломах костей таза (PFUDD)», который представляет собой хорошо описанную травматическую этиологию стеноза задней уретры.
Эффективность уретропластики при дистракционном дефекте уретры зависит от протяженности стриктуры, а точнее, от интраоперационных возможностей ликвидировать натяжение между проксимальными и дистальными отделами уретры и удалить рубцовые ткани. Приемы Webster являются наиболее эффективным методом при лечении дистракционного дефекта уретры. Техника проведения приемов Webster заключается в следующем (основные этапы анастомотической уретропластики по Webster представлены на рисунке 5): доступ осуществляется аналогично анастомотической уретропластике. При значительных рубцовых изменениях уретры и образовании протяженного дефекта между свободными концами уретры используются 4 приема: мобилизация бульбозного отдела уретры в дистальном направлении до пеноскротального угла, рассечение межкавернозной перегородки, латеральное разведение ножек кавернозных тел и рерутинг.
Эффективность уретропластики при дистракционном дефекте уретры в различных работах варьирует в пределах 94 %, что является хирургическим успехом в реконструктивной урологии [48].
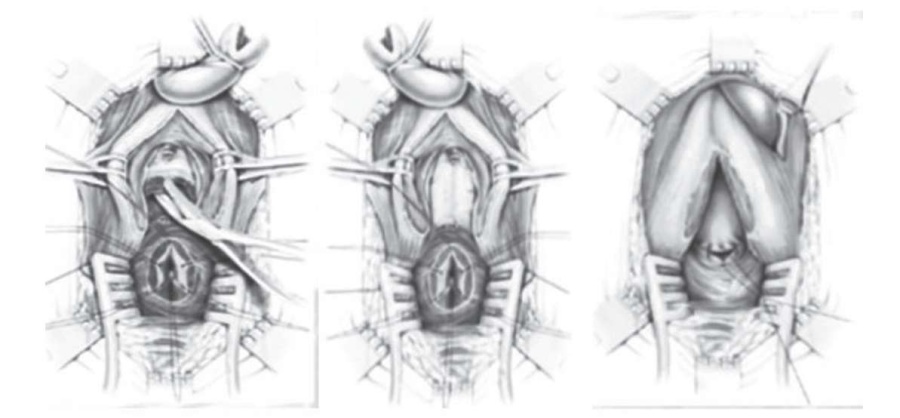
Рисунок 5. Основные этапы анастомотической уретропластики по Webster
Figure 5. Main stages of anastomotic urethroplasty, according to Webster
ЗАКЛЮЧЕНИЕ
На сегодняшний день хирургические методы лечения стриктур уретры являются методами, которые позволяют с большей вероятностью избавить пациента от данного заболевания. Оптическая уретротомия, бужирование уретры при подкупающей простоте выполнения чаще всего являются методами временного облегчения и способствуют прогрессированию процесса рубцевания уретры. Лишь строгое соблюдение рекомендаций по выбору метода лечения, сосредоточение пациентов в экспертных центрах оказания медицинской помощи позволяют надеяться на выздоровление пациента, но даже при этом остается высокий процент рецидивов, что требует проведения дальнейших исследований, направленных на улучшение результатов.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Funding. This work is not funded.
Список литературы
1. Котов С.В. Стриктуры уретры у мужчин. Выбор метода уретропластики. М.: АБВ-пресс; 2018.
2. Коган М.И., Котов С.В., Живов А.В., Митусов В.В., Глухов В.П., Ирицян М.М. Клинические рекомендации. Стриктура уретры (утв. Минздравом России). М.; 2020.
3. Коган М.И. Стриктуры уретры у мужчин: реконструктивновосстановительная хирургия: иллюстрированное руководство. М.: Практическая медицина; 2010.
4. Verla W., Oosterlinck W., Spinoit A.F., Waterloos M. A Comprehensive review emphasizing anatomy, etiology, diagnosis, and treatment of male urethral stricture disease. Biomed Res Int. 2019;2019:9046430. DOI: 10.1155/2019/9046430
5. Liaw A., Rickborn L., McClung C. Incidence of urethral stricture in patients with adult acquired buried penis. Adv Urol. 2017;2017:7056173. DOI: 10.1155/2017/7056173
6. Favre G., Gil S., Carminatti T., Tobia I., Giudice C., Giudice C. Predictors of complex urethral surgery in anterior urethral stricture disease. Arch Esp Urol. 2021;74(6):547–53. PMID: 34219056
7. Santucci R.A. Urethral complications after transgender phalloplasty: strategies to treat them and minimize their occurrence. Clin Anat. 2018;31(2):187–90. DOI: 10.1002/ca.23021
8. Robine E., Rigaud J., Luyckx F., Le Clerc Q.C., Madec F.X., Bouchot O., et al. Analysis of success rates of uretroplasty for adult male bulbar urethral stricture: A systematic review. Prog Urol. 2017;27(2):49–57. DOI: 10.1016/j.purol.2016.12.003
9. Davis N.F., Bhatt N.R., MacCraith E., Flood H.D., Mooney R., Leonard G., et al. Long-term outcomes of urethral catheterisation injuries: a prospective multi-institutional study. World J Urol. 2020;38(2):473–80. DOI: 10.1007/s00345-019-02775-x
10. Cotter K.J., Hahn A.E., Voelzke B.B., Myers J.B., Smith T.G. 3rd, Elliott S.P., et al. Trends in urethral stricture disease etiology and urethroplasty technique from a multi-institutional surgical outcomes research group. Urology. 2019;130:167–74. DOI: 10.1016/j.urology.2019.01.046
11. Falcone M., Garaffa G., Castiglione F., Ralph D.J. Current management of penile fracture: an up-to-date systematic review. Sex Med Rev. 2018;6(2):253–60. DOI: 10.1016/j.sxmr.2017.07.009
12. Barratt R.C., Bernard J., Mundy A.R., Greenwell T.J. Pelvic fracture urethral injury in males-mechanisms of injury, management options and outcomes. Transl Androl Urol. 2018;7(Suppl 1):S29–62. DOI: 10.21037/tau.2017.12.35
13. Abdeen B.M., Badreldin A.M. Urethral strictures. 2022 Oct 17. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan. PMID: 33231967
14. Казихинуров А.А., Казихинуров Р.А., Сафиуллин Р.И., Загидуллин А.А., Ишемгулов Р.Р., Мустафин А.Т., Насибуллин И.М. Расстройства и методы коррекции микроциркуляции при заболеваниях нижних мочевыводящих путей. Медицинский вестник Башкортостана. 2010;5(5):94–8.
15. Alsagheer G.A., Fathi A., Abdel-Kader M.S., Hasan A.M., Mohamed O., Mahmoud O., et al. Management of long segment anterior urethral stricture (≥8 cm) using buccal mucosal (BM) graft and penile skin (PS) flap: outcome and predictors of failure. Int Braz J Urol. 2018;44(1):163–71. DOI: 10.1590/S1677-5538.IBJU.2017.0083
16. Campos-Juanatey F., Osman N.I., Greenwell T., Martins F.E., Riechardt S., Waterloos M., et al. European association of urology guidelines on urethral stricture disease (part 2): diagnosis, perioperative management, and follow-up in males. Eur Urol. 2021;80(2):201–12. DOI: 10.1016/j.eururo.2021.05.032
17. Ivaz S.L., Veeratterapillay R., Jackson M.J., Harding C.K., Dorkin T.J., Andrich D.E., et al. Intermittent self-dilatation for urethral stricture disease in males: A systematic review and meta-analysis. Neurourol Urodyn. 2016;35(7):759–63. DOI: 10.1002/nau.22803
18. Pansadoro V., Emiliozzi P. Internal urethrotomy in the management of anterior urethral strictures: long-term followup. J Urol. 1996;156(1):73–5. PMID: 8648841
19. Al Taweel W., Seyam R. Visual internal urethrotomy for adult male urethral stricture has poor long-term results. Adv Urol. 2015;2015:656459. DOI: 10.1155/2015/656459
20. Barbagli G., Fossati N., Montorsi F., Balò S., Rimondi C., Larcher A., et al. Focus on internal urethrotomy as primary treatment for untreated bulbar urethral strictures: results from a multivariable analysis. Eur Urol Focus. 2020;6(1):164–9. DOI: 10.1016/j.euf.2018.10.014
21. Horiguchi A., Shinchi M., Masunaga A., Ito K., Asano T., Azuma R. Do transurethral treatments increase the complexity of urethral strictures? J Urol. 2018;199(2):508–14. DOI: 10.1016/j.juro.2017.08.100
22. Moynihan M.J., Voelzke B., Myers J., Breyer B.N., Erickson B., Elliott S.P., et al. Endoscopic treatments prior to urethroplasty: trends in management of urethral stricture disease. BMC Urol. 2020;20(1):68. DOI: 10.1186/s12894-020-00638-x
23. Mariyanovski V., Dorosiev E., Mladenov B. Surgical treatment of urethral stricture disease — the earlier, the better. Folia Med (Plovdiv). 2021;63(4):481–7. DOI: 10.3897/folmed.63.e57517
24. Кызласов П.С., Мартов А.Г., Мустафаев А.Т., Казанцев Д.В., Островский Д.В. Применение уретральных стентов при стриктурах уретры. Урология. 2022;4:109–13. DOI: 10.18565/urology.2022.4.109-113
25. Angulo J.C., Pankaj J., Arance I., Kulkarni S. Urethral reconstruction in patients previously treated with Memokath™ urethral endoprosthesis. Actas Urol Esp (Engl Ed). 2019;43(1):26–31. DOI: 10.1016/j.acuro.2018.05.013
26. Pallares-Méndez R., Cota-Agüero J.A., Gutierrez-Gonzalez A., Cervantes-Miranda D.E., Hernández-Aranda K.L., Ochoa-Arvizo M., et al. Risk factors associated with urethral stricture recurrence after end-to-end urethroplasty and buccal mucosal graft urethroplasty. Urologia. 2022;89(2):268–73. DOI: 10.1177/03915603211008739
27. Angulo J.C., Kulkarni S., Pankaj J., Nikolavsky D., Suarez P., Belinky J., et al. Urethroplasty after urethral urolume stent: an international multicenter experience. Urology. 2018;118:213–9. DOI: 10.1016/j. urology.2018.04.031
28. Yenice M.G., Seker K.G., Sam E., Colakoglu Y., Atar F.A., Sahin S., et al. Comparison of cold-knife optical internal urethrotomy and holmium:YAG laser internal urethrotomy in bulbar urethral strictures. Cent European J Urol. 2018;71(1):114–20. DOI: 10.5173/ceju.2017.1391
29. Fuehner C., Dahlem R., Fisch M., Vetterlein M.W. Update on managing anterior urethral strictures. Indian J Urol. 2019;35(2):94–100. DOI: 10.4103/iju.IJU_52_19
30. Akyüz M., Tokuç E., Ozsoy E., Koca O., Kanberoğlu H., Oztürk M., et al. Characteristics of the urethroplasty and our approach-Experience in patients with urethral stricture. Turk J Urol. 2018;45(4):307–11. DOI: 10.5152/tud.2018.68700
31. Barbagli G., Montorsi F., Balò S., Sansalone S., Loreto C., Butnaru D., et al. Treatments of 1242 bulbar urethral strictures: multivariable statistical analysis of results. World J Urol. 2019;37(6):1165–71. DOI: 10.1007/s00345-018-2481-6
32. Ekerhult T.O., Lindqvist K., Grenabo L., Kåbjörn Gustafsson C., Peeker R. Sclerosis as a predictive factor for failure after bulbar urethroplasty: a prospective single-centre study. Scand J Urol. 2018;52(4):302–8. DOI: 10.1080/21681805.2018.1505945
33. Kahokehr A.A., Granieri M.A., Webster G.D., Peterson A.C. A critical analysis of bulbar urethroplasty stricture recurrence: characteristics and management. J Urol. 2018;200(6):1302–7. DOI: 10.1016/j.juro.2018.07.036
34. Sawant A.S., Savalia A.J., Pawar P.W., Patil S.R., Kasat G.V., Narwade S., et al. An audit of urethroplasty techniques used for managing anterior urethral strictures at a tertiary care teaching institute-what we learned. J Clin Diagn Res. 2018;12(2):17–21. DOI: 10.7860/ JCDR/2018/31367.11202
35. Waterloos M., Verla W., Oosterlinck W., François P., Lumen N. Excision and primary anastomosis for short bulbar strictures: is it safe to change from the transecting towards the nontransecting technique? Biomed Res Int. 2018;2018:3050537. DOI: 10.1155/2018/3050537
36. Chapman D.W., Cotter K., Johnsen N.V., Patel S., Kinnaird A., Erickson B.A., et al. Nontransecting techniques reduce sexual dysfunction after anastomotic bulbar urethroplasty: results of a multi-institutional comparative analysis. J Urol. 2019;201(2):364–70. DOI: 10.1016/j.juro.2018.09.051
37. Horiguchi A., Shinchi M., Ojima K., Arai Y., Hatanaka M., Ito K., et al. Surgical and patient-reported outcomes of urethroplasty for bulbar stricture due to a straddle injury. World J Urol. 2020;38(7):1805–11. DOI: 10.1007/s00345-019-02971-9
38. Vasudeva P., Nanda B., Kumar A., Kumar N., Singh H., Kumar R. Dorsal versus ventral onlay buccal mucosal graft urethroplasty for longsegment bulbar urethral stricture: A prospective randomized study. Int J Urol. 2015;22(10):967–71. DOI: 10.1111/iju.12859
39. Котов С.В., Беломицев С.В., Гуспанов Р.И., Ирицян М.М., Суренков Д.Н., Семенов М.К. и др. Хирургическая техника и первый клинический опыт аугментационной уретропластики без рассечения губчатого тела (методика КОДАМА). Урология. 2018;5:39–44. DOI: 10.18565/urology.2018.5.39-44
40. Tyagi S., Parmar K.M., Singh S.K., Sharma A., Shukla M., Sharma A.P., et al. 'Pee'BuSt Trial: A single-centre prospective randomized study comparing functional and anatomic outcomes after augmentation urethroplasty with penile skin graft versus buccal mucosa graft for anterior urethral stricture disease. World J Urol. 2022;40(2):475–81. DOI: 10.1007/s00345-021-03843-x
41. Павлов В.Н., Казихинуров Р.А., Казихинуров А.А., Сафиуллин Р.И., Пушкарев А.М., Загитов А.Р. и др. Результаты хирургического лечения пациентов с посттравматическими и воспалительными стриктурами и облитерациями уретры. Медицинский вестник Башкортостана. 2020;15(5(89)):9–12.
42. Коган М.И., Глухов В.П., Митусов В.В., Красулин В.В., Ильяш А.В. Сравнительный анализ однои двухэтапной аугментационной дорсальной INLAY-пластики буккальным графтом протяженных стриктур спонгиозной уретры. Урология. 2018;1:84–90. DOI: 10.18565/urol.2018.1.84-90
43. Wu M., Chen F., Xie H., Lv Y., Huang Y., Liu Y., et al. Management of failed hypospadias: choosing the right method and achieving optimal results. Int Urol Nephrol. 2018;50(10):1795–800. DOI: 10.1007/s11255018-1962-2
44. Morrison C.D., Cinà D.P., Gonzalez C.M., Hofer M.D. Surgical approaches and long-term outcomes in adults with complex reoperative hypospadias repair. J Urol. 2018;199(5):1296–301. DOI: 10.1016/j.juro.2017.11.078
45. Aldamanhori R.B., Osman N.I., Inman R.D., Chapple C.R. Contemporary outcomes of hypospadias retrieval surgery in adults. BJU Int. 2018;122(4):673–9. DOI: 10.1111/bju.14355
46. Angulo J.C., Gómez R.G., Nikolavsky D. Reconstruction of membranous urethral strictures. Curr Urol Rep. 2018;19(6):37. DOI: 10.1007/s11934-018-0786-z
47. Bandini M., Yepes C., Joshi P.M., Basile G., Naranjo D., Bhadranavar S., et al. Which are the commonest sites and characteristics of post-transurethral prostate surgery strictures in a high-volume reconstructive center? J Endourol. 2022;36(10):1309–16. DOI: 10.1089/end.2022.0130
48. Rahman M.A., Haque M.E., Panna L.K., Asif M.S. Oral mucosal graft augmented anastomotic urethroplasty for post traumatic urethral stricture and distraction defect: outcome in 100 patients. Mymensingh Med J. 2020;29(3):516–22. PMID: 32844788
Об авторах
Р. А. КазихинуровРоссия
Казихинуров Рустем Альфредович — к.м.н., доцент, кафедра урологии с курсом ИДПО
Республика Башкортостан, Уфа
Б. И. Шамсов
Россия
Шамсов Бедил Исуфович — кафедра урологии с курсом ИДПО
Республика Башкортостан, Уфа
А. А. Казихинуров
Россия
Казихинуров Альберт Альфредович — д.м.н., профессор, кафедра урологии с курсом ИДПО
Республика Башкортостан, Уфа
Р. Р. Казихинуров
Россия
Казихинуров Радмир Рустемович — студент 6-го курса
Республика Башкортостан, Уфа
А. И. Хасанов
Россия
Хасанов Азат Ильдарович — урологическое от- деление
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Казихинуров Р.А., Шамсов Б.И., Казихинуров А.А., Казихинуров Р.Р., Хасанов А.И. Стриктура уретры и способы ее коррекции. Креативная хирургия и онкология. 2023;13(1):58-67. https://doi.org/10.24060/2076-3093-2023-13-1-58-67
For citation:
Kazikhinurov R.А., Shamsov B.I., Kazikhinurov A.A., Kazikhinurov R.R., Hasanov A.I. Urethral Stricture and Methods for its Correction. Creative surgery and oncology. 2023;13(1):58-67. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-1-58-67


































