Перейти к:
Атезолизумаб и бевацизумаб у пациентов с гепатоцеллюлярной карциномой в реальной клинической практике
https://doi.org/10.24060/2076-3093-2023-13-2-131-142
Аннотация
Рандомизированные клинические исследования и реальная клиническая практика имеют много различий. Создание новых лекарственных средств во время доказательной медицины основано прежде всего на фармацевтических разработках, проведении доклинических исследований и, самое основное, рандомизированных клинических исследованиях. Гепатоцеллюлярная карцинома является наиболее распространенной первичной злокачественной опухолью печени и одной из ведущих причин смертности среди онкологических пациентов во всем мире с примерным количеством 800 000 смертей ежегодно. Более 10 лет тирозинкиназный ингибитор сорафениб был единственным зарегистрированным средством лечения распространенной гепатоцеллюлярной карциномы. Следующим этапом развития лекарственной терапии гепатоцеллюлярной карциномы явилась терапия ингибиторами контрольных точек иммунитета. Комбинация атезолизумаба с бевацизумабом в исследовании III фазы (IMbrave150) улучшила результаты лечения распространенной гепатоцеллюлярной карциномы, такие как общая выживаемость и выживаемость без прогрессирования (6,8 против 4,3). Приведенные в статье исследования комбинации атезолизумаба и бевацизумаба демонстрируют сопоставимые данные при лечении пациентов с ГЦК в реальной клинической практике и в исследовании III фазы IMbrave150. Проспективные клинические испытания, которые включают разнородные группы пациентов, необходимы для дальнейшего анализа эффективности комбинации атезолизумаба и бевацизумаба.
Ключевые слова
Для цитирования:
Серебренников Г.А., Меньшиков К.В., Султанбаев А.В., Мусин Ш.И., Меньшикова И.А., Султанбаева Н.И., Липатов Д.О., Резяпова А.Ш. Атезолизумаб и бевацизумаб у пациентов с гепатоцеллюлярной карциномой в реальной клинической практике. Креативная хирургия и онкология. 2023;13(2):131-142. https://doi.org/10.24060/2076-3093-2023-13-2-131-142
For citation:
Serebrennikov G.A., Menshikov К.V., Sultanbaev A.V., Musin Sh.I., Menshikova I.A., Sultanbaeva N.I., Lipatov D.O., Rezyapova A.Sh. Atezolizumab and Bevacizumab in Therapy for Patients with Hepatocellular Carcinoma in Real Clinical Practice. Creative surgery and oncology. 2023;13(2):131-142. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-2-131-142
ВВЕДЕНИЕ
Рандомизированные клинические исследования и реальная клиническая практика имеют много различий. Создание новых лекарственных средств во время доказательной медицины основано прежде всего на фармацевтических разработках, проведении доклинических исследований и, самое основное, рандомизированных клинических исследованиях. Хотелось бы отметить прежде всего, что пациенты в рандомизированных клинических исследованиях и те пациенты, которые получают лечение в онкологических учреждениях, совершенно не соответствуют друг другу. Безусловно, рандомизированные клинические исследования важны и необходимы, не следует забывать о сульфаниламидной или талидомидовой трагедиях. Но также не следует забывать и о различиях в когортах пациентов в клинических исследованиях и пациентов, которых мы видим в ежедневной практике.
Гепатоцеллюлярная карцинома (ГЦК) является наиболее распространенной первичной злокачественной опухолью печени и одной из ведущих причин смертности среди онкологических пациентов во всем мире с примерным количеством 800 000 смертей ежегодно [1][2]. ГЦК возникает преимущественно в результате цирроза печени, но также может быть диагностирована у пациентов с хроническим гепатитом В или неалкогольным стеатогепатитом (НАСГ), которые являются причинами метаболических и геномных нарушений [3–5]. Возможности скрининговых программ, передовые диагностические инструменты и методы лечения ГЦК были разработаны за последнее десятилетие, но, к сожалению, такие показатели, как общая выживаемость (ОВ), остаются неудовлетворительными при запущенной стадии или неоперабельной ГЦК.
Многочисленные рандомизированные контролируемые клинические исследования были проведены для оценки эффективности лечения прогрессирующей или метастатической ГЦК [6]. Более 10 лет тирозинкиназный ингибитор сорафениб был единственным зарегистрированным средством лечения распространенной ГЦК. Внедрение сорафениба в качестве стандартного лечения прогрессирующей ГЦК основано на результатах двух рандомизированных исследований III фазы: рандомизированного исследования оценки эффективности сорафениба при распространенной ГЦК (SHARP) и азиатско-тихоокеанского (AP) исследования [7–9]. Вторым препаратом для терапии распространенной ГЦК в первой линии был зарегистрирован ленватиниб. Ленватиниб — пероральный мультикиназный ингибитор, мишенью которого являются рецепторы VEGF 1, 2 и 3, рецепторы FGF 1, 2, 3 и 4, PDGFR-α, RET и с-KIT. 22 сентября 2017 г. препарат зарегистрирован FDA в качестве 1-й линии лечения распространенной ГЦР по результатам опубликованных исследований III фазы. REFLECT — это открытое исследование фазы III по оценке не меньшей эффективности и безопасности ленватиниба (n = 478) по сравнению с сорафенибом (n = 476) при применении в качестве системной терапии первой линии у пациентов с ГЦР [10–16].
Следующим этапом развития лекарственной терапии ГЦК явилась терапия ингибиторами контрольных точек иммунитета. Комбинация атезолизумаба с бевацизумабом в исследовании III фазы (IMbrave150) улучшила результаты лечения распространенной ГЦК, такие как ОВ и выживаемость без прогрессирования (6,8 против 4,3) [17]. Профиль безопасности данной комбинации оказался не хуже, чем в группе сорафениба. Гипертония и протеинурия — типичные побочные эффекты бевацизумаба — входили в тройку самых неблагоприятных нежелательных явлений. Кровотечение из верхних отделов желудочно-кишечного тракта, еще один известный побочный эффект бевацизумаба и основная проблема у пациентов с циррозом печени, возникло у 7 % пациентов в этой группе, что находится в пределах ряда предыдущих исследований по оценке бевацизумаба при ГЦК [18–21].
Обзор исследований реальной клинической практики
Ниже хотелось бы рассмотреть данные реальной клинической практики применения комбинации атезолизумаба с бевацизумабом при распространенной ГЦК.
В исследование, проведенное в Германии, включались пациенты с прогрессирующей ГЦК, которые получали атезолизумаб в дозе 1200 мг плюс бевацизумаб 15 мг/кг массы тела внутривенно каждые 3 недели. Достаточно интересным представляется тот факт, что пациенты распределялись на две группы: соответствующие критериям включения и не включения в регистрационное исследование IMbrave и не соответствующие критериям. Включались пациенты, не подходящие для хирургического лечения и локорегиональной терапии. В период с ноября 2019 по ноябрь 2021 г. в общей сложности 155 пациентов с прогрессирующей ГЦК получали лечение атезолизумабом/бевацизумабом, за исключением одного пациента, который получал только атезолизумаб из-за тяжелой формы гемофилии А с высоким риском кровотечения. Восемь пациентов были исключены из дальнейшего анализа из-за неполных данных о функции печени, которые препятствовали адекватной оценке исходного уровня Чайлд-Пью и/или показателя ALBI. В целом 147 пациентов были включены в окончательный анализ и классифицированы как соответствующие критериям исследования IMbrave (n = 74) или не соответствующие критериям (n = 73). Большинство пациентов были мужчинами (85,0 %), а средний возраст на момент начала лечения составлял 68,7 года (диапазон 30–96 лет). У 116 пациентов (78,9 %) был диагностирован цирроз печени, без существенных различий между обеими подгруппами. У 41 пациента (27,9 %) наблюдалось нарушение функции печени, в то время как стратификация по шкале ALBI выявила прогрессирующую дисфункцию печени (степень ALBI ≈ 2) более чем у половины когорты (n = 96, 65,3 %) [22].
Медиана ОВ для всей когорты составила 10,8 месяца (95 % ДИ 8,2–13,5), а медиана выживаемости без прогрессирования (ВБП) — 5,1 месяца (95 % ДИ 2,6–7,6) (рис. 1 а и б). Пациенты в подгруппе, соответствующей критериям IMbrave, имели значительно более длительную медиану ОВ по сравнению с не соответствующими IMbrave и значительно более длительную медиану ВБП. Рентгенологическая оценка ответа опухоли была доступна для 119 пациентов (81,0 %). Полный ответ был отмечен у 3 пациентов (2,0 %), а у 27 (18,4 %) был частичный ответ, в результате чего частота объективных ответов (ЧОО) составила 20,4 %. Стабилизация заболевания была зарегистрирована у 46 пациентов (31,3 %), в результате чего частота контроля заболевания составила 51,7 %. Прогрессирование заболевания было зарегистрировано у 43 пациентов (29,3 %). Не было выявлено существенных различий по ЧОО и частоте контроля заболевания между подгруппами.
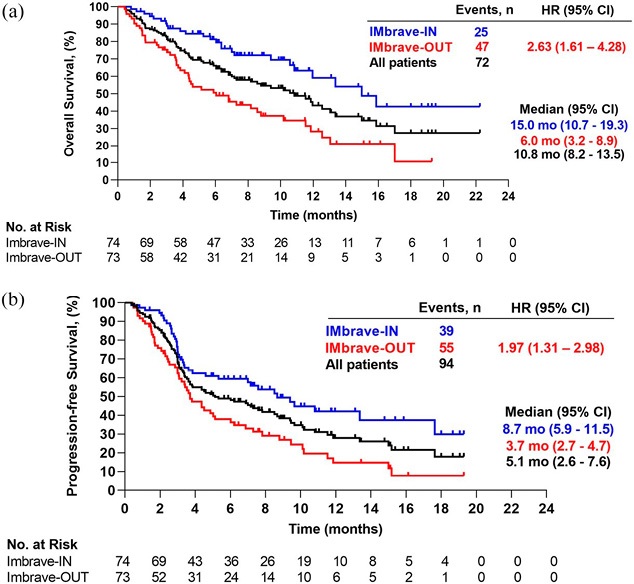
Рисунок 1. Анализ Каплана — Мейера (а) общей выживаемости и (б) выживаемости без прогрессирования у пациентов, получавших атезолизумаб/бевацизумаб в соответствии с критериями IMbrave
Figure 1. Kaplan — Meier estimator of (a) overall survival and (б) progression-free survival in patients treated with atezolizumab/bevacizumab, according to the criteria of IMbrave
Пациенты, рассматриваемые в данном исследовании, соответствовали полностью критериям включения в исследование IMbrave150 и пациенты, которые соответствовали по крайней мере одному основному критерию исключения в исследовании IMbrave150 [22].
Следующее исследование, которое хотелось бы прокомментировать, — японское. В ретроспективном когортном исследовании проведена оценка результатов лечения 399 пациентов с ГЦК, получавших комбинацию атезолизумаба и бевацизумаба с сентября 2020 по декабрь 2021 года. В исследовании приняли участие пациенты из 22 различных учреждений Японии. Были исключены пациенты со статусом Чайлд-Пью классов В или С, пациенты с функциональным статусом по Барселонской классификации (BCLC) стадии A или D (n = 45) и пациенты со статусом работоспособности (PS) ≥ 2 (n = 8). Соответственно, были включены оставшиеся 323 пациента с ГЦК с классом Чайлд-Пью A, стадией B или C BCLC и PS ≤ 1. ГЦК была диагностирована на основании морфологической верификации или на основании рентгенологической визуализации, включая компьютерную томографию и магнитно-резонансную томографию.
Средний возраст всей когорты составил 73 (68,0–79,0) года, при этом около 80 % пациентов были мужчинами. 103 (31,9 %) и 62 (19,2 %) пациента были HCV Ab и HBs-Ag положительными соответственно. Из оставшихся пациентов, не относящихся к категории инфицированных гепатитом В и гепатитом С, 59 (18.3 %), 56 (17.3 %) и 43 (13,3 %) пациента были расценены как страдающие алкогольной болезнью печени, НАЖБП и пациенты без этих факторов риска соответственно. Таким образом, 165 (51,1 %) и 158 (48,9 %) пациентов были отнесены к группам вирусной и невирусной этиологии соответственно. Что касается классификации Чайлд-Пью, то 205 (63,5 %) пациентов имели 5 баллов, а 118 (36,5 %) — 6 баллов соответственно. Средний балл ALBI был рассчитан как –2,47 (от –2,74 до –2,16). Соответственно, 130 (40,2 %) пациентов были классифицированы как mALBI 1, 82 (25,4 %) как mALBI 2a и 111 (34,4 %) как mALBI 2b. Комбинация атезолизумаба и бевацизумаба была в качестве первой линии терапии у 182 (56,3 %) пациентов. Почти половина пациентов (n = 152, 47,1 %) были отнесены к стадии B в соответствии с критериями BCLC. Пациенты с вирусной инфекцией были моложе, имели более низкий индекс массы тела, более низкое количество тромбоцитов, более высокий уровень альбумина, лучший показатель ALBI и лучшую оценку mALBI, чем пациенты с невирусной этиологией. Более того, у пациентов с вирусной ГЦК, как правило, чаще наблюдалась промежуточная стадия BCLC, чем у пациентов с невирусной ГЦК (р = 0,095).
Оценка ответа проводилась по критериям RECIST v. 1.1 и, соответственно, он мог быть полным, частичным ответом, стабилизацией, прогрессией заболевания и поддавался оценке у 4 (3.2 %), 22 (17.5 %), 60 (47.6 %), 21 (16.7 %), и 19 (15,1 %) пациентов с вирусной этиологией и у 3 (2.4 %), 28 (22.2 %), 56 (44.4 %), 24 (19.0 %), и 15 (11,9 %) пациентов с невирусной этиологией соответственно. Объективная частота ответов составила 20,6 и 24,6 % у пациентов с вирусной и невирусной этиологией соответственно, без существенной разницы (р = 0,55). Таким образом, уровень контроля заболевания также не отличался между пациентами с вирусной и невирусной этиологией (68,3 % против 69,0 %, р = 1,00). Средний показатель ВБП составил 7,0 месяца (95 % ДИ 6,0–9,6) у пациентов с вирусной этиологией, тогда как у пациентов с невирусной этиологией этот показатель составил 6,2 месяца (95 % ДИ 5,1–7,8), с ОР 0,96 (95 % ДИ 0,52–1,76) (рис. 2). Никакой существенной разницы между двумя группами обнаружено не было (р = 0,33).
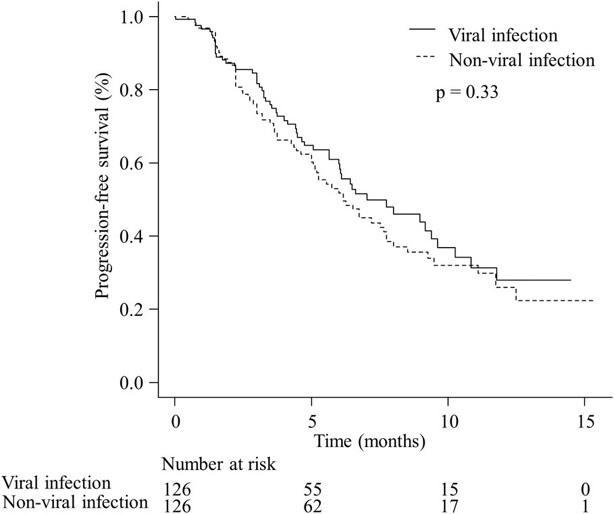
Рисунок 2. Выживаемость без прогрессирования пациентов с вирусной и невирусной этиологией. Медиана ВБП составила 7,0 (95 % ДИ 6,0–9,6) и 6,2 (95 % ДИ 5,1–7,8) месяца у вирусных и невирусных пациентов соответственно, с коэффициентом риска 0,96 (95 % ДИ 0,52–1,76). Достоверных различий между двумя группами не отмечено (р = 0,33) [23]
Figure 2. Progression-free survival in patients with viral and non-viral etiologies. Median PFS was 7.0 months (95 % confidence interval, CI [ДИ] 6.0–9.6) and 6.2 months (95 % CI 5.1–7.8) in viral and non-viral patients, respectively, with a risk ratio of 0.96 (95 % CI 0.52–1.76). No significant differences were revealed between two groups (p = 0.33) [23]
После окончания лечения комбинацией атезолизумаба и бевацизумаба 38 (70,4 %) и 56 (78,9 %) пациентов с вирусной и невирусной этиологией получали последующую линию терапии. При анализе ОВ за время наблюдения было зарегистрировано 44 случая смерти (17,5 %). Медиана ОВ не была достигнута в обеих группах. ОВ на этапе 3, 6 и 12 месяцев составила 97,4 % (95 % ДИ 92,2–99,2 %), 88,8 % (95 % ДИ 80,6–93,7 %) и 65,5 % (95 % ДИ 50,8–76,8 %) у пациентов с вирусной этиологией и 97,3 % (95 % ДИ 92,0–99,1 %), 91,1 % (95 % ДИ 83,5–95,3 %) и 71,7 % (95 % ДИ 57,3–81,9 %) у пациентов с невирусной этиологией заболевания соответственно [23].
В этом исследовании проведено сравнение между пациентами с вирусной и невирусной этиологией заболевания, выявлено, что пациенты с вирусной инфекцией были значительно моложе, с лучшей функцией печени, чем пациенты с невирусной этиологией. Кроме того, у пациентов с ГЦК, связанной с вирусной этиологией, как правило, была более высокая частота запущенной стадии по BCLC, чем у пациентов с невирусной этиологией. Также проведено исследование показателей ВБП и ОВ у пациентов, получавших комбинацию атезолизумаба и бевацизумаба в первой линии терапии и последующих линий. Проведено сравнение ОВ и ВБП в группах, отличающихся этиологией заболевания; существенной разницы обнаружено не было. Полученные реальные данные в ранее опубликованных исследованиях показали, что этиология ГЦК не влияла на клинический исход применения сорафениба [24]. Что касается ленватиниба, вопрос о том, повлияла ли этиология ГЦК на терапевтический исход, остается спорным. В двух реальных исследованиях сообщалось, что этиология заболевания не связана с ОВ, в то время как еще два исследования показали, что общая выживаемость лучше у пациентов с невирусной этиологией, чем у пациентов с ГЦК, связанной и инфекционным гепатитом [25–28].
Следующее исследование посвящено пациентам пожилого возраста. Оно представляло собой ретроспективное исследование, проведенное в Японии. Были включены 317 пациентов с неоперабельной ГЦК, которые получали комбинацию атезолизумаба и бевацизумаба в период с сентября 2020 по октябрь 2021 г. в 20 учреждениях Японии. В этом исследовании «пожилые пациенты» определялись как люди в возрасте ≥75 лет. Что касается этиологии ГЦК, то у пациентов, у которых был обнаружен поверхностный антиген вируса гепатита В, заболевание рассматривали как ГЦК, вызванная вирусом гепатита В; у пациентов, у которых были обнаружены антитела к вирусу гепатита С, был диагностирован соответствующий вариант ГЦК. Функцию печени оценивали с использованием системы Чайлд-Пью [29].
Среди 317 пациентов, включенных в исследование, было 59 (18,6 %) женщин и 258 (81,4 %) мужчин. Средний возраст составил 74,0 (68,0–80,0) года. Среди них было 143 (45,1 %) пожилых человека и 174 (54,9 %) пациента более молодого возраста. Включены 299 (94,3 %) пациентов с классом по Чайлд-Пью А, 17 (5,4 %) пациентов с классом В и 1 (0,3 %) пациент с классом С. В начале терапии комбинацией атезолизумаба и бевацизумаба было 26 (8,2 %), 129 (40.7 %), 158 (49.8 %), и 4 (1,3 %) пациента со стадией заболевания по BCLC A, B, C и D ГЦК соответственно. Средний период наблюдения составил 5,7 (3,0–8,5) месяца.
На рисунке 3 А показана кумулятивная кривая ОВ у пациентов этого исследования. Совокупные показатели общей выживаемости за 3, 6 и 9 месяцев составили 96,0, 89,7 и 81,9 % соответственно. На рисунке 3B показаны совокупные кривые ОВ, стратифицированные по статусу пожилого человека. Не было выявлено существенных различий в кумулятивных кривых ОВ в зависимости от пожилого статуса (р = 0,735). На рисунке 3С показана кумулятивная кривая ВБП у исследуемых пациентов. Совокупная 3-и 6-месячная ВБП составила 75,6 и 52,7 % соответственно. На рисунке 3D показаны кумулятивные кривые ВБП, стратифицированные по пожилым пациентам. Не было выявлено существенных различий в кривых кумулятивной ВБП в зависимости от пожилого статуса (р = 0,368 [30]).
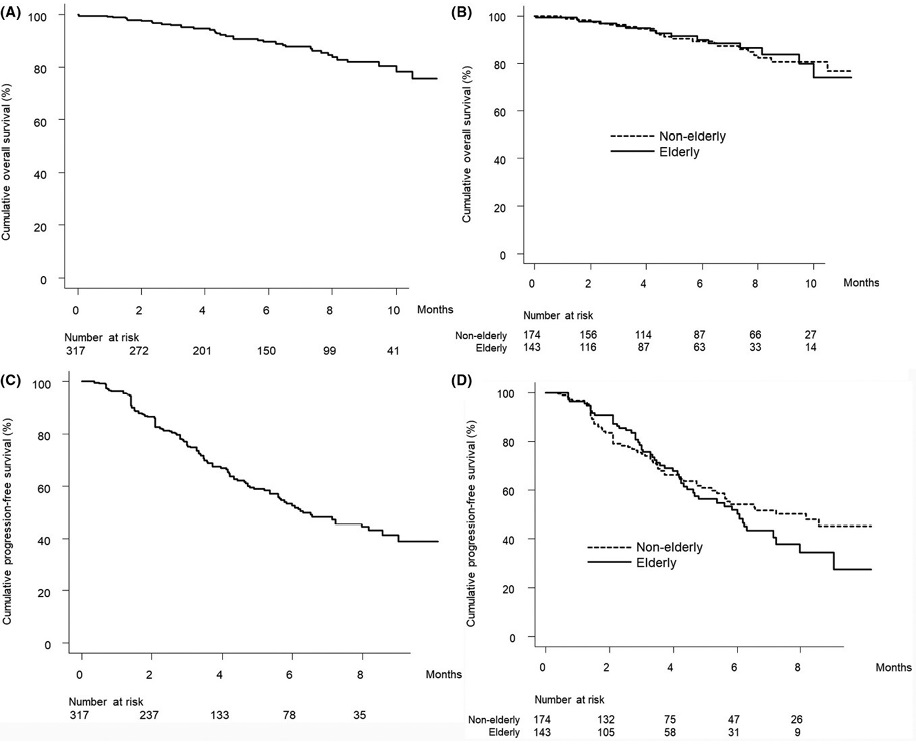
Рисунок 3. Результат ретроспективного исследования комбинации атезолизумаба и бевацизумаба в реальной клинической практике у пациентов с ГЦК: А — совокупная ОВ через 3, 6 и 9 месяцев составила 96,0, 89,7 и 81,9 % соответственно; B — общая выживаемость, стратифицированная по статусу пожилого человека, совокупная ОВ через 3, 6 и 9 месяцев составила 95,8, 90,0 и 83,9 % среди пациентов пожилого возраста (сплошная линия) и 96,2, 89,5 и 80,8 % среди пациентов немолодого возраста (пунктирная линия) соответственно (р = 0,735); C — совокупная ВБП через 3 и 6 месяцев составила 75,6 и 52,7 % соответственно; D — ВБП, стратифицированная по статусу пожилого человека, совокупная ВБП через 3 и 6 месяцев составила 76,6 и 50,3 % среди пациентов пожилого возраста (сплошная линия) и 74,8 и 54,2 % среди пациентов немолодого возраста (пунктирная линия) соответственно (р = 0,368) [30]
Figure 3. Results of a retrospective study of atezolizumab and bevacizumab combination in patients with HCC in real clinical practice: A — cumulative OS in 3, 6 and 9 months was 96.0, 89.7 and 81.9 %, respectively; B — overall survival stratified by elderly status, cumulative OS in 3, 6 and 9 months was 95.8, 90.0 and 83.9 % among elderly patients (solid line) and 96.2, 89.5, 80.8 % among middle-aged patients (dotted line), respectively (p = 0.735); C — cumulative PFS in 3 and 6 months was 75.6 and 52.7 %, respectively; D — PFS stratified by elderly status, cumulative PFS in 3 and 6 months was 76.6 and 50.3 % among elderly patients (solid line) and 74.8 и 54.2 % among mature patients (dotted line), respectively (p = 0.368) [30]
Общая частота ответов и контроль за заболеванием составили 26,1 и 81,8 % соответственно. Не было выявлено существенных различий в частоте ответов на терапию между группами пожилых и более молодых пациентов. В этом многоцентровом исследовании с большим числом пациентов с неоперабельной ГЦК на терапии комбинацией атезолизумаба и бевацизумаба не было выявлено существенных различий в частоте нежелательных явлений между группами пожилых и более молодых пациентов. В проведенном анализе в группе пожилых людей не было выявлено существенных различий в побочных явлениях, связанных с лечением, за исключением протеинурии любой степени тяжести. Эти результаты исследований свидетельствуют о том, что комбинация атезолизумаба и бевацизумаба может эффективно и безопасно применяться, несмотря на возраст, у пациентов с неоперабельной ГЦК.
В период с 1990 по 2015 год заболеваемость раком печени увеличилась на 75 % по всему миру [31]. Эта динамика, по-видимому, отражает изменения в возрастном распределении населения, росте численности населения, стандартизированных по возрасту показателях заболеваемости и этиологических факторов [32]. В течение этого периода наблюдалось значительное увеличение стандартизированной по возрасту заболеваемости ГЦК, вызванной вирусом гепатита С (+15,7 %), в то время как случаи ГЦК, связанной с гепатитом В, значительно снизились (-18,9 %), и не наблюдалось существенных изменений для доли случаев ГЦК, связанных с алкогольной болезнью печени (+13,5 %) или с другими факторами (-12,3 %) [32]. Авторы оценили изменения в характеристиках пациентов за 30-летний период, используя клинические данные 2347 пациентов на момент первоначального диагноза ГЦК. В их исследовании возраст на момент диагностики ГЦК в периоды 1990–1994, 1995–1999, 2000–2004, 2005–2009, 2010–2014 и 2015–2018 годов значительно возрос: 63 (57–59), 65 (60–70), 68 (62–74), 70 (63–76), 72 (65–78) и 74 (67–80) года соответственно (р < 0,001) [33].
Следующее исследование, посвященное реальной клинической практике при неоперабельной ГЦК, также проведено в Японии. В нем ретроспективно оценивался 61 пациент с неоперабельной ГЦК, которые получали лечение атезолизумабом и бевацизумабом в период с ноября 2020 по март 2021 года в четырех независимых учреждениях в Японии. Использовались следующие критерии включения: ГЦК, диагностированный путем рентгенологического обследования с использованием компьютерной томографии или магнитно-резонансной томографии в сочетании с анализами сыворотки крови на опухолевые маркеры; возраст > 18 лет; и возможность наблюдения за пациентом от начала терапии до наступления смерти или времени сбора данных в этом исследовании (31 апреля 2021 года). Из медицинских карт зарегистрированных пациентов информация о пациенте включала пол, возраст, этиологию ГЦК, класс по Чайлд-Пью, уровень альфа-фетопротеина (АФП), Des-гамма-карбоксипротромбин, размер опухоли и данные анамнеза. ГЦК была классифицирована с использованием BCLC и TNM Японской исследовательской группы по изучению рака печени. Дополнительно уровень ALBI рассчитывали на основе значений сывороточного альбумина и общего билирубина по следующей формуле: [показатель ALBI = (log10 билирубин (мкмоль/л) × 0,66 + (альбумин (г/л) × –0,085)] и определяли по следующим показателям: ≤-2,60 = Класс 1, от > –2,60 до ≤ –1,39 = класс 2, >-1,39 = класс 3 [34].
В общей сложности 61 пациенту в течение периода исследования вводили атезолизумаб и бевацизумаб. Среди них 4 пациента были исключены из-за короткого периода наблюдения, а 6 пациентам не проведено первое рентгенологическое обследование. Наконец, 51 пациент был проанализирован на предмет эффекта и нежелательных явлений. Средний период наблюдения у всех пациентов после начала терапии атезолизумабом в комбинации с бевацизумабом составил 87 (26–168) дней. Средний возраст составил 71 год (37–85), и 6 пациентов были женского пола. Этиология ГЦК не была связана с вирусной инфекцией гепатитом В или С у 24 % (n = 25) пациентов. Чайлд-Пью класса A и B наблюдался у 47 и 4 пациентов соответственно. ALBI 1, 2 и 3-й степени наблюдался у 11, 39 и 1 пациента соответственно. Что касается характеристик опухоли, средний размер опухоли составлял 40 мм (11–132 мм). По BCLC стадии B и C были 24 и 27 пациентов соответственно. Средний уровень альфа-фетопротеина составил 58 нг/мл (1,3–862 642 нг/мл). Средний уровень Des-гамма-карбоксипротромбина составил 1288 mAU/mL (18–87,529 mAU/mL). Что касается предыдущих линий терапии, то 62,7 % пациентов (n = 32) ранее получали лечение. Среди пациентов, получавших терапию, 22, 6 и 4 пациента получали лечение второй, третьей и четвертой линий соответственно [35].
При оценке с использованием критериев RECIST полный и частичный ответ наблюдались у 4 (7,8 %) и 14 пациентов (27,5 %) соответственно. ЧОО составила 35,3 %, стабилизация заболевания наблюдалась у 24 пациентов (51 %), а прогрессия — у 7 пациентов (13,7 %). Частота контроля за заболеванием составила 86,3 %. Данные по ВБП и ЧОО представлены на рисунке 4.
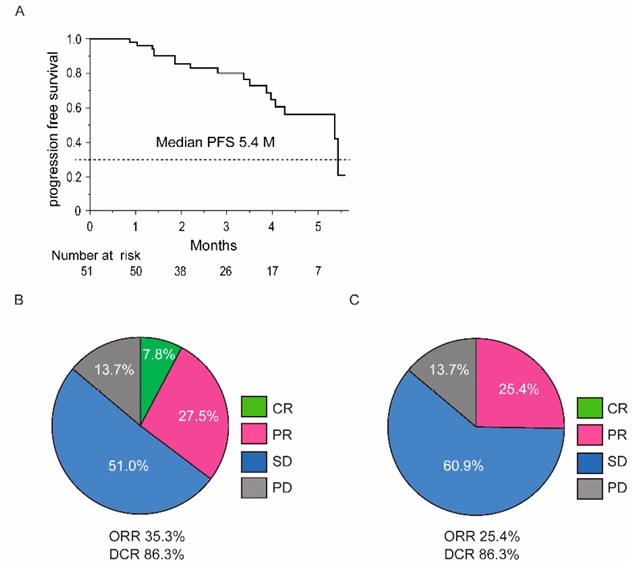
Рисунок 4. ВБП и частота объективных ответов: А — кривая ВБП пациентов, получавших атезолизумаб и бевацизумаб, медиана ВБП составила 5,4 месяца; B — частота объективных ответов с использованием модифицированных критериев RECIST; C — частота объективных ответов по RECIST [35]
Figure 4. PFS and objective response rate: A — PFS curve of patients treated with atezolizumab and bevacizumab, median PFS was 5.4 months; B — objective response rate using modified RECIST criteria; C — RECIST objective response rate [35]
Приведенное выше исследование продемонстрировало первый опыт применения атезолизумаба в сочетании с бевацизумабом у пациентов с неоперабельной ГЦК в реальной клинической практике. Атезолизумаб и бевацизумаб можно безопасно назначать даже пациентам, перенесшим ранее таргетную терапию. В этом исследовании проведено сравнение эффективности и безопасности комбинации атезолизумаба и бевацизумаба, особенно с учетом ранее проведенной таргетной терапии или нарушения функции печени. Не было выявлено существенных различий между этими группами в ЧОО и безопасности.
ГЦК — это одно из самых частых злокачественных первичных новообразований печени, являющееся ведущей причиной смерти от рака [1]. Иммунотерапия достаточно эффективна и имеет удовлетворительный профиль безопасности у пациентов с прогрессирующей ГЦК. Однако из-за формально отрицательных данных III фазы исследований такие препараты, как ниволумаб и пембролизумаб, не были одобрены в Европе [36][37]. Исследование IMbrave150 продемонстрировало, что комбинированная терапия атезолизумабом и бевацизумабом более эффективна по сравнению с лечением с сорафенибом в III фазе клинического исследования. Исследование достигло общих конечных точек: улучшение ОВ и ВБП, а также продемонстрировало благоприятное качество жизни в группе иммунотерапии [38–40]. Основываясь на этих результатах, атезолизумаб и бевацизумаб стали новым стандартом лечения распространенной ГЦК.
В ретроспективном исследовании, проведенном в Германии у пациентов, получавших атезолизумаб и бевацизумаб в качестве терапии первой линии для пациентов с подтвержденной ГЦК, получены интересные данные. Электронные больничные карты были ретроспективно проанализированы на предмет базовых демографических данных, результатов лабораторных исследований. Рентгенологический ответ регистрировали с помощью компьютерной томографии или магнитно-резонансной томографии в начале исследования, через 6–12 недель после начала лечения и примерно через 2–3 месяца после этого в соответствии с местными рекомендациями. Ответ опухоли оценивали в соответствии с Критериями оценки ответа в солидных опухолях (RECIST) V1.1 или модифицированными RECIST. Побочные эффекты регистрировались при каждом посещении и оценивались в соответствии с CTCAE версия 4.0 или 5.0 в зависимости от предпочтений центра [41–44].
При последней оценке результатов 51 пациент (77 %) прекратил лечение атезолизумабом и бевацизумабом. 13 пациентов (20 %) продолжали лечение, а 2 пациента (3 %) выбыли из статистического анализа. Среднее время лечения составило 110 дней (+995 дней, 33 месяца). Среднее количество циклов, проведенных пациентам, составило 21. В целом 52 пациента (79 %) имели по крайней мере одну последующую визуализацию для оценки ответа опухоли. Лучшие ответы включали полный ответ у 7 пациентов (11 %), частичный ответ у 12 пациентов (18 %), стабилизацию заболевания у 22 пациентов (33 %) и прогрессирование у 11 пациентов (17 %). Медиана ВБП составила 6,5 месяца (95 % ДИ 4,0–9,1 месяца) (рис. 5) [45].
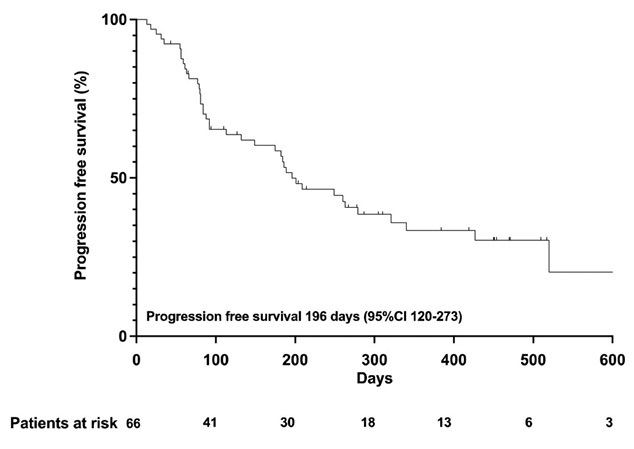
Рисунок 5. ВБП в исследовании на фоне терапии атезолизумабом и бевацизумабом [45]
Figure 5. PFS in atezolizumab and bevacizumab therapy [45]
У пациентов с ГЦК вследствие вирусного гепатита показатель ВБП был более благоприятным (медиана ВБП 17,3 месяца, 95 % ДИ 5,6–29,0 месяца), чем у пациентов без вирусной этиологии (медиана ВБП 6,1 месяца, 95 % ДИ 3,1–8,9 месяца). Медиана общей выживаемости (ОВ) в когорте ГЦК вирусной этиологии не была достигнута (6-месячная ОВ — 69 %, 12-месячная ОВ — 60 %, 18-месячная ОВ — 58 %) (рис. 6).
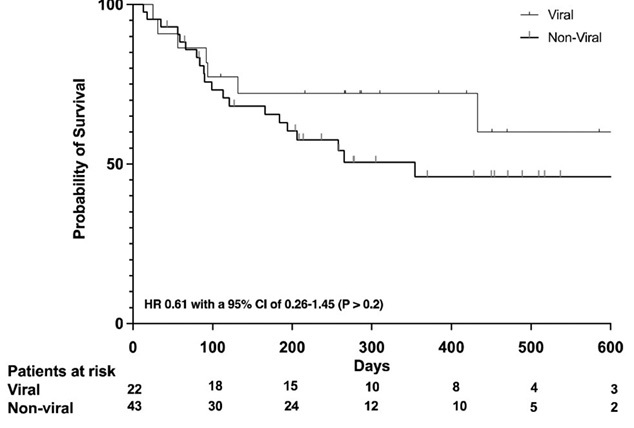
Рисунок 6. Общая выживаемость в зависимости от этиологии ГЦК [45]
Figure 6. Overall survival depending on etiology of HCC [45]
Известные предикторы выживаемости пациентов с ГЦК включают функцию печени и уровень АФП. Такие факторы, как пол, возраст (≤65 лет против >65 лет), вирусная инфекция, стадия BCLC, уровни АФП (≤400 нг/мл против >400 нг/мл), показатель альбумин-билирубина (ALBI), класс по шкале Чайлд-Пью, внепеченочное распространение и предшествующая терапия, были включены в анализ. В этом исследовании комбинация атезолизумаба и бевацизумаба в реальной клинической практике продемонстрировала медиану ВБП в 6,5 месяца, что было аналогично данным исследования III фазы. Кроме того, 12-месячная выживаемость у пациентов с компенсированным состоянием печени была даже лучше, чем у пациентов в регистрационном исследовании (78 % против 67 %). Подгруппа больных с вирусным гепатитом, а именно гепатитом В или гепатитом С, имела более благоприятный прогноз, чем у пациентов без истории вирусного гепатита в отношении ВБП и ОВ. Кроме того, предварительный анализ подгрупп исследования IMbrave150 показал пользу иммунотерапии пациентов с вирусным гепатитом [38].
Высокая эффективность атезолизумаба и бевацизумаба по сравнению с сорафенибом также была подтверждена анализом китайских пациентов, получавших лечение в исследовании IMbrave150 [46]. В этой группе больных более 90 % имели в анамнезе вирусный гепатит, преимущественно гепатит В, и 77 % пациентов были живы через 12 месяцев после начала лечения. Ответ на лечение в этом исследовании составил 29 %, что почти такой же, как и в исследовании III фазы (27 %). В проведенном анализе только цирроз печени стадии А по Чайлд-Пью и ранее проведенные мероприятия по локальной терапии были не связаны с ОВ. Также следует отметить, что у пациентов с невирусной этиологией ГЦК прогноз был хуже, чем у пациентов с вирусной этиологией ГЦК, что, однако, не было значимым при однофакторном или многофакторном анализе.
Недавно Pfister et al. опубликовали широко обсуждаемые данные о снижении эффективности иммунотерапии у больных ГЦК по сравнению с неалкогольным стеатогепатитом из-за наличия особых резидентных активированных CD8+ клеток [47]. Менее выраженные результаты у пациентов с НАСГ подтверждаются данными Inada et al. и др. [48].
ЗАКЛЮЧЕНИЕ
Приведенные выше исследования комбинации атезолизумаба и бевацизумаба в реальной клинической практике демонстрируют сопоставимые данные при лечении пациентов с ГЦК в реальной клинической практике и данными исследования III фазы IMbrave150. В исследовании IMbrave150 получали лечение строго отобранные пациенты, каких в реальной практике меньшинство. Пациенты с циррозом печени и ГЦК вирусной этиологии демонстрировали лучшие результаты, чем пациенты с ГЦК не вирусной этиологии. Клиническая эффективность наблюдалась независимо от предшествующей системной терапия, что указывает на то, что комбинация атезолизумаба и бевацизумаба имеет хорошие результаты также в терапии второй линии. Однако следует быть осторожными при использовании атезолизумаба и бевацизумаба у пациентов с явлениями декомпенсации функции печени, и не рекомендуется назначать этот вариант при значительных нарушениях функции печени. Проспективные клинические испытания, которые включают разнородные группы пациентов, необходимы для дальнейшего анализа эффективности комбинации атезолизумаба и бевацизумаба.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Funding. This work is not funded.
Список литературы
1. Villanueva A. Hepatocellular carcinoma. N Engl J Med. 2019; 380 (15): 1450–62. DOI: 10.1056/NEJMra1713263
2. Ахметгареева К. Т., Липатов О. Н., Меньшиков К. В., Султанбаев А. В. Заболеваемость первичным раком печени в Республике Башкортостан. В кн.: Белые ночи 2020 : тезисы VI Петербургского международного онкологического форума. СПб; 2020. С. 22.
3. Xie Y. Hepatitis B virus-associated hepatocellular carcinoma. Adv Exp Med Biol. 2017; 1018: 11–21. DOI: 10.1007/978-981-10-5765-6_2
4. Kanwal F., Kramer J. R., Mapakshi S., Natarajan Y., Chayanupatkul M., Richardson P. A., et al. Risk of hepatocellular cancer in patients with non-alcoholic fatty liver disease. Gastroenterology. 2018; 155 (6): 1828–37.e2. DOI: 10.1053/j.gastro.2018.08.024
5. Меньшиков К. В., Султанбаев А. В., Мусин Ш. И., Рахматуллина И. Р., Меньшикова И. А., Абдеев Р. Р. и др. Гепатоцеллюлярная карцинома: этиологические факторы и механизмы развития. Обзор литературы. Креативная хирургия и онкология. 2022; 12 (2): 139–50. DOI: 10.24060/2076-3093-2022-12-2-139-150
6. Llovet J. M., Villanueva A., Lachenmayer A., Finn R. S. Advances in targeted therapies for hepatocellular carcinoma in the genomic era. Nat Rev Clin Oncol. 2015; 12 (7): 408–24. DOI: 10.1038/nrclinonc.2015.103
7. Cheng A. L., Kang Y. K., Chen Z., Tsao C. J., Qin S., Kim J. S., et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, doubleblind, placebo-controlled trial. Lancet Oncol. 2009; 10 (1): 25–34. DOI: 10.1016/S1470-2045(08)70285-7
8. Llovet J. M., Ricci S., Mazzaferro V., Hilgard P., Gane E., Blanc J. F., et al. SHARP Investigators Study Group. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008; 359 (4): 378–90. DOI: 10.1056/NEJMoa0708857
9. Меньшиков К. В., Султанбаев А. В., Мусин Ш. И., Меньшикова И. A., Абдеев Р. Р., Султанбаева Н. И. и др. Иммунотерапия распространенной гепатоцеллюлярной карциномы : обзор литературы и клинический случай. Медицинский совет. 2022; 16 (9): 31–9. DOI: 10.21518/2079-701X-2022-16-9-31-39
10. Kudo M., Finn R. S., Qin S., Han K. H., Ikeda K., Piscaglia F., et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet. 2018; 391 (10126): 1163–73. DOI: 10.1016/S0140-6736(18)30207-1
11. Bruix J., Qin S., Merle P., Granito A., Huang Y. H., Bodoky G., et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017; 389 (10064): 56–66. DOI: 10.1016/S0140-6736(16)32453-9
12. Меньшиков К. В., Султанбаев А. В., Ахметгареева К. Т., Липатов Д. О. Лечение метастатического гепатоцеллюлярного рака ленватинибом. Клинический случай и обзор литературы. Современная онкология. 2021; 23 (1): 156–61. DOI: 10.26442/18151434.2021.1.200785
13. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol. 2018; 69 (1): 182–236. DOI: 10.1016/j.jhep.2018.03.019
14. Heimbach J. K., Kulik L. M., Finn R. S., Sirlin C. B., Abecassis M. M., Roberts L. R., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology. 2018; 67 (1): 358–80. DOI: 10.1002/hep.29086
15. Matsui J., Yamamoto Y., Funahashi Y., Tsuruoka A., Watanabe T., Wakabayashi T., et al. E7080, a novel inhibitor that targets multiple kinases, has potent antitumor activities against stem cell factor producing human small cell lung cancer H146, based on angiogenesis inhibition. Int J Cancer. 2008; 122 (3): 664–71. DOI: 10.1002/ijc.23131
16. Tamai T., Hayato S., Hojo S., Suzuki T., Okusaka T., Ikeda K., et al. Dose finding of lenvatinib in subjects with advanced hepatocellular carcinoma based on population pharmacokinetic and exposure-response analyses. J Clin Pharmacol. 2017; 57 (9): 1138–47. DOI: 10.1002/jcph.917
17. Finn R. S., Ikeda M., Zhu A. X., Sung M. W., Baron A. D., Kudo M., et al. Phase Ib study of lenvatinib plus pembrolizumab in patients with unresectable hepatocellular carcinoma. J Clin Oncol. 2020; 38 (26): 2960–70. DOI: 10.1200/JCO.20.00808
18. Pishvaian M. J., Lee M. S., Ryoo B.-Y., Stein S., Lee K-H., Verret W., et al. Updated safety and clinical activity results from a phase Ib study of atezolizumab + bevacizumab in hepatocellular carcinoma (HCC). Ann Oncol. 2018; 29 (Suppl.8): 718–9.
19. Finn R. S., Qin S., Ikeda M., Galle P. R., Ducreux M., Kim T. Y., et al. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. N Engl J Med. 2020; 382 (20): 1894–905. DOI: 10.1056/NEJMoa1915745
20. Giannini E. G., Aglitti A., Borzio M., Gambato M., Guarino M., Iavarone M., et al. Overview of immune checkpoint inhibitors therapy for hepatocellular carcinoma, and The ITA.LI.CA Cohort derived estimate of amenability rate to immune checkpoint inhibitors in clinical practice. Cancers (Basel). 2019;11(11):1689. DOI: 10.3390/cancers11111689
21. Gordan J. D., Kennedy E. B., Abou-Alfa G. K., Beg M. S., Brower S. T., Gade T. P., et al. Systemic therapy for advanced hepatocellular carcinoma: ASCO Guideline. J Clin Oncol. 2020; 38 (36): 4317–45. DOI: 10.1200/JCO.20.02672
22. de Castro T., Jochheim L. S., Bathon M., Welland S., Scheiner B., Shmanko K., et al. Atezolizumab and bevacizumab in patients with advanced hepatocellular carcinoma with impaired liver function and prior systemic therapy: a real-world experience. Ther Adv Med Oncol. 2022; 14: 17588359221080298. DOI: 10.1177/17588359221080298
23. Hatanaka T., Kakizaki S., Hiraoka A., Tada T., Hirooka M., Kariyama K., et al. Comparative efficacy and safety of atezolizumab and bevacizumab between hepatocellular carcinoma patients with viral and non-viral infection: A Japanese multicenter observational study. Cancer Med. 2023; 12 (5): 5293–303. DOI: 10.1002/cam4.5337
24. Shimose S., Hiraoka A., Nakano M., Iwamoto H., Tanaka M., Tanaka T., et al. First-line sorafenib sequential therapy and liver disease etiology for unresectable hepatocellular carcinoma using inverse probability weighting: A multicenter retrospective study. Cancer Med. 2021; 10 (23): 8530–41. DOI: 10.1002/cam4.4367
25. Hatanaka T., Kakizaki S., Nagashima T., Namikawa M., Ueno T., Tojima H., et al. Lenvatinib for hepatocellular carcinoma patients with nonviral infection who were unlikely to respond to immunotherapy: a retrospective, comparative study. Oncology. 2021; 99 (10): 641–51. DOI: 10.1159/000517494
26. Tsuchiya K., Kurosaki M., Sakamoto A., Marusawa H., Kojima Y., Hasebe C., et al. The real-world data in japanese patients with unresectable hepatocellular carcinoma treated with lenvatinib from a nationwide multicenter study. Cancers (Basel). 2021; 13 (11): 2608. DOI: 10.3390/cancers13112608
27. Hiraoka A., Kumada T., Tada T., Tani J., Kariyama K., Fukunishi S., et al. Efficacy of lenvatinib for unresectable hepatocellular carcinoma based on background liver disease etiology: multi-center retrospective study. Sci Rep. 2021; 11 (1): 16663. DOI: 10.1038/s41598-021-96089-x
28. Tomonari T., Sato Y., Tanaka H., Mitsuhashi T., Hirao A., Tanaka T., et al. Th erapeutic efficacy of lenvatinib in nonviral unresectable hepatocellular carcinoma. JGH Open. 2021; 5 (11): 1275–83. DOI: 10.1002/jgh3.12663
29. Pugh R. N., Murray-Lyon I. M., Dawson J. L., Pietroni M. C., Williams R. Transection of the oesophagus for bleeding oesophageal varices. Br J Surg. 1973; 60 (8): 646–9. DOI: 10.1002/bjs.1800600817
30. Tada T., Kumada T., Hiraoka A., Hirooka M., Kariyama K., Tani J., et al. Safety and efficacy of atezolizumab plus bevacizumab in elderly patients with hepatocellular carcinoma: A multicenter analysis. Cancer Med. 2022; 11 (20): 3796–808. DOI: 10.1002/cam4.4763
31. Singal A. G., Lampertico P., Nahon P. Epidemiology and surveillance for hepatocellular carcinoma: New trends. J Hepatol. 2020; 72 (2): 250–61. DOI: 10.1016/j.jhep.2019.08.025
32. Global Burden of Disease Liver Cancer Collaboration; Akinyemiju T., Abera S., Ahmed M., Alam N., Alemayohu M. A., Allen C., et al. The burden of primary liver cancer and underlying etiologies from 1990 to 2015 at the global, regional, and national level: results from the global burden of disease study 2015. JAMA Oncol. 2017; 3 (12): 1683–91. DOI: 10.1001/jamaoncol.2017.3055
33. Kumada T., Toyoda H., Tada T., Yasuda S., Tanaka J. Changes in background liver function in patients with hepatocellular carcinoma over 30 years: comparison of child-pugh classification and albumin bilirubin grade. Liver Cancer. 2020; 9 (5): 518–28. DOI: 10.1159/000507933
34. Johnson P. J., Berhane S., Kagebayashi C., Satomura S., Teng M., Reeves H. L., et al. Assessment of liver function in patients with hepatocellular carcinoma: a new evidence-based approach-the ALBI grade. J Clin Oncol. 2015; 33 (6): 550–8. DOI: 10.1200/JCO.2014.57.9151
35. Iwamoto H., Shimose S., Noda Y., Shirono T., Niizeki T., Nakano M., et al. Initial experience of atezolizumab plus bevacizumab for unresectable hepatocellular carcinoma in real-world clinical practice. Cancers (Basel). 2021; 13 (11): 2786. DOI: 10.3390/cancers13112786
36. Finn R. S., Ryoo B. Y., Merle P., Kudo M., Bouattour M., Lim H. Y., et al. Pembrolizumab as second-line therapy in patients with advanced hepatocellular carcinoma in KEYNOTE-240: a randomized, double-blind, phase III trial. J Clin Oncol. 2020; 38 (3): 193–202. DOI: 10.1200/JCO.19.01307
37. Yau T., Park J. W., Finn R. S., Cheng A. L., Mathurin P., Edeline J., et al. Nivolumab versus sorafenib in advanced hepatocellular carcinoma (CheckMate 459): a randomised, multicentre, open-label, phase 3 trial. Lancet Oncol. 2022; 23 (1): 77–90. DOI: 10.1016/S1470-2045(21)00604-5
38. Cheng A. L., Qin S., Ikeda M., Galle P. R., Ducreux M., Kim T. Y., et al. Updated efficacy and safety data from IMbrave150: Atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma. J Hepatol. 2022; 76 (4): 862–73. DOI: 10.1016/j.jhep.2021.11.030
39. Finn R. S., Qin S., Ikeda M., Galle P. R., Ducreux M., Kim T.-Y., et al. IMbrave150: Updated Overall Survival (OS) Data from a Global, Randomized, Open-Label Phase III Study of Atezolizumab (Atezo) + Bevacizumab (Bev) versus Sorafenib (Sor) in Patients (Pts) with Unresectable Hepatocellular Carcinoma (HCC). J Clin Oncol. 2021; 39 (3S): 267. DOI: 10.1200/JCO.2021.39.3_suppl.267
40. Galle P. R., Finn R. S., Qin S., Ikeda M., Zhu A. X., Kim T. Y., et al. Patient-reported outcomes with atezolizumab plus bevacizumab versus sorafenib in patients with unresectable hepatocellular carcinoma (IMbrave150): an open-label, randomised, phase 3 trial. Lancet Oncol. 2021; 22 (7): 991–1001. DOI: 10.1016/S1470-2045(21)00151-0
41. Eisenhauer E. A., Therasse P., Bogaerts J., Schwartz L. H., Sargent D., Ford R., et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009; 45 (2): 228–47. DOI: 10.1016/j.ejca.2008.10.026
42. Lencioni R., Llovet J. M. Modifi ed RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 2010; 30 (1): 52–60. DOI: 10.1055/s-0030-1247132
43. Common Terminology Criteria for Adverse Events v4.0 (CTCAE). Bethesda; 2009.
44. Common Terminology Criteria for Adverse Events (CTCAE). v.5.0; Cancer Therapy Evaluation Program (CTEP). Rockville; 2017.
45. Himmelsbach V., Pinter M., Scheiner B., Venerito M., Sinner F., Zimpel C., et al. Efficacy and safety of atezolizumab and bevacizumab in the real-world treatment of advanced hepatocellular carcinoma: experience from four tertiary centers. Cancers (Basel). 2022; 14 (7): 1722. DOI: 10.3390/cancers14071722
46. Qin S., Ren Z., Feng Y. H., Yau T., Wang B., Zhao H., et al. Atezolizumab plus bevacizumab versus sorafenib in the chinese subpopulation with unresectable hepatocellular carcinoma: phase 3 randomized, open-label IMbrave150 study. Liver Cancer. 2021; 10 (4): 296–308. DOI: 10.1159/000513486
47. Pfister D., Núñez N. G., Pinyol R., Govaere O., Pinter M., Szydlowska M., et al. NASH limits anti-tumour surveillance in immunotherapy-treated HCC. Nature. 2021; 592 (7854): 450–6. DOI: 10.1038/s41586-021-03362-0
48. Inada Y., Mizukoshi E., Seike T., Tamai T., Iida N., Kitahara M., et al. Characteristics of immune response to tumor-associated antigens and immune cell profile in patients with hepatocellular carcinoma. Hepatology. 2019; 69 (2): 653–65. DOI: 10.1002/hep.30212
Об авторах
Г. А. СеребренниковРоссия
Григорий Андреевич Серебренников
отделение противоопухолевой лекарственной терапии № 2
Республика Башкортостан
Уфа
К. В. Меньшиков
Россия
Константин Викторович Меньшиков, к. м. н., доцент
отдел химиотерапии
ИДПО
кафедра онкологии с курсами онкологии и патологической анатомии
Республика Башкортостан
Уфа
А. В. Султанбаев
Россия
Александр Валерьевич Султанбаев, к. м. н.
отдел противоопухолевой лекарственной терапии
Республика Башкортостан
Уфа
Ш. И. Мусин
Россия
Шамиль Исмагилович Мусин, к. м. н.
хирургическое отделение № 6
Республика Башкортостан
Уфа
И. А. Меньшикова
Россия
Ирина Асхатовна Меньшикова, к. м. н., доцент
кафедра биологической химии
Республика Башкортостан
Уфа
Н. И. Султанбаева
Россия
Надежда Ивановна Султанбаева
отделение противоопухолевой лекарственной терапии № 1
Республика Башкортостан
Уфа
Д. О. Липатов
Россия
Данила Олегович Липатов, студент
лечебный факультет
Республика Башкортостан
Уфа
А. Ш. Резяпова
Россия
Азалия Шамилевна Резяпова, студент
лечебный факультет
Республика Башкортостан
Уфа
Рецензия
Для цитирования:
Серебренников Г.А., Меньшиков К.В., Султанбаев А.В., Мусин Ш.И., Меньшикова И.А., Султанбаева Н.И., Липатов Д.О., Резяпова А.Ш. Атезолизумаб и бевацизумаб у пациентов с гепатоцеллюлярной карциномой в реальной клинической практике. Креативная хирургия и онкология. 2023;13(2):131-142. https://doi.org/10.24060/2076-3093-2023-13-2-131-142
For citation:
Serebrennikov G.A., Menshikov К.V., Sultanbaev A.V., Musin Sh.I., Menshikova I.A., Sultanbaeva N.I., Lipatov D.O., Rezyapova A.Sh. Atezolizumab and Bevacizumab in Therapy for Patients with Hepatocellular Carcinoma in Real Clinical Practice. Creative surgery and oncology. 2023;13(2):131-142. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-2-131-142



































