Перейти к:
Случай лечения солидно-псевдопапиллярной опухоли поджелудочной железы
https://doi.org/10.24060/2076-3093-2023-13-2-178-185
Аннотация
Ведение. Солидно-псевдопапиллярная опухоль поджелудочной железы составляет менее 3 % всех опухолей поджелудочной железы. Чаще встречается у молодых женщин в возрасте от 20 до 30 лет. Прогноз данной патологии благоприятный. Полное удаление опухоли приводит к излечению более чем у 85 % пациентов.
Материалы и методы. В публикации представлен клинический случай, иллюстрирующий результат хирургического лечения пациентки со злокачественной опухолью поджелудочной железы. Больная М., 1998 г. р., находилась на стационарном лечении в клинике им. И. К. Ахунбаева Национального госпиталя Министерства здравоохранения Кыргызской Республики с 12. 01. 2015 по 26. 01. 2015 г. с клиническим диагнозом: образование головки поджелудочной железы, которая была найдена интраоперационно. В связи с этим принято решение о расширении объема операции. При патогистологическом исследовании у больной обнаружена солидно-псевдопапиллярная опухоль.
Результаты и обсуждения. Данная опухоль является чрезвычайно редкой и, как правило, выявляется случайно во время профилактических осмотров либо когда опухоль становится больших размеров. В динамике наблюдения за 7 лет у данной пациентки на фоне проведенного лечения признаков прогрессирования и рецидивирования данной патологии не обнаружено.
Заключение. Солидно-псевдопапиллярная опухоль является редким высокодифференцированным злокачественным новообразованием, развивающимся чаще всего у молодых девушек, характеризующимся относительно благоприятным клиническим течением, что и демонстрирует данный клинический случай.
Ключевые слова
Для цитирования:
Рахимова Ф.С., Мамашев Н.Д., Шимкина О.А., Бебезов Б.Х. Случай лечения солидно-псевдопапиллярной опухоли поджелудочной железы. Креативная хирургия и онкология. 2023;13(2):178-185. https://doi.org/10.24060/2076-3093-2023-13-2-178-185
For citation:
Rakhimova F.S., Mamashev N.D., Shimkina O.A., Bebezov B.Kh. Case of Treatment of Solid Pseudopapillary Pancreatic Tumor. Creative surgery and oncology. 2023;13(2):178-185. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-2-178-185
ВВЕДЕНИЕ
Солидно-псевдопапиллярная опухоль (СППО) поджелудочной железы — очень редкое патологическое состояние, которое составляет менее 3 % всех экзокринных опухолей поджелудочной железы [1][2]. Более 90 % встречаются у молодых женщин от 20 до 30 лет [3–5]. За последние два десятилетия отмечается рост заболеваемости данной патологией, но, вероятно, это связано с улучшением методов визуализации и морфологической диагностики [6].
Впервые данная опухоль была описана Franz в 1959 г. как папиллярная опухоль поджелудочной железы [7]. Исторически к СППО применяли такие термины, как «папиллярное эпителиальное новообразование», «солидная и кистозная опухоль», «солидное и папиллярное эпителиальное новообразование», «папиллярное и кистозное новообразование» и «опухоль Франца» [8]. В 1996 году Всемирная организация здравоохранения (ВОЗ) официально назвала ее СППО и реклассифицировала как разновидность пограничной злокачественной опухоли с неясным биологическим поведением. В 2010 г. ВОЗ классифицировала СППО как эпителиальное злокачественное новообразование низкой степени злокачественности [9].
Обычно данная опухоль протекает доброкачественно, и полное удаление опухоли приводит к излечению более чем у 85 % пациентов. Однако в некоторых случаях могут возникать рецидивы, и у небольшого процента (менее 15 %) пациентов могут развиваться метастазы. Чаще всего они возникают в брюшине и печени [10], но имеются данные литературы, что метастазы поражают также лимфатические узлы, селезенку, сообщаются случаи карциноматоза [11]. Общая десятилетняя выживаемость после хирургического лечения составляет более 90 % [12].
Точный патогенез этой опухоли остается неясным, одни авторы утверждают, что она может возникать из центроацинарных клеток, расположенных между ацинусами поджелудочной железы и протоками, другие говорят, что она имеет эндокринное происхождение [13–15]. Однако отмечается особенность в зависимости от этнического происхождения: у женщин европеоидной расы опухоль практически не встречается; а наибольшая заболеваемость отмечена в Японии, описаны также случаи возникновения опухоли у африканцев, кавказцев и арабов.
Хотя чаще всего у СППО нет специфических симптомов и опухоль обнаруживается при скрининговом исследовании, наиболее распространенным из них является боль в животе [16–19]. Кроме того, примерно 1 % СППО расположены в головке поджелудочной железы, и у этих пациентов часто наблюдается механическая желтуха, связанная с обтурацией области фатерова соска. Предоперационный диагноз СППО в основном зависит от визуализирующего обследования [20–22]. Приблизительно у 80 % пациентов на КТ или МРТ обнаруживаются типичные признаки солидных и кистозных или солидных опухолей с неравномерной плотностью внутри капсулы. Кроме того, было обнаружено, что большинство опухолей имеют круглую форму, а дольчатые опухоли встречаются редко [23][24].
СППО имеет большой объем опухоли, полную капсулу и четкие границы с окружающими тканями [25]. Она состоит из солидных, псевдопапиллярных и кистозных областей. Клетки солидной области сходны по размеру и форме и располагаются группами вокруг кровеносных сосудов. Псевдопапиллярная зона включает псевдопапиллярные структуры вокруг центральных мелких сосудов опухолевых клеток. Кровоизлияния и некроз обычны в кистозных областях. Окрашивание гематоксилином и эозином обычно показывает эозинофильную цитоплазму опухолевых клеток и круглое и центрированное ядро с редкими ядерными митозами и атипиями.
В настоящее время не существует специфических иммуногистохимических биомаркеров для СППО, и β-катенин, виментин, Syn, CD10 и PR обычно комбинируются для повышения частоты диагностики [26]. LEF1 играет ключевую роль в активации транскрипции сигнального пути Wnt/CTNNB1, а мутация третьего экзона в CTNNB1 связана с возникновением СППО, что позволяет предположить, что белок LEF1 может играть важную роль в диагностике СППО [27]. Недавнее исследование показало, что белок CD99 дает уникальные парануклеарные пятна в СППО и может использоваться в качестве диагностического биомаркера [28].
Факторы риска злокачественного поведения и плохого прогноза SPN до настоящего времени полностью не выяснены, и результаты заметно различаются между исследованиями. В некоторых сообщениях предполагается, что микроскопические патологические характеристики, такие как плеоморфизм клеток, выраженный некроз, периневральная инвазия в окружающие ткани и множественные митотические фигуры, могут предсказывать злокачественный потенциал СППО [27][28]. Однако в одном исследовании De Robertis и соавторы показали отсутствие значимой корреляции между злокачественным потенциалом СППО и размером опухоли [28].
Методом выбора лечения СППО является радикальная резекция образования. Объем операции зависит от локализации образования, а именно: при локализации в головке поджелудочной железы — гастропанкреатодуоденальная резекция, при локализации в области тела или хвоста поджелудочной железы — дистальная резекция со спленэктомией, также возможны энуклеация или иссечение опухоли.
МАТЕРИАЛЫ И МЕТОДЫ
В клинике им. И. К. Ахунбаева Национального госпиталя Министерства здравоохранения Кыргызской Республики в период с 2015 по 2022 г. под наблюдением находились трое больных, которым по результатам патогистологического исследования был выставлен диагноз СППО.
Мы представляем случай наблюдения молодой девушки с диагнозом СППО поджелудочной железы.
Больная, М. 1998 г. р. находилась на стационарном лечении в клинике им. И. К. Ахунбаева Национального госпиталя Министерства здравоохранения Кыргызской Республики с 12.01.2015 по 26.01.2015 г.
При поступлении предъявляла жалобы на умеренные постоянные боли в области правого подреберья, правой поясничной области, усиливающиеся после приема пищи.
Из анамнеза: со слов больной жалобы появились за 10 дней до поступления, в связи с чем в амбулаторном порядке прошла обследование, на котором обнаружено образование правого надпочечника.
УЗИ органов брюшной полости от 05.01.2015 г: в забрюшинном пространстве справа в проекции верхнего полюса правой почки определяется объемное образование смешанной эхоструктуры размером 80×82 мм. Заключение: опухоль правого надпочечника.
МРТ органов брюшной полости (06.01.2015 г.): вдоль внутреннего контура печени определяется инкапсулированное гетерогенное объемное образование солидно-кистозного строения, с четкими контурами, округлой формы, размером до 77×73 мм в поперечнике. Описание деформирует желчный пузырь, прилежащие отделы кишечника и головку поджелудочной железы, местами без четкой дифференциации между ними. Сосудистые образования ворот печени также деформированы, прослеживаются в вышележащих отделах. Поджелудочная железа S-образной формы, с четкими дольчатыми контурами. Головка не прослеживается. Размеры тела и хоста в пределах нормы без патологических образований. Заключение: данные, вероятнее всего, соответствуют неоплазме, исходящей из правого надпочечника.
На основании данных предоперационного обследования выставлен диагноз: образование правого надпочечника. Планируется оперативное вмешательство: адреналэктомия справа.
13.01.2015 г. произведена операция: гастропанкреатодуоденальная резекция. Доступ — лапаротомия по Бруншвигу. При ревизии в брюшной полости отмечается спаечный процесс. Печень обычных размеров, не изменена. Правая почка и правый надпочечник не изменены, обычных размеров, без патологических очагов. При дальней ревизии в области головки поджелудочной железы по медиальной стенке двенадцатиперстной кишки имеется плотное образование размером 100×90 мм (рис. 1). Опухоль подвижная, прорастает в медиальную стенку 12-перстной кишки. Далее после мобилизации двенадцатиперстной кишки по Кохеру обнаружено, что опухоль исходит из головки поджелудочной железы и крючковидного отростка (рис. 2). В связи с чем интраоперационно решено расширить объем операции.
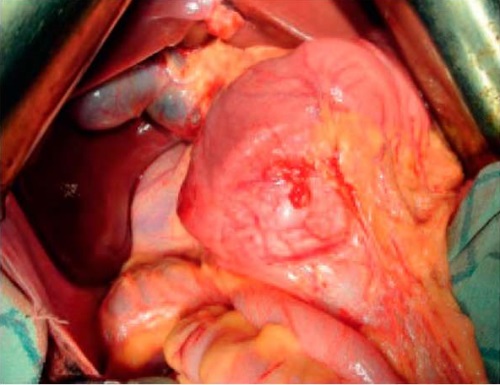
Рисунок 1. В панкреатодуоденальной зоне обнаружено образование
Figure 1. Mass found in pancreaticoduodenal area
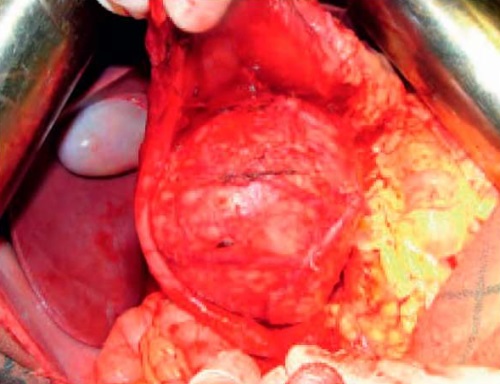
Рисунок 2. При разъединении спаек тупым и острым путем найдено образование, исходящее из головки поджелудочной железы
Figure 2. Pancreatic head mass revealed by blunt and sharp dissections of adhesions
Макропрепарат: Опухоль шаровидной формы диаметром 100×90 мм (рис. 3), капсула плотная, на разрезе — темно-красного цвета из-за диффузного кровоизлияния, также имеются распад опухоли. Фатеров сосочек, желудок, холедох без особенностей.
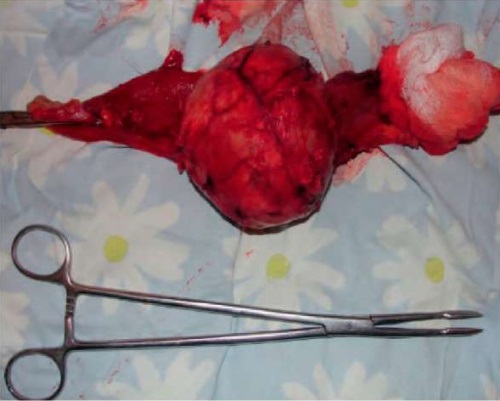
Рисунок 3. Макропрепарат
Figure 3. Gross specimen
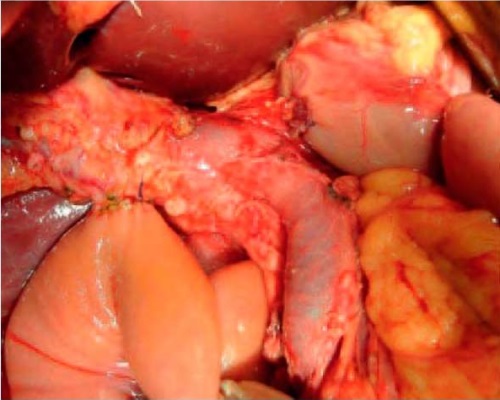
Рисунок 4. Интраоперационное формирование панкреатикогастро- и холедохоеюноанастомоза
Figure 4. Intraoperative formation of pancreaticogastro- and choledochojejunoanastomosis
Патогистологическое исследование от 19.01.2015 г.: обнаружена гетерогенная опухоль, состоящая из смеси солидных и псевдопапиллярных полей, с кровоизлиянием и распадом опухоли (рис. 5 и 6). Солидные поля представлены мономорфными клетками, разделенными мелкими сосудами капиллярного типа. Псевдопапиллярные участки, образованные опухолевыми клетками, розеткообразно распределяющиеся. Опухолевые клетки в одном из участков прорастают в капсулу и сосуды окружающей клетчатки. Желудок, двеннадцатиперстная кишка — опухолевого роста нет.
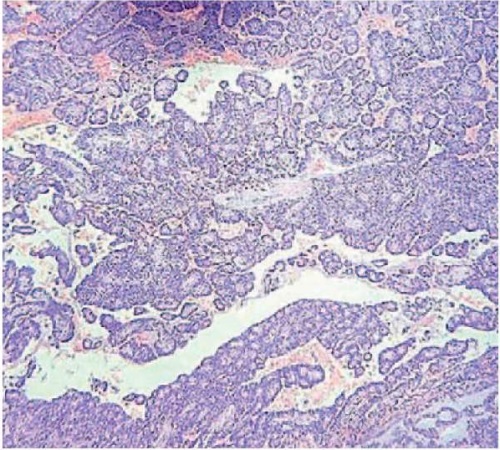
Рисунок 5. Фото микропрепарата, окраска гематоксилин-эозин, ×2 гематоксилин-эозин, ×2
Figure 5. Microslide. Hematoxylin-eosin staining, ×2
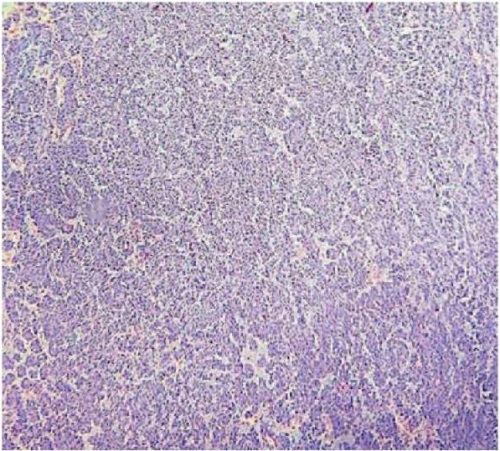
Рисунок 6. Фото микропрепарата, окраска
Figure 6. Microslide. Hematoxylin-eosin staining, ×2
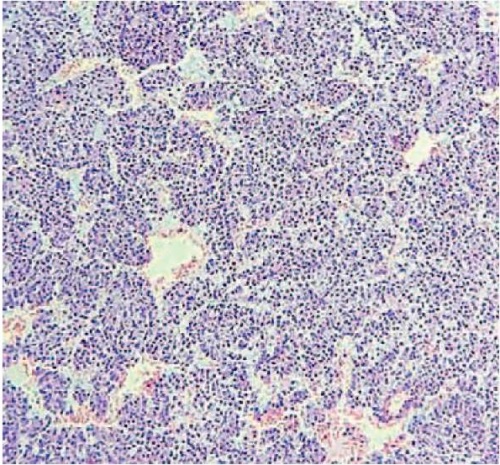
Рисунок 7. Микропрепарат. Солидные поля в виде мономорфных клеток. Окраска гематоксилин-эозин, ×10
Figure 7. Microslide. Solid areas as monomorphic cells. Hematoxylin-eosin staining, ×10
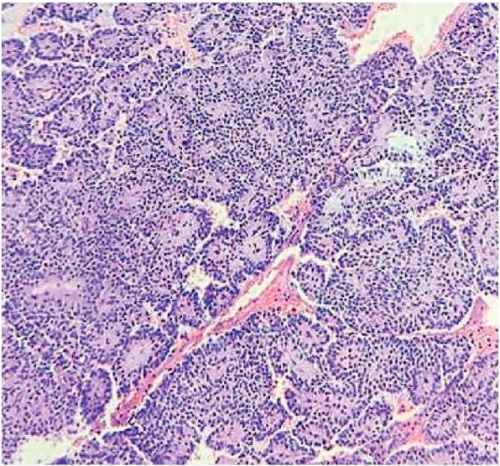
Рисунок 8. Микропрепарат. Среди солидных полей имеются сосуды капиллярного типа. Окраска гематоксилин-эозин, ×10
Figure 8. Microslide. Capillary-type vessels in solid areas. Hematoxylin-eosin staining, ×10
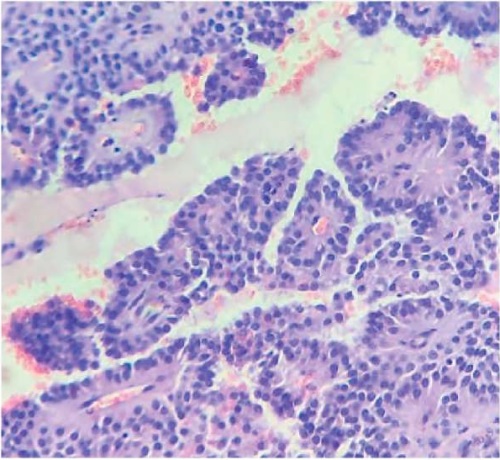
Рисунок 9. Микропрепарат. Ядра однородные с тонким хроматином. Окраска гематоксилин-эозин, ×40
Figure 9. Microslide. Homogeneous nuclei with fine chromatin. Hematoxylin-eosin staining, ×40
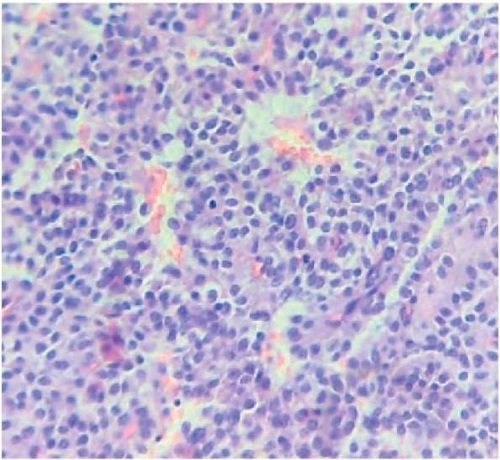
Рисунок 10. Микропрепарат. Незаметные ядрышки, митозы редки. Окраска гематоксилин-эозин, ×40
Figure 10. Microslide. Inconspicuous nuclei, rare mitoses. Hematoxylin-eosin staining, ×40
Для уточнения гистологического типа образования произведен иммуногистохимический анализ от 27.01.2015 г., микроскопическое исследование. Проведено иммуногистохимическое исследование опухоли головки pancreas с использованием антител к виментину, PR, CD 10, B-catenin, NSE. Symapt., Chromagr.A, CK7, CK18, CD99, CD56. Результаты: опухолевые клетки позитивны по экспрессии синаптофизина, виментина, нейронспецифической энолазы, B-catenin (ядерная реакция), PR, CK18, CD10. Заключение: результаты иммуногистохимического исследования опухоли соответствуют солидно-псевдопапиллярной опухоли.
На 14-е сутки пациентка выписана из стационара в удовлетворительном состоянии. При контрольном обследовании через 7 лет (декабрь 2022 г.): жалоб не предъявляет, по данным УЗИ, МРТ органов брюшной полости — признаков рецидива и прогрессирования процесса нет.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Солидно-псевдопапиллярная опухоль — редкое новообразование, составляющее всего 1–3 % всех опухолей поджелудочной железы, и большинство из них имеют низкий злокачественный потенциал. Характеристики СППО аналогичны характеристикам других новообразований поджелудочной железы; таким образом, патологическая диагностика может быть затруднена. Кроме того, в настоящее время нет диагностических биомаркеров, специфичных для СППО.
СППО могут возникать в любом возрасте, но в основном наблюдаются у молодых женщин в возрасте 20–30 лет. Хотя у СППО нет специфических симптомов, наиболее распространенным из них является боль в животе. В настоящее время не существует специфических иммуногистохимических биомаркеров для SPN, и β-катенин, виментин, Syn, CD10 и PR обычно комбинируются для повышения частоты диагностики. Факторы риска злокачественного поведения и плохого прогноза СППО до настоящего времени полностью не выяснены, и результаты заметно различаются между исследованиями. В некоторых сообщениях предполагается, что микроскопические патологические характеристики, такие как плеоморфизм клеток, выраженный некроз, периневральная инвазия в окружающие ткани и множественные митотизы, могут предсказывать злокачественный потенциал СППО. Имеются также сообщения о том, что мужской пол, неравномерная капсула образования, молодой возраст, наличие по краю резекции опухолевых клеток и большие размеры опухоли могут быть связаны с рецидивом СППО. В целом СППО имеют хороший прогноз после операции с частотой рецидивов всего 10–15 % и летальностью всего 2 %.
ЗАКЛЮЧЕНИЕ
СППО, как правило, возникают у молодых женщин. У данной патологии отсутствуют специфические клинические проявления и имеется низкий злокачественный потенциал. Большой размер опухоли, высокий индекс пролиферации и метастазирование в лимфатические узлы могут быть факторами риска агрессивного поведения и плохого прогноза СППО.
Информированное согласие. Информированное согласие пациента на публикацию своих данных получено.
Statement of informed consent. Written informed consent was obtained from the patient for publication of this case report and accompanying materials.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Funding. This work is not funded.
Список литературы
1. Чхиквадзе В. Д., Зеленина И. А., Ахаладзе Г. Г. Солидно-псевдопапиллярная опухоль поджелудочной железы: проблемы диагностики и лечения. Анналы хирургической гепатологии. 2015; 20 (1): 106–15. DOI: 10.16931/1995-5464.20151106-115
2. Massaras D., Masourou Z., Papazian M., Psarras G., Polydorou A. Solid pseudopapillary tumor of the pancreas in a 25-year-old female: a rare entity of pancreatic tumors. Cureus. 2021; 13 (4): e14747. DOI: 10.7759/cureus.14747
3. Кошель А. П., Клоков С. С., Попов К. М., Вторушин С. В., Завьялова М. В., Степанов И. В. и др. Солидно-псевдопапиллярная опухоль поджелудочной железы у молодой женщины: клиническое наблюдение. Сибирский онкологический журнал. 2016; 15 (3): 102–9. DOI: 10.21294/1814-4861-2016-15-3-102-109
4. Рахимова Ф. С., Бебезов Х. С., Бебезов Б. Х. Нейроэндокринные опухоли поджелудочной железы. Литературный обзор. Здравоохранение Кыргызстана. 2021; 3: 158–69. URL: https://zdrav.kg/arkhivy/product/view/109/78
5. Gao H., Gao Y., Yin L., Wang G., Wei J., Jiang K., et al. Risk factors of the recurrences of pancreatic solid pseudopapillary tumors: a systematic review and meta-analysis. J Cancer. 2018; 9 (11): 1905–14. DOI: 10.7150/jca.24491
6. Antoniou E. A., Damaskos C., Garmpis N., Salakos C., Margonis G. A., Kontzoglou K., et al. Solid pseudopapillary tumor of the pancreas: a single-center experience and review of the literature. In Vivo. 2017; 31 (4): 501–10. DOI: 10.21873/invivo.11089
7. Guo N., Zhou Q. B., Chen R. F., Zou S. Q., Li Z. H., Lin Q., et al. Diagnosis and surgical treatment of solid pseudopapillary neoplasm of the pancreas: analysis of 24 cases. Can J Surg. 2011; 54 (6): 368–74. DOI: 10.1503/cjs.011810
8. Wang P., Wei J., Wu J., Xu W., Chen Q., Gao W., et al. Diagnosis and treatment of solid-pseudopapillary tumors of the pancreas: A single institution experience with 97 cases. Pancreatology. 2018; 18 (4): 415–9. DOI: 10.1016/j.pan.2017.12.012
9. Kang C. M., Choi S. H., Kim S. C., Lee W. J., Choi D. W., Kim S. W., et al. Predicting recurrence of pancreatic solid pseudopapillary tumors after surgical resection: a multicenter analysis in Korea. Ann Surg. 2014; 260 (2): 348–55. DOI: 10.1097/SLA.0000000000000583
10. Lin D. L., Li H., Jiang T. J., Wu J., Zhao H., Hu S. S., et al. Extrapancreatic solid pseudopapillary neoplasm: report of a unique case of primary posterior mediastinum origin and review of the literature. Transl Cancer Res. 2020; 9 (4): 3024–9. DOI: 10.21037/tcr.2020.02.58
11. Jutric Z., Rozenfeld Y., Grendar J., Hammill C. W., Cassera M. A., Newell P. H., et al. Analysis of 340 patients with solid pseudopapillary tumors of the pancreas: a closer look at patients with metastatic disease. Ann Surg Oncol. 2017; 24 (7): 2015–22. DOI: 10.1245/s10434-017-5772-z
12. Lanke G., Ali F. S., Lee J. H. Clinical update on the management of pseudopapillary tumor of pancreas. World J Gastrointest Endosc. 2018; 10 (9): 145–55. DOI: 10.4253/wjge.v10.i9.145
13. Din N. U., Rahim S., Abdul-Ghafar J., Ahmed A., Ahmad Z. Clinicopathological and immunohistochemical study of 29 cases of solid-pseudopapillary neoplasms of the pancreas in patients under 20 years of age along with detailed review of literature. Diagn Pathol. 2020; 15 (1): 139. DOI: 10.1186/s13000-020-01058-z
14. Miao L., Lei R., Guo M., Yang H. Solid pseudopaillary neoplasm of the pancreas: analysis of clinicopathological and immunohistochemical features in 10 cases. Int J Clin Exp Pathol. 2018; 11 (10): 5072–8.
15. Hao E. I. U., Hwang H. K., Yoon D. S., Lee W. J., Kang C. M. Aggressiveness of solid pseudopapillary neoplasm of the pancreas: A literature review and meta-analysis. Medicine (Baltimore). 2018; 97 (49): e13147. DOI: 10.1097/MD.0000000000013147
16. Tjaden C., Hassenpflug M., Hinz U., Klaiber U., Klauss M., Büchler M. W., et al. Outcome and prognosis after pancreatectomy in patients with solid pseudopapillary neoplasms. Pancreatology. 2019; 19 (5): 699–709. DOI: 10.1016/j.pan.2019.06.008
17. Chen H., Huang Y., Yang N., Yan W., Yang R., Zhang S., et al. Solid-pseudopapillary neoplasm of the pancreas: a 63-case analysis of clinicopathologic and immunohistochemical features and risk factors of malignancy. Cancer Manag Res. 2021; 13: 3335–43. DOI: 10.2147/CMAR.S304981
18. Bochis O. V., Bota M., Mihut E., Buiga R., Hazbei D. S., Irimie A. Solid pseudopapillary tumor of the pancreas: clinical-pathological features and management of 13 cases. Clujul Med. 2017; 90 (2): 171–8. DOI: 10.15386/cjmed-672
19. Anil G., Zhang J., Al Hamar N. E., Nga M. E. Solid pseudopapillary neoplasm of the pancreas: CT imaging features and radiologic-pathologic correlation. Diagn Interv Radiol. 2017; 23 (2): 94–9. DOI: 10.5152/dir.2016.16104
20. Kim J. H., Lee J. M. Clinicopathologic review of 31 cases of solid pseudopapillary pancreatic tumors: can we use the scoring system of microscopic features for suggesting clinically malignant potential? Am Surg. 2016; 82 (4): 308–13. PMID: 27097622.
21. Ardengh J. C., Lopes C. V., Venco F. E., Machado M. A. Diagnosis of pancreatic solid pseudopapillary neoplasms using cell-blocks and immunohistochemical evaluation of endoscopic ultrasound-guided fine needle aspiration biopsy specimens. Cytopathology. 2021; 32 (1): 50–6. DOI: 10.1111/cyt.12905
22. Lin Y. J., Burkhart R., Lu T. P., Wolfgang C., Wright M., Zheng L., et al. Solid pseudopapillary neoplasms of the pancreas across races demonstrate disparities with comparably good prognosis. World J Surg. 2022; 46 (12): 3072–80. DOI: 10.1007/s00268-022-06717-4
23. Hu S., Zhang H., Wang X., Sun Z., Ge Y., Yan G., et al. Asymptomatic versus symptomatic solid pseudopapillary tumors of the pancreas: clinical and MDCT manifestations. Cancer Imaging. 2019; 19 (1): 13. DOI: 10.1186/s40644-019-0198-4
24. Irtan S., Galmiche-Rolland L., Elie C., Orbach D., Sauvanet A., Elias D., et al. Recurrence of solid pseudopapillary neoplasms of the pancreas: results of a nationwide study of risk factors and treatment modalities. Pediatr Blood Cancer. 2016; 63 (9): 1515–21. DOI: 10.1002/pbc.25986
25. Lee H. S., Kim H. K., Shin B. K., Choi J. H., Choi Y. J., Kim H. Y. A rare case of recurrent metastatic solid pseudopapillary neoplasm of the pancreas. J Pathol Transl Med. 2017; 51 (1): 87–91. DOI: 10.4132/jptm.2016.06.16
26. Song H., Dong M., Zhou J., Sheng W., Zhong B., Gao W. Solid pseudopapillary neoplasm of the pancreas: clinicopathologic feature, risk factors of malignancy, and survival analysis of 53 cases from a single center. Biomed Res Int. 2017; 2017: 5465261. DOI: 10.1155/2017/5465261
27. Liu Q., Dai M., Guo J., Wu H., Wang W., Chen G., et al. Long-term survival, quality of life, and molecular features of the patients with solid pseudopapillary neoplasm of the pancreas: a retrospective study of 454 cases. Ann Surg. 2023 Apr 10. DOI: 10.1097/SLA.0000000000005842
28. De Robertis R., Marchegiani G., Catania M., Ambrosetti M. C., Capelli P., Salvia R., et al. Solid pseudopapillary neoplasms of the pancreas: clinicopathologic and radiologic features according to size. AJR Am J Roentgenol. 2019; 213 (5): 1073–80. DOI: 10.2214/AJR.18.20715
Об авторах
Ф. С. РахимоваКыргызстан
Фарида Сулеймановна Рахимова
кафедра госпитальной хирургии
Бишкек
Н. Д. Мамашев
Кыргызстан
Нурлан Джурабаевич Мамашев, к. м. н., доцент
кафедра госпитальной хирургии
Бишкек
О. А. Шимкина
Кыргызстан
Ольга Андреевна Шимкина
отделение морфологических методов исследования
Бишкек
Б. Х. Бебезов
Кыргызстан
Бахадыр Хакимович Бебезов, д. м. н., профессор
кафедра госпитальной хирургии
Бишкек
Рецензия
Для цитирования:
Рахимова Ф.С., Мамашев Н.Д., Шимкина О.А., Бебезов Б.Х. Случай лечения солидно-псевдопапиллярной опухоли поджелудочной железы. Креативная хирургия и онкология. 2023;13(2):178-185. https://doi.org/10.24060/2076-3093-2023-13-2-178-185
For citation:
Rakhimova F.S., Mamashev N.D., Shimkina O.A., Bebezov B.Kh. Case of Treatment of Solid Pseudopapillary Pancreatic Tumor. Creative surgery and oncology. 2023;13(2):178-185. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-2-178-185


































