Перейти к:
Высокоинтенсивная фокусированная ультразвуковая абляция рака предстательной железы: 15 лет наблюдений
https://doi.org/10.24060/2076-3093-2023-13-4-271-277
Аннотация
Введение. Рак предстательной железы (РПЖ) является одним из самых распространенных злокачественных новообразований у мужчин. Наряду с традиционными методами лечения РПЖ в последние годы появились высокоэффективные малоинвазивные методы лечения, такие как высокоинтенсивная фокусированная ультразвуковая абляция (HIFU). При этом опубликованы единичные исследования о долгосрочной онкологической эффективности HIFU-терапии РПЖ. Цель. Оценить онкологическую эффективность HIFU в лечении РПЖ при долгосрочном наблюдении. Материалы и методы. В ретроспективный анализ были включены результаты лечения 171 пациента с РПЖ, которым была проведена HIFU-терапия в Самарском клиническом онкологическом диспансере в 2007–2009 годах. Средний возраст пациентов составил 69,7 года. Из них 48 были с низким риском прогрессии по D’Amico, 57 с промежуточным и 66 с высоким риском. Время наблюдения составляло от 13 до 15 лет (медиана 14,3 года). Положительные результаты гистологического исследования, повышение ПСА и/или появление локальных или отдаленных метастазов оценивались как рецидив. Для графического представления кривых выживаемости использовали метод Каплана — Мейера. Для оценки прогностической значимости различных клинических данных в общей, канцерспецифичной и безрецидивной выживаемости был проведен многопараметрический регрессионный анализ пропорциональных рисков Кокса. Все значения р < 0,05 рассматривались как статистически значимые. Результаты и обсуждение. Общая пятнадцатилетняя выживаемость для пациентов групп низкого, промежуточного и высокого риска составила 52,1, 56,1 и 37,9 % соответственно. Пятнадцатилетняя РПЖ-специфичная выживаемость была определена у 90,1 % пациентов данного исследования. Пятнадцатилетняя безрецидивная выживаемость для пациентов групп низкого, промежуточного и высокого риска составила 95,4, 80,7 и 69,7 % соответственно. Достоверно значимым фактором риска развития рецидива явилось распределение по шкале риска прогрессии D’Amico. Выводы. HIFU-терапия продемонстрировала хорошие долгосрочные онкологические результаты в лечении больных раком предстательной железы.
Ключевые слова
Для цитирования:
Соловов В.А., Тюрин А.А. Высокоинтенсивная фокусированная ультразвуковая абляция рака предстательной железы: 15 лет наблюдений. Креативная хирургия и онкология. 2023;13(4):271-277. https://doi.org/10.24060/2076-3093-2023-13-4-271-277
For citation:
Solovov V.A., Tiurin A.A. High-Intensity Focused Ultrasound Ablation of Prostate Cancer: 15 Years of Follow-up. Creative surgery and oncology. 2023;13(4):271-277. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-4-271-277
ВВЕДЕНИЕ
Рак предстательной железы (РПЖ) является одним из наиболее распространенных злокачественных заболеваний у мужчин в мире [1]. В 2021 г. РПЖ занял третье место в структуре онкологических заболеваний среди мужского населения России, зафиксировано 38 810 новых случаев заболевания. 2523 пациента умерли от рака простаты [2]. Наряду с традиционными методами лечения рака предстательной железы в последние годы появились альтернативные стратегии и подходы к лечению РПЖ. Высокоинтенсивная фокусированная ультразвуковая абляция (HIFU) является одной из наиболее изученных аблятивных методик и используется для лечения РПЖ с 1990-х годов. При этом опубликовано лишь несколько исследований, сообщающих о долгосрочных результатах HIFU-терапии рака предстательной железы [3][4].
Цель настоящего исследования: оценить клиническую эффективность 15-летних наблюдений пациентов, получивших HIFU-терапию РПЖ в 2007–2009 гг. в Самарском онкологическом клиническом диспансере. На сегодняшний день это самое продолжительное и объемное исследование в Российской Федерации.
МАТЕРИАЛЫ И МЕТОДЫ
Ранее нами было опубликовано исследование с 7-летними результатами HIFU-терапии [5]. Исследование включало 976 пациентов, пролеченных в период с 2007 по 2014 год. Данный ретроспективный анализ включает пациентов только с наибольшим сроком наблюдения, пролеченных в период с 2007 по 2008 год. Всего в этот период было пролечено 194 пациента с неметастатическим РПЖ. 23 пациента выбыли из наблюдения (иногородние). 171 пациент включен в данное исследование. Из них с низким риском прогрессии — 48, средним — 57, высоким — 66 пациентов. Лечение проводилось на системе Ablatherm (EDAP-TMS).
Критерии включения были следующие: пациенты с противопоказаниями к хирургическому лечению из-за преклонного возраста или сопутствующих заболеваний, выбор пациентами менее инвазивного варианта лечения для исключения долгосрочных побочных эффектов и осложнений. Критерием исключения являлись анальный стеноз и метастатический РПЖ. В большинстве случаев (89,4 %) до HIFU-терапии выполнялась трансуретральная резекция (ТУР) предстательной железы с целью уменьшения ее размера. Показания к ТУР были следующие: объем предстательной железы больше 40 куб. см, выраженные симптомы инфравезикальной обструкции (средняя скорость при урофлоуметрии меньше 10 мл/с). Средний возраст пациентов составил 68,7 (51,0–87,0) года.
Последующее наблюдение включало контроль уровня простат-специфического антигена (ПСА), контрольную биопсию в случаях повышения уровня ПСА. Все биопсии выполнялись трансректальным доступом. В случае если последующие визиты не проводились в нашем центре, данные были получены путем личного контакта с пациентами.
Статистический анализ проводили с использованием SPSS, версия 25.0. Для описательной статистики непрерывные переменные были представлены как среднее (стандартное отклонение) или медиана, а категориальные переменные были представлены как абсолютные числа и проценты. Показатели выживаемости через 5, 10 и 15 лет были рассчитаны и стратифицированы в соответствии с категориями групп риска D’Amico [6]. Для графического представления кривых выживаемости использовали графики Каплана — Мейера. Для оценки прогностической значимости различных клинических переменных в общей выживаемости, канцерспецифичной и безрецидивной выживаемости был проведен многопараметрический регрессионный анализ пропорциональных рисков Кокса. Все значения p < 0,05 рассматривались как статистически значимые.
РЕЗУЛЬТАТЫ
В итоговый анализ были включены данные 171 пациента. Характеристики пациентов представлены в таблице 1. Большинство пациентов имели низкий 48 (28 %) или средний (33,3 %) риск развития прогрессии. Более половины пациентов (54,6 %) получали краткосрочный курс (3–6 месяцев) неоадъювантной гормонотерапии (ГТ), которая была прекращена после HIFU-терапии. 12 (7,0 %) пациентам была выполнена повторная HIFU-терапия из-за местного рецидива, причем бóльшая часть этих пациентов была из группы высокого риска — 83,3 %.
Результаты наблюдения представлены в таблице 2. Общая выживаемость, канцерспецифическая выживаемость, безрецидивная выживаемость определялись через 5, 10 и 15 лет наблюдений. Кривые выживаемости для 15-летнего срока наблюдения представлены на рисунке 1.
Безрецидивная выживаемость по Каплану — Мейеру у всей группы больных составила 77,8 % при 15-летнем сроке наблюдении, при этом у пациентов с низким риском — 85,4 %, со средним риском — 80,7 % и у пациентов с высоким риском прогрессии — 69,7 % (рис. 2).
Осложнения. После HIFU-терапии осложнения были незначительными и краткосрочными. Учащенное мочеиспускание в первый месяц после вмешательства отмечалось у 36 (19 %) пациентов. Стрессовое недержание мочи I–II степени у 63 (32,5 %) пациентов (купировалось в течение 3–6 месяцев). Стриктуры простатического отдела уретры определялись у 31 (16 %) пациента (проведена трансуретральная оптическая уретротомия). Уретрально-прямокишечный свищ у 1 (0,5 %) пациента (закрылся самостоятельно в течение 6 месяцев после наложения эпицистостомы и колостомы) (табл. 3). Количество осложнений в группах первичного и спасительного HIFU отличались незначимо (p = 0,035).
Наименование | Значение |
Количество пациентов | 171 |
Возраст (лет), ср. значение; медиана (интервал) | 68,7; 69 (51–87) |
Размер простаты (куб. см), сред. значение; медиана (интервал) | 42,3; 40 (5,8–92,9) |
ПСА (нг/мл), сред. значение, интервал | 9,4 (4,0–20,0) |
Стадия, n (%) T1–T2 T3 |
112 (65,5) 59 (34,5) |
Глисон, n (%) ≤6 7 ≥8 |
130 (76,0) 28 (16,4) 13 (7,6) |
Категория риска по D’Amico 2003, n (%) Низкий риск Средний риск Высокий риск |
48 (27,3) 57 (40,2) 66 (32,5) |
Сеансов HIFU на пациента, n (%) 1 2 |
159 (93 %) 12 (7 %) |
Неоадъювантная гормонотерапия, n (%) Да Нет |
93 (54,4) 78 (45,6) |
Таблица 1. Характеристика пациентов и данные лечения
Table 1. Patient characteristics and treatment data
| Низкий риск прогрессии, % | Средний риск прогрессии, % | Высокий риск прогрессии, % | Все группы, % |
Общая выживаемость | ||||
5 лет наблюдений | 84,4 | 81,5 | 73,6 | 81,6 |
10 лет наблюдений | 73,2 | 72,0 | 52,2 | 75 |
15 лет наблюдений | 56,1 | 52,1 | 37,9 | 47,9 |
Канцерспецифическая выживаемость | ||||
5 лет наблюдений | 100 | 94,1 | 92,3 | 95,8 |
10 лет наблюдений | 91,3 | 85,5 | 81,7 | 88,2 |
15 лет наблюдений | 85,4 | 75,4 | 66,7 | 74,8 |
Безрецидивная выживаемость | ||||
5 лет наблюдений | 94,7 | 91,8 | 87,2 | 92,6 |
10 лет наблюдений | 93,9 | 87,2 | 72,5 | 86,5 |
15 лет наблюдений | 85,4 | 80,7 | 69,7 | 77,8 |
Таблица 2. Показатели общей выживаемости, канцерспецифической выживаемости, безрецидивной выживаемости, стратифицированные по предоперационной классификации риска прогрессии D’Amico
Table 2. Overall survival, cancer-specific survival, recurrence-free survival, classified according to the D’Amico progression risk scale
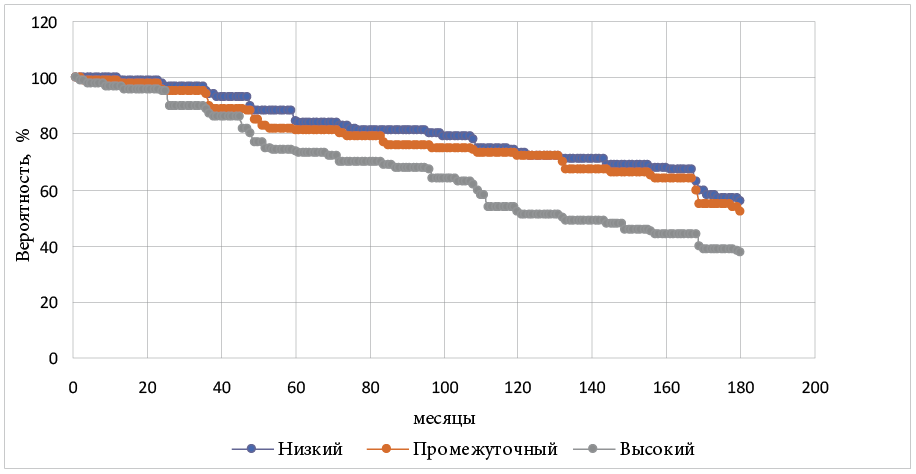
Рисунок 1. Общая выживаемость по Каплану — Мейеру для больных группы HIFU-терапии
Figure 1. Overall Kaplan — Meier survival for patients in the HIFU group
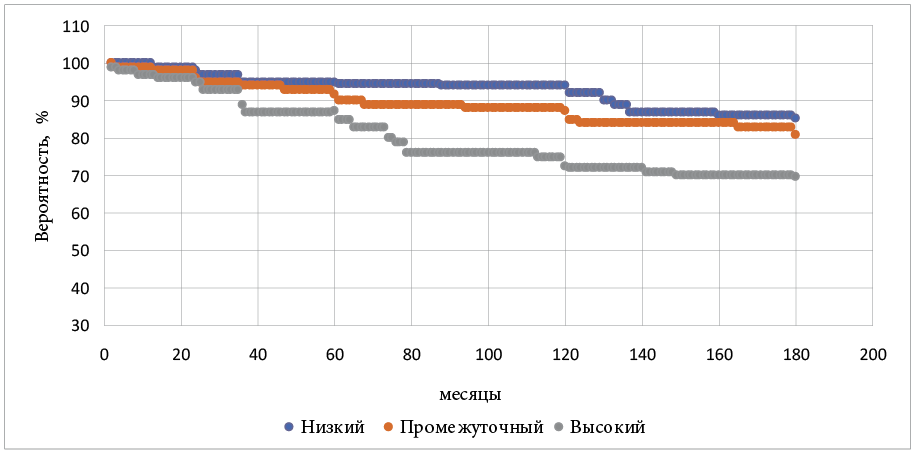
Рисунок 2. Безрецидивная выживаемость по Каплану — Мейеру для больных группы HIFU-терапии
Figure 2. Recurrence-free Kaplan — Meier survival for patients in the HIFU group
Осложнение | Количество пациентов/ % |
Учащенное мочеиспускание | 36/19,0 |
Стрессовое недержание мочи I–II степени | 63/32,5 |
Стриктура простатического отдела уретры | 31/16,0 |
Уретрально-прямокишечный свищ | 1/0,5 |
Таблица 3. Осложнения после HIFU-терапии
Table 3. Complications after HIFU therapy
ОБСУЖДЕНИЕ
Значительное количество осложнений, травматичность традиционных методов лечения РПЖ привели к развитию альтернативных малоинвазивных методов лечения. HIFU — одна из интенсивно изучаемых технологий. Хотя в последние годы чаще выполнятся фокальная HIFU-терапия, долгосрочные результаты HIFU всей предстательной железы имеют большое и решающее значение для доказательства ее онкологической эффективности.
В настоящем исследовании мы предоставили онкологические результаты долгосрочного наблюдения за 171 пациентом с РПЖ, пролеченным HIFU-терапией. Насколько нам известно, это одно из самых продолжительных наблюдений в мире и РФ из всех серий HIFU, с медианой наблюдения 14,3 года.
В отличие от нашего предыдущего исследования о 7-летнем наблюдении [5], где было уделено внимание в том числе и биохимическому рецидиву, в настоящем исследовании мы сделали акцент на анализе общей, безрецидивной и канцерспецифической выживаемости.
В то время как наши предыдущие результаты подтвердили, что HIFU всей железы является терапевтическим вариантом для пациентов пожилого возраста с низким и средним риском, текущее исследование добавляет важную информацию о его применении у пациентов с более высоким риском прогрессии. Показатели канцероспецической выживаемости для пациентов с низким и средним риском составили 91,3 и 85,5 % через 10 лет и 85,4 и 75,4 % через 15 лет соответственно, общей выживаемости — 73,2 и 72,0 % через 10 лет и 56,1 и 52,1 % через 15 лет соответственно, что подтверждают более ранние опубликованные исследования со значительно более короткими периодами наблюдения [2]. Несмотря на отсутствие проспективных сравнительных исследований с длительными периодами наблюдения, наши данные показывают, что HIFU всей железы может обеспечить долгосрочную онкологическую эффективность у пациентов с низким и средним риском прогрессии и ожидаемой продолжительностью жизни 10–15 лет, сравнимую с РПЭ.
При этом наши результаты показывают, что HIFU также возможно рекомендовать в качестве варианта первой линии для пациентов с высоким риском, поскольку показатели общей и канцерспецифичной выживаемости в 10/15 лет составляли 52,2/37,9 % и 88,2/74,8 % соответственно. Кроме того, группа пациентов с высоким риском прогрессии значительно повлияла на все конечные точки в нашем многофакторном анализе.
Определение неэффективности лечения после HIFU-терапии до сих пор является предметом споров. В отличие от общепринятого определения биохимического рецидива после РПЭ и дистанционной лучевой терапии (ДЛТ), после HIFU нет четко определенных критериев. Многие авторы использовали критерии Феникса (надир ПСА + 2 нг/мл), заимствованные из ДЛТ. Кроме того, был предложен «Штутгартский критерий» (надир ПСА + 1,2 нг/мл) [7], которым мы и руководствовались. При этом только около половины пациентов подверглись контрольной биопсии, чтобы исключить/подтвердить гистопатологический рецидив опухоли. Во многих случаях терапия спасения была начата исключительно из-за повышения уровня ПСА без гистопатологически доказанного рецидива. Роль повторного HIFU в определении неэффективности лечения спорна [8–11]. С одной стороны, повторная HIFU поддерживает первоначальный терапевтический подход в качестве альтернативы установленным радикальным методам лечения (РПЭ и ДЛТ). С другой стороны, разумно рассматривать любую последующую терапию рака при неудаче первоначального подхода.
В нашем исследовании предпочтительной терапией спасения (кроме повторного HIFU) в то время была ГТ для пациентов со средним и особенно высоким риском. В настоящее время визуализация на основе простатспецифического мембранного антигена часто позволяет более точно дифференцировать локальный и отдаленный рецидив опухоли с последующим индивидуальным подходом к спасительному лечению [12].
ЗАКЛЮЧЕНИЕ
Настоящее исследование предоставляет онкологические результаты 15-летнего наблюдения после HIFU-терапии при неметастатическом РПЖ, что является самым длительным наблюдением в РФ. HIFU-терапия обеспечила долгосрочную безрецидивную выживаемость у пациентов с низким и средним риском прогрессии, эффективность у пациентов с высоким риском была значительно ниже. Поэтому при лечении пациентов с высоким риском следует учитывать возможные варианты спасительного лечения. Долгосрочные данные HIFU-терапии предстательной железы имеют решающее значение для доказательства ее онкологической эффективности и могут помочь в выборе метода лечения и отборе пациентов.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Sponsorship data. This work is not funded.
Список литературы
1. Global Burden of Disease Cancer Collaboration; Fitzmaurice C., Akinyemiju T.F., Al Lami F.H., Alam T., Alizadeh-Navaei R., Allen C., et al. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 29 cancer groups, 1990 to 2016: A systematic analysis for the global burden of disease study. JAMA Oncol. 2018;4(11):1553–68. DOI: 10.1001/jamaoncol.2018.2706
2. Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.) Злокачественные новообразования в России в 2021 году (заболеваемость и смертность). М., 2022. 252 с.
3. Thuroff S., Chaussy C. Evolution and outcomes of 3 MHz high intensity focused ultrasound therapy for localized prostate cancer during 15 years. J Urol. 2013;190:702–10. DOI: 10.1016/j.juro.2013.02.010
4. Bründl J., Osberghaus V., Zeman F., Breyer J., Ganzer R., Blana A., et al. Oncological long-term outcome after whole-gland high-intensity focused ultrasound for prostate cancer-21-yr follow-up. Eur Urol Focus. 2022;8(1):134–40. DOI: 10.1016/j.euf.2020.12.016
5. Соловов В.А., Орлов А.Е., Воздвиженский М.О., Фесенко Д.В., Матяш Я.С., Копылов А.В. и др. Высокоинтенсивная фокусированная ультразвуковая абляция (HIFU) рака предстательной железы у 976 пациентов: 7-летние результаты. Известия Самарского научного центра Российской академии наук. 2015;17(2–3):682–5.
6. D’Amico A.V., Whittington R., Malkowicz S.B., Schultz D., Blank K., Broderick G.A., et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA. 1998;280(11):969–74. DOI: 10.1001/jama.280.11.969
7. Blana A., Brown S.C., Chaussy C., Conti G.N., Eastham J.A., Ganzer R., et al. High-intensity focused ultrasound for prostate cancer: comparative definitions of biochemical failure. BJU Int. 2009;104(8):1058–62. DOI: 10.1111/j.1464-410X.2009.08518.x
8. Guillaumier S., Peters M., Arya M., Afzal N., Charman S., Dudderidge T., et al. A multicentre study of 5-year outcomes following focal therapy in treating clinically significant nonmetastatic prostate cancer. Eur Urol. 2018;74(4):422–9. DOI: 10.1016/j.eururo.2018.06.006
9. Stabile A., Orczyk C., Hosking-Jervis F., Giganti F., Arya M., Hindley R.G., et al. Medium-term oncological outcomes in a large cohort of men treated with either focal or hemi-ablation using high-intensity focused ultrasonography for primary localized prostate cancer. BJU Int. 2019;124(3):431–40. DOI: 10.1111/bju.14710
10. Tourinho-Barbosa R.R., Sanchez-Salas R., Claros O.R., Collura-Merlier S., Bakavicius A., Carneiro A., et al. Focal therapy for localized prostate cancer with either high intensity focused ultrasound or cryoablation: a single institution experience. J Urol. 2020;203(2):320–30. DOI: 10.1097/JU.0000000000000506
11. Shah T.T., Peters M., Eldred-Evans D., Miah S., Yap T., Faure-Walker N.A., et al. Early-medium-term outcomes of primary focal cryotherapy to treat nonmetastatic clinically significant prostate cancer from a prospective multicentre registry. Eur Urol. 2019;76(1):98–105. DOI: 10.1016/j.eururo.2018.12.030
12. Maurer T., Robu S., Schottelius M., Schwamborn K., Rauscher I., van den Berg N.S., et al. 99mTechnetium-based prostate-specific membrane antigen-radioguided surgery in recurrent prostate cancer. Eur Urol. 2019;75(4):659–66. DOI: 10.1016/j.eururo.2018.03.013
Об авторах
В. А. СолововРоссия
Соловов Вячеслав Александрович — д.м.н., доцент, кафедра последипломного образования, отделение интервенционных методов диагностики и лечения
Самара
А. А. Тюрин
Россия
Тюрин Александр Александрович — аспирант, кафедра последипломного образования, отделение интервенционных методов диагностики и лечения, онкологическое отделение хирургических методов лечения
Самара
Рецензия
Для цитирования:
Соловов В.А., Тюрин А.А. Высокоинтенсивная фокусированная ультразвуковая абляция рака предстательной железы: 15 лет наблюдений. Креативная хирургия и онкология. 2023;13(4):271-277. https://doi.org/10.24060/2076-3093-2023-13-4-271-277
For citation:
Solovov V.A., Tiurin A.A. High-Intensity Focused Ultrasound Ablation of Prostate Cancer: 15 Years of Follow-up. Creative surgery and oncology. 2023;13(4):271-277. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-4-271-277


































