Перейти к:
Иммунная терапия злокачественных глиом: преодоление барьеров и перспективы комбинированных подходов
https://doi.org/10.24060/2076-3093-2024-14-4-351-359
Аннотация
Несмотря на значительное развитие иммунной терапии (ИТ) в последние годы и ее успешное применение при различных видах злокачественных новообразований, стандартные методы лечения злокачественных глиом, включая глиобластому, не претерпели значительных изменений. Основные препятствия для использования ИТ при этих опухолях связаны с уникальными особенностями микросреды, иммунодепрессивным статусом центральной нервной системы (ЦНС), защитной функцией гематоэнцефалического барьера и трудностями в интерпретации данных нейровизуализации. Кроме того, глиомы характеризуются низкой экспрессией PD-L1, низкой мутационной нагрузкой и высокой гетерогенностью, что ограничивает эффективность ИТ. Несмотря на это, клинические исследования показывают перспективные результаты при использовании ингибиторов контрольных точек иммунитета, вирусной терапии, вакцинации и адаптивной Т-клеточной терапии. Одним из многообещающих направлений является сочетание ИТ с лучевой терапией для усиления иммунного ответа. Дальнейшие исследования в этой области, включая разработку биомаркеров, специфичных для глиобластомы, и адаптацию ИТ к особенностям опухолевой микросреды, могут значительно улучшить исходы лечения злокачественных глиом.
Ключевые слова
Для цитирования:
Бейлерли О.А., Мусаев Э.Р., Бухвостов А.А. Иммунная терапия злокачественных глиом: преодоление барьеров и перспективы комбинированных подходов. Креативная хирургия и онкология. 2024;14(4):351-359. https://doi.org/10.24060/2076-3093-2024-14-4-351-359
For citation:
Beylerli O.A., Musaev E.R., Bukhvostov A.A. Immunotherapy for Malignant Gliomas: Overcoming Barriers and Defining Prospects for Integrated Approaches. Creative surgery and oncology. 2024;14(4):351-359. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-4-351-359
ВВЕДЕНИЕ
Развитие в области онкотерапии за последние годы, безусловно, связано с внедрением иммунной терапии (ИТ) в повседневную клиническую практику [1][2]. ИТ уже показала результаты при лечении различных типов опухолей, включая некоторые агрессивные формы рака, и в случае с меланомой ее адъювантное применение может стать обычной практикой. На фоне этих положительных клинических результатов возникает логичное ожидание, что иммунная терапия также принесет существенные улучшения в лечении тех типов опухолей, которые ранее поддавались лечению с минимальными результатами или считались резистентными к терапии. К этим видам опухолей относится группа злокачественных глиом, представляющая собой самые распространенные первичные опухоли ЦНС, включая глиобластому — наиболее агрессивную из них. За последние десятилетия в лечении глиобластомы, к сожалению, не произошло значительного улучшения результатов. Несмотря на многочисленные исследования и клинические испытания, пока нет иммунной терапии или других онкотерапевтических стратегий с высокоуровневой доказательной базой, способной изменить повседневную практику в лечении глиобластомы. Эта нехватка подтвержденных клинических результатов и специфический иммунологический статус ЦНС побуждают исследователей и клиницистов изучать эффективность не только иммунных контрольных точек (ингибиторов контрольных точек иммунитета, ИКТИ), но и других методов иммунной терапии. Есть ряд причин, по которым лечение пока не принесло ожидаемых результатов. В первую очередь ЦНС обладает уникальным иммунодепрессивным статусом и защитной системой (гематоэнцефалический барьер), из-за чего ее часто называют «иммунологическим убежищем». Цель данного обзора — обобщить факторы, которые осложняют адекватную работу иммунной системы в ЦНС, что снижает терапевтическую эффективность. Также работа предлагает краткий обзор текущих результатов и альтернативных методов иммунной терапии с кратким изложением основ взаимодействия иммунной и нервной систем для клиницистов.
Актуальные подходы к лечению глиом и глиобластомы
Глиомы составляют около двух третей всех первичных опухолей центральной нервной системы, и за последние десятилетия их стандартное лечение изменилось незначительно. Единственным прогрессом стало регулярное применение адъювантной химиотерапии для диффузных низкозлокачественных глиом высокого риска (по протоколу PCV или на основе темозоломида (TMZ)) [3]. Однако стандартный подход к лечению глиобластомы, который остается неизменным уже около 15 лет, включает проведение послеоперационной радиохимиотерапии на основе TMZ для пациентов с приемлемым состоянием [4][5]. Хотя понимание молекулярной патологии и прогноза заболевания (например, мутации IDH, амплификации EGFR или метилирования MGMT) стало более глубоким, терапевтический алгоритм остается неизменным. Для анапластических глиом по-прежнему рекомендуется последовательное проведение лучевой и химиотерапии [6]. При рецидиве возможны повторные операции, стереотаксическое переоблучение, альтернативная химиотерапия (например, BCNU) или чаще всего лечение бевацизумабом [7]. Эти терапевтические подходы значительно улучшились по сравнению с теми, что были 20–30 лет назад, однако при глиобластоме часто встречается ранний рецидив, резистентный к лечению, и медиана общей выживаемости по-прежнему не превышает полутора лет [8]. Поэтому необходимость в разработке новых методов лечения остается высокой, и специалисты в области нейроонкологии с большим интересом ожидают первых положительных результатов от применения иммунной терапии (рис. 1).
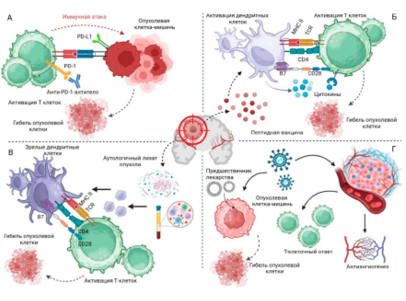
Рисунок 1. Иллюстрация методов иммунотерапии глиобластомы: А — ингибиторы контрольных иммунных точек (анти-PD-1); Б — вакцины на основе антигенных пептидов; В — вакцины на основе дендритных клеток (DCVax-L); Г— виротерапия
Figure 1. Immunotherapy methods for glioblastoma: A — immune checkpoint inhibitors (anti-PD-1); Б — antigen peptide-based vaccines; В — dendritic cell-based vaccines (DCVax-L); Г — virotherapy
Центральная нервная система как «иммунологическое убежище»
Специфический иммунологический статус ЦНС известен уже несколько десятилетий. В научной литературе до сих пор нередко упоминается, что ЦНС является «иммунологическим убежищем» благодаря существованию гематоэнцефалического барьера (ГЭБ), отсутствию конвенциональных лимфатических путей и уникальному защитному механизму, включающему специфические клеточные элементы. Хотя исследования последних лет показывают, что в ЦНС существует сильный иммунный ответ, иммунные клетки проникают в мозг даже через здоровый гематоэнцефалический барьер и есть собственная лимфатическая система, глиомы и их микросреда характеризуются подавленным иммунным состоянием [9]. Эти факторы, а также регулярное применение стероидных препаратов при опухолях головного мозга, могут затруднять эффективность иммунной терапии и управление побочными эффектами. В следующих разделах обобщены особенности иммунологического статуса ЦНС и факторы, усложняющие проведение иммунной терапии в этих условиях.
Защитная роль гематоэнцефалического барьера
ГЭБ состоит из плотно соединенных эндотелиальных клеток капилляров мозга, образующих двойную базальную мембрану, соединенную с отростками окружающих глиальных клеток. Этот барьер является физическим и функциональным фильтром, обеспечивающим первичную защиту ЦНС от различных вредных веществ, патогенов, токсинов, лекарственных средств и других макромолекул, которые могут попасть в кровоток [10]. Эта система защиты, препятствуя свободному проникновению клеток и молекул иммунной системы в ЦНС, объясняет низкое количество лимфоцитов в нормальных условиях в ЦНС. Существуют обходные пути, через которые иммунные клетки могут проникать в мозг, такие как посткапиллярные и лептоменингеальные вены или сосудистое сплетение, где они чаще всего обнаруживаются в периваскулярной области. В случае глиобластомы ГЭБ обычно нарушен из-за аномального кровоснабжения, вызванного опухолевыми клетками, что облегчает взаимодействие между иммунной системой и опухолевыми клетками [11]. Однако крупные иммунные препараты могут не проходить через неповрежденный барьер или не достигать опухоли в достаточной концентрации из-за микрососудистых изменений и повышенного давления в тканях. Некоторые локальные терапевтические методы, такие как радиотерапия, могут нарушать целостность ГЭБ, что облегчает проникновение ингибиторов PD-1/PD-L1 (программируемая клеточная гибель 1 (PD-1) и его лиганд (PD-L1)) в ЦНС [12].
Иммунодепрессивное действие стероидов
Одним из характерных ответов ЦНС на любое повреждение является формирование отека. При опухолях головного мозга само заболевание и его терапия часто усиливают склонность к отекам. Радиационный отек связан с каскадной реакцией, в которой основным фактором является повышенная проницаемость капилляров после облучения. Это приводит к неконтролируемой миграции жидкости и ионов в межклеточное пространство и проникновению биологически активных веществ через поврежденные барьеры, что особенно выражено вблизи патологических сосудов опухоли или хирургических дефектов. Этот усиленный отек со временем приводит к неврологическим и психическим симптомам, а прогрессирование может привести к повышению внутричерепного давления и даже к жизнеугрожающему состоянию. Наиболее эффективными средствами для устранения опухолевого или терапевтического отека являются различные диуретики, такие как осмотические мочегонные средства (маннит, глицерин) и кортикостероиды (дексаметазон, метилпреднизолон). В нейроонкологии для длительного лечения первичных и метастатических опухолей головного мозга предпочтение отдается стероидам [13]. Многие центры используют стероиды для профилактики отека у пациентов с опухолями головного мозга. Часто отменить эти препараты невозможно из-за развития зависимости у пациентов. Известно, что длительная стероидная терапия может значительно снизить эффективность иммунной терапии, например снижая количество периферических CD4+ и CD8+ Т-клеток [14][15]. Большинство клинических исследований по ИТ не допускают включение пациентов, находящихся на длительной стероидной терапии, хотя дозировки и другие ограничивающие факторы до сих пор точно не определены. Однако некоторые исследователи полагают, что стероидная терапия не всегда является абсолютным противопоказанием для ингибиторов PD-1/PD-L1 [16]. Предполагается также, что влияние стероидов на иммунную терапию менее выражено в случае опухолей ЦНС [17].
Оценка изображений опухолей мозга: сложности и ограничения
Оценка изображений ЦНС и связанных с ней патофизиологических процессов часто представляет трудности, что усложняет определение эффективности иммунной терапии. Известно, что в случае рецидивирующей глиобластомы, которая ранее подвергалась лучевой терапии, в тканевых образцах часто обнаруживаются как активные опухолевые очаги, так и некротические участки и зоны радионекроза. Эти области смешиваются в пределах опухоли, что затрудняет оценку морфологических и функциональных изображений, а также дифференциацию радионекроза и рецидива заболевания. Примечательно, что феномен псевдопрогрессии, хорошо известный в иммунной терапии, впервые был описан именно при наблюдении за опухолями ЦНС после лучевой терапии [18–22]. Определить прогрессирование у пациента с глиобластомой, находящегося под наблюдением, бывает трудно. Помимо данных визуализации, при постановке диагноза учитываются степень облучения пораженного участка, реакция окружающих тканей, клиническое состояние пациента и стероидная зависимость. Сложность ситуации заключается также в псевдопрогрессии, особенно после стероидной или антиангиогенной терапии [23]. В связи с этим оценка эффективности иммунной терапии в случаях предварительно облученных глиом затруднена, и специалисты рекомендуют рутинное использование критериев iRANO (immunotherapy response assessment for neuro-oncology, разработаны для оценки эффективности иммунотерапии в нейроонкологии), а также разработку новых диагностических методов МРТ или ПЭТ [11][14][18][24].
Микросреда глиом: иммунодепрессивный статус
ЦНС имеет особый иммунный статус, и в нормальных условиях в мозговой ткани находится лишь небольшое количество иммунных клеток, а основную иммунную функцию выполняют микроглиальные клетки, макрофаги и дендритные клетки [25]. Однако по сравнению с другими типами опухолей в опухолях ЦНС, особенно в глиомах, доля стромальных элементов, таких как астроциты, олигодендроциты и иммунные клетки, составляет не менее 30–40 %. В опухолевой микросреде часто встречаются следующие клеточные элементы: микроглия, дендритные клетки, макрофаги типов M1 и M2, миелоидные супрессорные клетки (MDSC), NK-клетки (естественные киллеры или натуральные киллеры), Т-лимфоциты (CD4+ и CD8+), а также регуляторные Т-клетки [26]. По сравнению с другими опухолями глиомы имеют меньшее количество лимфоцитов, крайне низкое число эффекторных CD8+ Т-клеток и низкое соотношение CD8+/CD4+ Т-клеток. При этом микроглия и опухолеассоциированные макрофаги обладают подавляющим иммунным эффектом [27][28]. Кроме того, сами опухолевые клетки способны блокировать нормальные иммунные реакции, например снижая активность дендритных клеток (ДК) через выработку PGE2, IL-10 и VEGF [25]. Также в опухолевой микросреде наблюдается высокое содержание иммунодепрессивных регуляторных Т-клеток и выделение цитокинов, таких как TGF-β и PGE2, а также увеличенное количество макрофагов с ингибирующим эффектом типа M2 [11][14]. Примечательно, что иммунодепрессивное состояние при глиобластоме проявляется также системно, изменяя количество и соотношение циркулирующих лейкоцитов [28][29]. Глиобластома чаще всего поражает пожилых людей. С возрастом уровень иммунодепрессивных ферментов, таких как IDO, и некоторых поверхностных маркеров ДК, например CD11c, в мозговой ткани возрастает, а количество регуляторных Т-клеток в крови увеличивается, при этом число CD8+ Т-клеток сокращается. Высокая активность IDO особенно характерна для агрессивного подтипа глиобластомы с диким типом IDH, что, вероятно, объясняет повышенную заболеваемость в пожилом возрасте и ухудшение прогноза для возрастных пациентов, а также ограниченную эффективность иммунной терапии [30].
Низкая экспрессия PD-l1, низкая мутационная нагрузка, гетерогенность и гипоксия
Экспрессия белка PD-L1 у пациентов с опухолями ЦНС, включая глиомы, как правило, ниже, чем у пациентов с другими типами опухолей, хотя существуют данные, варьирующиеся от 3 до 88 % положительных результатов. Это усложняет активацию противоопухолевого иммунного ответа при использовании ИКТИ [31]. Помимо низкой экспрессии PD-L1, глиомы характеризуются низкой мутационной нагрузкой (НМН), которая служит и негативным прогностическим фактором для эффективного ответа на иммунную терапию [32]. Среди образцов глиобластомы почти невозможно найти такой, который был бы положительным по всем биомаркерам, предсказывающим эффективность ИКТИ (PD-L1+, высокая НМН, MSI).
Следует отметить, что пространственная и временная гетерогенность опухоли является одной из основных преград для любой терапии, и глиобластома в этом отношении является одной из самых гетерогенных опухолей, что дополнительно затрудняет как таргетную, так и иммунную терапию [9][25]. Быстрый рост глиобластомы, высокая степень некроза и нарушенная микроциркуляция также могут затруднять адекватное функционирование иммунной системы (табл. 1).
Фактор | Описание |
Иммунодепрессивная среда | ЦНС характеризуется низким числом иммунных клеток, таких как CD8+ Т-лимфоциты, и высокой долей иммунодепрессивных клеток, включая регуляторные Т-клетки и макрофаги типа M2. Это создает неблагоприятную среду для иммунной активации и снижает эффективность терапии |
Гематоэнцефалический барьер | Физический барьер, ограничивающий проникновение иммунных клеток и крупных молекул в мозговую ткань. |
Регулярное применение стероидов | Длительное использование стероидов, применяемых для контроля отеков и воспалений, снижает количество Т-лимфоцитов в периферической крови и препятствует нормальной работе иммунной системы. Это особенно заметно при попытках применения иммунных методов терапии, таких как ингибиторы контрольных точек |
Сложности визуализации | При оценке изображений ЦНС сложно отличить прогрессирование заболевания от псевдопрогрессии, вызванной иммунной терапией или лучевой терапией. Это затрудняет принятие решений о продолжении или корректировке лечения, так как радионекроз и активные опухолевые клетки могут выглядеть схоже |
Низкая экспрессия PD-L1 | В сравнении с другими типами опухолей глиомы характеризуются низкой экспрессией белка PD-L1, который необходим для успешного ответа на ингибиторы PD-1/PD-L1. Это снижает шансы на успешное использование этих препаратов |
Низкая мутационная нагрузка | Глиомы обычно обладают низкой мутационной нагрузкой, что ограничивает создание новых антигенов, способных стимулировать иммунный ответ. Это делает опухоли менее восприимчивыми к иммунной терапии, которая ориентируется на иммуногенные антигены |
Гетерогенность опухоли | Глиобластома известна своей высокой степенью клеточной и молекулярной гетерогенности. Это приводит к различиям в ответе на терапию и делает трудным выбор универсальной стратегии лечения |
Гипоксия и некротические участки | Гипоксические условия и некроз, характерные для быстрорастущих глиом, ухудшают доставку кислорода и питательных веществ, что снижает иммунную активность и ограничивает эффективность Т-клеточных ответов |
Таблица 1. Основные факторы, влияющие на эффективность иммунной терапии при глиомах
Table 1. Key factors influencing the effectiveness of immunotherapy in gliomas
Клинические подходы к иммунной терапии глиом
Несмотря на перечисленные выше трудности и сложности в применении иммунной терапии для опухолей ЦНС, множество клинических исследований, направленных на изучение иммунных методов лечения злокачественных глиом, продолжаются. Хотя на данный момент ни одно исследование III фазы не продемонстрировало значимого увеличения выживаемости, многообещающие промежуточные результаты и успешные случаи побуждают исследователей инициировать все больше комбинированных исследований и проводить биомаркерные исследования. Тем не менее из-за возможных серьезных побочных эффектов, таких как риск аутоиммунного энцефалита, при разработке протоколов требуется особая осторожность [9]. Важно отметить, что исследования все чаще дифференцируют различные прогностические подтипы глиобластомы (например, проневральный, нейрональный, классический и мезенхимальный подтипы) для разработки более точных подходов к лечению [11][32].
Хотя значительный прорыв пока ожидается, ниже представлены основные направления иммунной терапии, имеющиеся клинические результаты и выводы. Из множества методов ИТ и их комбинаций в настоящее время наиболее часто исследуются ИКТИ, а также вакцины, вирусная терапия и терапия на основе CAR-T-клеток. В заключение также кратко рассматривается возможное комбинированное использование иммунной и лучевой терапии [9][28].
Применение ингибиторов контрольных точек иммунитета в нейроонкологии
После того как ИКТИ произвели революцию в лечении злокачественных форм других типов опухолей, было основание ожидать аналогичного прорыва и в случае с глиомами [14][32]. Однако подавляющий иммунный фон, неблагоприятные микроокружение и циркуляторные факторы, а также высокая гетерогенность и общая резистентность к лечению пока не позволили продемонстрировать клиническую эффективность. Тем не менее большинство текущих исследований клинических испытаний по лечению глиобластомы сосредоточено на применении ингибиторов PD-1, таких как ниволумаб и пембролизумаб, часто в комбинации с другими методами [11][32].
Исследование III фазы CheckMate-143, в котором сравнивали эффекты ниволумаба и бевацизумаба, не показало преимуществ в увеличении выживаемости. Одним из объяснений провала терапии было не только наличие иммунодепрессивной среды, но и противоотечное и иммуномодулирующее действие бевацизумаба, которое снижало потребность в стероидах. Однако стоит отметить, что среди долгоживущих пациентов было больше тех, кто получал ИТ, и у пациентов с дефицитом системы исправления ошибок репликации ДНК (MMR) и гипермутациями ИКТИ-терапия показала лучшие результаты [33]. Для преодоления этих трудностей предлагается использовать комбинации препаратов. Например, продолжающиеся исследования CheckMate-498 и –548 изучают эффект комбинации ИТ с радиохимиотерапией [31][32].
Вирусная иммунотерапия
Идея использования вирусов для иммунотерапии возникла более двух десятилетий назад, и первые экспериментальные исследования были проведены именно на глиомах. Принцип вирусной терапии заключается в том, что при введении онколитических вирусов непосредственно в опухоль они вызывают воспалительную реакцию, иммуногенную клеточную гибель и распад клеток, что способствует высвобождению антигенов и активирует иммунный ответ. Вирусную терапию иногда рассматривают как своего рода вакцинацию. Некоторые исследователи считают, что именно вторичный иммунный ответ на вирусную терапию является ее основным механизмом действия, особенно в иммунодепрессивной среде, характерной для глиобластомы, что может сыграть роль триггера. Доказано, что такая терапия эффективна в сочетании с радиотерапией и TMZ, и, хотя вирус действует преимущественно локально, он может также оказывать системное воздействие, особенно при одновременном приеме стероидов. Важную роль в этом процессе играет активность интерфероновых путей [28]. С помощью генетических модификаций в вирусы можно внедрять гены, кодирующие иммуногенные белки (например, интерлейкины) или производные химиотерапевтических препаратов. Иммуногенный эффект вирусной терапии был подтвержден в нескольких моделях на животных, и аналогичный эффект наблюдался в клинических испытаниях с использованием адено-, ретро-, полио- и парвовирусов [28]. На снимках этот эффект проявляется в виде псевдопрогрессии и усиленного перифокального отека. В связи с этим кажется логичным комбинировать вирусную терапию с ИКТИ, и уже имеются положительные результаты доклинических исследований с использованием вирусов Ньюкасла и аденовирусов. Кроме того, интерес представляет системное применение вирусной терапии, особенно нейротропных агентов, которые могут транспортироваться в ЦНС через циркулирующие белые клетки крови, такие как моноциты (эффект «троянского коня»). На фоне перспективных доклинических данных множество клинических исследований вирусной терапии также находятся в стадии реализации, и уже существуют единичные отчеты о полном регрессе опухоли у пациентов с глиобластомой [34][35].
Вакцинация против опухоли: результаты
Концепция вакцинации против опухолей для стимуляции активного иммунного ответа существует уже несколько десятилетий и, как и следовало ожидать, широко исследуется на глиомах. С учетом центральной роли ДК в высвобождении воспалительных факторов, инициировании иммунного ответа, представлении антигенов и активизации Т-клеток, наиболее изученной формой является ДК-вакцинация [25]. Однако дендритные клетки сами по себе не всегда генерируют достаточный иммунный ответ, поэтому часто их применение сочетается с добавлением различных опухолевых лизатов, антител к TGF-β, экзосом или даже NK-клеток. Для достижения более целенаправленного иммунного ответа перспективным считается введение опухолеспецифических антигенов, например EGFRvIII [36].
Сейчас проводится множество клинических испытаний с использованием ДК-вакцин. Наиболее обнадеживающими являются промежуточные данные первого исследования III фазы, в котором вакцинация дендритными клетками была использована для лечения пациентов с впервые диагностированной глиобластомой в сочетании с поддерживающей терапией TMZ. У пациентов, получавших вакцину (в некоторых случаях после переключения с других методов лечения), медиана выживаемости достигла двух лет, при этом серьезных побочных эффектов не наблюдалось [37]. Стоит отметить, что для производства таких «адаптированных» вакцин требуется значительное количество ткани, полученной при операции [9].
На сегодняшний день клиническое место ДК-вакцинации еще не определено, и в большинстве клинических испытаний ее используют в комбинациях (например, с ингибиторами PD-1). Есть также возможность ее адъювантного использования, однако до сих пор неясно, в какой степени ее эффекты могут быть усилены при использовании с традиционными методами онкотерапии [25]. Вакцинация также возможна не только с использованием дендритных клеток, но и с применением других опухолевых компонентов, опухолеассоциированных пептидов (например, эфрин, сурвивин), фрагментов ДНК или других клеточных элементов, таких как NK-клетки. Недавно был опубликован результат давно ожидаемого, но не принесшего успеха исследования III фазы (ACT IV), в котором изучалось влияние вакцины на основе конъюгата белка EGFRvIII и гемоцианина, риндоцепимута, в комбинации с традиционной терапией у пациентов с впервые диагностированной EGFRvIII-положительной глиобластомой. Однако и в контрольной группе медиана выживаемости достигала 20 месяцев, что не позволило продемонстрировать значимого преимущества [38].
Адаптивная Т-клеточная терапия
Технология терапии с использованием Т-клеток, модифицированных для экспрессии химерного рецептора антигена (CAR), произвела значительный прорыв в лечении гематологических заболеваний. Логично, что возникли надежды на ее применение и для лечения солидных опухолей, таких как глиомы [39]. Суть метода состоит в том, что аутологичные Т-клетки пациента, модифицированные с помощью вирусных векторов для распознавания опухолеассоциированных антигенов (например, CD19 и CD20 для B-клеточных лимфом), возвращают в организм, что стимулирует иммунный ответ и может обеспечить долгосрочный противоопухолевый эффект за счет формирования иммунной памяти. В случаях, когда аутологичные клетки недоступны, могут быть использованы универсальные CAR-T-клетки. В качестве мишеней для лечения солидных опухолей рассматриваются раково-эмбриональные антигены (РЭА), муцин-1, мезотелин, HER2 и другие опухолеассоциированные антигены (ОАА). Однако ОАА не всегда обладают высокой иммуногенностью, и CAR-T-клетки не всегда достигают своей цели, поскольку могут быть подавлены иммунодепрессивным влиянием опухолевого окружения. Кроме того, существует вероятность, что здоровые ткани также экспрессируют эти антигены, что увеличивает риск побочных эффектов. В процессе дальнейшей разработки CAR-T-терапии рассматривается поиск новых специфических антигенов, таргетирование нескольких антигенов одновременно, блокирование патологического роста сосудов, доставка и удержание Т-клеток непосредственно в опухоли, а также ослабление иммунодепрессивного окружения опухоли. Другие стратегии предполагают использование комбинаций иммунных терапий, включение антигенов, вызванных традиционной онкотерапией (неоантигенов), а также разработку Т-клеточной терапии, направленной против этих неоантигенов [39]. В случае глиобластомы разработаны различные адаптивные Т-клеточные терапии с использованием генетически модифицированных клеток для запуска иммунного ответа, не зависящего от ГКГ (главный комплекс гистосовместимости). В настоящее время тестируются различные CAR-T-клетки, нацеленные на такие антигены, как EGFRvIII, HER2 и определенные интерлейкин-рецепторы, экспрессируемые глиальными клетками [11][39]. На данный момент, несмотря на наличие множества текущих исследований и некоторых эффектов у отдельных пациентов, обширные клинические результаты все еще ограничены, так как терапия может усиливать иммунодепрессивное влияние опухолевой среды, что затрудняет достижение устойчивых клинических результатов [40].
Совмещение лучевой и иммунной терапии
Глиомы считаются инфильтративными и локально агрессивными опухолями, поэтому лучевая терапия остается одним из наиболее значимых методов лечения. Почти все пациенты с глиомами подвергаются облучению, а в случае рецидива все чаще применяется дополнительная стереотаксическая радиотерапия. В связи с этим комбинация лучевой и иммунной терапии представляется многообещающим направлением для будущих комбинированных методов лечения. С течением времени было получено больше данных о взаимодействиях между этими методами, о так называемом абскопальном эффекте и возможностях их клинического применения [11][41]. Применение лучевой терапии вызывает иммуногенную клеточную гибель, способствует высвобождению ОАА или неоантигенов и увеличивает мутационную нагрузку. Это сопровождается усиленной экспрессией ГКГ, выделением тепловых шоковых белков и повышением уровня некоторых цитокинов, таких как интерферон, что активирует Т-клетки, ДК и NK-клетки и вызывает их проникновение в опухолевую ткань. Результатом этого может быть аддитивный или синергический эффект, хотя на данный момент остается неясным оптимальное количество фракций и дозировка облучения [11][41].
Предклинические исследования показали обнадеживающие результаты на моделях глиом, где лучевая терапия сочеталась с ингибиторами PD-1 или ко-стимуляторными агонистическими антителами, такими как CD137 и 4–1BB [11][32][41]. На клиническом уровне также были получены первые результаты при сочетанном применении ингибиторов контрольных точек или ингибиторов TGF-β и IDO с лучевой терапией [11]. Ведутся исследования, изучающие комбинации облучения с различными цитокинами, вакцинами и CAR-T-клетками (табл. 2).
Метод иммунной терапии | Описание |
Ингибиторы контрольных точек иммунитета | Ингибиторы контрольных точек, такие как ниволумаб и пембролизумаб, блокируют белки, которые препятствуют активации Т-клеток, и способствуют более активному атакующему ответу на опухоль. Однако их эффективность при глиомах ограничена низкой экспрессией PD-L1 и другими факторами, такими как иммунодепрессивная микросреда |
Вирусная терапия | Онколитические вирусы вводятся непосредственно в опухоль и вызывают иммуногенную гибель клеток, что приводит к высвобождению антигенов и активации иммунного ответа. Вирусная терапия может иметь как локальные, так и системные эффекты, усиливая противоопухолевый иммунный ответ |
Вакцинация против опухоли | Вакцины на основе дендритных клеток и других компонентов активируют иммунную систему, помогая ей распознавать и атаковать опухолевые клетки. ДК-вакцины часто комбинируются с другими методами для усиления эффекта, такими как использование специфических опухолевых антигенов (например, EGFRvIII) |
Адаптивная Т-клеточная терапия (CAR-T) | CAR-T-клетки модифицируются для экспрессии химерных рецепторов, которые распознают и связываются с опухолевыми антигенами. Этот метод продемонстрировал успех при лечении гематологических опухолей, но сталкивается с трудностями при использовании для солидных опухолей, таких как глиомы, из-за сложности доставки клеток и воздействия иммунодепрессивной среды |
Комбинированная терапия с облучением | Сочетание лучевой терапии с ИТ помогает усилить иммунный ответ за счет высвобождения антигенов и активации иммунных клеток. Это может способствовать синергетическому эффекту, при котором лучевая терапия способствует проникновению и активности иммунных агентов в опухолевой ткани |
Таблица 2. Основные подходы к иммунной терапии глиом
Table 2. Primary approaches to immunotherapy for gliomas
ЗАКЛЮЧЕНИЕ
В связи с тем что терапевтические результаты при злокачественных глиомах, особенно при глиобластоме, остаются весьма скромными, возникает острая необходимость в поиске новых методов лечения. Поэтому неудивительно, что именно в области ИТ, которая в последние годы оказалась одной из самых успешных в онкотерапии, ведутся наиболее интенсивные исследования [9][26][42]. В октябре 2024 года крупнейший медицинский поисковик PubMed выдал более 5200 публикаций по запросу «иммунная терапия и глиома» и более 3500, если ограничить запрос только глиобластомой. Каждый год появляется более 400 новых публикаций на эту тему. На сайте Clinicaltrials.gov представлено в общей сложности 152 клинических исследования, связанных с ИТ для глиом, из которых 63 — активные, и 120 исследований, нацеленных на глиобластому, из которых 48 продолжаются. Эти цифры подтверждают актуальность и значимость данной темы. К сожалению, до сих пор не проведено ни одного завершенного клинического исследования III фазы с положительными результатами, способного повлиять на клиническую практику. Однако на основании предварительных данных и единичных случаев можно надеяться, что ИТ станет важной частью стандартного лечения первичных опухолей ЦНС в ближайшие годы. При этом исследователям и клиницистам еще предстоит преодолеть множество уникальных трудностей, упомянутых выше. Не менее важно обеспечить тесное взаимодействие между фундаментальными исследованиями, молекулярной диагностикой и клинической практикой. Есть надежда, что будущие исследования позволят достичь значительных улучшений в лечении злокачественных глиом, одной из самых сложных для лечения опухолей.
Список литературы
1. Abdel-Rahman S.A., Gabr M. Small molecule immunomodulators as next-generation therapeutics for glioblastoma. Cancers (Basel). 2024;16(2):435. DOI: 10.3390/cancers16020435
2. Yuan F., Wang Y., Ma C. Current WHO Guidelines and the critical role of genetic parameters in the classification of glioma: opportunities for immunotherapy. Curr Treat Options Oncol. 2022;23(2):188–98. DOI: 10.1007/s11864-021-00930-4
3. McDuff S.G.R., Dietrich J., Atkins K.M., Oh K.S., Loeffler J.S., Shih H.A. Radiation and chemotherapy for high-risk lower grade gliomas: Choosing between temozolomide and PCV. Cancer Med. 2020;9(1):3–11. DOI: 10.1002/cam4.2686
4. Hart M.G., Garside R., Rogers G., Stein K., Grant R. Temozolomide for high grade glioma. Cochrane Database Syst Rev. 2013;2013(4):CD007415. DOI: 10.1002/14651858.CD007415.pub2
5. Sahoo L., Paikray S.K., Tripathy N.S., Fernandes D., Dilnawaz F. Advancements in nanotheranostics for glioma therapy. Naunyn Schmiedebergs Arch Pharmacol. 2024 Oct 31. DOI: 10.1007/s00210-024-03559-w
6. van den Bent M.J., Baumert B., Erridge S.C., Vogelbaum M.A., Nowak A.K., Sanson M., et al. Interim results from the CATNON trial (EORTC study 26053-22054) of treatment with concurrent and adjuvant temozolomide for 1p/19q non-co-deleted anaplastic glioma: a phase 3, randomised, open-label intergroup study. Lancet. 2017;390(10103):1645–53. DOI: 10.1016/S0140-6736(17)31442-3. Erratum in: Lancet. 2017;390(10103):1644. DOI: 10.1016/S0140-6736(17)32438-8
7. Rodríguez-Camacho A., Flores-Vázquez J.G., Moscardini-Martelli J., Torres-Ríos J.A., Olmos-Guzmán A., Ortiz-Arce C.S., et al. Glioblastoma treatment: state-of-the-art and future perspectives. Int J Mol Sci. 2022;23(13):7207. DOI: 10.3390/ijms23137207
8. Rock K., McArdle O., Forde P., Dunne M., Fitzpatrick D., O’Neill B., et al. A clinical review of treatment outcomes in glioblastoma multiforme--the validation in a non-trial population of the results of a randomised Phase III clinical trial: has a more radical approach improved survival? Br J Radiol. 2012;85(1017):e729–33. DOI: 10.1259/bjr/83796755
9. Rocha Pinheiro S.L., Lemos F.F.B., Marques H.S., Silva Luz M., de Oliveira Silva L.G., Faria Souza Mendes Dos Santos C., et al. Immunotherapy in glioblastoma treatment: Current state and future prospects. World J Clin Oncol. 2023;14(4):138–59. DOI: 10.5306/wjco.v14.i4.138
10. Arvanitis C.D., Ferraro G.B., Jain R.K. The blood-brain barrier and blood-tumour barrier in brain tumours and metastases. Nat Rev Cancer. 2020;20(1):26–41. DOI: 10.1038/s41568-019-0205-x
11. Dapash M., Castro B., Hou D., Lee-Chang C. Current immunotherapeutic strategies for the treatment of glioblastoma. Cancers (Basel). 2021;13(18):4548. DOI: 10.3390/cancers13184548
12. Abid H., Watthanasuntorn K., Shah O., Gnanajothy R. Efficacy of pembrolizumab and nivolumab in crossing the blood brain barrier. Cureus. 2019;11(4):e4446. DOI: 10.7759/cureus.4446
13. Mangel L., Vönöczky K., Hanzély Z., Kiss T., Agoston P., Somogy A., et al. CT densitometry of the brain: a novel method for early detection and assessment of irradiation induced brain edema. Neoplasma. 2002;49(4):237–42.
14. Huang B., Zhang H., Gu L., Ye B., Jian Z., Stary C., et al. Advances in immunotherapy for glioblastoma multiforme. J Immunol Res. 2017;2017:3597613. DOI: 10.1155/2017/3597613
15. Maxwell R., Luksik A.S., Garzon-Muvdi T., Hung A.L., Kim E.S., Wu A., et al. Contrasting impact of corticosteroids on anti-PD-1 immunotherapy efficacy for tumor histologies located within or outside the central nervous system. Oncoimmunology. 2018;7(12):e1500108. DOI: 10.1080/2162402X.2018.1500108
16. Garant A., Guilbault C., Ekmekjian T., Greenwald Z., Murgoi P., Vuong T. Concomitant use of corticosteroids and immune checkpoint inhibitors in patients with hematologic or solid neoplasms: A systematic review. Crit Rev Oncol Hematol. 2017;120:86–92. DOI: 10.1016/j.critrevonc.2017.10.009
17. Fujii T., Colen R.R., Bilen M.A., Hess K.R., Hajjar J., Suarez-Almazor M.E., et al. Incidence of immune-related adverse events and its association with treatment outcomes: the MD Anderson Cancer Center experience. Invest New Drugs. 2018;36(4):638–46. DOI: 10.1007/s10637-017-0534-0
18. Aquino D., Gioppo A., Finocchiaro G., Bruzzone M.G., Cuccarini V. MRI in glioma immunotherapy: evidence, pitfalls, and perspectives. J Immunol Res. 2017;2017:5813951. DOI: 10.1155/2017/5813951
19. Okan Cakir M., Kirca O., Gunduz S., Ozdogan M. Hyperprogression after immunotherapy: A comprehensive review. J BUON. 2019;24(6):2232–41
20. Brandsma D., Stalpers L., Taal W., Sminia P., van den Bent M.J. Clinical features, mechanisms, and management of pseudoprogression in malignant gliomas. Lancet Oncol. 2008;9(5):453–61. DOI: 10.1016/S1470-2045(08)70125-6
21. Young J.S., Al-Adli N., Scotford K., Cha S., Berger M.S. Pseudoprogression versus true progression in glioblastoma: what neurosurgeons need to know. J Neurosurg. 2023;139(3):748–59. DOI: 10.3171/2022.12.JNS222173
22. Gatson N.T.N., Makary M., Bross S.P., Vadakara J., Maiers T., Mongelluzzo G.J., et al. Case series review of neuroradiologic changes associated with immune checkpoint inhibitor therapy. Neurooncol Pract. 2020;8(3):247–58. DOI: 10.1093/nop/npaa079
23. Cuoco J.A., Klein B.J., Busch C.M., Guilliams E.L., Olasunkanmi A.L., Entwistle J.J. Corticosteroid-Induced Regression of Glioblastoma: A Radiographic Conundrum. Front Oncol. 2019;9:1288. DOI: 10.3389/fonc.2019.01288
24. Chen D., Zhang R., Huang X., Ji C., Xia W., Qi Y., et al. MRI-derived radiomics assessing tumor-infiltrating macrophages enable prediction of immune-phenotype, immunotherapy response and survival in glioma. Biomark Res. 2024;12(1):14. DOI: 10.1186/s40364-024-00560-6
25. Srivastava S., Jackson C., Kim T., Choi J., Lim M. A Characterization of dendritic cells and their role in immunotherapy in glioblastoma: from preclinical studies to clinical trials. Cancers (Basel). 2019;11(4):537. DOI: 10.3390/cancers11040537
26. Xu S., Tang L., Li X., Fan F., Liu Z. Immunotherapy for glioma: Current management and future application. Cancer Lett. 2020;476:1–12. DOI: 10.1016/j.canlet.2020.02.002
27. Huang R., Lu X., Sun X., Wu H. A novel immune cell signature for predicting glioblastoma after radiotherapy prognosis and guiding therapy. Int J Immunopathol Pharmacol. 2024;38:3946320241249395. DOI: 10.1177/03946320241249395
28. Martikainen M., Essand M. Virus-based immunotherapy of glioblastoma. Cancers (Basel). 2019;11(2):186. DOI: 10.3390/cancers11020186
29. Alban T.J., Alvarado A.G., Sorensen M.D., Bayik D., Volovetz J., Serbinowski E., et al. Global immune fingerprinting in glioblastoma patient peripheral blood reveals immune-suppression signatures associated with prognosis. JCI Insight. 2018;3(21):e122264. DOI: 10.1172/jci.insight.122264
30. Ladomersky E., Zhai L., Lauing K.L., Bell A., Xu J., Kocherginsky M., et al. Advanced Age Increases Immunosuppression in the Brain and Decreases Immunotherapeutic Efficacy in Subjects with Glioblastoma. Clin Cancer Res. 2020;26(19):5232–45. DOI: 10.1158/1078-0432.CCR-19-3874
31. Filley A.C., Henriquez M., Dey M. Recurrent glioma clinical trial, CheckMate-143: the game is not over yet. Oncotarget. 2017;8(53):91779–94. DOI: 10.18632/oncotarget.21586
32. Wang X., Guo G., Guan H., Yu Y., Lu J., Yu J. Challenges and potential of PD-1/PD-L1 checkpoint blockade immunotherapy for glioblastoma. J Exp Clin Cancer Res. 2019;38(1):87. DOI: 10.1186/s13046-019-1085-3
33. Bouffet E., Larouche V., Campbell B.B., Merico D., de Borja R., Aronson M., et al. Immune checkpoint inhibition for hypermutant glioblastoma multiforme resulting from germline biallelic mismatch repair deficiency. J Clin Oncol. 2016;34(19):2206–11. DOI: 10.1200/JCO.2016.66.6552
34. Cloughesy T.F., Landolfi J., Vogelbaum M.A., Ostertag D., Elder J.B., Bloomfield S., et al. Durable complete responses in some recurrent high-grade glioma patients treated with Toca 511 + Toca FC. Neuro Oncol. 2018;20(10):1383–92. DOI: 10.1093/neuonc/noy075
35. Mahmoud A.B., Ajina R., Aref S., Darwish M., Alsayb M., Taher M., et al. Advances in immunotherapy for glioblastoma multiforme. Front Immunol. 2022;13:944452. DOI: 10.3389/fimmu.2022.944452
36. Sampson J.H., Archer G.E., Mitchell D.A., Heimberger A.B., Herndon J.E. 2nd, Lally-Goss D., et al. An epidermal growth factor receptor variant III-targeted vaccine is safe and immunogenic in patients with glioblastoma multiforme. Mol Cancer Ther. 2009;8(10):2773–9. DOI: 10.1158/1535-7163.MCT-09-0124
37. Liau L.M., Ashkan K., Tran D.D., Campian J.L., Trusheim J.E., Cobbs C.S., et al. First results on survival from a large Phase 3 clinical trial of an autologous dendritic cell vaccine in newly diagnosed glioblastoma. J Transl Med. 2018;16(1):142. DOI: 10.1186/s12967-018-1507-6. Erratum in: J Transl Med. 2018;16(1):179. DOI: 10.1186/s12967-018-1552-1
38. Weller M., Butowski N., Tran D.D., Recht L.D., Lim M., Hirte H., et al. Rindopepimut with temozolomide for patients with newly diagnosed, EGFRvIII-expressing glioblastoma (ACT IV): a randomised, double-blind, international phase 3 trial. Lancet Oncol. 2017;18(10):1373–85. DOI: 10.1016/S1470-2045(17)30517-X
39. Filley A.C., Henriquez M., Dey M. CART immunotherapy: development, success, and translation to malignant gliomas and other solid tumors. Front Oncol. 2018;8:453. DOI: 10.3389/fonc.2018.00453
40. O’Rourke D.M., Nasrallah M.P., Desai A., Melenhorst J.J., Mansfield K., Morrissette J.J.D., et al. A single dose of peripherally infused EGFRvIII-directed CAR T cells mediates antigen loss and induces adaptive resistance in patients with recurrent glioblastoma. Sci Transl Med. 2017;9(399):eaaa0984. DOI: 10.1126/scitranslmed.aaa0984
41. Zhou L., Liu Y., Wu Y., Yang X., Spring Kong F.M., Lu Y., et al. Low-dose radiation therapy mobilizes antitumor immunity: New findings and future perspectives. Int J Cancer. 2024;154(7):1143–57. DOI: 10.1002/ijc.34801
42. Yang M., Oh I.Y., Mahanty A., Jin W.L., Yoo J.S. Immunotherapy for glioblastoma: current state, challenges, and future perspectives. Cancers (Basel). 2020;12(9):2334. DOI: 10.3390/cancers12092334
Об авторах
О. А. БейлерлиРоссия
Бейлерли Озал Арзуман оглы — к.м.н., старший научный сотрудник
Уфа
Э. Р. Мусаев
Россия
Мусаев Эльмар Расим оглы — д.м.н., профессор, член-корр. РАН, кафедра онкологии
Москва
А. А. Бухвостов
Россия
Бухвостов Александр Александрович — к.б.н., доцент, кафедра медицинских нанобиотехнологий МБФ
Москва
Рецензия
Для цитирования:
Бейлерли О.А., Мусаев Э.Р., Бухвостов А.А. Иммунная терапия злокачественных глиом: преодоление барьеров и перспективы комбинированных подходов. Креативная хирургия и онкология. 2024;14(4):351-359. https://doi.org/10.24060/2076-3093-2024-14-4-351-359
For citation:
Beylerli O.A., Musaev E.R., Bukhvostov A.A. Immunotherapy for Malignant Gliomas: Overcoming Barriers and Defining Prospects for Integrated Approaches. Creative surgery and oncology. 2024;14(4):351-359. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-4-351-359


































