Перейти к:
Роль белка TRAP1 в развитии и прогрессировании глиобластомы
https://doi.org/10.24060/2076-3093-2024-14-4-369-381
Аннотация
Глиобластома — наиболее агрессивный тип первичной опухоли головного мозга. Несмотря на недавние достижения в понимании молекулярных механизмов, вовлеченных в биологию глиобластомы, показатели выживаемости пациентов с данной опухолью по-прежнему разочаровывают, в первую очередь из-за отсутствия эффективных методов лечения. Белок-1, ассоциированный с рецептором фактора некроза опухоли (TRAP1), относится к семейству белка теплового шока 90 (Hsp90), представляет собой белок, локализующийся в первую очередь в митохондриях, который контролирует как клеточное метаболическое перепрограммирование, так и митохондриальный апоптоз. Этот белок высоко экспрессируется в нескольких видах опухолей, таких как рак толстой кишки, рак молочной железы, рак простаты и рак легких, и часто ассоциируется с лекарственной устойчивостью. Однако TRAP1 также подавляется в определенных опухолях, таких как рак яичников, рак мочевого пузыря и рак почек, где его более низкая экспрессия коррелирует с наихудшими прогнозами и химиорезистентностью. Роль TRAP1 заключается в усилении или подавлении окислительного фосфорилирования, где влияние такой регуляции на развитие и прогрессирование опухоли является спорным. Эти наблюдения подталкивают на изучение механизмов, ответственных за двойственную роль TRAP1 как онкогена или онкосупрессора в определенных типах опухолей, в частности при глиобластоме. В этом обзоре мы проанализируем роль TRAP1 в развитии и прогрессировании глиобластомы и обсудим возможности того, что воздействие на TRAP1 представляет собой новый противоопухолевый подход.
Ключевые слова
Для цитирования:
Гареев И.Ф., Ясинская А.С., Румянцев С.А., Бухвостов А.А. Роль белка TRAP1 в развитии и прогрессировании глиобластомы. Креативная хирургия и онкология. 2024;14(4):369-381. https://doi.org/10.24060/2076-3093-2024-14-4-369-381
For citation:
Gareev I.F., Yasinskaya A.S., Roumiantsev S.A., Bukhvostov A.A. Role of TRAP1 Protein in the Development and Progression of Glioblastoma. Creative surgery and oncology. 2024;14(4):369-381. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-4-369-381
ВВЕДЕНИЕ
Глиобластома является наиболее распространенным и злокачественным типом первичной опухоли головного мозга у взрослых. Несмотря на важные достижения в понимании молекулярного патогенеза и биологии этой опухоли за последнее десятилетие, прогноз для пациентов с глиобластомой остается неблагоприятным. Глиобластома характеризуется агрессивным биологическим поведением и высокой степенью меж- и внутриопухолевой гетерогенности [1][2]. Более глубокое понимание молекулярной и клеточной гетерогенности данной опухоли может не только помочь более точно определить конкретные подгруппы для точной диагностики, но и заложить основу для успешного внедрения таргетной терапии.
Белок-1, ассоциированный с рецептором фактора некроза опухоли (TRAP1), является митохондриально-специфическим членом семейства белка теплового шока 90 (Hsp90) и локализуется в митохондриальном матриксе, внутренней митохондриальной мембране и межмембранном пространстве (рис. 1).
TRAP1 играет важную роль в поддержании целостности митохондрий и внутриклеточного гомеостаза и тесно связан с путями апоптоза. На сегодняшний день основные выявленные функции TRAP1 включают в себя: 1) антагонизм про-апоптотической активности циклофилина D (CypD) для последующего ингибирования открытия пор переходной проницаемости митохондрий (mPTP); 2) снижение генерации активных форм кислорода (АФК) для защиты клеток от окислительного стресса; 3) регулирование стресса эндоплазматического ретикулума (ER) и 4) ингибирование активности сукцинатдегидрогеназы (SDH), тем самым регулируя биоэнергетику митохондрий [3][4]. В последнее время все больше исследований показывают, что TRAP1 функционирует как онкоген или супрессор опухолей при различных опухолях [3].
Известно, что опухоли представляют собой группу сложных заболеваний с несколькими отличительными признаками, которые считаются фенотипическими адаптациями для преодоления всех имеющихся препятствий на пути прогрессирования заболевания. Среди этих отличительных признаков метаболическое перепрограммирование и избегание путей апоптоза необходимо для выживания опухоли [5]. TRAP1 участвует в метаболическом перепрограммировании и влияет на переключение между окислительным фосфорилированием (OXPHOS) и аэробным гликолизом. Кроме того, белок TRAP1 участвует во многих других клеточных процессах. TRAP1 регулирует клеточный цикл, модулируя пролиферацию клеток, и способствует метастазированию опухолей, вызывая деление митохондрий. Более того, вмешательство в функцию TRAP1 может привести к гибели опухолевых клеток, но не влияет на нормальные клетки [6][7]. Таким образом, подход, который избирательно нацелен на TRAP1, может быть многообещающей стратегией для разработки новых противоопухолевых препаратов для пациентов с глиобластомой (рис. 2). Несмотря на критическую важность TRAP1 для этих процессов, молекулярные механизмы функционирования TRAP1 при глиобластоме остаются в значительной степени нерешенными. Здесь мы обсудим последние достижения в понимании механизмов регуляции TRAP1 в развитии и прогрессировании глиобластомы, а также оценим потенциальную терапевтическую ценность TRAP1 при данном типе опухоли.
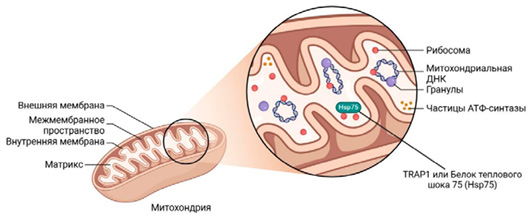
Рисунок 1. Схематическая иллюстрация расположения TRAP1 в митохондриях
Figure 1. Schematic representation of TRAP1 localization in mitochondria
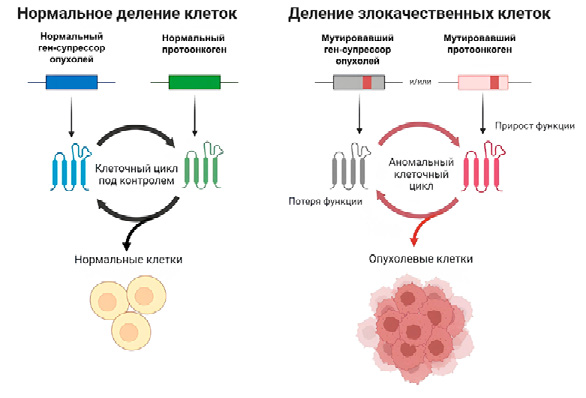
Рисунок 2. Протонкогены и опухоль
Figure 2. Oncogenes and tumor
Двойственная роль TRAP1 в онкогенезе
Известно, что в любой нормальной клетке есть протоонкогены, которые являются ключевыми регуляторными факторами биологических процессов. Протоонкогены могут функционировать как факторы роста, передатчики клеточных сигналов и факторы транскрипции. Геном человека содержит ряд протоонкогенов, которые контролируют нормальную дифференциацию и пролиферацию клеток. Изменения в этих генах, которые влияют либо на контроль их поведения, либо на способ, которым структурированы их кодируемые белки, могут проявляться в опухолевых клетках как задействованные онкогены [8][9]. Когда онкогены активируются, они продолжают управлять размножением клеток и принимают на себя ключевую роль в онкогенезе. Физические мутации, которые приводят к активации протоонкогенов, можно разделить на те, которые приводят к различиям в структуре кодируемого белка, и те, которые вызывают дерегуляцию экспрессии белка (рис. 2) [10].
В типичной клетке экспрессия протоонкогенов контролируется ее собственным транскрипционным промотором — последовательностью ДНК, которая контролирует степень транскрипции. Каждый промотор протоонкогенов позволяет гену реагировать на набор физиологических сигналов. Протоонкоген может экспрессироваться на довольно низком уровне в зависимости от метаболических потребностей клетки; тем не менее при определенных событиях, когда это необходимо, экспрессия гена может быть сильно индуцирована [8][9]. В нормальной клетке, помимо онкогенов, есть гены — супрессоры опухолей, которые играют важную роль в нормальной дифференциации клетки, тем самым блокируя развитие опухоли [8]. Гены — супрессоры опухолей образуют огромную группу, которая демонстрирует одну общую характеристику: каким-то образом каждый из этих генов защищает организм от запуска процессов онкогенеза. Обе копии гена — супрессора опухолей должны находиться в неактивном состоянии, прежде чем опухолевая клетка сможет размножаться или выживать дальше. Отсутствие или инактивация из-за мутаций генов — супрессоров опухолей приводит к запуску онкогенеза [11].
В последнее время все больше исследований демонстрируют, что TRAP1 функционирует как онкоген или супрессор опухолей. Экспрессия TRAP1 повышается при различных злокачественных новообразованиях человека, включая рак носоглотки, рак молочной железы, рак простаты и немелкоклеточный рак легких [12]. Например, TRAP1, наряду с локализованным в митохондриях HSP90, как было показано, обильно и повсеместно экспрессируется как в локализованном, так и в метастатическом раке простаты, но в значительной степени не обнаруживается в клетках нормальной простаты или доброкачественной гиперплазии простаты в исследовании in vivo [13]. Более того, у трансгенных мышей, имеющих высокий уровень экспрессии TRAP1 в тканях простаты, развивалась эпителиальная гиперплазия и клеточная атипия, а при изучении параллельно активности фосфатазы с двойной субстратной специфичностью (PTEN), распространенного онкогена при раке простаты у человека, наблюдалось ускоренное развитие инвазивной аденокарциномы простаты; тогда как инактивация TRAP1 задерживало возникновение развитие рака простаты [13]. Соответственно, данные результаты подтверждают роль TRAP1 как драйвера рака предстательной железы с потенциалом для новых терапевтических подходов.
Результаты иммуногистохимического анализа ткани колоректальной карциномы 714 пациентов показали, что высокая экспрессия TRAP1 наблюдается в 79 % случаев [14]. Кроме того, уровень экспрессии TRAP1 повышался в клетках колоректальной карциномы, устойчивых к 5-фторурацилу, оксалиплатину и иринотекану, и, в свою очередь, его сверхэкспрессия приводила к лекарственной устойчивости. При этом экспрессия TRAP1 значительно увеличилась при колоректальном раке на поздней патологической стадии, что значительно коррелировало с низкими показателями выживаемости, хотя лишь в незначительной степени было связано с поражением лимфатических узлов и дифференциацией опухоли.
Аналогично, было обнаружено, что экспрессия TRAP1 аномально повышена при раке молочной железы по сравнению с контрольной группой [15–17]. Его экспрессия в образцах рака молочной железы человека обратно коррелировала со степенью злокачественности опухоли. Более того, повышение экспрессии TRAP1 в клетках рака молочной железы приводило к резистентности к паклитакселу, препарату, обычно используемому при лечении рака молочной железы [17]. Поэтому снижение экспрессии TRAP1 в клетках рака молочной железы также повышало чувствительность клеток к химиотерапии и подавляло рост опухоли. В соответствии с этими результатами ранее была продемонстрирована механистическая связь между высокой экспрессией TRAP1, активацией сигнализации внеклеточных сигнальных киназ (ERK) и прогрессированием клеточного цикла при колоректальном раке [18]. Другое исследование продемонстрировало механистическую связь между дерегулированной сигнализацией Ras/ERK и пронеопластическим метаболическим переключением с OXPHOS на гликолиз, регулируемый TRAP1 посредством ингибирования SDH [19]. Это исследование показало, что активный ERK1/2 взаимодействует с TRAP1 и SDH в митохондриях клеток с дефицитом нейрофибромина, где ERK-зависимое фосфорилирование TRAP1 усиливает связывание TRAP1-SDH и ингибирование SDH и, следовательно, потенциал развития опухоли.
Существуют убедительные доказательства связи между антиоксидантной функцией TRAP1 и его активностью в подавлении развития и прогрессирования опухолей [12]. Однако корреляции между молекулярными функциями TRAP1 и их эффектом в опухолевых клетках все еще остаются спорными; некоторые авторы предполагают, что онкогенный потенциал TRAP1 также зависит от активности очистки шаперона, а не только от его способности вызывать псевдогипоксию посредством ингибирования SDH с последующим накоплением метаболита сукцината, стабилизирующего фактор, индуцируемый гипоксией 1-альфа (HIF-1α) [20][21]. Тем не менее, учитывая, что повышенный уровень АФК также может способствовать инвазии опухолевых клеток, было предположено, что подавление активности TRAP1 в опухолевых клетках может усиливать миграцию, способствуя более злокачественному фенотипу [22]. Поскольку на повышенную инвазивность влияют препараты, поглощающие АФК, ряд исследователей предположили существование прямой связи между низкой экспрессией TRAP1, повышенным уровнем АФК и активацией миграции и инвазии опухолевых клеток [23][24].
Влияние сниженной экспрессии TRAP1 на инвазию клеток in vitro привело к гипотезе о том, что некоторые более агрессивные, метастатические или поздние опухоли могут иметь более низкий уровень экспрессии TRAP1, чем доброкачественные опухоли или опухоли на ранней стадии развития. В соответствии с этой гипотезой была продемонстрирована обратная корреляция между экспрессией TRAP1 и стадией опухоли, в частности рака шейки матки, рака мочевого пузыря и светлоклеточной почечно-клеточной карциномы [25–27].
Гипотеза о том, что TRAP1 может действовать как супрессор опухоли в зависимости от типа опухоли и ее относительного контекста, была первоначально предложена в исследовании 208 пациентов, страдающих раком яичников [28]. Авторы показали, что высокая иммуногистохимическая окраска TRAP1 положительно коррелировала с ответом на химиотерапию и общей выживаемостью. Более того, они обнаружили значительную корреляцию между высокой экспрессией TRAP1 и активностью рецепторов α эстрогена. В этой опухоли TRAP1 инактивируется на поздних стадиях заболевания, что предполагает генетическую потерю как наиболее вероятный механизм снижения экспрессии TRAP1 по мере прогрессирования заболевания. Этот механизм, может быть либо связан с метаболическим ремоделированием опухоли, либо быть частью процесса отбора, обусловленного преимуществом выживания.
Согласно некоторым данным, пациенты с раком яичников, устойчивым к платине, показывают более низкий уровень экспрессии TRAP1, чем их чувствительные аналоги в клеточных моделях высокозлокачественного серозного рака яичников изогенно соответствующих парных клеточных линий, полученных от одного и того же пациента до и после терапии на основе платины [29]. Соответственно, метаболическое перепрограммирование OXPHOS инициирует воспалительный статус, ответственный за лекарственную устойчивость в этих опухолевых клетках. Более того, при серозном раке яичников высокой степени злокачественности экспрессия TRAP1 в основном обнаруживается в биоптатах брюшины, удаленных от первичных опухолей, что позволяет предположить, что опухолевые клетки с низким уровнем экспрессии TRAP1 могут быть более склонны к распространению из первичного очага. Экспрессия TRAP1 также обратно коррелировала с экспрессией нескольких маркеров эпителиально-мезенхимального перехода (ЭМП) как в клетках, так и в тканях рака яичников [29].
В заключение можно сказать, что хотя в настоящее время хорошо установлено участие TRAP1 в ряде фундаментальных процессов как во время развития опухоли, так и в ее прогрессировании, все еще не совсем ясно, является ли TRAP1 онкогеном или онкосупрессором, и это, вероятно, зависит от гетерогенности опухоли и влияния, которое микроокружение опухоли может оказывать на развитие опухоли. Таким образом, будущая клиническая разработка стратегий нацеливания TRAP1 должна учитывать, что его ингибирование может быть полезным в зависимости от типов опухолей / контекстов, в том числе при глиобластоме.
Влияние TRAP1 на метаболизм глиобластомы
Аденозинтрифосфат (АТФ) образуется в результате полного окисления глюкозы до CO2 и H2O, и каждая молекула глюкозы может максимально дать 36–38 молекул АТФ. Нормальные клетки производят АТФ в основном посредством клеточного дыхания, где клеточное дыхание — это метаболический процесс, в котором метаболизм глюкозы путем гликолиза сопряжен с циклом трикарбоновых кислот (ЦТК). Известно, что большинство нормальных клеток в основном генерируют большое количество АТФ через OXPHOS в аэробных условиях, но получают энергию путем гликолиза в условиях гипоксии [30]. Однако даже в условиях с достаточным количеством кислорода гликолиз так же активен в большинстве злокачественных опухолевых клеток, которые характеризуются высокой скоростью поглощения глюкозы и высоким содержанием молочной кислоты среди метаболитов [31]. Метаболические характеристики этого сдвига в сторону аэробного гликолиза называются эффектом Варбурга, и это перепрограммирование энергетического метаболизма имеет важное значение для прогрессирования глиобластомы (рис. 3).
Несколько возможных механизмов способствуют эффекту Варбурга в клетках глиобластомы, включая следующие: 1) Продукция АТФ через гликолиз (две молекулы АТФ на молекулу глюкозы) гораздо менее эффективна, чем продукция АТФ через OXPHOS (36 молекул АТФ на молекулу глюкозы). Таким образом, клетки глиобластомы поддерживают энергетический гомеостаз, существенно увеличивая свою гликолитическую активность, что благоприятно для быстрого роста опухоли. 2) Рост глиобластомы происходит быстрее, чем рост нормальной нервной ткани; поэтому для роста требуются не только энергия, но и биомакромолекулы. Гликолиз обеспечивает метаболические промежуточные продукты и предшественники для макромолекулярного биосинтеза, а затем способствует образованию никотинамидадениндинуклеотидфосфата (NADH), рибозо-5-фосфата и заменимых аминокислот, тем самым способствуя биосинтезу нуклеиновых кислот, липидов и белков. 3) Неограниченный рост глиобластомы приводит к атипичному ангиогенезу (нарушение сосудистой архитектуры опухоли, дефектная способность к саморегуляции и изменение гемореологии), что, в конце концов, приводит к гипоксии локальной опухолевой ткани. Таким образом, гликолиз может быть повышен в клетках глиобластомы для адаптации в условиях гипоксии. 4) Накопление молочной кислоты, вызванное высокой скоростью гликолиза, приводит к закислению микроокружения глиобластомы, что облегчает ее инвазию в паренхиму головного мозга посредством разрушения внеклеточного матрикса (ВКМ) и подавление иммунного ответа хозяина. Подводя итог, можно сказать, что для адаптации к окружающей микросреде и конкуренции с окружающими нормальными клетками за ограниченные ресурсы, такие как глюкоза, клетки глиобластомы изменяют свои метаболические характеристики в сторону фенотипа Варбурга, чтобы иметь возможности к росту, инвазии и метастазированию (рис. 4) [32–35].
Как ключевой регуляторный фактор в метаболическом перепрограммировании при различных злокачественных новообразованиях TRAP1 в метаболическом перепрограммировании в клетках глиобластомы может участвовать в различных механизмах. TRAP1 поддерживает фолдинг (процесс сворачивания белка) и стабильность митохондриальных комплексов OXPHOS II (субъединица B сукцинатдегидрогеназы (SDHB)) и IV (цитохром с-оксидаза II), способствуя росту опухоли. В условиях метаболического стресса, особенно в условиях недостатка питательных веществ и гипоксии, регуляция SDHB с помощью фолдинга белка, направленного на TRAP1, производит достаточно АТФ для удовлетворения потребностей энергетического метаболизма клеток глиобластомы. TRAP1 конкурентно может связываться с SDHB, а затем снижать активность SDH, что приведет к подавлению митохондриального дыхания и повышению внутриклеточной концентрации сукцината. Даже в нормоксических условиях накопление сукцината стабилизирует активность HIF-1α, а затем вызывает псевдогипоксию. HIF-1α не только способствует переключению метаболизма клеток глиобластомы по эффекту Варбурга, но также регулирует ЭМП, ангиогенез и другие процессы, способствующие возникновению и развитию глиобластомы. Таким образом, TRAP1 может привести к накоплению HIF-1α, ингибировав митохондриальное дыхание и способствуя переключению энергетического метаболизма с OXPHOS на аэробный гликолиз посредством взаимодействия с SDH (рис. 5) [36][37].
Результаты Wu и др. показали, что нокдаун TRAP1 снизил жизнеспособность клеток глиобластомы, образование колоний, миграцию клеток и индуцировал апоптоз и остановку G2/M [38]. Анализ образования трубок с использованием матригеля с пониженным содержанием факторов роста использовался для проверки способности клеток глиобластомы развивать сосудистый фенотип. Эта способность согласуется с их васкулогенным поведением, выявленным у ксенотрансплантированных животных, процессом, известным как васкулогенная мимикрия [39]. Существует множество доказательств того, что васкулогенная мимикрия, опосредованная опухолевыми клетками, играет жизненно важную роль в развитии опухоли [39][40]. Результаты исследования Wu и др. показали, что нокдаун TRAP1 снизил образование трубок клеток глиобластомы [38]. Более того, авторы показали, что нокдаун TRAP1 ингибировал восстановление нейросфер и формирование вторичных нейросфер, а также усиливал терапевтический эффект темолозомида в культурах нейросфер глиобластомы. В целом, эти результаты подтверждают важную онкогенную роль TRAP1 в клетках глиобластомы и потенциальные синергические эффекты с темолозомидом, влияя либо на пролиферацию, апоптоз, либо на стволовость в опухоли. При этом известно, что пролиферирующие клетки используют аэробный гликолиз для содействия своему росту [33]. Метаболическое перепрограммирование все чаще признается ключевым требованием агрессивного поведения глиобластомы, сохраняющим фенотип ОСК и способствующим устойчивости к химиотерапии. Как сказано выше, ОСК являются важным элементом микроокружения глиобластомы. Чтобы способствовать развитию глиобластомы, ОСК должны обладать способностью модулировать микроокружение опухоли путем метаболического перепрограммирования [41]. В итоге инактивация TRAP1 может быть связана с усилением митохондриального дыхания и снижением гликолиза в клетках глиобластомы. Результаты этого исследования в совокупности показывают, что TRAP1 является основным регулятором аэробного гликолиза в клетках глиобластомы.
Таким образом, аберрантная экспрессия TRAP1 в злокачественных опухолях человека тесно коррелирует с его ролью в метаболическом перепрограммировании. Идентификация TRAP1 как критического фактора, регулирующего метаболическое переключение глиобластомы, может дать новое понимание терапии данного заболевания.
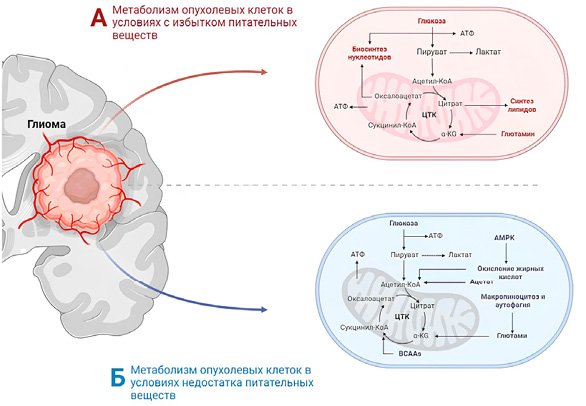
Рисунок 3. Гликолиз в условиях избытка и недостатка питательных веществ в клетках глиобластомы (А, Б)
Figure 3. Glycolysis under nutrient-rich and nutrient-deficient conditions in glioblastoma cells (A, Б)
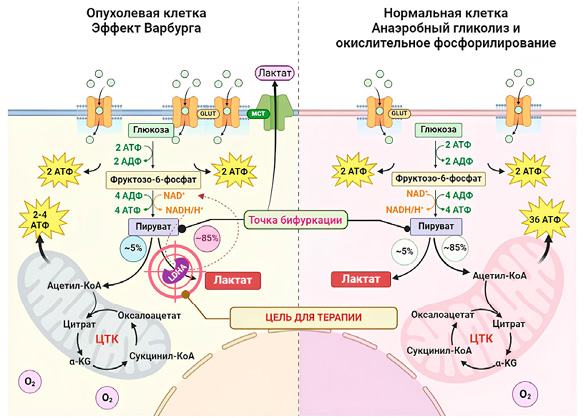
Рисунок 4. Метаболизм глюкозы в опухолевой клетке и анаэробный гликолиз и окислительное фосфорилирование (OXPHOS) в нормальной клетке. Клетки глиобластомы характеризуются повышенной скоростью гликолиза, обеспечивая энергетические потребности быстрорастущих опухолевых клеток, что приводит к увеличению выработки лактата
Figure 4. Glucose metabolism in tumor cells: anaerobic glycolysis and oxidative phosphorylation in normal cells. Glioblastoma cells exhibit an increased glycolytic rate to meet the energetic demands of rapidly proliferating tumor cells, leading to elevated lactate production
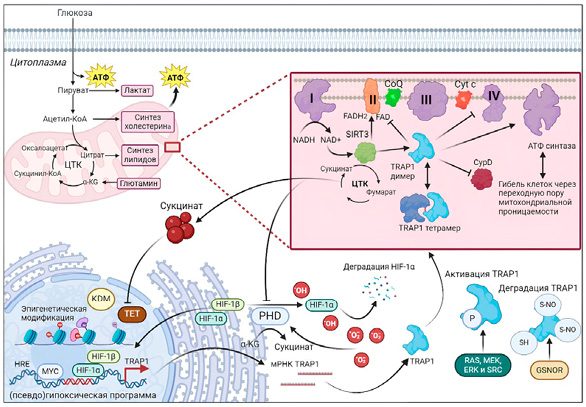
Рисунок 5. Регуляторные пути TRAP1 в опухолевой клетке
Figure 5. Regulatory pathways of TRAP1 in tumor cells
Избежание апоптоза
Клеточная смерть, в частности апоптоз, вероятно, является одной из наиболее широко изучаемых тем среди исследователей. Понимание апоптоза в условиях болезни очень важно, поскольку оно не только дает представление о патогенезе заболевания, но и может дать подсказки о том, как можно лечить болезнь. В опухоли происходит потеря баланса между делением клеток и смертью клеток, и клетки, которые должны были умереть, не получили сигналов для этого. При этом проблема может возникнуть на любом этапе путей апоптоза. Одним из примеров является подавление экспрессии генов — супрессоров опухолей, что приводит к снижению апоптоза и усилению роста и развития опухоли [42]. Апоптоз может быть как причиной проблемы, так и ее решением, поскольку многие исследовали ведут поиск новых препаратов, нацеленных на различные аспекты путей апоптоза. Таким образом, апоптоз играет важную роль как в прогрессировании, так и в лечении глиобластомы [43]. Участие митохондрий в гибели клеток опосредовано высвобождением цитохрома c. Длительное открытие mPTP во внутренней митохондриальной мембране инициирует ряд событий, которые приводят к высвобождению цитохрома c и апоптозу или некрозу. После открытия mPTP частицы с массой менее 1500 Da, такие как ионы (Ca2+, K+ и H+), вода и другие растворенные вещества, заполняют внутреннюю митохондриальную мембрану, и в итоге разрыв внешней митохондриальной мембраны. Последующий отток цитохрома c через скомпрометированную внешнюю митохондриальную мембрану в цитозоль индуцирует каскад каспазы. Это устойчивое открытие mPTP известно как переход митохондриальной проницаемости, и оно может быть вызвано несколькими механизмами, включая повышение уровня АФК, Ca2+ или неорганического фосфата, а также снижение pH или истощение АТФ [44][45].
Было исследовано, что инактивация TRAP1 вызывает открытие mPTP и высвобождение цитохрома c, а повышение уровня экспрессии TRAP1, вероятно, препятствует инициации апоптоза посредством двух различных, но потенциально перекрывающихся механизмов: регуляция триггеров, которые передают сигнал в mPTP, и прямое нарушение физического механизма открытия mPTP [46]. Было показано, что нокдаун TRAP1 приводит к повышенному накоплению АФК при окислительном стрессе, а сверхэкспрессия TRAP1 изолирует клетки от продукции АФК, опосредованной хелатированием Fe2+ [47]. Эти эффекты, вероятно, являются следствием как прямой, так и косвенной роли TRAP1 в минимизации генерации АФК. TRAP1 является прямым регулятором OXPHOS посредством его регулирования комплексов II и IV и играет косвенную роль в инактивации существующих АФК, поскольку экспрессия TRAP1 связана с повышенным уровнем восстановленной формы антиоксиданта глутатиона [48]. Синтез АФК связан с перегрузкой митохондрий Ca2+ и высвобождением цитохрома c, что впоследствии запускает открытие mPTP и гибель клеток. Как показано в исследовании Basit и др., повышенная экспрессия TRAP1 предотвращает апоптоз, уменьшает генерацию АФК и задерживает открытие mPTP в клетках меланомы [49]. Эти данные указывают на то, что TRAP1 защищает опухолевые клетки от окислительного повреждения и апоптоза, противодействуя генерации АФК.
Yin и др. обнаружили, что экспрессия cтресс-индуцированного фосфопротеина1 (STIP1) в глиобластоме была выше, чем в нормальной мозговой ткани, но не было значительного увеличения экспрессии STIP1 в образцах глиом Grade 2-3 [50]. Различные исследования демонстрируют, что STIP1 влияет на множество клеточных процессов, включая пролиферацию, апоптоз и инвазию, а экспрессия STIP1 коррелирует с химиорезистентностью и неблагоприятным исходом у пациентов с различными типами рака, включая рак молочной железы, рак печени и рак яичников [51–53]. Более того, Yin и др. продемонстрировали, что снижение экспрессии TRAP1 в результате подавления STIP1 приводит к ингибированию пути Akt, что приводит к снижению пролиферации, повышению апоптоза и снижению инвазивности клеток глиобластомы. В совокупности эти наблюдения указывают на то, что TRAP1 участвует в апоптозе опухолевых клеток, способствуя прогрессированию глиобластомы.
TRAP1 и стволовые клетки глиобластомы
Стволовые клетки — это самообновляющиеся клетки, которые сохраняют способность к пролиферации, генерируя новые стволовые клетки и дочерние клетки, которые подвергаются дифференциации и пополняют пул функциональных клеток. Стволовые клетки плюрипотентны, а именно, они могут давать начало различным линиям дочерних клеток. Например, нейральная стволовая клетка может генерировать клетки, которые подвергаются дифференциации в нейроны, астроциты и олигодендроциты [54]. Аналогичным образом традиционная теория неопухолевых стволовых клеток определяет опухолевые стволовые клетки (ОСК) как небольшую субпопуляцию самообновляющихся злокачественных клеток, которые поддерживают низкий, но устойчивый уровень неограниченной пролиферации [55]. В настоящее время достаточно достоверно установлено, что ОСК участвуют в развитии глиобластомы и ответственны за такие ключевые события в прогрессировании, как инвазия, рецидив опухоли и метастазирование. Будучи более химио- и радиорезистентными, чем обычные опухолевые клетки глиобластомы, ОСК за счет своей низкой митотической активности могут выживать после химио- и радиотерапии и таким образом быть причиной рецидивов глиобластомы после лечения. Существует набор специфических признаков, характеризующих незначительную (но крайне опасную) фракцию клеток микроокружения глиобластомы как ОСК, и, конечно, известен набор молекулярных детерминант, определяющих такие признаки [56][57].
Имеются данные о влиянии TRAP1 на стволовость (англ. stemness) в опухоли. Согласно данным Lettini и др., при колоректальном раке человека TRAP1 коэкспрессируется с маркерами стволовости и способствует развитию/поддержанию фенотипа ОСК путем активации сигнального пути Wnt/-катенина [58]. Этот механизм, способствующий стволовости в опухоли, был основан на опосредованной TRAP1 модуляции экспрессии лигандов Wnt и модификации катенина (убиквитинирование/фосфорилирование). Напротив, в других исследованиях, проведенных при раке яичников, снижение уровня экспрессии TRAP1 приводило к усилению инвазии и ЭПТ; такое несоответствие подразумевает, что активность TRAP1, связанная со стволовостью в опухоли, может кардинально различаться в различных типах опухолей [59][60]. Однако активность TRAP1 в глиобластомах, по-видимому, способствует развитию стволовости в опухоли, где TRAP1 проявляет себя как онкоген. Было показано, что повышенная экспрессия TRAP1 необходима для пролиферации, миграции и образования нейросфер в клетках глиобластомы, а также для их устойчивости к химиотерапии темозоломидом, что было связано с метаболическим перепрограммированием, опосредованным TRAP1 [61]. В другом исследовании сообщалось, что кооперативное взаимодействие между митохондриальным TRAP1 и основной митохондриальной деацетилазой сиртуином-3 (SIRT3) в ОСК глиобластомы приводит к снижению продукции АФК и пластичности энергетического метаболизма в ОСК, тем самым способствуя их адаптации к гипоксии и дефициту питательных веществ и поддерживая фенотип ОСК [62]. Принимая во внимание, что миграция опухолевых клеток и образование сфероидов, устойчивость к химиотерапии, а также адаптивность к гипоксии и «энергетическому голоданию» являются отличительными чертами ОСК [63]. Описанная же выше активность TRAP1 в глиобластоме характеризует этот митохондриальный шаперон как один из драйверов развития стволовости в данном злокачественном новообразовании. Другими словами, SIRT3, который в основном локализуется в митохондриальном матриксе, играет важную роль в поддержании стволовости в глиобластоме посредством кооперативного взаимодействия с TRAP1 для модуляции митохондриального дыхания и окислительного стресса.
Существует другое недавнее исследование, направленное на дальнейшее выяснение конкретных механизмов, посредством которых SIRT3 влияет на стволовость в глиобластоме, включая то, служит ли SIRT3 субстратом аутофагии, и механизма деградации SIRT3 [64]. Авторы обнаружили, что SIRT3 обогащен в CD133+ ОСК. Дальнейшие результаты показали, что в дополнение к стимулированию митохондриального дыхания и снижению окислительного стресса SIRT3 поддерживает стволовость в глиобластоме путем эпигенетической регуляции экспрессии CD133 через сукцинат. Что еще более важно, было обнаружено, что SIRT3 деградирует через путь аутофагии-лизосомы во время дифференцировки ОСК в объемные клетки глиобластомы. Выживание ОСК в значительной степени зависит от глутамина, и в этих клетках в результате было выяснено, что лишение глутамина запускает аутофагическую деградацию SIRT3, чтобы ограничить экспрессию CD133, тем самым нарушая стволовость в глиобластоме. На основе данных результатов авторы предположили, что ограничение глутамина для запуска аутофагической деградации SIRT3 предлагает стратегию устранения ОСК, которая в сочетании с другими методами лечения может быть применена против глиобластомы. TRAP1-опосредованное перепрограммирование энергетического метаболизма в опухоли может играть особенно важную роль в гипоксических (слабо васкуляризированных) зонах солидных опухолей, местах, где индуцируется ЭМП и происходит генерация ОСК.
Ингибиторы TRAP1
Большинство ингибиторов семейства HSP90 конкурентно связываются с N-концевым АТФ-карманом. Этот способ действия был использован для создания первого набора ингибиторов для TRAP1, домен АТФазы которого имеет гомологию с другими членами семейства HSP90. Однако, поскольку митохондриальная мембрана непроницаема для традиционных ингибиторов HSP90, для того чтобы эти ингибиторы достигли митохондриального матрикса, необходимо было добавить митохондриальную нацеливающую часть, такую как от одного до четырех тандемных повторов циклического гуанидия или трифенилфосфония (TPP) [65][66]. Наиболее широко используемыми ингибиторами TRAP1 являются гамитринибы, малые молекулы, состоящие из ингибитора HSP90 17-аллиламино-17-деметоксигелданамицина (17-AAG), присоединенного к митохондриально-нацеленной части, такой как циклические гуанидиновые повторы или TPP [67]. Эти гамитринибы наглядно использовались в терапии рака простаты, рака толстой кишки, меланомы, рака шейки матки, рака яичников, рака молочной железы и глиобластомы [67–70]. Гамитринибы нарушают антиапоптотические эффекты TRAP1, о чем свидетельствует снижение потенциала митохондриальной мембраны и повышенное высвобождение цитохрома с.
Кроме того, эти данные подчеркивают важность понимания эффекторов TRAP1 для идентификации потенциальных комбинированных методов лечения глиобластомы для усиления ингибирования сигнальных путей, опосредованных TRAP1. В текущем режиме комплексной терапии химиотерапия играет незаменимую роль, и темолозомид как эффективный химиотерапевтический агент, подтвержденный крупномасштабными клиническими испытаниями, остается доминирующим препаратом для химиотерапии глиобластом. Однако длительная химиотерапия темолозомидом приводит к развитию резистентности, что является важным фактором, влияющим на эффективность препарата. Поэтому существует острая необходимость в разработке соответствующих адъювантных препаратов для комбинации с темолозомидом для повышения чувствительности и снижения резистентности. Wang и др. обнаружили, что темолозомил индуцирует апоптоз клеточных линий глиобластомы SHG44, U251-MG и U87-MG, активируя p53 и одновременно подавляя митофагию и усиливая слияние митохондрий [61].
Последнее может происходить для компенсации дефекта, вызванного подавленной митофагией. В последующем подавление функции TRAP1 гамитриниб трифенилфосфонием (G-TPP) нарушило этот компенсаторный механизм, индуцируя mPTP, что привело к всплеску образования АФК и сенсибилизации клеток глиобластомы к эффектам лечения темолозомида. В другом исследовании Ngyen и др. на основе скрининга лекарственных препаратов сделали интригующее открытие, что ингибиторы гистондеацетилазы (HDAC) могут усиливать терапевтическую эффективность гамитриниба при комбинированной терапии глиобластомы [71]. Авторы установили эту концепцию, продемонстрировав, что глобальные (панобиностат) и селективные (ромидепсин) ингибиторы HDAC в сочетании с гамитринибом синергически снижали жизнеспособность клеточной линии глиобластомы U87, LN229 и T98G. Учитывая, что гамитриниб, как известно, вмешивается в электронно-транспортную цепь, авторы исследования предположили, что гамитриниб и его мишень TRAP1 могут помешать активации дыхания опухоли, вызванной ингибитором HDAC.
В соответствии с этим представлением результаты данного исследования продемонстрировали, что гамитриниб ослабил повышенное дыхание клеток глиобластомы, вызванное панобиностатом. Кроме того, авторы подтвердили участие про-апоптотического белка Bcl-2 в комбинации данных лекарств. В результате комбинация препаратов гамитриниба и ромидеспина вызвала увеличение экспрессии Bcl-2. Комбинированное ингибирование TRAP1 и HDACs является потенциально новой стратегией борьбы с резистентными злокачественными новообразованиями, такими как глиобластома. Авторы раскрыли механизм, который связан с метаболизмом опухолевых клеток, интегрированным ответом на стресс и модуляцией членов семейства Bcl-2, что в целом привело к индукции апоптоза.
ЗАКЛЮЧЕНИЕ И ПЕРСПЕКТИВЫ
Несмотря на растущие знания об TRAP1 в онкогенезе глиобластомы, все еще есть нерешенные проблемы, которые требуют дальнейшего изучения. Во-первых, крайне важно оценить потенциальную значимость активности АТФазы для функции TRAP1. Это связано с тем, что предыдущие исследования продемонстрировали, что TRAP1, даже в каталитически неактивном состоянии, способен выполнять свою роль и обращать вспять митохондриальную дисфункцию при некоторых видах злокачественных новообразований. Во-вторых, что касается того, как TRAP1 регулирует опухолеобразование и резистентность к терапии на молекулярном уровне, наше познание все еще ограничено. Тем не менее результаты приведенных исследований демонтируют, что TRAP1 является онкогеном при глиобластоме (рис. 6).
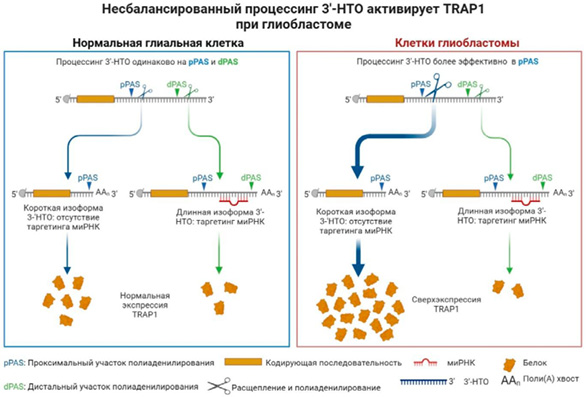
Рисунок 6. Активация TRAP1 при глиобластоме. 3’ — нетранслируемые области (3’-НТО) TRAP1 как онкогена с двумя сайтами полиаденилирования (PAS) могут быть альтернативно расщеплены и полиаденилированы в проксимальной (P) или дистальной (D) PAS, что приводит к короткой или длинной изоформе соответственно. Экспрессия белка из длинной изоформы ограничена нацеливанием микроРНК (миРНК). Обычно 3’-НТО одинаково обрабатываются при обоих проходах, что приводит к сбалансированной продукции TRAP1. При глиобластоме 3’-НТГ получают преимущественно в PPA, вызывая сверхэкспрессию белка TRAP1, лежащую в основе активации онкогена
Figure 6. Activation of TRAP1 in glioblastoma. 3’ — untranslated regions (3’-НТО) of TRAP1, functioning as an oncogene, possess two polyadenylation sites (PAS) that can be alternatively cleaved and polyadenylated at the proximal (P) or distal (D) PAS, resulting in the formation of short or long isoforms, respectively. The expression of the protein from the long isoform is regulated through the targeting of microRNAs (миРНК). Typically, the 3’-НТОs are processed uniformly during both transcriptional pathways, leading to a balanced production of TRAP1. However, in glioblastoma, 3’-НТОs are primarily obtained from PPA, resulting in the overexpression of TRAP1 protein, which underlies the activation of oncogene
В будущем мы можем больше сосредоточиться на молекулярных функциональных механизмах и связанных сигнальных путях с TRAP1. Кроме того, учитывая отсутствие клинического успеха, наблюдаемого у многочисленных ингибиторов TRAP1, может быть разумным изучить возможность разработки стратегии для одновременного нарушения пула TRAP1, чтобы оценить их совместную эффективность при глиобластоме. Метаболическое ремоделирование/перепрограммирование является общей стратегией выживания опухолевых клеток, подходящей как для адаптации к враждебным средам, так и для устойчивости к противоопухолевым препаратам. Это приводит к связи между химиорезистентностью и метаболической зависимостью, которая сама по себе представляет многообещающую терапевтическую мишень. Таким образом, нацеливание на метаболические сети глиобластомы, а не на отдельные биомолекулы, становится новой стратегией для эффективных терапевтических подходов как в виде отдельных, так и в составе комбинированной терапии.
Ингибиторы TRAP1 продемонстрировали способность эффективно контролировать рост клеток глибластомы как in vitro, так и in vivo. Существует несколько ингибиторов TRAP1, таких как гамитринибы, которые были успешно разработаны для воздействия на митохондрии клеток глиобластомы. Между тем, синтез и исследование новых ингибиторов TRAP1 также продолжаются. Более того, ингибиторы TRAP1 обладают потенциалом избирательно накапливаться в митохондриях опухолевых клеток и ограничивать токсичность для нормальных тканей. Еще одной перспективной областью исследований является сочетание ингибиторов TRAP1 с другими методами лечения глиобластомы. Недавние исследования показали, что ингибиторы TRAP1 могут повышать эффективность других методов лечения, таких как химиотерапия, лучевая терапия и иммунотерапия. Объединение этих методов лечения может привести к более эффективным схемам лечения с меньшей токсичностью и лучшими результатами для пациентов. Однако, несмотря на то что доклинические испытания постоянно демонстрируют осуществимость и универсальную применимость ингибиторов TRAP1, клинических испытаний на людях по-прежнему недостаточно. Необходимы дальнейшие исследования, чтобы убедиться в возможности применения этих ингибиторов перед их испытаниями на людях.
Список литературы
1. Lan Z., Li X., Zhang X. Glioblastoma: An Update in Pathology, Molecular Mechanisms and Biomarkers. Int j mol sci. 2024;25(5):3040. DOI: 10.3390/ijms25053040
2. Read R.D., Tapp Z.M., Rajappa P., Hambardzumyan D. Glioblastoma microenvironment-from biology to therapy. Genes dev. 2024;38(9–10):360–79. DOI: 10.1101/gad.351427.123
3. Masgras I., Laquatra C., Cannino G., Serapian S.A., Colombo G., et al. The molecular chaperone TRAP1 in cancer: From the basics of biology to pharmacological targeting. Semin cancer biol. 2021;76:45–53. DOI: 10.1016/j.semcancer.2021.07.002
4. Kang S., Kang B.H. Structure, Function, and Inhibitors of the Mitochondrial Chaperone TRAP1. J med chem. 2022;65(24):16155–72. DOI: 10.1021/acs.jmedchem.2c01633
5. Yang J., Shay C., Saba N.F., Teng Y. Cancer metabolism and carcinogenesis. Exp hematol oncol. 2024;13(1):10. DOI: 10.1186/s40164-024-00482-x
6. Li X.T., Li Y.S., Shi Z.Y., Guo X.L. New insights into molecular chaperone TRAP1 as a feasible target for future cancer treatments. Life sci. 2020;254:117737. DOI: 10.1016/j.lfs.2020.117737
7. Albakova Z., Mangasarova Y., Albakov A., Gorenkova L. HSP70 and HSP90 in Cancer: Cytosolic, Endoplasmic Reticulum and Mitochondrial Chaperones of Tumorigenesis. Front Oncol. 2022;12:829520. DOI: 10.3389/fonc.2022.829520. Erratum in: Front Oncol. 2023;13:1210051. DOI: 10.3389/fonc.2023.1210051
8. Kontomanolis E.N., Koutras A., Syllaios A., Schizas D., Mastoraki A., Garmpis N., et al. Role of Oncogenes and Tumor-suppressor Genes in Carcinogenesis: A Review. Anticancer res. 2020;40(11):6009–15. DOI: 10.21873/anticanres.14622
9. Hnisz D., Weintraub A.S., Day D.S., Valton A.L., Bak R.O., Li CH., et al. Activation of proto-oncogenes by disruption of chromosome neighborhoods. Science. 2016;351(6280):1454–8. DOI: 10.1126/science.aad9024
10. Brown G. Oncogenes, Proto-Oncogenes, and Lineage Restriction of Cancer Stem Cells. Int J Mol Sci. 2021;22(18):9667. DOI: 10.3390/ijms22189667
11. Hui-Ying X., Da-Hong Z., Li-Juan J., Xiao-Jie L. Anticancer Opportunity Created by Loss of Tumor Suppressor Genes. Technol cancer res treat. 2016;15(6):729–31. DOI: 10.1177/1533034615604798
12. Matassa D.S., Agliarulo I., Avolio R., Landriscina M., Esposito F. TRAP1 Regulation of Cancer Metabolism: Dual Role as Oncogene or Tumor Suppressor. Genes (Basel). 2018;9(4):195. DOI: 10.3390/genes9040195
13. Lisanti S., Garlick D.S., Bryant K.G., Tavecchio M., Mills G.B., Lu Y., et al. Transgenic Expression of the Mitochondrial Chaperone TNFR-associated Protein 1 (TRAP1) Accelerates Prostate Cancer Development. J biol chem. 2016;291(48):25247–54. DOI: 10.1074/jbc.M116.745950
14. Pak M.G., Koh H.J., Roh M.S. Clinicopathologic significance of TRAP1 expression in colorectal cancer: a large scale study of human colorectal adenocarcinoma tissues. Diagn pathol. 2017;12(1):6. DOI: 10.1186/s13000-017-0598-3
15. Zhang B., Wang J., Huang Z., Wei P., Liu Y., Hao J., et al. Aberrantly upregulated TRAP1 is required for tumorigenesis of breast cancer. Oncotarget. 2015;6(42):44495–508. DOI: 10.18632/oncotarget.6252
16. Vartholomaiou E., Madon-Simon M., Hagmann S., Mühlebach G., Wurst W., Floss T., et al. Cytosolic Hsp90α and its mitochondrial isoform Trap1 are differentially required in a breast cancer model. Oncotarget. 2017;8(11):17428–42. DOI: 10.18632/oncotarget.15659
17. Maddalena F., Sisinni L., Lettini G., Condelli V., Matassa D.S., Piscazzi A., et al. Resistance to paclitxel in breast carcinoma cells requires a quality control of mitochondrial antiapoptotic proteins by TRAP1. Mol oncol. 2013;7(5):895–906. DOI: 10.1016/j.molonc.2013.04.009
18. Condelli V., Piscazzi A., Sisinni L., Matassa D.S., Maddalena F., et al. TRAP1 is involved in BRAF regulation and downstream attenuation of ERK phosphorylation and cell-cycle progression: a novel target for BRAF-mutated colorectal tumors. Cancer Res. 2014;74(22):6693–704. DOI: 10.1158/0008-5472.CAN-14-1331
19. Masgras I., Ciscato F., Brunati A.M., Tibaldi E., Indraccolo S., Curtarello M., et al. Absence of Neurofibromin Induces an Oncogenic Metabolic Switch via Mitochondrial ERK-Mediated Phosphorylation of the Chaperone TRAP1. Cell Rep. 2017;18(3):659–72. DOI: 10.1016/j.celrep.2016.12.056
20. Bruno G., Li Bergolis V., Piscazzi A., Crispo F., Condelli V., Zoppoli P., et al. TRAP1 regulates the response of colorectal cancer cells to hypoxia and inhibits ribosome biogenesis under conditions of oxygen deprivation. Int J Oncol. 2022;60(6):79. DOI: 10.3892/ijo.2022.5369
21. Serwetnyk M.A., Blagg B.S.J. The disruption of protein-protein interactions with co-chaperones and client substrates as a strategy towards Hsp90 inhibition. Acta pharm sin B. 2021;11(6):1446–68. DOI: 10.1016/j.apsb.2020.11.015
22. Rasola A., Neckers L., Picard D. Mitochondrial oxidative phosphorylation TRAP(1)ped in tumor cells. Trends Cell Biol. 2014;24(8):455–63. DOI: 10.1016/j.tcb.2014.03.005
23. Tsai H.Y., Bronner M.P., March J.K., Valentine J.F., Shroyer N.F., Lai LA., et al. Metabolic targeting of NRF2 potentiates the efficacy of the TRAP1 inhibitor G-TPP through reduction of ROS detoxification in colorectal cancer. Cancer Lett. 2022;549:215915. DOI: 10.1016/j.canlet.2022.215915
24. Zhang X., Dong Y., Gao M., Hao M., Ren H., Guo L., et al. Knockdown of TRAP1 promotes cisplatin-induced apoptosis by promoting the ROS-dependent mitochondrial dysfunction in lung cancer cells. Mol Cell Biochem. 2021;476(2):1075–82. DOI: 10.1007/s11010-020-03973-7
25. Jin Y., Murata H., Sakaguchi M., Kataoka K., Watanabe M., Nasu Y., et al. Partial sensitization of human bladder cancer cells to a gene-therapeutic adenovirus carrying REIC/Dkk-3 by downregulation of BRPK/PINK1. Oncol Rep. 2012;27(3):695–9. DOI: 10.3892/or.2011.1543
26. Annunziata C., Buonaguro L., Buonaguro F.M., Tornesello M.L. Characterization of the human papillomavirus (HPV) integration sites into genital cancers. Pathol oncol res. 2012;18(4):803–8. DOI: 10.1007/s12253-012-9507-y
27. Nicolas E., Demidova E.V., Iqbal W., Serebriiskii I.G., Vlasenkova R., Ghatalia P., et al. Interaction of germline variants in a family with a history of early-onset clear cell renal cell carcinoma. Mol Genet Genomic Med. 2019;7(3):e556. DOI: 10.1002/mgg3.556
28. Aust S., Bachmayr-Heyda A., Pateisky P., Tong D., Darb-Esfahani S., Denkert C., et al. Role of TRAP1 and estrogen receptor alpha in patients with ovarian cancer -a study of the OVCAD consortium. Mol Cancer. 2012;11:69. DOI: 10.1186/1476-4598-11-69
29. Amoroso M.R., Matassa D.S., Agliarulo I., Avolio R., Lu H., Sisinni L., et al. TRAP1 downregulation in human ovarian cancer enhances invasion and epithelial-mesenchymal transition. Cell Death Dis. 2016;7(12):e2522. DOI: 10.1038/cddis.2016.400
30. Ye L., Jiang Y., Zhang M. Crosstalk between glucose metabolism, lactate production and immune response modulation. Cytokine growth factor rev. 2022;68:81–92. DOI: 10.1016/j.cytogfr.2022.11.001
31. Park J.H., Pyun W.Y., Park H.W. Cancer Metabolism: Phenotype, Signaling and Therapeutic Targets. Cells. 2020;9(10):2308. DOI: 10.3390/cells9102308
32. Lu E., Gareev I., Yuan C., Liang Y., Sun J., Chen X., et al. The Mechanisms of Current Platinum Anticancer Drug Resistance in the Glioma. Curr pharm des. 2022;28(23):1863–9. DOI: 10.2174/1381612828666220607105746
33. Beylerli O., Sufianova G., Shumadalova A., Zhang D., Gareev I. MicroRNAs-mediated regulation of glucose transporter (GLUT) expression in glioblastoma. Noncoding RNA Res. 2022;7(4):205–11. DOI: 10.1016/j.ncrna.2022.09.001
34. Gareev I., Beylerli O., Liang Y., Xiang H., Liu C., Xu X., et al. The Role of MicroRNAs in Therapeutic Resistance of Malignant Primary Brain Tumors. Front cell dev biol. 2021;9:740303. DOI: 10.3389/fcell.2021.740303
35. Zhang R., Wang C., Zheng X., Li S., Zhang W., Kang Z., et al. Warburg effect-related risk scoring model to assess clinical significance and immunity characteristics of glioblastoma. Cancer Med. 2023;12(21):20639–54. DOI: 10.1002/cam4.6627
36. Wengert L.A., Backe S.J., Bourboulia D., Mollapour M., Woodford M.R. TRAP1 Chaperones the Metabolic Switch in Cancer. Biomolecules. 2022;12(6):786. DOI: 10.3390/biom12060786
37. Ramkumar B., Dharaskar S.P., Mounika G., Paithankar K., Sreedhar A.S. Mitochondrial chaperone, TRAP1 as a potential pharmacological target to combat cancer metabolism. Mitochondrion. 2020;50:42–50. DOI: 10.1016/j.mito.2019.09.011
38. Wu J., Liu Y., Cho K., Dong X., Teng L., Han D., et al. Downregulation of TRAP1 sensitizes glioblastoma cells to temozolomide chemotherapy through regulating metabolic reprogramming. Neuroreport. 2016;27(3):136–44. DOI: 10.1097/WNR.0000000000000513
39. Luo Q., Wang J., Zhao W., Peng Z., Liu X., Li B., et al. Vasculogenic mimicry in carcinogenesis and clinical applications. J hematol oncol. 2020;13(1):19. DOI: 10.1186/s13045-020-00858-6
40. Wei X., Chen Y., Jiang X., Peng M., Liu Y., Mo Y., et al. Mechanisms of vasculogenic mimicry in hypoxic tumor microenvironments. Mol Cancer. 2021;20(1):7. DOI: 10.1186/s12943-020-01288-1
41. Calinescu A.A., Kauss M.C., Sultan Z., Al-Holou W.N., O’Shea S.K. Stem cells for the treatment of glioblastoma: a 20-year perspective. CNS Oncol. 2021;10(2):CNS73. DOI: 10.2217/cns-2020-0026
42. Dome A., Dymova M., Richter V., Stepanov G. Post-Transcriptional Modifications of RNA as Regulators of Apoptosis in Glioblastoma. Int j mol sci. 2022;23(16):9272. DOI: 10.3390/ijms23169272
43. Li W., Xu X. Advances in mitophagy and mitochondrial apoptosis pathway-related drugs in glioblastoma treatment. Front Pharmacol. 2023;14:1211719. DOI: 10.3389/fphar.2023.1211719
44. Adebayo M., Singh S., Singh A.P., Dasgupta S. Mitochondrial fusion and fission: The fine-tune balance for cellular homeostasis. FASEB J. 2021;35(6):e21620. DOI: 10.1096/fj.202100067R
45. Bock F.J., Tait SWG. Mitochondria as multifaceted regulators of cell death. Nat Rev Mol Cell Biol. 2020;21(2):85–100. DOI: 10.1038/s41580-019-0173-8
46. Matassa D.S., Amoroso M.R., Maddalena F., Landriscina M., Esposito F. New insights into TRAP1 pathway. Am j cancer res. 2012;2(2):235–48.
47. Im C.N., Lee J.S., Zheng Y., Seo J.S. Iron chelation study in a normal human hepatocyte cell line suggests that tumor necrosis factor receptor-associated protein 1 (TRAP1) regulates production of reactive oxygen species. J cell biochem. 2007;100(2):474–86. DOI: 10.1002/jcb.21064
48. Liu J., Ren Z., Yang L., Zhu L., Li Y., Bie C et al. The NSUN5-FTH1/FTL pathway mediates ferroptosis in bone marrow-derived mesenchymal stem cells. Cell Death Discov. 2022;8(1):99. DOI: 10.1038/s41420-022-00902-z
49. Basit F., van Oppen L.M., Schöckel L., Bossenbroek H.M., van Emst-de Vries S.E., Hermeling J.C., et al. Mitochondrial complex I inhibition triggers a mitophagy-dependent ROS increase leading to necroptosis and ferroptosis in melanoma cells. Cell Death Dis. 2017;8(3):e2716. DOI: 10.1038/cddis.2017.133
50. Yin H., Deng Z., Li X., Li Y., Yin W., Zhao G., et al. Down-regulation of STIP1 regulate apoptosis and invasion of glioma cells via TRAP1/AKT signaling pathway. Cancer Genet. 2019;237:1–9. DOI: 10.1016/j.cancergen.2019.05.006
51. Zhang S., Shao J., Su F. Prognostic significance of STIP1 expression in human cancer: A meta-analysis. Clin Chim Acta. 2018;486:168–76. DOI: 10.1016/j.cca.2018.07.037
52. Lin C.Y., Chen S.H., Tsai C.L., Tang Y.H., Wu K.Y., Chao A. Intracellular targeting of STIP1 inhibits human cancer cell line growth. Transl cancer res. 2021;10(3):1313–23. DOI: 10.21037/tcr-20-3333
53. Cheng F., Zhao J., Fooksa M., Zhao Z. A network-based drug repositioning infrastructure for precision cancer medicine through targeting significantly mutated genes in the human cancer genomes. J am med inform assoc. 2016;23(4):681–91. DOI: 10.1093/jamia/ocw007
54. Zakrzewski W., Dobrzyński M., Szymonowicz M., Rybak Z. Stem cells: past, present, and future. Stem Cell Res Ther. 2019;10(1):68. DOI: 10.1186/s13287-019-1165-5
55. Lytle N.K., Barber A.G., Reya T. Stem cell fate in cancer growth, progression and therapy resistance. Nat Rev Cancer. 2018;18(11):669–80. DOI: 10.1038/s41568-018-0056-x
56. Sloan A.R., Silver D.J., Kint S., Gallo M., Lathia J.D. Cancer stem cell hypothesis 2.0 in glioblastoma: Where are we now and where are we going? Neuro oncol. 2024;26(5):785–95. DOI: 10.1093/neuonc/noae011
57. Ramar V., Guo S., Hudson B., Liu M. Progress in Glioma Stem Cell Research. Cancers (Basel). 2023;16(1):102. DOI: 10.3390/cancers16010102
58. Lettini G., Sisinni L., Condelli V., Matassa D.S., Simeon V., Maddalena F., et al. TRAP1 regulates stemness through Wnt/β-catenin pathway in human colorectal carcinoma. Cell Death Differ. 2016;23(11):1792–803. DOI: 10.1038/cdd.2016.67
59. Amoroso M.R., Matassa D.S., Agliarulo I., Avolio R., Maddalena F., et al. Stress-Adaptive Response in Ovarian Cancer Drug Resistance: Role of TRAP1 in Oxidative Metabolism-Driven Inflammation. Adv Protein Chem Struct Biol. 2017;108:163–98. DOI: 10.1016/bs.apcsb.2017.01.004
60. Matassa D.S., Amoroso M.R., Lu H., Avolio R., Arzeni D., Procaccini C., et al. Oxidative metabolism drives inflammation-induced platinum resistance in human ovarian cancer. Cell Death Differ. 2016;23(9):1542–54. DOI: 10.1038/cdd.2016.39
61. Wang N., Zhu P., Huang R., Sun L., Dong D., Gao Y. Suppressing TRAP1 sensitizes glioblastoma multiforme cells to temozolomide. Exp ther med. 2021;22(5):1246. DOI: 10.3892/etm.2021.10681
62. Park H.K., Hong J.H., Oh Y.T., Kim S.S., Yin J., Lee A.J., et al. Interplay between TRAP1 and Sirtuin-3 Modulates Mitochondrial Respiration and Oxidative Stress to Maintain Stemness of Glioma Stem Cells. Cancer Res. 2019;79(7):1369–82. DOI: 10.1158/0008-5472.CAN-18-2558
63. Lin W., Huang L., Li Y., Fang B., Li G., Chen L., et al. Mesenchymal Stem Cells and Cancer: Clinical Challenges and Opportunities. Biomed Res Int. 2019;2019:2820853. DOI: 10.1155/2019/2820853
64. Xing Z., Jiang X., Chen Y., Wang T., Li X., Wei X., et al. Glutamine deprivation in glioblastoma stem cells triggers autophagic SIRT3 degradation to epigenetically restrict CD133 expression and stemness. Apoptosis. 2024;29(9–10):1619–31. DOI: 10.1007/s10495-024-02003-x
65. Merfeld T., Peng S., Keegan B.M., Crowley V.M., Brackett C.M., Gutierrez A., et al. Elucidation of novel TRAP1-Selective inhibitors that regulate mitochondrial processes. Eur J Med Chem. 2023;258:115531. DOI: 10.1016/j.ejmech.2023.115531
66. Seo Y.H. Organelle-specific Hsp90 inhibitors. Arch Pharm Res. 2015;38(9):1582–90. DOI: 10.1007/s12272-015-0636-1
67. Wei S., Yin D., Yu S., Lin X., Savani M.R., Du K., et al. Antitumor Activity of a Mitochondrial-Targeted HSP90 Inhibitor in Gliomas. Clin Cancer Res. 2022;28(10):2180–95. DOI: 10.1158/1078-0432.CCR-21-0833
68. Kang B.H., Siegelin M.D., Plescia J., Raskett C.M., Garlick D.S., Dohi T., et al. Preclinical characterization of mitochondria-targeted small molecule hsp90 inhibitors, gamitrinibs, in advanced prostate cancer. Clin cancer res. 2010;16(19):4779–88. DOI: 10.1158/1078-0432.CCR-10-1818
69. Caino M.C., Altieri D.C. Molecular Pathways: Mitochondrial Reprogramming in Tumor Progression and Therapy. Clin cancer res. 2016;22(3):540–5. DOI: 10.1158/1078-0432.CCR-15-0460
70. Soga S., Akinaga S., Shiotsu Y. Hsp90 inhibitors as anti-cancer agents, from basic discoveries to clinical development. Curr Pharm Des. 2013;19(3):366–76. DOI: 10.2174/138161213804143617
71. Nguyen T.T.T., Zhang Y., Shang E., Shu C., Quinzii C.M., Westhoff M.A., et al. Inhibition of HDAC1/2 Along with TRAP1 Causes Synthetic Lethality in Glioblastoma Model Systems. Cells. 2020;9(7):1661. DOI: 10.3390/cells9071661
Об авторах
И. Ф. ГареевРоссия
Гареев Ильгиз Фанилевич — старший научный сотрудник
Уфа, Москва
А. С. Ясинская
Россия
Ясинская Анна Сергеевна — отделение ранней медицинской реабилитации
Уфа
С. А. Румянцев
Россия
Румянцев Сергей Александрович — д.м.н., профессор, член-корр. РАН
Москва
А. А. Бухвостов
Россия
Бухвостов Александр Александрович — к.б.н., доцент, кафедра медицинских нанобиотехнологий МБФ
Москва
Рецензия
Для цитирования:
Гареев И.Ф., Ясинская А.С., Румянцев С.А., Бухвостов А.А. Роль белка TRAP1 в развитии и прогрессировании глиобластомы. Креативная хирургия и онкология. 2024;14(4):369-381. https://doi.org/10.24060/2076-3093-2024-14-4-369-381
For citation:
Gareev I.F., Yasinskaya A.S., Roumiantsev S.A., Bukhvostov A.A. Role of TRAP1 Protein in the Development and Progression of Glioblastoma. Creative surgery and oncology. 2024;14(4):369-381. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-4-369-381


































