Перейти к:
Мини-инвазивное коронарное шунтирование передней межжелудочковой артерии на работающем сердце: опыт одного центра
https://doi.org/10.24060/2076-3093-2025-15-1-19-25
Аннотация
Введение. Мини-инвазивное коронарное шунтирование передней межжелудочковой артерии (MIDCAB) позволяет избежать искусственного кровообращения и полной стернотомии, снижая риск связанных с ними осложнений.
Цель: оценить непосредственные результаты MIDCAB.
Материалы и методы. В ретроспективное исследование включены 172 пациента (132 мужчины, 40 женщин), оперированные в 2017–2022 гг. Средний возраст — 60,83 ± 8,36 года, индекс массы тела — 28,7 (25,8–32,3) кг/м 2. Фракция выброса левого желудочка — 55 (49–59) %. Сахарный диабет выявлен у 27,9 %, фибрилляция предсердий — 15,1 %. В анамнезе инсульт (4,7 %), ЧКВ (25,6 %), инфаркт миокарда ранее перенесли 60,5 %. Конечные точки: госпитальная летальность и послеоперационные осложнения.
Результаты. Гибридные вмешательства (MIDCAB + ЧКВ) выполнены у 4,7 % пациентов. Длительность операции — 112 (90–130) минут. Периоперационный инфаркт миокарда и острое почечное повреждение случилось у 1,2 %. Инсультов не было. Фибрилляция предсердий была диагностирована у 13,4 %, реэксплорация по поводу кровотечения — у 2,9 %, нагноение послеоперационной раны — у 0,6 %. Госпитальная летальность — 0,6 %. Длительность нахождения в реанимации 22 (18–24) часа, в стационаре — 9 (8–11) дней.
Обсуждение. MIDCAB демонстрирует хорошие непосредственные результаты, сочетая преимущества малоинвазивного доступа и стандартного шунтирования.
Заключение. MIDCAB — эффективный метод реваскуляризации передней межжелудочковой артерии, обеспечивающий низкую летальность и частоту осложнений.
Ключевые слова
Для цитирования:
Колесников В.Н., Энгиноев С.Т., Зеньков А.А., Екимов С.С., Хассан М.М., Рамазанова Н.Э., Джамбиева М.Н., Магомедов Г.М., Чернов И.И. Мини-инвазивное коронарное шунтирование передней межжелудочковой артерии на работающем сердце: опыт одного центра. Креативная хирургия и онкология. 2025;15(1):19-25. https://doi.org/10.24060/2076-3093-2025-15-1-19-25
For citation:
Kolesnikov V.N., Enginoev S.T., Ziankou A.A., Ekimov S.S., Hassan M.M., Ramazanova N.E., Dzhambieva M.N., Magomedov G.M., Chernov I.I. Minimally Invasive off-Pump Coronary Artery Bypass Grafting of the Anterior Descending Artery: Single-Center Experience. Creative surgery and oncology. 2025;15(1):19-25. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-1-19-25
ВВЕДЕНИЕ
Поражение передней межжелудочковой артерии (ПМЖА) может поставить под угрозу большую площадь кровоснабжаемого миокарда. И по данным рекомендаций по реваскуляризации миокарда таким пациентам показана реваскуляризация миокарда. Для решения этой потенциально жизненно важной проблемы доступны различные варианты реваскуляризации, в том числе коронарное шунтирование (КШ) или чрескожное коронарное вмешательство (ЧКВ) [1]. КШ ПМЖА путем мини-инвазивного доступа через левостороннюю мини-торакотомию (MIDCAB) по данным метаанализов показало в отдаленном периоде преимущество перед ЧКВ в виде снижения смертности от всех причин, повторной реваскуляризации [2]. Также MIDCAB по сравнению со стандартными доступами характеризуется косметическим эффектом, небольшой травмой, уменьшением длительности искусственной вентиляции легких, периода нахождения в реанимации и в клинике [3]. MIDCAB позволяет избежать искусственного кровообращения и полной стернотомии и тем самым устраняет осложнения, связанные как с использованием искусственного кровообращения, так и с полной стернотомией. Самое главное, что оно предлагает общепризнанные преимущества левой внутренней грудной артерии (ЛВГА) для ПМЖА, что остается «золотым стандартом» в стратегии реваскуляризации ПМЖА.
Цель исследования: оценить непосредственные результаты MIDCAB.
МАТЕРИАЛЫ И МЕТОДЫ
В ретроспективное одноцентровое исследование включены 172 пациента (132 мужчины и 40 женщин) с ишемической болезнью сердца, которые были прооперированы с 2017 по декабрь 2022 г. в одной клинике. Всем больным на догоспитальном этапе помимо коронарографии выполнялась трансторакальная эхокардиография. Критерии включения: все больные, которым была выполнена MIDCAB. Критерии исключения: КШ с искусственным кровообращением, комбинированные вмешательства. Основные конечные точки: госпитальная летальность, периоперационный инфаркт миокарда, инсульт, острое почечное повреждение требующее гемодиафильтрации, нагноение послеоперационной раны, реэксплорация по поводу кровотечения.
Хирургическая техника
Во всех случаях использовался эндотрахеальный наркоз при помощи севорана и пропофола. В некоторых случаях, в зависимости от предпочтения хирурга, выполнялась однолегочная вентиляция легких. Инвазивный мониторинг артериального давления (в большинстве случаев через лучевую артерию, реже через плечевую и бедренную), инвазивный мониторинг центрального венозного давления путем катетеризации правой яремной вены под ультразвуковым контролем, измерение сатурации. Доступ к сердцу осуществлялся через левостороннюю мини-торакотомию в IV–V межреберье (рис. 1). Далее при отсутствии спаечного процесса в плевральной полости выполнялось выделение скелетизированной ЛВГА, при спаечном процессе выполнялось рассечение спаек, далее забор ЛВГА. После выделения ЛВГА вводился гепарин 300 Ед/кг до достижения целевого уровня активированного времени свертывания крови — 450 секунд и более. Рутинно использовался интракоронарный шунт и стабилизатор миокарда. После ревизии ПМЖА выполнялась артериотомия и наложение дистального анастомоза с ЛВГА «парашютным» способом. После завершения дистального анастомоза выполнялась интраоперационная флоуметрия, далее контрольная флоуметрия после введения протамина. Устанавливался послеоперационный дренаж в левую плевральную полость и фиксация перикарда в области верхушки сердца. По предпочтению хирурга некоторым пациентам выполнялась паравертебральная блокада для обезболивания в послеоперационном периоде, для этого до ушивания раны устанавливался катетер паравертебрально. Сведение ребер осуществлялось леской, на коже накладывался внутрикожный шов (рис. 2). При гибридном вмешательстве у всех больных ЧКВ выполнялось вторым этапом.
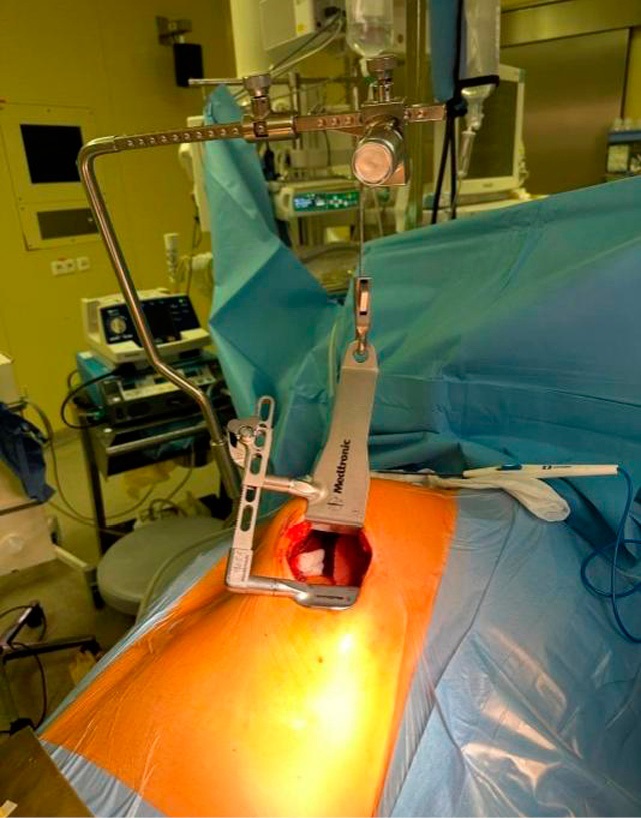
Рисунок 1. Интраоперационный вид после мини-торакотомии
Figure 1. Intraoperative view after minithoracotomy
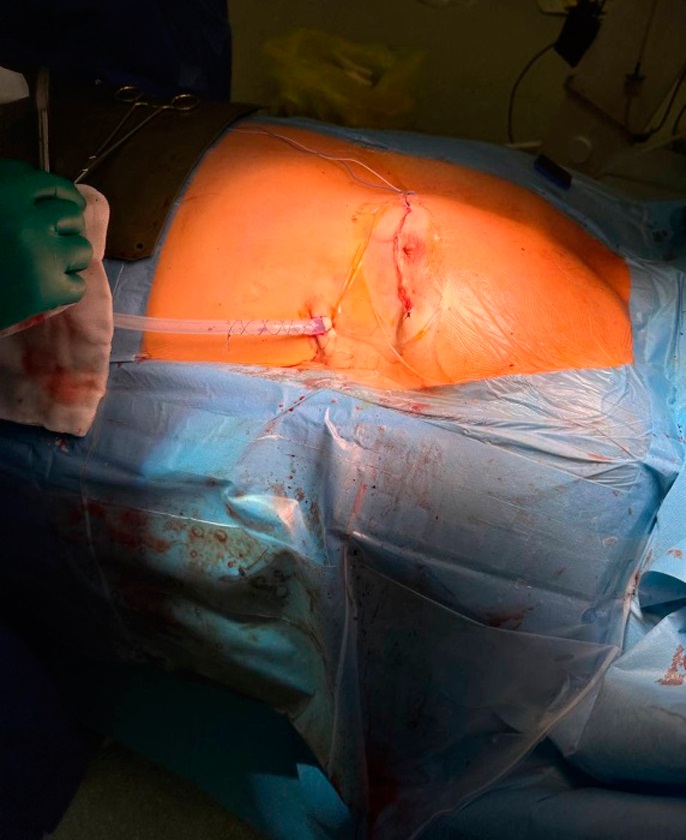
Рисунок 2. Окончательный вид после операции
Figure 2. Final post-operative view
Статистическая обработка материала выполнялась с использованием пакета программного обеспечения IBM SPSS Statistics 26 (Chicago, IL, USA). Выполнена проверка всех количественных переменных на тип распределения с помощью критерия Колмогорова — Смирнова с поправкой Лиллиефорса. Количественные признаки, имеющие распределение близкое к нормальному, описывали в форме среднего значения и стандартного отклонения (M ± SD), в случае отличного от нормального распределения — в виде медианы и 25-го, 75-го процентиля (Me [Q1–Q3]). Качественные переменные описывали абсолютными (n) и относительными (%) значениями.
РЕЗУЛЬТАТЫ
Средний возраст включенных больных составил 60,83 ± 8,36 года. Индекс массы тела — 28,7 (25,8–32,3) кг/м². По данным эхокардиографии фракции выброса левого желудочка составила 55 (49–59) %, конечно-диастолический объем левого желудочка — 103,5 (81,5–133,5) мл. По функциональному классу (ФК) стенокардии распределились следующим образом: без стенокардии — 7 (4,1 %) больных, с I ФК — 4 (2,3 %), II ФК — 77 (44,8 %), III ФК — 79 (45,9 %), IV ФК — 5 (2,9 %). Сахарный диабет и фибрилляция предсердий в анамнезе имелись у 48 (27,9 %) и 26 (15,1 %) человек соответственно. Инсульт, ЧКВ и инфаркт миокарда ранее перенесли 8 (4,7 %), 44 (25,6 %) и 104 (60,5 %) больных соответственно. У 75 (43,6 %) больных ПМЖА была окклюзирована. Гибридные вмешательства (MIDCAB + ЧКВ) были применены у 8 (4,7 %) больных. Демографические и дооперационные данные представлены в таблице 1. Распределение больных по годам отображено на рисунке 3.
Параметры | n = 172 |
Возраст, годы, M ± SD c 95 % ДИ | 60,83 ± 8,36 (59,57–62,08) |
Пол, мужчины, n (%) | 132 (76,7) |
ИМТ, кг/м², Me (Q1–Q3) | 28,70 (25,80–32,32) |
ФК стенокардии, n (%) Без стенокардии I II III | 7 (4,1) 4 (2,3) 77 (44,8) 76 (44,2) |
СД, n (%) | 48 (27,9) |
АГ, n (%) | 154 (89,5) |
ХОБЛ, n (%) | 28 (16,3) |
ФП в анамнезе, n (%) | 26 (15,1) |
Инсульт в анамнезе, n (%) | 8 (4,7) |
ЧКВ в анамнезе, n (%) | 44 (25,6) |
ПИКС, n (%) | 104 (60,5) |
ФВ ЛЖ, %, Me (Q1–Q3) | 55 (49–59) |
КДО ЛЖ, мл, Me (Q1–Q3) | 103,5 (81,5–135,5) |
Окклюзия ПМЖА | 75 (43,6) |
Поражение ОА >75 % | 11 (6,4) |
Поражение ПКА >75 % | 22 (12,8) |
Таблица 1. Общая характеристика включенных больных
Table 1. General characteristics of the included patients
Примечание: АГ — артериальная гипертензия, ИМТ — индекс масса тела, ПИКС — постинфарктный кардиосклероз, ПКА — правая коронарная артерия, ПМЖА — передняя межжелудочковая артерия, ОА — огибающая артерия, СД — сахарный диабет, ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий, ХОБЛ — хроническая обструктивная болезнь легких, ЧКВ — чрескожное коронарное вмешательство.
Note. АГ — arterial hypertension, ИМТ — body mass index, ПИКС — post-infarction cardiosclerosis, ПКА — right coronary artery, ПМЖА — anterior descending artery, ОА — circumflex artery, СД — diabetes mellitus, ФВ ЛЖ — left ventricular ejection fraction, ФП — atrial fibrillation, ХОБЛ — chronic obstructive pulmonary disease, ЧКВ — percutaneous coronary intervention.
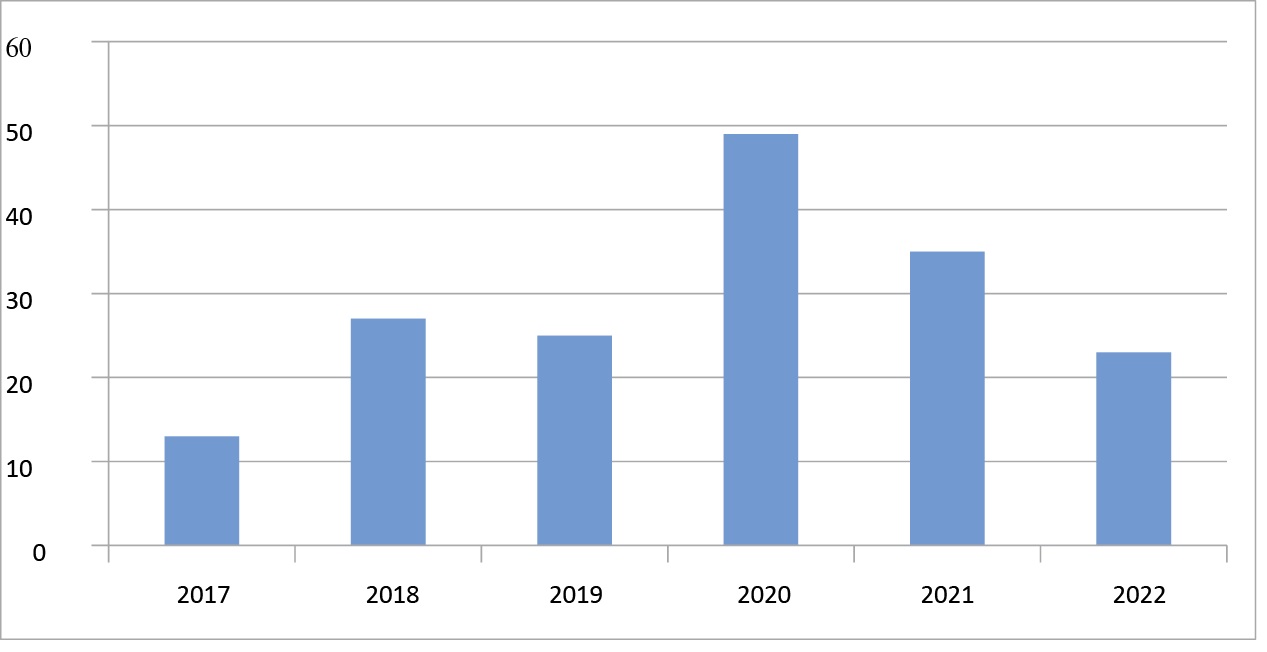
Рисунок 3. Распределение больных по годам
Figure 3. Patient distribution by year
В раннем послеоперационном периоде умер 1 пациент (0,6 %) от геморрагического шока. Периоперационное повреждение миокарда составило 3,8 %, но при выписке из стационара у всех больных имелась такая ФВ ЛЖ, как и при поступлении (55 (51–60) %). Нарушение проводимости, потребовавшее имплантации постоянного ЭКС, составило 1,9 %, частота инсультов и острого почечного повреждения, потребовавшего гемодиализа, — 0,6 %. Длительность операции — 112 (90–130) минут. Периоперационный инфаркт миокарда и острое почечное повреждение случились у 2 (1,2 %) пациентов, ни у одного пациента не было инсульта. Впервые возникшая фибрилляция предсердий была диагностирована у 23 (13,4 %). Реэксплорация по поводу кровотечения выполнена 5 (2,9 %). Нагноение послеоперационной раны случилось у 1 (0,6 %) больного. Госпитальная летальность — у 1 (0,6 %). Длительность нахождения в реанимации и клинике составила 22 (18–24) часа и 9 (8–11) дней соответственно. Данные представлены в таблице 2.
Параметры | n = 172 |
Длительность операции, мин, Me (Q1–Q3) | 112 (90,00–130,25) |
ГРМ | 8 (4,7) |
Периоперационный ИМ, n (%) | 2 (1,2) |
Инсульт, n (%) | 0 (0) |
ОПП, n (%) | 2 (1,2) |
Нагноение послеоперационной раны, n (%) | 1 (0,6) |
ПОФП, n (%) | 23 (13,4) |
ЭКМО, n (%) | 0 (0) |
ВАБК, n (%) | 0 (0) |
Реэксплорация по поводу кровотечения, n (%) | 5 (2,9) |
Госпитальная летальность, n (%) | 1 (0,6) |
Время нахождения в ОАРИТ, ч, Ме (Q1–Q3) | 22,0 (18,75–24,0) |
Период госпитализации, дн, Ме (Q1–Q3) | 9,0 (8,0–11,0) |
Таблица 2. Операционные параметры и послеоперационные осложнения
Table 2. Parameters of the procedure and postoperative complications
Примечание: ВАБК — внутриаортальный баллонный контрпульсатор, ГРМ — гибридная реваскуляризация миокарда, ИМ — инфаркт миокарда, ОПП — острое почечное повреждение, ПОФП — постоперационная фибрилляция предсердий, ЭКМО — экстракорпоральная мембранная оксигенация.
Note: ВАБК — intra-aortic balloon pump, ГРМ — hybrid coronary revascularization, ИМ — myocardial infarction, ОПП — acute kidney injury, ПОФП — postoperative atrial fibrillation, ЭКМО — extracorporeal membrane oxygenation.
ОБСУЖДЕНИЕ
Первая комплексная оценка MIDCAB была проведена K. Kettering и его коллегами в 2004 г. [4]. Они провели систематический обзор 15 опубликованных исследований между 1998 и 2002 годами. По их данным госпитальная смертность варьировала от 0 до 4,9 %, а поздняя смертность (смертность >30 дней после MIDCAB) — от 0,3 до 12,6 %. Частота инфаркта миокарда колебалась от 0 до 3,1 %. Для 8,9 % пациентов потребовалось повторное вмешательство из-за отказа трансплантата.
L. Manuel и соавторы представили данные о 271 операции MIDCAB с акцентом на долгосрочные результаты, включающие 20-летний период наблюдения [5]. В раннем послеоперационном периоде случаев летальности не зафиксировано, а 30-дневная летальность составила всего 0,4 %. Долговременные показатели выживаемости составили 91,9 % через 5 лет, 84,7 % через 10 лет, 71,3 % через 15 лет и 56,5 % через 20 лет, что свидетельствует о высокой эффективности методики в отдаленной перспективе.
И. Ф. Шабаев и соавт. [6] опубликовали отдаленные результаты с периодом наблюдения 31,4 ± 20,9 мес. Частота развития летальных исходов за период наблюдения составила 6 %, инфаркта миокарда — 2,6 %, частота цереброваскулярных событий регистрировалась в 6 % случаев (n = 7), повторная реваскуляризация в виде ЧКВ потребовалась в 1,2 % случаев.
Stanbridge и Hadjinikolaou опубликовали метаанализ, сравнивающий 3304 случая MIDCAB и 3060 случаев аортокоронарного шунтирования без искусственного кровообращения (OPCAB), хирургическое вмешательство через стернотомию [7]. Частота смертности между двумя группами была одинаковой (1,6 % против 2,2 %). Частота инфаркта миокарда была выше при MIDCAB (2,9 % против 1,45 %; P < 0,03).
В исследовании J. Gofus и соавторов проведено сравнение робот-ассистированного забора ВГА при выполнении MIDCAB с традиционным MIDCAB. Анализ показал отсутствие значимых различий в госпитальной летальности и частоте послеоперационных осложнений. Однако было отмечено снижение послеоперационной кровопотери и сокращение продолжительности искусственной вентиляции легких при использовании робот-ассистированной техники. На основании полученных данных авторы пришли к выводу, что робот-ассистированная MIDCAB является перспективной альтернативой традиционной MIDCAB [8].
Г. В. Лев и его коллеги [9] показали, что объем интраоперационной кровопотери больше после операции OPCAB, время пребывания в отделении реанимации и клинике дольше после операции OPCAB по сравнению с MIDCAB. В группе OPCAB достоверно чаще требовалась трансфузия компонентов крови. Кумулятивная четырехлетняя выживаемость и свобода от неблагоприятных кардиальных событий также были одинакова в группе OPCAB и MIDCAB.
В литературе представлено сравнительное исследование с самым длительным периодом наблюдения MIDCAB (n = 508) и полной стернотомии (n = 160). Одинаковая 30-дневная смертность (2,0 % против 2,5 %), частота инсультов (1,3 % против 1,4 %) и частота повторных реваскуляризаций (0,8 % против 1,3 %). При среднем времени наблюдения 12,95 ± 0,45 года долгосрочная выживаемость была сопоставима для двух групп [10].
В 2023 году были опубликованы результаты одного из крупнейших метаанализов, в котором сравнивались результаты MIDCAB и ЧКВ при поражении ПМЖА [11]. В исследование включены 1757 пациентов, перенесших MIDCAB, и 15 245 пациентов после ЧКВ. Анализ не выявил различий в послеоперационной летальности, частоте осложнений и отдаленной выживаемости. Однако было показано, что MIDCAB ассоциируется с меньшей частотой необходимости повторной реваскуляризации и снижением риска серьезных сердечно-сосудистых событий, что подчеркивает ее преимущество перед ЧКВ. В другом метаанализе также отмечена лучшая отдаленная выживаемость пациентов после MIDCAB, а также более низкая частота повторных реваскуляризаций по сравнению с ЧКВ [2]. Эти данные подтверждают перспективность MIDCAB как эффективного метода хирургического лечения ишемической болезни сердца (ИБС), особенно в контексте снижения необходимости повторных вмешательств.
ИБС обычно лечат либо медикаментозно, либо с помощью ЧКВ, либо с помощью КШ. По мере развития технологий стентирования и мини-инвазивной кардиохирургии появился третий вариант: гибридная коронарная реваскуляризация (ГКР). Пациенты со сложными поражениями ПМЖА, которые могут быть неоптимальными для стентирования, а также с поражениями других коронарных артерий, которые легко стентируются, представляют собой идеальных кандидатов для ГКР, поскольку они могут извлечь выгоду из долговечности ЛВГА, анастомозированной с ПМЖА. Эти пациенты избегают стернотомии, манипуляций на аорте, избегают использования трансплантатов подкожной вены и быстрее восстанавливаются после операции. В многоцентровом обсервационном исследовании 12,2 % пациентов, перенесших диагностическую ангиографию, были признаны подходящими для гибридного подхода [12]. В некоторых руководствах определены показания для ГКР [1]. В ранее проведенных метаанализах было показано, что ГКР имеет такую же выживаемость, одинаковую частоту больших сердечно-сосудистых событий, однако после ГКР меньше трансфузий крови, длительность пребывания в реанимации и клинике, но выше частота повторных реваскуляризаций миокарда в отдаленном периоде по сравнению с традиционным КШ [13][14]. В нашем исследовании частота применения ГКР составила 4,7 %, первым этапом выполнялась MIDCAB, вторым этапом ЧКВ.
По мере развития технологии мини-инвазивный доступ возможен для применения и при многососудистом поражении коронарных артерий. Так, А. А. Зеньков с соавт. проанализировали 611 пациентов с ишемической болезнью сердца при множественном поражении коронарного русла, прооперированных путем мини-инвазивного доступа. Было показано, что отдаленная восьмилетняя выживаемость и свобода от неблагоприятных сердечных и мозговых события составили 91,4 и 87,6 % соответственно [15].
ЗАКЛЮЧЕНИЕ
Операция MIDCAB является привлекательной для реваскуляризации изолированного поражения ПМЖА, поскольку она предлагает преимущества «золотого стандарта» анастомоза ЛВГА с ПМЖА, сопровождаясь низкой госпитальной летальностью и периоперационными осложнениями.
Список литературы
1. Lawton J.S., Tamis-Holland J.E., Bangalore S., Bates E.R., Beckie T.M., Bischoff J.M., et al. 2021 ACC/AHA/SCAI Guideline for coronary artery revascularization: a report of the American college of cardiology/American heart association joint committee on clinical practice guidelines. J Am Coll Cardiol. 2022;79:e21–129. DOI: 10.1016/j.jacc.2021.09.006
2. Gianoli M., de Jong A.R., Jacob K.A., Namba H.F., van der Kaaij N.P., van der Harst P., et al. Minimally invasive surgery or stenting for left anterior descending artery disease — meta-analysis. Int J Cardiol Hear Vasc. 2022;40:101046. DOI: 10.1016/j.ijcha.2022.101046
3. Xu Y., Li Y., Bao W., Qiu S. MIDCAB versus off-pump CABG: Comparative study. Hellenic J Cardiol. 2020;61:120–4. DOI:10.1016/j.hjc.2018.12.004
4. Kettering K., Dapunt O., Baer F.M. Minimally invasive direct coronary artery bypass grafting: a systematic review. J Cardiovasc Surg (Torino). 2004;45:255–64. PMID: 15179338
5. Manuel L., Fong L.S., Betts K., Bassin L., Wolfenden H. LIMA to LAD grafting returns patient survival to age-matched population: 20-year outcomes of MIDCAB surgery. Interact Cardiovasc Thorac Surg. 2022; 35(4):ivac243. DOI:10.1093/icvts/ivac243
6. Шабаев И.Ф., Козырин К.А., Тарасов Р.С. Отдаленные результаты минимально инвазивного коронарного шунтирования на работающем сердце. Патология кровообращения и кардиохирургия. 2020;24(3):62–9. DOI: 10.21688/1681-3472-2020-3-62-69
7. Sheu J.J., Wang J.S., Lai S.T., Yu T.J., Weng Z.C., Shih C.C. Minimally-invasive, direct coronary artery bypass grafting. Chinese Med J. 1998;61:507–12. DOI: 10.21037/amj.2020.03.05
8. Gofus J., Cerny S., Shahin Y., Sorm Z., Vobornik M., Smolak P., et al. Robot-assisted vs. conventional MIDCAB: A propensity-matched analysis. Front Cardiovasc Med. 2022;9:943076. DOI: 10.3389/fcvm.2022.943076
9. Лев Г.В., Жбанов И.В., Киладзе И.З., Урюжников В.В., Шабалкин Б.В. Результаты операций MIDCAB И OPCAB при изолированном шунтировании передней нисходящей артерии. Минимально инвазивная сердечно-сосудистая хирургия. 2022;1(1):53–62.
10. Raja S.G., Garg S., Rochon M., Daley S., De Robertis F., Bahrami T. Short-term clinical outcomes and long-term survival of minimally invasive direct coronary artery bypass grafting. Ann Cardiothorac Surg. 2018;7:621–7. DOI: 10.21037/acs.2018.06.14
11. Zhang S., Chen S., Yang K., Li Y., Yun Y., Zhang X., et al. Minimally invasive direct coronary artery bypass versus percutaneous coronary intervention for isolated left anterior descending artery stenosis: an updated meta-analysis. Heart Surg Forum. 2023;26:E114–25. DOI: 10.1532/hsf.5211
12. Puskas J.D., Halkos M.E., DeRose J.J., Bagiella E., Miller M.A., Overbey J., et al. Hybrid coronary revascularization for the treatment of multivessel coronary artery disease: a multicenter observational study. J Am Coll Cardiol. 2016;68:356–65. DOI: 10.1016/j.jacc.2016.05.032
13. Dixon L.K., Akberali U., Di Tommaso E., George S.J., Johnson T.W., Bruno V.D. Hybrid coronary revascularization versus coronary artery bypass grafting for multivessel coronary artery disease: A systematic review and meta-analysis. Int J Cardiol. 2022;359:20–7. DOI: 10.1016/j.ijcard.2022.04.030
14. Nagraj S., Tzoumas A., Kakargias F., Giannopoulos S., Ntoumaziou A., Kokkinidis D.G., et al. Hybrid coronary revascularization (HCR) versus coronary artery bypass grafting (CABG) in multivessel coronary artery disease (MVCAD): A meta-analysis of 14 studies comprising 4226 patients. Catheter Cardiovasc Interv. 2022;100:1182–94. DOI: 10.1002/ccd.30446
15. Зеньков А.А., Исаев М.Н., Чернов И.И. Мини-инвазивное многососудистое коронарное шунтирование — опыт первых шестисот операций. Минимально инвазивная сердечно-сосудистая хирургия. 2023;2(1):8–17.
Об авторах
В. Н. КолесниковРоссия
Колесников Владимир Николаевич — к.м.н.
Астрахань
С. Т. Энгиноев
Россия
Энгиноев Сослан Тайсумович — к.м.н., кардиохирургическое отделение № 1, кафедра сердечно-сосудистой хирургии факультета последипломного образования (ФПО)
Астрахань
А. А. Зеньков
Россия
Зеньков Александр Александрович — д.м.н., кардиохирургическое отделение № 1
Астрахань
С. С. Екимов
Россия
Екимов Сергей Сергеевич — кардиохирургическое отделение № 1
Астрахань
М. М. Хассан
Россия
Хассан Мадиан Мохамед — ординатор, кафедра сердечно-сосудистой хирургии ФПО
Астрахань
Н. Э. Рамазанова
Россия
Рамазанова Наргиз Эльшадовна — ординатор, кафедра сердечно-сосудистой хирургии ФПО
Астрахань
М. Н. Джамбиева
Россия
Джамбиева Муминат Назимовна — ординатор, кафедра сердечно-сосудистой хирургии ФПО
Астрахань
Г. М. Магомедов
Россия
Магомедов Гасан Магомедзагирович — кардиохирургическое отделение № 3
Астрахань
И. И. Чернов
Россия
Чернов Игорь Ионович — к.м.н.
Астрахань
Рецензия
Для цитирования:
Колесников В.Н., Энгиноев С.Т., Зеньков А.А., Екимов С.С., Хассан М.М., Рамазанова Н.Э., Джамбиева М.Н., Магомедов Г.М., Чернов И.И. Мини-инвазивное коронарное шунтирование передней межжелудочковой артерии на работающем сердце: опыт одного центра. Креативная хирургия и онкология. 2025;15(1):19-25. https://doi.org/10.24060/2076-3093-2025-15-1-19-25
For citation:
Kolesnikov V.N., Enginoev S.T., Ziankou A.A., Ekimov S.S., Hassan M.M., Ramazanova N.E., Dzhambieva M.N., Magomedov G.M., Chernov I.I. Minimally Invasive off-Pump Coronary Artery Bypass Grafting of the Anterior Descending Artery: Single-Center Experience. Creative surgery and oncology. 2025;15(1):19-25. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-1-19-25
JATS XML


































