Перейти к:
Обоснование нового подхода к хирургическому лечению пациентов с первичным гиперпаратиреозом на основании анализа динамики лабораторных показателей костного метаболизма
https://doi.org/10.24060/2076-3093-2025-15-1-26-33
Аннотация
Введение. Для повышения результативности лечения первичного гиперпаратиреоза актуальным является научно обоснованный выбор способа хирургического вмешательства. Цель: обосновать новый подход к хирургическому лечению пациентов с первичным гиперпаратиреозом на основании динамики лабораторных показателей костного обмена.
Материалы и методы. Сравнивали динамику лабораторных показателей костного обмена у пациентов с первичным гиперпаратиреозом (n = 394), разделенных на 4 группы: 1 (n = 97) — паратиреоидэктомия из центрального мини-доступа с двухсторонней ревизией паращитовидных желез и применением конфокальной лазерной микроскопии; 2 (n = 150) — из мини-доступа с односторонней ревизией; 3 (n = 72) — из минидоступа без ипсилатеральной ревизии (местная анестезия); 4 (n = 75) — из доступа Кохера на шее.
Результаты и обсуждение. У пациентов группы 1 в 100 % случаев (n = 97) достигались целевые интраоперационные значения интактного паратиреоидного гормона (иПТГ) — нормализация в 84,6 % случаев (n = 82) или снижение на 50 % и более от дооперационных значений в 15,4 % случаев (n = 15). При других вариантах доступов (группы 2, 3, 4) нормализация иПТГ была в 61,3 % случаев (n = 182), снижение иПТГ на 50 % и более — в 25,6 % (n = 76), в 13,1 % случаев (n = 39) не достигались целевые значения иПТГ. Только в группе 1 через 3 месяца после операции происходила полная нормализация кальция ионизированного и иПТГ. В группах 2, 3, 4 в ряде случаев сохранялись значения ионизированного кальция более 1,35 ммоль/л, у 30,3 % пациентов (n = 90) — значения иПТГ более 68,3 пг/мл.
Заключение. Предложен новый подход к хирургическому лечению пациентов с первичным гиперпаратиреозом с использованием конфокальной лазерной микроскопии, позволяющий повысить эффективность лечения и достигнуть в 100 % случаев целевых значений иПТГ и нормализации ионизированного кальция. Данный подход также обосновывает возможность отказа от обязательного интраоперационного исследования иПТГ, обеспечивая снижение длительности оперативного вмешательства без уменьшения его радикальности.
Ключевые слова
Для цитирования:
Величко А.В., Ярец Ю.И., Дундаров З.А. Обоснование нового подхода к хирургическому лечению пациентов с первичным гиперпаратиреозом на основании анализа динамики лабораторных показателей костного метаболизма. Креативная хирургия и онкология. 2025;15(1):26-33. https://doi.org/10.24060/2076-3093-2025-15-1-26-33
For citation:
Velichko A.V., Yarets Yu.I., Dundarov Z.A. Rationale for a New Approach to the Surgical Treatment of Primary Hyperparathyroidism Patients Based on the Analyzed Dynamics of Laboratory Bone Turnover Markers. Creative surgery and oncology. 2025;15(1):26-33. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-1-26-33
ВВЕДЕНИЕ
Хирургическое удаление гиперфункционирующих паращитовидных желез (паратиреоидэктомия) является радикальным методом лечения первичного гиперпаратиреоза, эффективность которого составляет 92–98 % [1–3]. Показателем успешной операции является нормализация лабораторных показателей костного обмена: кальция, фосфора, паратиреоидного гормона и др. Паратиреоидэктомия с использованием поперечного доступа по Кохеру с выполнением ревизии всех паращитовидных желез является классическим вариантом хирургического доступа [3][4]. Однако в настоящее время методики паратиреоидэктомии претерпевают изменения, в связи с чем обсуждается и объем предстоящего оперативного вмешательства. Отмечается тенденция к снижению инвазивности операции, разработаны открытые минимально инвазивные паратиреоидэктомии, сопровождаемые техниками визуализации (видео-ассистированные и робот-ассистированные паратиреоидэктомии), селективная паратиреоидэктомия [5–7]. Высокую эффективность показывает минимально инвазивная паратиреоидэктомия, выполняемая под местным обезболиванием, в том числе в амбулаторных условиях [8].
Для повышения результативности лечения первичного гиперпаратиреоза актуальным является научно обоснованный выбор способа хирургического вмешательства, который будет иметь преимущества не только в виде косметического эффекта, сокращения времени операции, снижения длительности госпитализации, уменьшения послеоперационного болевого синдрома, но и позволит достичь значимого изменения и нормализации патологически измененных показателей костного обмена.
Цель: обосновать новый подход к хирургическому лечению пациентов с первичным гиперпаратиреозом на основании динамики лабораторных показателей костного обмена.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено проспективное одноцентровое исследование. Проанализированы показатели костного метаболизма у 394 пациентов с первичным гиперпаратиреозом (женщин — 354, 89,8 %; мужчин — 40; 10,2 %) в возрасте 54,0 (49,0; 61,0) года, которые поступали в хирургическое отделение (трансплантации, эндокринной и реконструктивной хирургии) ГУ «РНПЦ РМиЭЧ» в период 2013–2018 гг. Топическая диагностика новообразований паращитовидных желез проводилась с использованием комплекса инструментальных методов: УЗИ, КТ-ангиографии, МРТ, сцинтиграфии с 99mТс-sestamibi, с помощью разработанного нами алгоритма диагностики и компьютерной программы «Гиперпаратиреоз» [9].
В зависимости от способа хирургического вмешательства пациенты были разделены на 4 группы. У 97 пациентов (группа 1) операцию выполняли из центрального мини-доступа с двухсторонней ревизией паращитовидных желез и применением конфокальной лазерной микроскопии, для чего использовали эндомикроскопическую систему «Cellvizio» (Mauna Kea Technologies, Франция). Для насыщения тканей флуорофором, обеспечивающим флуоресцентное свечение, использован 10 % раствор флуоресцеина натрия («Флуоресцеин Новартис», Novartis Pharma, Франция). Группу 2 составили пациенты (n = 150), прооперированные мини-доступом с односторонней ревизией паращитовидных желез. У пациентов группы 3 (n = 72) хирургическое вмешательство выполняли под местной анестезией из мини-доступа без ипсилатеральной ревизии. Группа 4 была представлена 75 пациентами, которые были прооперированы с использованием классического доступа Кохера на шее. У пациентов 1, 2 и 4-й групп операция выполнялась под эндотрахеальным наркозом.
У пациентов в крови определяли уровень общего кальция и неорганического фосфора (автоматический биохимический анализатор Architect с8000, Abbott Laboratories, США), ионизированного кальция (анализатор электролитов NOVA 8, NOVA Biomedical, США), интактного паратиреоидного гормона (иПТГ), витамина D (аналит — 25 (ОН) D) (автоматический иммунохимический анализатор Architect i2000, Abbott Laboratories, США), остазы (костного фрагмента щелочной фосфатазы) (хемилюминесцентный анализатор Liaison, Diasorin, Германия). Референтными считали значения, указанные в инструкциях к соответствующим набора реагентов: иПТГ 15,0–68,3 пг/мл, кальций общий 2,10–2,55 ммоль/л, кальций ионизированный 1,05–1,40 ммоль/л, остаза 3,0–30,0 мкг/л (с учетом возраста и пола), фосфор неорганический 0,75–1,55 ммоль/л. Исследования выполняли в клинико-диагностической лаборатории ГУ «РНПЦ РМиЭЧ». Для витамина D учитывали существующие рекомендации по интерпретации значений, разделяющие состояния выраженного дефицита, дефицита, недостаточности витамина D, а также целевых и адекватных значений витамина D [10]. Лабораторные исследования проводили перед операцией и через 3 месяца после проведенного вмешательства; иПТГ дополнительно определяли интраоперационно, после удаления новообразования паращитовидной железы. Витамин D оценивали только в послеоперационном периоде, после ожидаемого восстановления нормального уровня иПТГ.
Данные подвергали статистической обработке. Характеристики распределения выражали медианы и интерквартильный размах: Ме (25 %; 75 %), где Me — медиана, 25 % — нижний квартиль, 75 % — верхний квартиль. Анализ различий по количественным показателям во взаимосвязанных выборках проводили с использованием W-критерия Вилкоксона, в независимых выборках — с помощью рангового U-критерия Манна — Уитни. Определение различий в независимых группах проводили с использованием Н-критерия Краскела — Уоллиса. Встречаемость признаков выражали в относительных частотах (%). Частотный анализ в таблицах сопряженности проводили с использованием критерия χ² Пирсона. Расчеты и графические построения выполняли с помощью программного пакета Statistica 6.1 (StatSoft Inc., США, регистрационный номер лицензионной версии GS-35F-589).
РЕЗУЛЬТАТЫ
При первичном исследовании перед проведением операции у всех пациентов (n = 394) регистрировались повышенные значения иПТГ и остазы, составляя 154,4 (109,0; 247,1) пг/мл и 140,5 (79,0; 195,0) мкг/л, с максимумом до 2500,0 пг/мл и 721,0 мкг/л соответственно. У большинства пациентов 82,5 % (n = 325) значения неорганического фосфора в крови находились в пределах референтных значений, у 17,5 % пациентов (n = 69) были снижены до менее 0,75 ммоль/л. На фоне повышенных значений иПТГ и остазы уровень общего кальция составил 2,56 (2,34; 2,80) ммоль/л, кальция ионизированного — 1,32 (1,20; 1,44) ммоль/л. Анализ распределения значений показал, что 4,6 % (n = 18) значений общего кальция были снижены до менее 2,10 ммоль/л; с одинаковой частотой 47,7 % (n = 188 и n = 188) регистрировались повышенные (более 2,55 ммоль/л) и нормальные (от 2,10 до 2,55 ммоль/л) значения общего кальция. Нормальные значения ионизированного кальция встречались чаще — у 67,5 % пациентов (n = 266), реже наблюдались повышенные значения — у 29,2 % пациентов (n = 115) (χ² = 31,6 и χ² = 28,6; p < 0,001, по сравнению с частотой встречаемости аналогичных значений общего кальция); 3,3 % пациентов (n = 13) имели сниженный уровень ионизированного кальция. Детальное распределение дооперационных значений кальция представлено на рисунке 1.
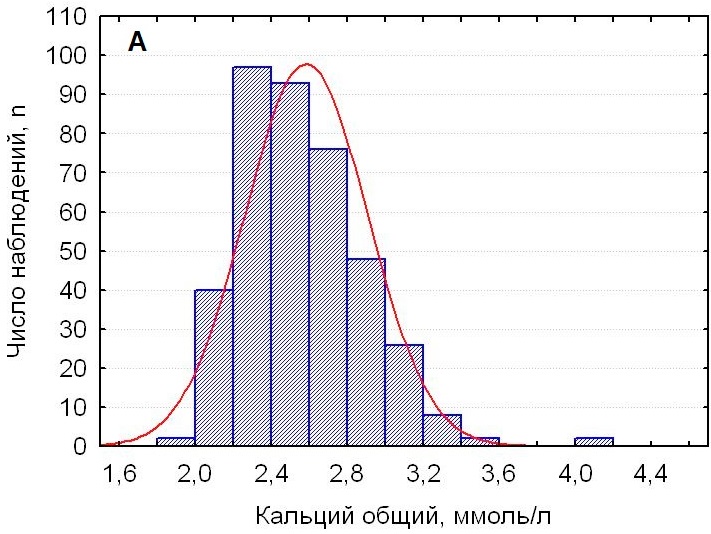

Рисунок 1. Гистограммы распределения дооперационных значений кальция общего (А) и кальция ионизированного (Б) у пациентов с первичным гиперпаратиреозом
Figure 1. Histograms showing the distribution of preoperative total calcium (A) and ionized calcium (B) levels in primary hyperparathyroidism patients
В сравниваемых группах пациентов отсутствовали различия в дооперационных уровнях кальция (общего и ионизированного), фосфора и остазы, иПТГ, что обеспечивало сопоставимость групп по лабораторным показателям (табл. 1).
Показатель | Группа 1 | Группа 2 | Группа 3 | Группа 4 |
Ме (25 %; 75 %) | ||||
Кальций общий | 2,67 (2,45; 2,82) | 2,51 (2,38; 2,80) | 2,58 (2,40; 2,80) | 2,53 (2,34; 2,68) |
Кальций ионизированный | 1,33 (1,20; 1,44) | 1,33 (1,2; 1,45) | 1,33 (1,18; 1,50) | 1,30 (1,17; 1,36) |
Фосфор неорганический | 0,97 (0,79; 1,09) | 0,97 (0,76; 1,10) | 0,99 (0,79; 1,08) | 1,02 (0,86; 1,13) |
Остаза | 117,0 (75,0; 177,0) | 139,0 (76,0; 196,0) | 115,0 (74,0; 188,0) | 153,0 (83,5; 196,0) |
иПТГ | 109,5 (85,4; 161,7) | 169,0 (116,7; 316,6) | 186,9 (133,5; 2265,0) | 154,9 (103,5; 207,7) |
Таблица 1. Дооперационные значения лабораторных показателей костного обмена в группах пациентов с первичным гиперпаратиреозом
Table 1. Preoperative levels of laboratory bone turnover markers in the groups of primary hyperparathyroidism patients
Интраоперационно у пациентов регистрировалось значимое снижение иПТГ до 53,5 (34,7; 74,6) пг/мл (тест Вилкоксона p < 0,001). При этом у 67,0 % пациентов (n = 264) достигались нормальные значения иПТГ, повышенными оставались иПТГ у 33,0 % пациентов (n = 130).
При сравнении групп пациентов с первичным гиперпаратиреозом в зависимости от подхода к хирургическому лечению получены значимые различия по уровням иПТГ. Минимальными были значения иПТГ в группе 1: 40,0 (24,8; 61,0) пг/мл; максимальными оставались интраоперационные значения иПТГ в группе 2: 57,35 (34,9; 109,0) пг/мл (Н = 17,95; p < 0,001) (рис. 2).
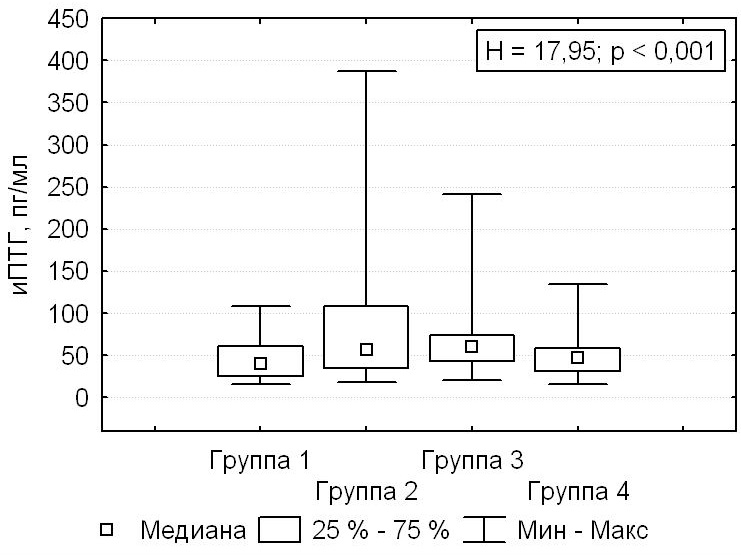
Рисунок 2. Интраоперационные значения паратиреоидного гормона.
Figure 2. Intraoperative parathyroid hormone levels.
У пациентов группы 1 интраоперационные значения иПТГ в 84,6 % случаев (n = 82) соответствовали референтному диапазону. В группе 2 нормализация интраоперационного уровня иПТГ достигалась у 56,7 % пациентов (n = 85), в группе 3 — у 54,2 % (n = 39), в группе 4 — у 77,3 % (n = 58). Более высокая частота достижения нормальных значений иПТГ в группе 1 (χ² = 61,3; p < 0,001) объясняется новым подходом к хирургическому лечению пациентов с первичным гиперпаратиреозом с применением конфокальной лазерной микроскопии, которая обеспечивает более высокую радикальность операции. При использовании других вариантов доступа (группы 2, 3, 4, n = 297) нормализация иПТГ происходила в 61,3 % случаев (n = 182).
В остальных случаях (n = 130) интраоперационные значения иПТГ, превышающие референтный диапазон, анализировали по степени их снижения относительно исходных значений. Только в группе 1 (n = 15, 15,4 %) снижение иПТГ после паратиреоидэктомии достигалось на целевые 50 % и более от дооперационных значений, что значимо отличало пациентов группы 1 от пациентов других групп (Н = 15,21; p < 0,001). У пациентов групп 2, 3, 4 (n = 115) степень снижения иПТГ была в среднем на 57,9 (39,2; 73,4) %, при этом не было выявлено значимых различий между этими группами пациентов (H = 0,15; p = 0,9). Целевые значения степени снижения иПТГ у пациентов групп 2, 3, 4 не достигались в 13,1 % случаев (n = 39), у 76 пациентов (25,6 %) происходило снижение иПТГ на 50 % и более от исходных дооперационных значений (рис. 3).
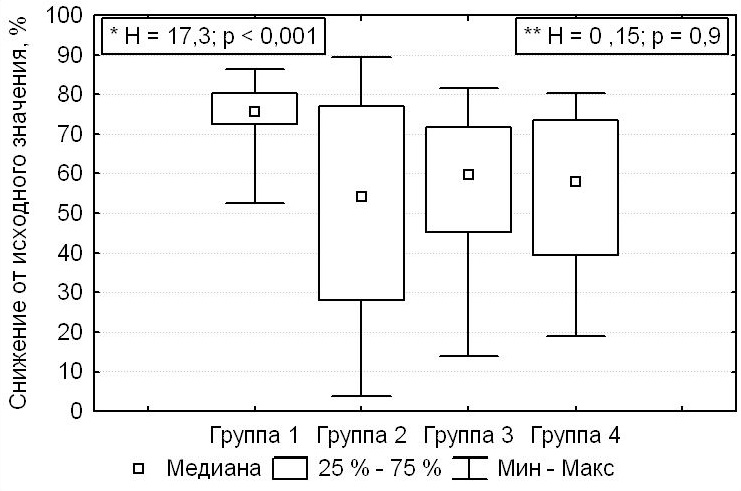
Рисунок 3. Степень снижения интраоперационных значений паратиреоидного гормона относительно исходного уровня.
Примечание: * значимые различия между группами 1–4 (критерий Краскела — Уоллиса); ** отсутствие значимых различий (критерий Краскела — Уоллиса) между группами 2,3,4.
Figure 3. The degree of reduction in the levels of intraoperative parathyroid hormone relative to the baseline
Note. * significant differences between Groups 1–4 (Kruskal-Wallis test); ** no significant differences between Groups 2,3, and 4 (Kruskal-Wallis test).
Через 3 месяца после хирургического лечения у всех пациентов наблюдались значимые изменения анализируемых показателей (тест Вилкоксона p < 0,001). Отсутствовали межгрупповые различия по уровню общего кальция, который составлял 2,41 (2,26; 2,5) ммоль/л, фосфора неорганического: 1,06 (0,99; 1,1) ммоль/л, остазы: 114,0 (91,5; 170,5) мкг/л. Снижение общего кальция до 2,0 ммоль/л в послеоперационном периоде наблюдалось у 7,1 % пациентов 2, 3 и 4-й групп (n = 21). Незначительно повышенные значения общего кальция от 2,56 до 2,59 ммоль/л выявлялись у 9,1 % пациентов (n = 36) вне зависимости от способа хирургического доступа.
Только в группе 1, пациенты которой были прооперированы с использованием нового подхода, предусматривающего применение конфокальной лазерной микроскопии, через 3 месяца после операции кальций ионизированный находился на уровне нормальных значений 1,21 (1,14; 1,25) ммоль/л (Н = 15,21; p = 0,002). В остальных группах в ряде случаев выявлялись повышенные послеоперационные значения ионизированного кальция более 1,35 ммоль/л (U = 2,7; p = 0,04). Также в группе 1 происходила полная нормализация уровня иПТГ до 35,6 (27,0; 49,0) пг/мл (Н = 72,0; p < 0,001). В группах 2, 3, 4 через 3 месяца после хирургического лечения гиперпаратиреоза у 30,3 % пациентов (n = 90) сохранялись повышенные значения иПТГ (U = 7,65; р < 0,001) (рис. 4).
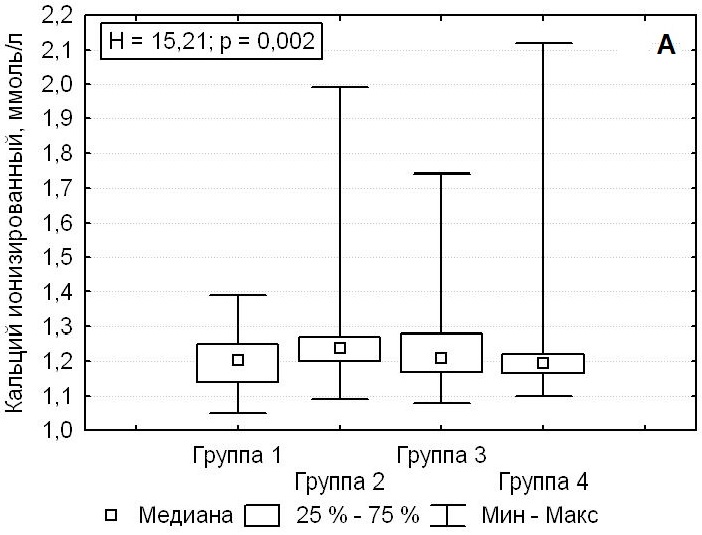
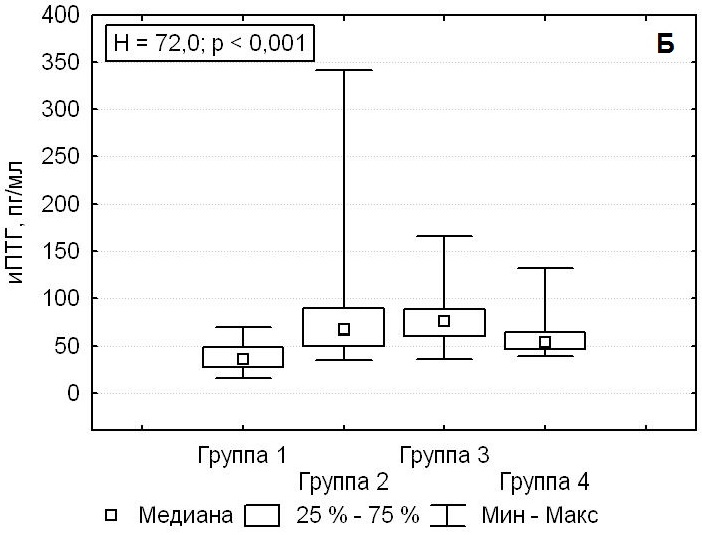
Рисунок 4. Послеоперационные значения кальция ионизированного кальция (А) и паратиреоидного гормона (Б) у пациентов с первичным гиперпаратиреозом.
Figure 4. Postoperative levels of ionized calcium (A) and parathyroid hormone (Б) in primary hyperparathyroidism patients.
В послеоперационном периоде в сравниваемых группах пациентов отсутствовали значимые различия показателей витамина D, который в среднем составлял 32,7 (25,8; 41,3) нг/мл (рис. 5).
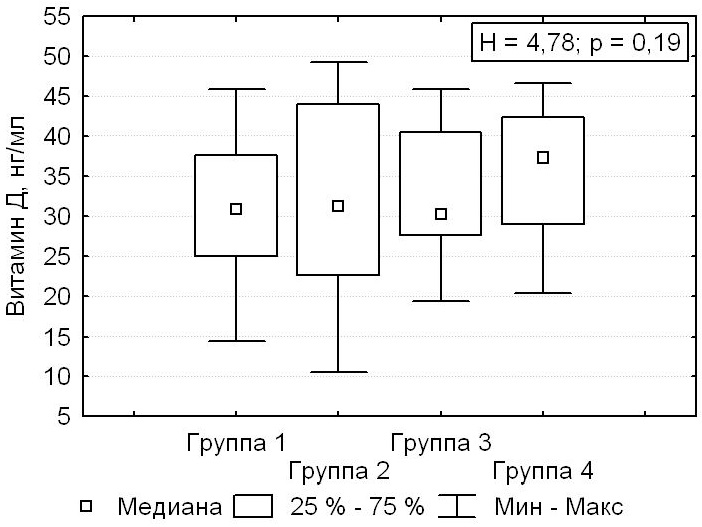
Рисунок 5. Послеоперационные значения витамина D.
Figure 5. Postoperative levels of vitamin D.
У 7,9 % пациентов (n = 31) витамин D находился на уровне дефицита (<20 нг/мл), у 31,2 % пациентов (n = 123) регистрировалась недостаточность витамина D (≥20 и <30 нг/мл). В большинстве случаев в послеоперационном периоде у пациентов (60,9 %, n = 240) устанавливали целевые уровни витамина D от 30 до 49,2 нг/мл.
ОБСУЖДЕНИЕ
Исследователи отмечают, что хирургическая тактика, объем и способ оперативного вмешательства зависят от первичной визуализации патологически измененных паращитовидных желез. В настоящее время отсутствует единый подход к объему и способу выполнения оперативного пособия, так как техника выполнения паратиреоидэктомии претерпевает изменения [1][11]. Показана эффективность минимально инвазивной паратиреоидэктомии, сопровождаемой ультразвуковым контролем паращитовидных желез [5][12]. Тем не менее ультразвуковой метод визуализации является информативным при одиночных поражениях паращитовидных желез, чувствительность этого метода контроля снижается при наличии множественных изменений, например при эктопированных и добавочных паращитовидных железах, вовлечении в процесс нескольких паращитовидных желез. В связи с этим в качестве метода визуализации при использовании минимально инвазивной техники паратиреоидэктомии нами использована конфокальная лазерная микроскопия, относящаяся к эндоскопическому методу исследования [13–15]. Ранее нами была определена эндомикроскопическая картина при патологии паращитовидных желез с разработкой компьютерной программы «Гиперпаратиреоз» для определения морфологической структуры патологических образований паращитовидных желез методом конфокальной лазерной микроскопии при выполнении хирургического вмешательства. Также была показана эффективность использования этого метода для интраоперационной дифференциальной диагностики патологически измененной и интактной паращитовидной железы, сопоставимая с гистологическим исследованием [16].
Настоящее исследование обосновывает новый подход к хирургическому лечению пациентов с первичным гиперпаратиреозом с использованием конфокальной лазерной микроскопии, обеспечивающей достижение целевых значений лабораторных показателей костного обмена (иПТГ, кальция общего и кальция ионизированного).
Критерием эффективности паратиреоидэктомии считается интраоперационное определение иПТГ, снижение которого до нормы или более чем на 50 % от дооперационного уровня указывает на радикальность выполненного хирургического вмешательства еще до получения результатов гистологического исследования [17][18]. Однако целесообразность интраоперационного исследования уровня иПТГ обсуждается, особенно если новообразование паращитовидной железы было точно подтверждено топическими методами [19][20]. Указанным критериям соответствовал 90,1 % (n = 355) всех случаев хирургического вмешательства у пациентов с гиперпаратиреозом, при этом эффективность центрального мини-доступа с двухсторонней ревизией паращитовидных желез и применением конфокальной лазерной микроскопии составила 100 %. При других вариантах мини-доступов (с односторонней ревизией и без ипсилатеральной ревизии паращитовидных желез), классического доступа Кохера, необходимо применение точной предоперационной топической диагностики с применением комплекса, включающего УЗИ шеи, сцинтиграфию с 99mТс-sestamibi, КТ-ангиографию, МРТ [9].
Новый подход к хирургическому лечению пациентов с первичным гиперпаратиреозом позволяет отказаться от обязательного интраоперационного исследования иПТГ, что приведет к существенному снижению длительности оперативного вмешательства, не уменьшая его радикальности. Как показывают наши наблюдения, TAT (turn-around time, время «оборота» лабораторного теста) иПТГ составляет не менее 40–45 минут, включая доставку пробы в лабораторию, пробоподготовку и постановку исследования иПТГ на анализаторе, валидацию и передачу результатов в медицинскую информационную систему учреждения или непосредственное информирование врача-хирурга.
Определение витамина D у пациентов с первичным гиперпаратиреозом проводили только в послеоперационном периоде, так как считается, что его низкий уровень не имеет существенного значения для течения первичного гиперпаратиреоза на дооперационном этапе. В свою очередь, недостаток/дефицит витамина D в послеоперационном периоде требует назначения препаратов витамина D и кальция по причине возможного сочетания с гипокальциемией. Таким образом, информация о послеоперационных значениях витамина D позволит изменить тактику ведения пациентов после паратиреоидэктомии [17]. В представленном исследовании через 3 месяца после операции во всех группах пациентов выявлена минимальная частота встречаемости дефицита (7,9 %) витамина D, недостаточность выявлялась у 31,2 % пациентов. При этом послеоперационное снижение содержания общего кальция регистрировалось у 7,1 % пациентов групп 2, 3 и 4. Только в группе 1 происходила полная нормализация ионизированного и общего кальция.
ЗАКЛЮЧЕНИЕ
Предложен новый подход к хирургическому лечению пациентов с первичным гиперпаратиреозом с использованием конфокальной лазерной микроскопии, позволяющий повысить эффективность лечения и достигнуть в 100 % случаев целевых значений иПТГ (в пределах референтного диапазона или снижение на 50 % и более от исходного уровня) и нормализации ионизированного кальция. Данный подход также обосновывает возможность отказа от обязательного интраоперационного исследования иПТГ, обеспечивая существенное снижение длительности оперативного вмешательства без уменьшения его радикальности.
Список литературы
1. Макаров И.В., Галкин Р.А., Прокофьева Н.А., Болтовская В.А., Романов Р.М., Хохлова Д.О. Опыт диагностики и хирургического лечения первичного гиперпаратиреоза. Эндокринная хирургия. 2017;11(2):81–9. DOI: 10.14341/serg2017281-89
2. Armstrong V.L., Hangge P.T., Butterfield R., Norain A., Wasif N., Stucky C.H., et al. Phenotypes of primary hyperparathyroidism: Does parathyroidectomy improve clinical outcomes for all? Surgery. 2023;173(1):173–9. doi: 10.1016/j.surg.2022.05.042
3. Majcen M., Hocevar M. Surgical options in treating patients with primary hyperparathyroidism. Radiol Oncol. 2020;54(1):22–32. doi: 10.2478/raon-2020-0010
4. Огородников А.В., Харнас С.С. Непосредственные и отдаленные результаты хирургического лечения первичного гиперпаратиреоза из стандартного и малого доступов. Клиническая и экспериментальная хирургия. Журнал имени академика Б.В. Петровского. 2021;9(4):88–95. DOI: 10.33029/2308-1198-2021-9-4-88-95
5. Пампутис С.Н., Лопатникова Е.Н., Пампутис Д.С. Выбор варианта паратиреоидэктомии при первичном гиперпаратиреозе. Таврический медико-биологический вестник. 2021;24(2):83–91. DOI: 10.37279/2070-8092-2021-24-2-83-91
6. Paspala A., Spartalis E., Nastos C., Tsourouflis G., Dimitroulis D., Pikoulis E., et al. Robotic-assisted parathyroidectomy and short-term outcomes: a systematic review of the literature. J Robot Surg. 2020;14(6):821–7. doi: 10.1007/s11701-020-01119-x
7. Pappachan J.M., Lahart I.M., Viswanath A.K., Borumandi F., Sodi R., Metzendorf M.I., et al. Parathyroidectomy for adults with primary hyperparathyroidism. Cochrane Database Syst Rev. 2023;3(3):CD013035. doi: 10.1002/14651858.CD013035.pub2
8. Teksoz S., Bukey Y., Ozcan M., Arikan A.E., Erbabacan S.E., Ozyegin A. Minimal invasive parathyroidectomy with local anesthesia for well-localized primary hyperparathyroidism: “Cerrahpasa experience”. Updates Surg. 2013;65(3):217–23. doi: 10.1007/s13304-013-0202-7
9. Величко А.В., Ярец Ю.И., Рожко А.В., Дундаров З.А. Алгоритм топической диагностики патологии паращитовидных желез с использованием конфокальной лазерной микроскопии. Медико-биологические проблемы жизнедеятельности. 2024;1:95–103. Doi: 10.58708/2074-2088.2024-1(31)-95-103
10. Пигарова Е.А., Рожинская Л.Я., Белая Ж.Е., Дзеранова Л.К., Каронова Т.Л., Ильин А.В. и др. Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина D у взрослых. Проблемы эндокринологии. 2016;62(4):60–84. DOI: 10.14341/probl201662460-84
11. Canu G.L., Cappellacci F., Noordzij J.P., Piras S., Erdas E., Calò P.G., et al. A mini-invasive approach is feasible in patients with primary hyperparathyroidism and discordant or negative localisation studies. Updates Surg. 2022;74(2):747–55. doi: 10.1007/s13304-021-01213-1
12. Liu C., Wu B., Huang P., Ding Qian, Xiao Lei, Zhang Mei, et al. US-guided percutaneous microwave ablation for primary hyperparathyroidism with parathyroid nodules: feasibility and safety study. J Vasc Interv Radiol. 2016;27(6):867–75. doi: 10.1016/j.jvir.2016.02.013
13. Prades J.M., Asanau A., Timoshenko A.P., Gavid M., Martin C., et al. Endoscopic parathyroidectomy in primary hyperparathyroidism. Eur Arch Otorhinolaryngol. 2011;268(6):893–7. doi: 10.1007/s00405-010-1414-9
14. Ignat M., Lindner V., Vix M., Marescaux J., Mutter D. Intraoperative probe-based confocal endomicroscopy to histologically differentiate thyroid from parathyroid tissue before resection. Surg Innov. 2019;26(2):141–8. doi: 10.1177/1553350618814078
15. Fuks D., Pierangelo A., Validire P., Lefevre M., Benali A., Trebuchet G. Intraoperative confocal laser endomicroscopy for real-time in vivo tissue characterization during surgical procedures. Surg Endosc. 2019;33(5):1544–52. doi: 10.1007/s00464-018-6442-3
16. Величко А.В., Жандаров М.Ю., Зыблев С.Л., Борсук А.Д. Конфокальная лазерная микроскопия в диагностике патологии паращитовидных желез. Медико-биологические проблемы жизнедеятельности. 2019;2:66–73.
17. Пампутис С.Н., Александров Ю.К., Лопатникова Е.Н. Значение витамина D в диагностике и лечении гиперпаратиреоза. Альманах клинической медицины. 2014;32:56–60. DOI: 10.18786/2072-0505-2014-32-56-60
18. Дедов И.И., Мельниченко Г.А., Мокрышева Н.Г., Рожинская Л.Я., Кузнецов Н.С., Пигарова Е.А. и др. Первичный гиперпаратиреоз: клиника, диагностика, дифференциальная диагностика, методы лечения. Проблемы эндокринологии. 2016;62(6):40–77. DOI: 10.14341/probl201662640-77
19. Joliat G.R., Demartines N., Portmann L., Boubaker A., Matter M. Successful minimally invasive surgery for primary hyperparathyroidism: influence of preoperative imaging and intraoperative parathyroid hormone levels. Langenbecks Arch Surg. 2015;400(8):937–44. doi: 10.1007/s00423-015-1358-z
20. Akgün I.E., Ünlü M.T., Aygun N., Kostek M., Uludag M. Contribution of intraoperative parathyroid hormone monitoring to the surgical success in minimal invasive parathyroidectomy. Front Surg. 2022;9:1024350. doi: 10.3389/fsurg.2022.1024350
Об авторах
А. В. ВеличкоБеларусь
Величко Александр Владимирович — к.м.н., доцент, хирургическое отделение трансплантации, эндокринной и реконструктивной хирургии
Гомель
Ю. И. Ярец
Беларусь
Ярец Юлия Игоревна — к.м.н., доцент, клинико-диагностическая лаборатория
Гомель
З. А. Дундаров
Беларусь
Дундаров Залимхан Анварбегович — д.м.н., профессор, кафедра хирургических болезней № 2
Гомель
Рецензия
Для цитирования:
Величко А.В., Ярец Ю.И., Дундаров З.А. Обоснование нового подхода к хирургическому лечению пациентов с первичным гиперпаратиреозом на основании анализа динамики лабораторных показателей костного метаболизма. Креативная хирургия и онкология. 2025;15(1):26-33. https://doi.org/10.24060/2076-3093-2025-15-1-26-33
For citation:
Velichko A.V., Yarets Yu.I., Dundarov Z.A. Rationale for a New Approach to the Surgical Treatment of Primary Hyperparathyroidism Patients Based on the Analyzed Dynamics of Laboratory Bone Turnover Markers. Creative surgery and oncology. 2025;15(1):26-33. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-1-26-33


































