Перейти к:
Профилактика билиарных осложнений после обширных резекций печени: опыт одного центра
https://doi.org/10.24060/2076-3093-2025-15-1-34-40
Аннотация
Введение. Билиарные осложнения являются серьезными и жизнеугрожающими нарушениями после обширных резекций печени. Профилактика данных состояний имеет важное значение для успешного лечения. Цель исследования: оценка результатов применения метода интраоперационного дренирования внепеченочных желчевыводящих путей как способа профилактики пострезекционных билиарных осложнений.
Материалы и методы. Проведен анализ результатов оперативного лечения пациентов хирургического отделения Клиники ФГБОУ ВО БГМУ с заболеваниями печени за период 2020–2024 гг. Представлены результаты лечения 61 пациента, которым были выполнены обширные резекции печени. В опытную группу вошел 31 (50,8 %) пациент, которым выполнялось интраоперационное дренирование желчных путей, а в контрольную группу — 30 (49,2 %) пациентов, которым не производилась установка дренажа. Сравнивались периоперационные критерии между двумя группами. Статистическую обработку данных производили с помощью программы Statistica 10.0, уровень статистической значимости — при p < 0,05.
Результаты. Наблюдаются статистически значимые отличия между группами по показателям времени оперативного вмешательства и продолжительности госпитализации. В опытной группе оперативные вмешательства продолжались дольше (p < 0,05), в то же время сроки госпитализации были меньше (p < 0,05). При этом по показателям интраоперационной кровопотери, объема гемотрансфузий и времени до восстановления нормальной функции кишечника отличий не обнаружено (p > 0,05). В опытной группе, по сравнению с контрольной, статистически значимо меньше уровень общего билирубина на 3-и сутки после проведения оперативного вмешательства (p < 0,05). В контрольной группе суммарно больше возникало пострезекционных билиарных осложнений в сравнении с опытной группой (7 (23,3 %) и 3 (9,7 %), соответственно, p < 0,05).
Обсуждение. Данные мировых литературных источников демонстрируют преимущества интраоперационной установки желчного дренажа. Разрабатываются шкалы, позволяющие прогнозировать билиарные осложнения.
Заключение. Представленный способ позволяет значительно снизить риски возникновения билиарных осложнений после обширных резекций печени.
Ключевые слова
Для цитирования:
Нартайлаков М.А., Нагаев Ф.Р., Минигалин Д.М., Бакеев М.Р., Сафаргалина А.Г. Профилактика билиарных осложнений после обширных резекций печени: опыт одного центра. Креативная хирургия и онкология. 2025;15(1):34-40. https://doi.org/10.24060/2076-3093-2025-15-1-34-40
For citation:
Nartailakov M.A., Nagaev F.R., Minigalin D.M., Bakeev M.R., Safargalina A.G. Prevention of biliary complications after extensive liver resections: Single-center experience. Creative surgery and oncology. 2025;15(1):34-40. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-1-34-40
ВВЕДЕНИЕ
История хирургических вмешательств на печени насчитывает не одно десятилетие. По мере развития оперативных техник и углубления знаний в анатомо-физиологических особенностях гепатобилиарной системы стало увеличиваться количество расширенных и больших резекций печени. Огромный вклад в понимание анатомии печени внес C. Couinaud, опубликовавший в 1954 году фундаментальный труд о сегментарном строении печени [1]. Классификация по Couinaud не потеряла своей актуальности по настоящее время и имеет огромное практическое значение. Представление о взаимоотношениях сегментов печени, печеночных вен и сосудисто-секреторных пучков позволило выполнять как анатомические, так и неанатомические резекции печени. Несмотря на достижения в области анестезиологии, реанимации и послеоперационной интенсивной терапии, а также внедрение современного высокотехнологичного оборудования, обширные резекции печени остаются травматичными и технически сложными вмешательствами, требующими большого опыта от всей операционной бригады [2][3].
На заре эпохи печеночной хирургии главными опасениями для хирургов-гепатологов были значительные риски массивной интраоперационной кровопотери и пострезекционной печеночной недостаточности. В настоящее время большое значение среди возникающих нарушений в нормальном течении послеоперационного периода также имеют пострезекционные билиарные осложнения (ПРБО), к которым относят наружные желчные свищи, ограниченные скопления желчи (биломы), внутреннее желчеистечение и желчный перитонит. Нарушения герметичности билиарной системы после больших операций на печени являются инвалидизирующими и жизнеугрожающими осложнениями. Имеются сведения, что за последние 20 лет частота возникновения ПРБО варьировала в пределах от 0,8 до 29,7 % [4]. Для своевременной диагностики и купирования данных состояний было предложено определять желчеистечение после резекций печени по наличию отделяемого по дренажам или скопления жидкости в брюшной полости с повышенной концентрацией билирубина (минимум в 3 раза в сравнении с сывороткой крови) по истечении 3 дней с момента выполнения операции [5].
Для стратификации пациентов и определения тактики лечения международная группа по хирургии печени (The International Study Group for Liver Surgery — ISGLS) разработала классификацию ПРБО, где разграничила течение данного осложнения на 3 категории. При типе А не требуется дополнительных диагностических, инвазивных и лечебных мероприятий, а желчеистечение разрешается самостоятельно. При типе В необходимы дополнительные диагностические мероприятия с малоинвазивными пункционно-дренирующими вмешательствами. При типе С требуется интенсивная терапия, коррекция имеющихся нарушений гомеостаза и экстренная релапаротомия [6]. Смертность от ПРБО за последние годы снизилась до 3 % [7]. Согласно последним данным к наиболее частым причинам возникновения ПРБО относят недостаточный билиостаз раневой поверхности печени, не диагностированные интраоперционные повреждения внутри- и внепеченочных желчных протоков, отсутствие герметичности билиодигестивных анастомозов (в случае их наложения при реконструктивных вмешательствах) [8]. Стоит отметить, что до конца не определена корреляция между типом (объемом) резекции печени и риском возникновения ПРБО [9]. Однако все больше исследователей заявляют об увеличении вероятности развития ПРБО при обширных резекциях печени [10][11].
В мировой практике рутинно применяются малоинвазивные методы лечения возникающих ПРБО, к которым относятся чрескожные пункции желчных затеков и установки дренажей, в том числе с использованием эндоскопических технологий. Ряду пациентов с декомпенсированными тяжелыми формами ПРБО требуется выполнение релапаротомии. На наш взгляд, наиболее целесообразно выполнять профилактику ПРБО, что может позволить свести к минимуму риски их возникновения. Одним из эффективных инструментов превентивного воздействия на возникновение ПРБО является интраоперационное наружно-внутреннее дренирование желчевыводящих путей. Декомпрессия желчевыводящей системы в послеоперационном периоде позволяет уменьшить желчеотделение через раневую поверхность печени и желчные протоки небольшого калибра [12]. Существуют различные варианты билиарного дренирования после обширных резекций печени. Наиболее простыми и технически доступными методиками являются дренирования через культю пузырного протока по Холстеду — Пиковскому и через холедохотомическое отверстие по Керу.
Цель исследования — оценка эффективности метода интраоперационного дренирования внепеченочных желчевыводящих путей как способа профилактики билиарных осложнений после обширных резекций печени.
МАТЕРИАЛЫ И МЕТОДЫ
В настоящей работе проведен ретроспективный анализ результатов оперативного лечения пациентов с заболеваниями печени в хирургическом отделении Клиники ФГБОУ ВО БГМУ за период 2020–2024 гг. Для исследования были отобраны пациенты (n = 61), которым выполнялись обширные резекции печени (гемигепатэктомия с атипичной резекций, расширенная гемигепатэктомия, комбинированная гемигепатэктомия). Все пациенты имели сохранный соматический статус (ECOG = 0–2, ASA = 1–3), средний возраст был равен 55,8 ± 10,4 года ± стандартное отклонение). Количество пациентов мужского пола составило 37 (60,7 %), женского пола — 24 (39,3 %).
Все пациенты были обследованы амбулаторно, при этом проводился стандартный перечень лабораторно-инструментальных исследований. В обязательном порядке делалась мультиспиральная компьютерная томография (МСКТ) органов брюшной полости с внутривенным контрастированием. Всем пациентам при планировании обширных резекций печени определялся объем остаточной паренхимы (Future Liver Remnant — FLR), при этом пороговым значением выступал показатель 30 %. В случае недостаточного показателя FLR проводилось двухэтапное оперативное вмешательство, при котором на первом этапе осуществлялась эндоваскулярная эмболизация сосудов (артерия и/или вена) пораженной доли. В последующем производились пересмотр КТ и повторная оценка FLR с планированием второго этапа (обширной резекции).
Пациенты были разделены на две группы: в опытную группу вошел 31 (50,8 %) пациент, которым выполнялось интраоперационное дренирование желчных путей, а в контрольную группу — 30 (49,2 %) пациентов, которым не производилась установка дренажа. Структура нозологий в обеих группах, по поводу которых были выполнены оперативные вмешательства, отражена в таблице 1.
Основное заболевание | Опытная группа (n = 31) | Контрольная группа (n = 30) |
Метастазы колоректального рака в печень | 23 (74,2 %) | 26 (86,67 %) |
Альвеококкоз | 5 (16,1 %) | 2 (6,67 %) |
Эхинококкоз | 3 (9,7 %) | 2 (6,67 %) |
Таблица 1. Структура нозологий
Table 1. Structure of nosologies
Для объективной оценки результатов оперативного лечения нами был проведен всесторонний анализ периоперационных критериев, влияющих на исход госпитализации. По интраоперационным показателям нами оценивались продолжительность времени оперативного вмешательства, количество интраоперационной кровопотери, объем гемотрансфузии. В послеоперационном периоде фиксировались возникающие ПРБО, методы их диагностики и лечения. Важным параметром также выступало количество проведенных койко-дней в период госпитализации, в том числе в отделении реанимации.
Техника оперативных вмешательств
Во всех случаях техники оперативного вмешательства были стандартизированы, а сами операции проводились одной бригадой с большим опытом выполнения обширных резекций печени. Все оперативные вмешательства осуществлялись в условиях комбинированного анестезиологического обеспечения. Универсальным доступом выступала J-образная лапаротомия (по Федорову). По стандартной методике проводились мобилизация связочного аппарата печени, элементов печеночно-двенадцатиперстной связки, при этом общая печеночная артерия, холедох и воротная вена брались на турникеты (рис. 1).
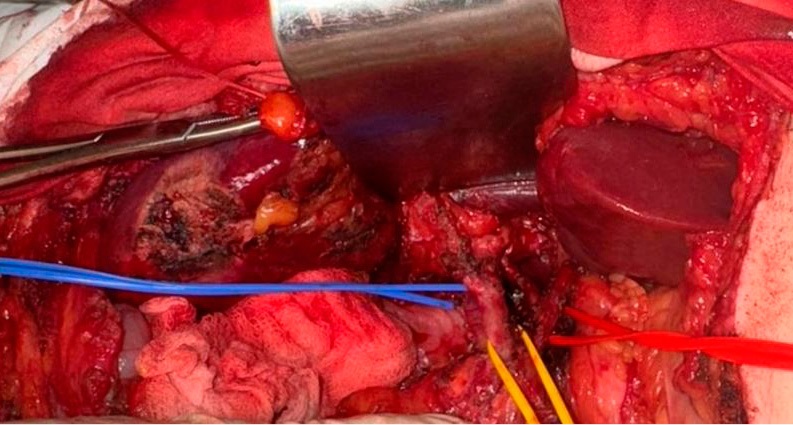
Рисунок 1. Элементы гепато-дуоденальной связки (голубой турникет — воротная вена, желтый турникет — общий желчный проток, красный турникет — собственная печеночная артерия)
Figure 1. Elements of the hepatoduodenal ligament (blue tourniquet — portal vein, yellow tourniquet — common bile duct, red tourniquet — proper hepatic artery)
Скелетизация трубчатых структур проводилась до ворот печени, где в обязательном порядке определялись долевые бифуркации сосудов и конфлюенс желчных протоков. Мобилизовались кавальные ворота печени, обнажались устья печеночных вен, прошивалась и перевязывалась печеночная вена удаляемой доли. Производились прошивание и перевязка элементов главной сосудисто-секреторной ножки доли печени, подлежащей удалению. Следующим этапом, после идентификации демаркационной линии, намечалась граница резекции (рис. 2).
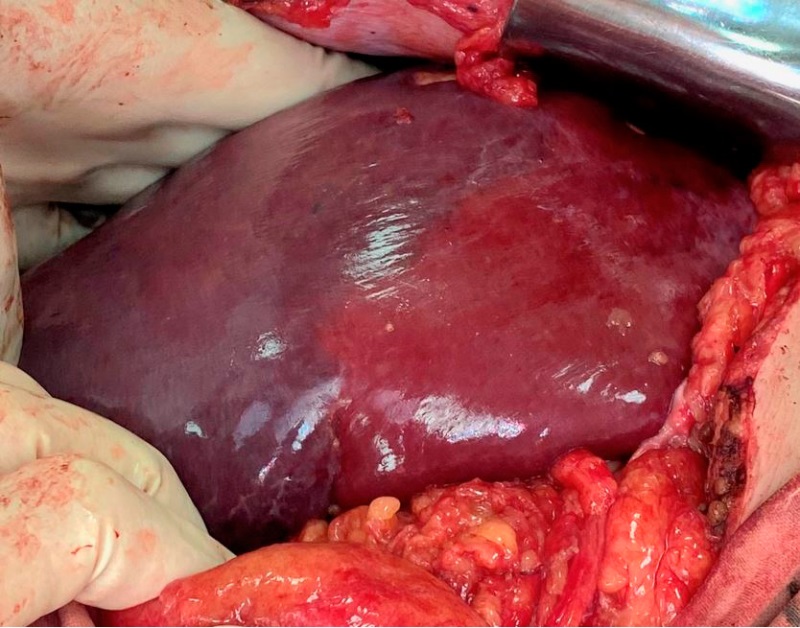
Рисунок 2. По диафрагмальной поверхности печени визуализируется демаркационная линия — граница резекции
Figure 2. A demarcation line is visualized along the diaphragmatic surface of the liver — the border of resection
С помощью биполярной коагуляции производилась резекция печени с тщательным гемо- и билиостазом. В ряде случаев выполнялись атипичные резекции остающейся доли печени, в том числе с проведением пластики нижней полой и/или печеночных вен. Окончательный объем оперативного вмешательства определялся интраоперационно в зависимости от распространенности патологического процесса в паренхиме печени. При выполнении холецистэктомии наружно-внутреннее дренирование внепеченочных желчевыводящих путей осуществляли через культю пузырного протока по методике Пиковского. При этом использовался трубчатый дренаж размером 9 Fr с перфорированным дистальным концом. В ситуациях, когда уже ранее была выполнена холецистэктомия, а культя пузырного протока не визуализировалась, дренирование осуществлялось через холедохотомическое отверстие по методике Кера. При этом использовался подготовленный Т-образный дренаж, размер которого подбирался в соответствии с просветом холедоха. Во всех случаях выполнялось дренирование брюшной полости, в обязательном порядке дренаж подводился к плоскости резекции печени.
Все расчеты производились с использованием пакета Microsoft Office 2021 и программного обеспечения Statistica 10.0 (StatSoft Inc., США). Параметрические количественные признаки были описаны в виде средних значений с указанием среднего квадратичного отклонения. Сравнительный анализ параметрических признаков проводили с помощью t-критерия Стьюдента, непараметрические количественные признаки оценивали с помощью U-критерия Манна — Уитни. При обработке статистических данных уровень значимости считался достоверным при p < 0,05.
РЕЗУЛЬТАТЫ
Пациенты обеих групп не имели статистически значимых различий по полу, возрасту и соматическому статусу. Также опытная и контрольная группы статистически не отличались по структуре нозологий, по поводу которых выполнялись оперативные вмешательства (p > 0,05). Двухэтапные резекции печени были выполнены у 11 (35,5 %) пациентов в опытной группе и у 10 (33,3 %) — в контрольной группе. При этом в опытной группе было выполнено 25 (80,6 %) правосторонних гемигепатэктомий с атипичной резекцией левой доли и 6 (19,4 %) комбинированных правосторонних гемигепатэктомий. В контрольной группе было выполнено 19 (63,3 %) правосторонних гемигепатэктомий с атипичной резекцией левой доли и 11 (36,7 %) расширенных левосторонних трисегментэктомий. Между двумя группами не было статистически значимых различий по показателям FLR по данным МСКТ перед выполнением оперативных вмешательств (p > 0,05). Периоперационные критерии опытной и контрольной групп представлены в таблице 2.
Опытная группа (n = 31) | Контрольная группа (n = 30) | |
Среднее время выполнения оперативного вмешательства, минуты ± стандартное отклонение | 311 ± 34 | 231 ± 37 |
Интраоперационная кровопотеря, мл ± стандартное отклонение | 805 ± 130 | 880 ± 170 |
Объем интраоперационной гемотрансфузии, мл ± стандартное отклонение | 450 ± 230 | 390 ± 250 |
Время до восстановления функции кишечника, дни ± стандартное отклонение | 2,5 ± 1,0 | 3,5 ± 1,5 |
Продолжительность госпитализации, дни ± стандартное отклонение | 11 ± 1,5 | 16 ± 3,5 |
Продолжительность пребывания в отделении реанимации, дни ± стандартное отклонение) | 1,5 ± 0,5 | 2,5 ± 1,0 |
Таблица 2. Периоперационные критерии
Table 2. Perioperative criteria
Наблюдаются статистически значимые отличия между опытной и контрольной группами по показателям времени оперативного вмешательства и продолжительности госпитализации. В опытной группе оперативные вмешательства продолжались дольше (p < 0,05), в то же время сроки госпитализации были короче (p < 0,05). При этом по показателям интраоперационной кровопотери, объема гемотрансфузий и времени до восстановления функции пищеварительного тракта статистически значимых отличий не обнаружено (p > 0,05).
Возникающие ПРБО были стратифицированы согласно классификации ISGLS. Отдельно нами учитывались показатели общего билирубина крови на 3, 7 и 10-е сутки после оперативного вмешательства. Полученные результаты отражены в таблице 3.
Опытная группа (n = 31) | Контрольная группа (n = 30) | |
Уровень общего билирубина, мкмоль/л ± стандартное отклонение | ||
3-е сутки | 39,0 ± 6,1 | 66,0 ± 15,8 |
7-е сутки | 26,0 ± 9,4 | 38,0 ± 10,4 |
10-е сутки | 19,0 ± 7,9 | 25,0 ± 12,1 |
Количество ПРБО по ISGLS | ||
Тип А | 2 (6,5 %) | 4 (13,3 %) |
Тип B | 1 (3,2 %) | 2 (6,7 %) |
Тип C | - | 1 (3,3 %) |
Таблица 3. Показатели пострезекционных билиарных осложнений
Table 3. Indicators of post-resection biliary complications
Как видно из таблицы, в опытной группе по сравнению с контрольной статистически значимо меньше уровень общего билирубина на 3-и сутки после проведения оперативного вмешательства (p < 0,05). В то же время на 7-е и 10-е сутки уровень билирубина в опытной и контрольной группах статистически значимо не отличался (p > 0,05).
Методики консервативного лечения пациентов в раннем послеоперационном периоде были стандартизированы и не отличались между двумя группами. Всем пациентам назначалась адекватная инфузионная, анальгетическая и антибактериальная терапии. При этом в контрольной группе суммарно больше возникало ПРБО в сравнении с опытной группой (7 (23,3 %) и 3 (9,7 %), соответственно, p < 0,05), среди которых 2 осложнения типа B и 1 осложнение типа С. При наличии осложнений типа B проводилась чрескожная пункция биломы (1 пациент из опытной группы) либо чрескожное чреспеченочное дренирование желчевыводящих путей (1 пациент из контрольной группы).
Важной опцией эффективного лечения ПРБО выступает использование эндоскопических технологий. В нашем исследовании 1 пациенту из контрольной группы с осложнением типа B успешно применили эндоскопическую ретроградную холангиографию со стентированием внепеченочных желчевыводящих путей. Пациенту с осложнением типа C была выполнена релапаротомия по жизненным показаниям с санацией и дренированием брюшной полости, ликвидацией источника желчного перитонита (вскрытие и дренирование нагноившейся биломы в области плоскости резекции печени). Повреждений и травм желчевыводящих путей не было ни у одного пациента.
Стоит отметить удобство контролирования функции желчевыделения с помощью наружно-внутреннего дренирования в опытной группе в раннем послеоперационном периоде, что позволяет прогнозировать и своевременно диагностировать нарушения пассажа желчи. В опытной группе наружно-внутренний дренаж удалялся по истечении 3–3,5 недели с момента выполнения оперативного вмешательства.
При этом не было зарегистрировано ни одного случая формирования наружного желчного свища либо нарушения пассажа желчи в пищеварительный тракт. При удалении дренажа, установленного по методу Пиковского, наблюдалось наиболее быстрое закрытие дренажного канала, так как культя пузырного протока функционировала в роли клапана, герметично закрывающего отверстие холедоха. Удаление желчного дренажа, установленного по методике Кера, сопровождалось незначительным наружным желчеистечением, которое прекращалось в течение нескольких дней без возникновения каких-либо осложнений.
ОБСУЖДЕНИЕ
Ежегодно увеличивается количество выполняемых обширных резекций печени. При этом профессиональное научное сообщество хирургов-гепатологов старается улучшить ранние и отдаленные результаты данных операций. Очень важно не допускать развития тяжелых послеоперационных осложнений, способных нивелировать лечебный эффект проведенного оперативного вмешательства. В настоящее время большое значение имеет диагностика и профилактика ПРБО. Разрабатываются прогностические критерии развития ПРБО, которые могут помочь в своевременном распознавании данных нарушений нормального послеоперационного течения [13–16]. В крупном метаанализа S. Xue и соавт. были изучены 24 предоперационных показателя, которые потенциально рассматривались в качестве факторов риска возникновения ПРБО. По результатам исследования к критериям с высоким уровнем достоверности можно отнести пол (у мужчин чаще возникают ПРБО, p = 0,004), наличие гепатоцеллюлярной карциномы или холангиокарциномы (p = 0,004 и p = 0,0001 соответственно), проведение неоадъювантной химиотерапии (p = 0,014), выполнение повторной резекции печени (p = 0,017). Также авторы демонстрируют статистически значимую корреляцию между большим объемом резекции печени и развитием ПРБО [4]. Учитывая данные факторы, можно стратифицировать пациентов по вероятности возникновения ПРБО, при этом пациентам из группы высокого риска рекомендовать интраоперационно устанавливать желчный дренаж.
В мировой литературе не так много публикаций, описывающих способы профилактики возникновения ПРБО. Как правило, демонстрируются новые методы лечения возникающих ПРБО. Однако в работе Т. Hotta и соавт. представлены результаты применения дренирования холедоха с помощью трубчатого дренажа. Авторы отметили лучшее течение послеоперационного периода у пациентов, которым интраоперационно был установлен дренаж через культю пузырного протока. В исследовании приведены данные, что ПРБО возникли у 3,6 % пациентов с интраоперационным дренированием холедоха и у 26,3 % пациентов — без дренирования [17]. Также интерес представляет исследование А. Nanashima и соавт., где демонстрируются результаты анализа 550 резекций печени за период с 1990 по 2011 г. Авторами было показано, что установка интраоперационного наружно-внутреннего билиарного дренажа (через культю пузырного протока) не коррелировала с возникновением ПРБО (p < 0,05). В то же время у пациентов с дренированием меньше возникали ПРБО типа B и C по ISGLS (p = 0,016) и был меньше срок госпитализации в случае развития ПРБО (p = 0,0323) [18].
ЗАКЛЮЧЕНИЕ
Профилактика ПРБО имеет особое значение для эффективного лечения пациентов после обширных резекций печени. В нашем исследовании представлены результаты успешного применения наружно-внутреннего билиарного дренирования в качестве метода профилактики ПРБО. Техническая простота и удобство в использовании дренажей по методам Холстеда — Пиковского и Кера позволяют применять указанный способ профилактики во всех случаях обширных резекций печени. Дальнейшая перспектива данного направления, на наш взгляд, будет заключаться в разработке и внедрении в клиническую практику интегрированных алгоритмов прогнозирования и профилактики возникновения ПРБО. Представленный персонифицированный подход позволит значительно снизить частоту возникновения ПРБО и связанную с ними смертность после обширных резекций печени. Определенную конкуренцию для снижения ПРБО после открытых вмешательства также составляют и лапароскопические методики выполнения подобных операций. Требуются дальнейшие исследования для установления наиболее рациональных и безопасных подходов снижения ПРБО при выполнении обширных резекций печени.
Список литературы
1. Калинин Д.С., Хоронько Ю.В., Сапронова Н.Г., Стагниев Д.В. Варианты венозного оттока от печени, пищевода и желудка при портальной гипертензии. Анналы хирургической гепатологии. 2023;28(2):88–94. DOI: 10.16931/1995-5464.2023-2-88-94
2. Krige A., Kelliher L.J.S. Anaesthesia for hepatic resection surgery. Anesthesiol Clin. 2022;40(1):91–105. DOI: 10.1016/j.anclin.2021.11.004
3. Koh Y.X., Zhao Y., Tan I.E., Tan H.L., Chua D.W., Loh W.L., et al. The impact of hospital volume on liver resection: A systematic review and Bayesian network meta-analysis. Surgery. 2024;175(2):393–403. DOI: 10.1016/j.surg.2023.10.034
4. Xue S., Wang H., Chen X., Zeng Y. Risk factors of postoperative bile leakage after liver resection: A systematic review and meta-analysis. Cancer Med. 2023;12(14):14922–36. DOI: 10.1002/cam4.6128
5. Ботиралиев А.Ш., Степанова Ю.А., Вишневский В.А., Чжао А.В. Пострезекционные билиарные осложнения. Вестник экспериментальной и клинической хирургии. 2021;14(3):228–36. DOI: 10.18499/2070-478X-2021-14-3-228-236
6. Harimoto N., Araki K., Yamanaka T., Hagiwara K., Ishii N., Tsukagoshi M., et al. Direct bilirubin in drainage fluid 3 days after hepatectomy is useful for detecting severe bile leakage. Eur Surg Res. 2022;63(1):33–9. DOI: 10.1159/000518267
7. Sliwinski S., Heil J., Franz J., El Youzouri H., Heise M., Bechstein W.O., et al. A critical appraisal of the ISGLS definition of biliary leakage after liver resection. Langenbecks Arch Surg. 2023;408(1):77. DOI: 10.1007/s00423-022-02746-8
8. Rennie O., Sharma M., Helwa N. Hepatobiliary anastomotic leakage: a narrative review of definitions, grading systems, and consequences of leaks. Transl Gastroenterol Hepatol. 2024;9:70. DOI: 10.21037/tgh-24-9
9. Shehta A., Elsabbagh A.M., Medhat M., Farouk A., Monier A., Said R., et al. Impact of tumor size on the outcomes of hepatic resection for hepatocellular carcinoma: a retrospective study. BMC Surg. 2024;24(1):7. DOI: 10.1186/s12893-023-02296-w
10. Patkar S., Kunte A., Sundaram S., Goel M. Post-hepatectomy biliary leaks: analysis of risk factors and development of a simplified predictive scoring system. Langenbecks Arch Surg. 2023;408(1):63. DOI:10.1007/s00423-023-02776-w
11. Zhang D., Qi F., Sun W., Zhao G., Wang D., Zhou S., et al. Influencing factors of biliary fistula after radical resection of hilar cholangiocarcinoma: a prospect cohort. Eur J Med Res. 2022;27(1):214. DOI: 10.1186/s40001-022-00851-4
12. Ozdemir F., Usta S., Ersan V., Sarıcı K.B., Abulut S., Çiftçi F., et al. Transcystic biliary drainage after living donor hepatectomy prevents biliary complications. Int J Surg. 2022;100:106464. DOI: 10.1016/j.ijsu.2022.106464
13. Mo S., He Y., Zhu G., Su H., Han C., Ye X., et al. A novel Peng’s test in reducing bile leakage after partial hepatectomy for hepatocellular carcinoma: From an animal study to a clinical cohort Propensity score matching comparative study. Int J Surg. 2022;104:106748. DOI: 10.1016/j.ijsu.2022.106748
14. Riediger C., Hoffmann R., Löck S., Giehl-Brown E., Dennler S., Kahlert C., et al. Novel personalized score predicts risk for postoperative biliary leak in liver surgery-a retrospective database analysis. J Gastrointest Surg. 2022;26(10):2101–10. DOI: 10.1007/s11605-022-05366-1
15. Ueno M., Hayami S., Miyamoto A., Okada K.I., Kitahata Y., Shimizu A., et al. Relationship between postoperative biliary complications and biliary anatomical aspects in performing right anterior- or central bisectionectomy: Single-center retrospective observational study. Ann Gastroenterol Surg. 2024;8(6):1076–83. DOI: 10.1002/ags3.12805.
16. Calamia S., Barbara M., Cipolla C., Grassi N., Pantuso G., Li Petri S., et al. Risk factors for bile leakage after liver resection for neoplastic disease. Updates Surg. 2022;74(5):1581–7. DOI: 10.1007/s13304-022-01326-1
17. Hotta T., Kobayashi Y., Taniguchi K., Johata K., Sahara M., Naka T., et al. Postoperative evaluation of C-tube drainage after hepatectomy. Hepatogastroenterology. 2003;50(50):485–90. PMID: 12749253
18. Nanashima A., Abo T., Shibuya A., Tominaga T., Matsumoto A., Tou K., et al. Does the placement of a cystic duct tube after a hepatic resection help reduce the incidence of post-operative bile leak? HPB (Oxford). 2013;15(7):517–22. DOI: 10.1111/j.1477-2574.2012.00611.x
Об авторах
М. А. НартайлаковРоссия
Нартайлаков Мажит Ахметович — д.м.н., профессор, кафедра общей хирургии, трансплантологии и лучевой диагностики
Республика Башкортостан, Уфа
Ф. Р. Нагаев
Россия
Нагаев Фарит Робертович — хирургическое отделение, кафедра общей хирургии, трансплантологии и лучевой диагностики
Республика Башкортостан, Уфа
Д. М. Минигалин
Россия
Минигалин Даниил Масхутович — к.м.н., кафедра хирургических болезней лечебного факультета, хирургическое отделение
Республика Башкортостан, Уфа
М. Р. Бакеев
Россия
Бакеев Марат Радикович — ординатор, кафедра хирургических болезней лечебного факультета
Республика Башкортостан, Уфа
А. Г. Сафаргалина
Россия
Сафаргалина Айгуль Гирфановна — кафедра хирургических болезней лечебного факультета, хирургическое отделение
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Нартайлаков М.А., Нагаев Ф.Р., Минигалин Д.М., Бакеев М.Р., Сафаргалина А.Г. Профилактика билиарных осложнений после обширных резекций печени: опыт одного центра. Креативная хирургия и онкология. 2025;15(1):34-40. https://doi.org/10.24060/2076-3093-2025-15-1-34-40
For citation:
Nartailakov M.A., Nagaev F.R., Minigalin D.M., Bakeev M.R., Safargalina A.G. Prevention of biliary complications after extensive liver resections: Single-center experience. Creative surgery and oncology. 2025;15(1):34-40. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-1-34-40


































