Перейти к:
Видеоэндоскопическая пахово-бедренная лимфаденэктомия при раке вульвы. Обзор литературы
https://doi.org/10.24060/2076-3093-2025-15-1-41-49
Аннотация
Рак вульвы является одним из редких злокачественных новообразований в онкогинекологии. Рак вульвы занимает девятнадцатое место среди наиболее распространенных видов злокачественных новообразований у европейских женщин. Основным методом лечения локализованного рака вульвы является хирургический. Начиная со стадии по критерию Т Ib и латеральном расположении опухоли пациенткам показано хирургическое лечение в объеме вульвэктомии, пахово-бедренной лимфаденэктомии. Классическая операция по методу Дюкена (J. Ducuing) разработана в 1934 году и сопровождается в большинстве случаев осложнениями в послеоперационном периоде, такими как лимфорея, длительное заживление послеоперационных ран, гнойно-септические осложнения. Одним из способов сократить количество осложнений является использование видеоэндоскопических технологий. В приведенном обзоре исследований, посвященных данной теме, продемонстрированы результаты использования видеоэндоскопической техники. Показано значительное снижение количества осложнений в послеоперационном периоде. Также следует отметить, что время операции сокращается с наработкой опыта выполнения подобных вмешательств. Необходимо проведение рандомизированных исследований для оценки отдаленных результатов при использовании видеоэндоскопических технологий при выполнении пахово-бедренной лимфаденэктомии.
Ключевые слова
Для цитирования:
Меньшиков К.В., Киямов Б.Ф., Гирфанов Т.К. Видеоэндоскопическая пахово-бедренная лимфаденэктомия при раке вульвы. Обзор литературы. Креативная хирургия и онкология. 2025;15(1):41-49. https://doi.org/10.24060/2076-3093-2025-15-1-41-49
For citation:
Menshikov K.V., Kiyamov B.F., Girfanov Т.К. Videoendoscopic Inguinofemoral Lymphadenectomy for Vulvar Cancer. Literature Review. Creative surgery and oncology. 2025;15(1):41-49. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-1-41-49
ВВЕДЕНИЕ
Рак вульвы (РВ) является одним из редких злокачественных новообразований в онкогинекологии. РВ занимает девятнадцатое место среди наиболее распространенных видов злокачественных новообразований у европейских женщин. В 2020 году было выявлено 16 506 новых случаев [1]. Инвазивный плоскоклеточный рак вульвы составляет до 90 % всех злокачественных опухолей вульвы и 1–2 % злокачественных эпителиальных опухолей у женщин. В Российской Федерации в 2018 году выявлено всего 2068 пациенток со злокачественными новообразованиями вульвы, пик заболеваемости приходится на 75–79 лет. Удельный вес составил 0,61 % [2]. Так как большинство больных РВ находится в группе пожилого населения, следует предположить, что заболеваемость будет расти с учетом роста продолжительности жизни.
Основным методом лечения локализованного РВ является, безусловно, хирургический. Начиная со стадии по критерию Т Ib и латеральном расположении опухоли пациенткам показано хирургическое лечение в объеме вульвэктомии, пахово-бедренной лимфаденэктомии (ПБЛАЭ). При центральном расположении РВ (переднем или заднем, в пределах 2 см от средней линии) рекомендуется выполнение радикальной вульвэктомии с двусторонней ПБЛАЭ [3].
Классическая ПБЛАЭ по методу Дюкена (J. Ducuing) разработана в 1934 году [4][5]. Операция Дюкена состоит в удалении лимфатического аппарата пахово-бедренной области вместе с клетчаткой, фасцией и частью большой подкожной вены бедра [5]. Операция выполняется через широкий кожный разрез, который проводится от уровня передневерхней ости подвздошной кости до вершины бедренного треугольника по ходу бедренного сосудистого пучка. Ткани пахово-бедренной области, включая широкую фасцию бедра, а также большую подкожную вену, лигированную у места впадения в бедренную, удаляются одним блоком [6]. Одним из основных недостатков данного метода является высокая частота послеоперационных осложнений, таких как длительная лимфорея, несостоятельность кожных швов, некроз краев раны и кожных лоскутов, инфицирование раны, формирование сером. Все эти осложнения ухудшают качество жизни пациентам, не позволяют начать адъювантную лучевую терапию в рекомендуемые сроки.
Одним из способов избежать послеоперационных осложнений является проведение ПБЛАЭ видеоэндоскопическим методом (VEIL). Использование видеоэндоскопических технологий позволяет существенно сократить пребывание пациента в стационаре и уменьшить количество послеоперационных осложнений.
Проведен обзор литературы по видеоэндоскопическим методикам ПБЛАЭ по базе РИНЦ, PubMed, Wiley Online Library.
Видеоскопическая техника ПБЛАЭ
Впервые видеоскопическая техника ПБЛАЭ была использована в 2003 году J. T. Bishoff у пациентов со злокачественными новообразованиями мочеполовой системы [7]. В 2007 году R. Sotelo и соавт. опубликовали результаты 14 видеоскопических ПБЛАЭ у пациентов с раком полового члена, которые продемонстрировали отсутствие типичных осложнений, отмечаемых при классической операции Дюкена [8].
Методика выполнения VEIL чаще предлагается следующая. После индукции общей анестезии пациенты размещаются в положении лежа на спине, нижние конечности поворачиваются кнаружи и разводятся в стороны. Проводится разметка операционного поля, включая бедренный треугольник. Границы лимфодиссекции аналогичны открытой операции. Хирург располагается на медиальной, а ассистент на латеральной стороне оперируемой конечности (рис. 1).
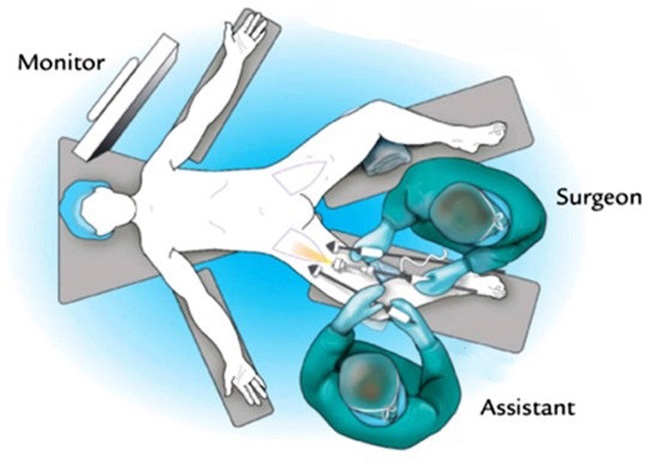
Рисунок 1. Положение пациента и хирургов при выполнении VEIL [9]
Figure 1. Position of the patient and surgeons during VEIL [9]
Процедура начинается с выполнения 12-миллиметрового разреза, поверхностного по отношению к скарповской фасции, примерно на 3 см дистальнее вершины бедренного треугольника. Разрабатывается переднее рабочее пространство, которое представляет собой область между кожными лоскутами и фиброзно-жировым пакетом, содержащим лимфатические узлы. Затем два троакара вводятся примерно на ширину ладони от порта для камеры с каждой стороны. Кожные лоскуты создаются путем рассечения между фасцией Кемпера и скарповской фасции. Необходимо соблюдать осторожность, чтобы не повредить фасцию Кампера, так как это может привести к повреждению сосудов, питающих кожные лоскуты, что приведет к послеоперационному некрозу кожного лоскута. Затем разрабатывается переднее рабочее пространство, которое больше границ рассечения. Следующим этапом начинается рассечение фиброзно-жирового пакета с лимфатическими узлами. Лимфатические сосуды обрабатываются с помощью аппаратов LigaSure или Harmonic, чтобы минимизировать послеоперационную лимфорею. Подкожная вена в вершине бедренного треугольника обрабатывается хирургическими клипсами или сосудистым сшивающим аппаратом.
В качестве альтернативы подкожную вену можно сохранить, если нет врастания метастатических лимфатических узлов. При диссекции в каудальном направлении визуализируются бедренные сосуды, последние скелетезируются. Диссекция проводится до уровня бедренного канала, пока не будет визуализирована гребенчатая мышца, чтобы обеспечить полное удаление лимфатических узлов, включая глубокие паховые узлы, расположенные на гребенчатой мышце. Последним этапом блок жировой клетчатки с лимфатическими узлами отсекается от паховой связки и удаляется. Полость дренируется [9].
Таким образом, методика выполнения VEIL сходна как при РВ, так и при раке полового члена. Ниже рассмотрим несколько литературных обзоров, посвященных данной теме.
В обзоре литературы, опубликованном в 2021 году, проведена оценка 11 исследований, посвященных данной проблеме. Девять исследований включали только одну группу пациентов с проведенной операцией методом VEIL, а в исследованиях Naldini и Zhang сравнили методику VEIL и классическую ПБЛАЭ [10][11]. Изучались также два метода проведения видеоэндоскопической ПБЛАЭ: с установкой портов на бедре (VEIL–L) и с установкой портов в подвздошной области (VEIL-H). В двух исследованиях напрямую сравнивали два метода VEIL [12][13]. Также методика VEIL–L использовалась в семи группах пациентов (114 пациентов, 178 сторон), а VEIL-H использовалась в шести группах (98 пациентов, 151 сторона). Средний возраст пациентов составлял от 47,2 до 70,5 года. Всего у 185 пациентов был плоскоклеточный рак, что составляло 87,3 % от общего числа. Во всех 11 сериях операций, рассмотренных в анализе, сохранялась подкожная вена. Mathevet et al. сообщили, что двум пациентам была проведена классическая ПБЛАЭ вместо VEIL из-за травмы бедренной вены во время операции [14]. Большая подкожная вена у одного пациента в группе VEIL-H была повреждена во время операции, а в остальных случаях осложнений не отмечено [13]. Среднее время операции в группе VEIL–L составило 85 (диапазон 33,00–180,12) мин, а в группе VEIL-H — 112 (диапазон 35,00–170,79) мин.
В трех статьях описан объем кровопотери как небольшой, или <5 мл [14–16]. Средняя кровопотеря в группе VEIL–L составила 9 (диапазон 5–30) мл, а в группе VEIL-H — 96 (диапазон 5,5–214,8) мл. Среднее количество удаленных лимфатических узлов в группе VEIL–L составило 9 (диапазон 7,5–13,2), а в группе VEIL-H — 14 (диапазон 9,5–16,0).
В восьми исследованиях интраоперационные или послеоперационные данные морфологии продемонстрировали, что метастазы в лимфатических узлах и инфильтрация лимфатических узлов составила 21,1 % (24 случая) в группе VEIL–L и 24,5 % (24 случая) в группе VEIL-H [17].
Операция методом VEIL выполняется в подкожном пространстве без открытых ран в паховой области. Данный метод эффективно снижает частоту некроза кожи и замедленного заживления ран в паховой области, как при открытой операции, значительно улучшает качество жизни пациентов и позволяет достичь сопоставимых результатов [10][11][18][19]. Ранее проведенные исследования также продемонстрировали, что метод VEIL применим не только для пациенток с ранним РВ, но также для пациенток с реализованными метастазами в лимфатические узлы [13][16][20–24]. В настоящее время операция VEIL выполняется двумя способами: VEIL–L и VEIL-H. Выбор операции зависит от расположения опухоли у пациентки, состояния кожных покровов, а также опыта хирурга.
Большинство из 11 исследований, включенных в этот обзор, показали, что время операции в группе VEIL-H было немного выше, чем в группе VEIL–L, а кровопотеря у последней была значительно ниже, чем у первой. Ни ранее опубликованные результаты исследований, ни результаты данного обзора не обнаружили никаких существенных различий в количестве осложнений, таких как некроз кожи, инфицирование раны, лимфорея, развитие лимедемы. Однако обзор более ранних исследований показал, что частота осложнений в виде послеоперационных лимфатических кист была выше в группе VEIL–L, чем в группе VEIL-H (P = 0,037).
Важными показателями для оценки плюсов и минусов хирургического метода являются частота послеоперационных рецидивов и оценка 5-летней выживаемости пациенток. Ранее опубликованные данные показали, что при операциях методом VEIL эффективность сопоставима с традиционной открытой хирургией [16][25]. При обзоре предыдущих исследований у 5 пациенток (4,4 %) в группе VEIL–L был отмечен местный рецидив, и также рецидив развился у 5 пациенток (5,1 %) в группе VEIL-H. Butler et al. предположили, что локальный рецидив после хирургического лечения РВ обусловлен удалением менее восьми лимфатических узлов, тогда как Sopracordevole et al. предложили удалять не менее шести лимфоузлов [26,][27]. Baiocchi et al. показали, что прогноз плохой, когда у пациентов с реализованными метастазами в паховые лимфатические узлы было удалено менее 12 лимфатических узлов с двух сторон [28].
Также следует отметить обзор исследований для VEIL при РВ, опубликованный в 2017 году. В обзор было включено в общей сложности 9 исследований с 249 операциями VEIL у 138 пациентов. Было одно ретроспективное исследование «случай-контроль», а остальные были ретроспективными неконтролируемыми исследованиями. Они включали 3 статьи, опубликованные на английском языке, и 6 статей, опубликованных на китайском языке [29–37]. Во всех публикациях было продемонстрировано, что операция VEIL проводилась не только для пациенток с РВ на ранней стадии, но и для пациенток с клинически определяемыми метастазами в лимфатические узлы. По данным послеоперационной морфологии было 27 пациенток с III стадией РВ. Кроме того, у одной пациентки был диагностирован местный рецидив, и ей проведена VEIL с радикальной вульвэктомией; эта пациентка ранее перенесла иссечение РВ IA стадии по FIGO. Всего 6 исследований [29–31][36–38] включали только двустороннюю VEIL, тогда как другие [27][28][32] включали как одностороннюю, так и двустороннюю VEIL [25–33]. Характеристики проанализированных исследований приведены в таблице 1.
Авторы | Дата публикации | Количество пациентов/VEIL | Уровень доказательности | Средний возраст | Стадия по FIGO I/II/III | Морфологический вариант (плоскоклеточный рак/аденокарцинома/другое) | Сопутствующая патология (сахарный диабет/артериальная гипертензия) |
Wu et al. [25] | 2013 | 10/11 | 4 | 47,2 (30,0–68,0) | 6/0/3 | 7/1/2 | - |
Mathevet et al. [26] | 2002 | 28/41 | 4 | - | 12/12/4 | - | - |
Cui et al. [27] | 2013 | 15/30 | 4 | 51,9 (28,0–66,0) | 6/7/2 | 15/0/0 | 1/2 |
Xu et al. [28] | 2011 | 17/34 | 4 | 52,6 (33,0–69,0) | 8/4/5 | 15/1/1 | 1/1 |
Lu et al. [29] | 2012 | 10/20 | 4 | 50,7 (31,0–73,0) | 5/3/2 | 8/0/2 | 1/0 |
Liu et al. [30] | 2013 | 8/13 | 4 | 50,2 (39,0–63,0) | 5/1/2 | 7/0/1 | 2/2 |
Xia et al. [31] | 2014 | 13/26 | 4 | 48,6 (30,0–71,0) | 6/4/3 | 10/0/3 | - |
Li et al. [32] | 2014 | 29/58 | 4 | 54,2 (37,0–67,0) | 14/10/5 | 22/3/4 | - |
Tang et al. [33] | 2012 | 8/16 | 4 | 58,0 (48,0–65,0) | 7/1 | 8/0/0 | - |
Таблица 1. Характеристики исследований [34]
Table 1. Characteristics of the studies [34]
В таблице 2 продемонстрированы различные параметры оперативных вмешательств. Большая подкожная вена с ее притоками была сохранена во всех исследованиях. Диапазон времени операции составил от 62 до 110 минут (n = 8 исследований). Диапазон предполагаемой кровопотери составил от 5,5 до 22 мл (n = 7 исследований). Из 249 случаев VEIL, включенных в данный обзор, только в одном случае (0,4 %) потребовалась конверсия из-за повреждения бедренной вены. Другие операции VEIL были выполнены без интраоперационных осложнений. Среднее количество числа удаленных лимфатических узлов составило от 7,3 до 16 (n = 9 исследований). Wu et al. сообщили, что в выполненных ими операциях количество лимфатических узлов (12–18), удаленных с помощью VEIL, было сопоставимо с количеством, удаленным с помощью открытой хирургии [31]. Из 9 исследований в двух с 52 операциями VEIL использовали доступ VEIL–L, а в 7 исследованиях, включая 197 операций, подкожный гипогастральный доступ VEIL-H [25–37].
Авторы | Время операции | Кровопотеря | Конверсия % | Количество удаленных лимфоузлов | Сохранение большой подкожной вены | Хирургический подход | Удаление подвздошных лимфоузлов | Комментарий |
Wu et al. [25] | - | Маленький объем | 0 | 8,5 | Да | VEIL–L | - | Липолиз и липосакция |
Mathevet et al. [26] | 62 (43–120) | Маленький объем | 2,4 | 7,5 (2–15) | Да | VEIL–L | 7,1 | - |
Cui et al. [27] | 80,8 | 5,5 | 0 | 9,5 | Да | VEIL-H | 13,3 | - |
Xu et al. [28] | 94 (70–150) | 137 (80–170) | 0 | 16 (11–23) | Да | VEIL-H | 29,4 | липосакция |
Lu et al. [29] | 91 (80–130) | 6,3 (5–10) | 0 | 7,4 | Да | VEIL-H | 20 | - |
Liu et al, [30] | 83 (45–120) | 22 (10–40) | 0 | 10 (6–16) | Да | VEIL-H | 25 | - |
Xia et al. [31] | 92,3 | 6,2 | 0 | 7,3 | Да | VEIL-H | - | - |
Li et al. [32] | 102 | 64,9 | 0 | 11,2 | Да | VEIL-H | - | - |
Tang et al. [33] | 110 (65–130) | 70 (40–100) | 0 | 12,8 (9–15) | Да | VEIL-H | 12,5 | - |
Таблица 2. Параметры выполненных операций VEIL [34]
Table 2. Parameters of the performed VEIL procedures [34]
При интраоперационном выявленном метастатическом поражении паховых лимфатических узлов в 6 исследованиях у 14 пациенток выполнена тазовая лимфаденэктомия [26–30][33]. Mathevet et al. использовали метод VEIL–L для паховой и наружной подвздошной диссекции в двух случаях, которые были верифицированы как метастазы на срочном морфологическом исследовании [26]. В других пяти исследованиях использовали метод VEIL-H и выполнили тазовую лимфаденэктомию, которая состояла в перемещении троакаров в брюшную полость из тех же разрезов без создания другого разреза [27–30][33]. Wu et al. [25] использовали методики липолиза и липосакции для получения адекватного операционного поля и достижения косметического эффекта. Также Cui et al. [30] использовали эту технику в своих 10 выполненных операциях; однако эти авторы впоследствии отказались от первоначальной техники липолиза и липосакции.
В таблице 3 продемонстрированы непосредственные результаты хирургического лечения с использованием методики VEIL. Средняя продолжительность пребывания в стационаре варьировала от 7 до 13,6 дней. Li et al. сравнили сроки госпитализации 27 пациенток, перенесших открытую ПБЛАЭ, с 29 пациентками, перенесшими VEIL, и сообщили, что средняя продолжительность госпитализации была значительно меньше в случаях VEIL, чем в случаях открытой операции (11,6 против 17,5 дня, P = 0,010). Этот вывод также согласуется с данными Mathevet et al., которые включали 28 пациенток, перенесших 6 открытых ПБЛАЭ и 41 операцию по методу VEIL [39]. Это исследование показало, что средняя продолжительность пребывания в стационаре после VEIL составила всего 3,5 дня, тогда как после открытых операций этот показатель был 11 дней.
Авторы | Время госпитализации | Время до удаления дренажа | Метастазы в лимфоузлы % | Осложнения со стороны кожи, % Инфекционные осложнения со стороны раны/некротические явления в паховой области/некротические изменения со стороны вульвы | Лимфатические осложнения, % Лимфорея/Лимфокисты/Лимфедема |
Wu et al. [25] | - | 9,8 (4–13) | 30 | 0/0/- | 0/0/0 |
Mathevet et al. [26] | 11 (2–20) | - | 14,3 | 0/0/0 | 0/17,1/0 |
Cui et al. [27] | 10,7 | - | 13,3 | 0/0/6,7 | 3,3/6,7/0 |
Xu et al. [28] | 11 (8–19) | 6 (5–8) | 29,4 | 0/0/11,8 | 0/0/2,9 |
Lu et al. [29] | - | 6,8 (5–10) | 20 | 10/0/10 | 0/0/0 |
Liu et al. [30] | 7 (5–12) | - | 25 | 0/0/0 | 7,7/0/0 |
Xia et al. [31] | - | 6,7 | - | 0/0/- | -/-/- |
Li et al. [32] | 11,6 | 6,7 | 17,2 | 3,4/0/0 | 0/0/0 |
Tang et al. [33] | 13,6 | - | 12,5 | 0/0/0 | 0/0/0 |
Таблица 3. Характеристики послеоперационного периода [34]
Table 3. Characteristics of the postoperative period [34]
Послеоперационная морфология показала, что 27 (19,7 %) пациенток имели метастатическое поражение лимфатических узлов. Послеоперационные осложнения после VEIL наблюдались у 14 (10,1 %) пациенток, включая образование крупных лимфоцист у 9 (3,6 %), лимфорею у 2 (0,8 %), инфекционное осложнение со стороны раны в виде расхождения швов у 3 (1,2 %) и лимфедему у 1 (0,4 %). По данным Li et al. частота послеоперационных осложнений была значительно ниже в группе VEIL, чем в группе открытой ПБЛАЭ (P < 0,05) [40]. Кроме того, у 4 (2,9 %) пациенток развился некроз раны вульвы.
Только в 4 исследованиях проводилось последующее наблюдение за 70 пациентками после VEIL в течение относительно короткого периода (3–41 месяц) [26–29]. Согласно этим исследованиям в 3 (4,3 %) случаях развился местный рецидив. Тем не менее не было отмечено отдаленного метастазирования и смертей среди оперированных пациенток.
В приведенном выше обзоре рассмотрены различные параметры как операции, так и послеоперационного течения. Количество удаленных лимфатических узлов являлось приемлемым. В частности, среди интраоперационных осложнений только 1 случай травмы бедренной вены (0,4 %) послужил поводом для конверсии. Частота послеоперационных осложнений, связанных с VEIL (10,1 % пациентов и 6,0 % случаев VEIL), была ниже по сравнению с ранее опубликованными данными (34,1–66,0 %) при открытой ПБЛАЭ [35–38]. Осложнения в послеоперационном периоде наблюдаются у пациенток с РВ при открытой ПБЛАЭ: некрозы у 6,5–18,8 % пациенток, инфекционные осложнения у 5,6–39 %, лимфатические кисты у 1,9–40 % и лимфедема у 28–48,8 % [35–38]. Частота послеоперационных осложнений, безусловно, связана с характером оперативного вмешательства и такими факторами, как натяжение тканей, нарушение кровообращения. Было отмечено очевидное снижение частоты послеоперационных осложнений у пациенток с РВ при выполнении VEIL: некрозов не отмечено, инфекционные осложнения со стороны раны у 0–10 % и лимфатические кисты у 0–17,1 % [39–46].
В Российской Федерации на базе ГБУЗ «Санкт-Петербургский клинический научно-практический центр (онкологический)» с 2013 по 2016 г. проведено исследование видеоэндоскопической паховой лимфаденэктомии в сравнении с открытой ПБЛАЭ при меланоме [47]. Конечной точкой исследования являлось сравнение частоты хирургических осложнений в группе видеоэндоскопической ПБЛАЭ и открытой. В исследование были включены 72 пациента, у 48 (66,7 %) пациентов использована эндоскопическая техника. Средняя длительность видеоэндоскопической ПБЛАЭ составила 90 минут (от 60 до 160 минут). Серьезные осложнения были выявлены у 4/48 (8 %) пациентов в группе видеоэндоскопической ПБЛАЭ (1 случай некроза кожного лоскута, 3 случая длительной лимфореи) и у 16/24 (66 %) в группе открытой ПБЛАЭ (4 случая некроза кожного лоскута, 11 случаев длительной лимфореи, 2 случая диастаза послеоперационной раны) [47].
ЗАКЛЮЧЕНИЕ
Видеоскопическая пахово-бедренная лимфаденэктомия позволяет радикально удалить пахово-бедренные лимфатические узлы без потери принципа радикализма. Результаты проведенных исследований демонстрируют снижение количества послеоперационных осложнений, уменьшение сроков нахождения пациентов в стационаре. Также следует отметить, что время операции сокращается с наработкой опыта выполнения подобных вмешательств. Необходимо проведение рандомизированных исследований для оценки отдаленных результатов при использовании видеоэндоскопических технологий при выполнении ПБЛАЭ.
Список литературы
1. Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209–49. DOI: 10.3322/caac.21660
2. Меньшиков К.В., Липатов О.Н., Пушкарев А.В., Меньшикова И.А., Липатов Д.О., Ахметгареева К.Т. Редкие опухоли вульвы по материалам Республиканского онкологического диспансера Республики Башкортостан. Медицинский вестник Башкортостана. 2020;15(2):25–31.
3. Abu-Rustum N.R., Yashar C.M., Arend R., Barber E., Bradley K., Brooks R., et al. Vulvar Cancer, Version 3.2024, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2024;22(2):117–35. DOI: 10.6004/jnccn.2024.0013
4. Мельников А.В. «Радикальная» операция иссечение общим блоком метастазов в лимфатические узлы Скарповского треугольника и подвздошной ямки при раке. Вопросы хирургии войны и абдоминальной хирургии. Горький; 1946. С. 162–71.
5. Петерсон Б.Е., Чиссов В.И., Пачес А.И. Атлас онкологических операций. М.: Медицина; 1987.
6. Azevedo R.A., Roxo A.C., Alvares S.H.B., Baptista D.P., Favorito L.A. Use of flaps in inguinal lymphadenectomy in metastatic penile cancer. Int Braz J Urol. 2021;47(6):1108–19. DOI: 10.1590/S1677-5538.IBJU.2021.99.14
7. Bishoff J.T., Basler J.W., Teichman J.M., Thompson I.M., et al. Endoscopic subcutaneous modified inguinal lymph node dissection (ESMIL) for squamous cell carcinoma of the penis. J Urol. 2003;169(1):78.
8. Brassetti A., Chiacchio G., Anceschi U., Bove A., Ferriero M., D’Annunzio S., et al. Robot-assisted inguinal lymphadenectomy to treat penile and vulvar cancers: a scoping review. Minerva Urol Nephrol. 2024;76(3):278–85. DOI: 10.23736/S2724-6051.24.05532-0
9. Nabavizadeh R., Petrinec B., Necchi A., Tsaur I., Albersen M., Master V. Utility of minimally invasive technology for inguinal lymph node dissection in penile cancer. J Clin Med. 2020;9(8):2501. DOI: 10.3390/jcm9082501
10. Naldini A., Rossitto C., Pacelli F., Vizzielli G., Campagna G., Moruzzi M.C., et al. The video endoscopy inguinal lymphadenectomy for vulvar cancer: A pilot study. Taiwan J Obstet Gynecol. 2017;56(3):281–5. DOI: 10.1016/j.tjog.2017.04.003
11. Zhang M., Chen L., Zhang X., Ding J., Hua K. A Comparative study of video endoscopic inguinal lymphadenectomy and conventional open inguinal lymphadenectomy for treating vulvar cancer. Int J Gynecol Cancer. 2017;27(9):1983–9. DOI: 10.1097/IGC.0000000000001100
12. Le A., Xiong J., Wang Z., Dai X.Y., Xiao T.H., Zhuo R., et al. Endoscopy-assisted inguinal lymphadenectomy in vulvar cancer. Arch Gynecol Obstet. 2018;297(5):1277–83. DOI: 10.1007/s00404-018-4732-6
13. Ma S., Zhao J., Liu Z., Wu T., Wang S., Wu C., et al. Prophylactic inguinal lymphadenectomy for high-risk cN0 penile cancer: The optimal surgical timing. Front Oncol. 2023;13:1069284. DOI: 10.3389/fonc.2023.1069284
14. Mathevet P., Schettini S., Roy M., Dargent D. Inguinoscopy or video-endoscopy inguinal lymph node dissection. The trocar. J Gynecol Surg Endosc. 2013. Available from: http://thetrocar.com/inguinoscopy-for-vulvar-cancer
15. Ma S., Zhang K., Li R., Lu J., Wu T., Liu Z., et al. Bilateral inguinal lymphadenectomy using simultaneous double laparoscopies for penile cancer: A retrospective study. Urol Oncol. 2022;40(3):112.e1–e9. DOI: 10.1016/j.urolonc.2021.12.022
16. Wu Q., Gong Z., Zhao Y., Sun Z., Shao H., Dai Z., et al. Video endoscopic inguinal lymphadenectomy via 3-incision lateral approach for vulvar cancers: our preliminary outcome of 37 cases. Int J Gynecol Cancer. 2016 Nov;26(9):1706–11. DOI: 10.1097/IGC.0000000000000816
17. Luan L., Chen R., Yang Y., Xue F., Wang W. Comparison of the two routes of video endoscopic inguinal lymphadenectomy in vulvar cancer: a systematic review and a single-center experience. Transl Cancer Res. 2021;10(2):1034–42. DOI: 10.21037/tcr-20-2690. PMID: 35116430; PMCID: PMC8797899
18. Sotelo R., Sayegh A.S., Medina L.G., Perez L.C., La Riva A., Eppler M.B., et al. Complications and adverse events in lymphadenectomy of the inguinal area: worldwide expert consensus. BJS Open. 2024;8(4):zrae056. DOI: 10.1093/bjsopen/zrae056
19. Wang S., Du P., Tang X., An C., Zhang N., Yang Y. Comparison of efficiency of video endoscopy and open inguinal lymph node dissection. Anticancer Res. 2017;37(8):4623–8. DOI: 10.21873/anticanres.11863
20. Cui Z.Y., Wang Y.F., Chen G.W., Wang Y., Zhu H.L., Zhu Y., et al. Application of video endoscopic inguinal lymphadenectomy in radical vulvectomy for carcinoma. Zhonghua Yi Xue Za Zhi. 2013;93(21):1653–6. Chinese. PMID: 24125676
21. Shao Y., Hu X., Ren S., Liao D., Yang Zh., Liu Y., et al. Comparison of different surgical methods and strategies for inguinal lymph node dissection in patients with penile cancer. Sci Rep. 2022;12:2560. DOI: 10.1038/s41598-022-06494-z
22. Zemp L.W., Rudzinski J.K., Pettaway C.A., Nicholson S., Spiess P.E. Management of Bulky Inguinal and pelvic lymph nodes. Urol Clin North Am. 2024;51(3):335–45. DOI: 10.1016/j.ucl.2024.03.012
23. Brassetti A., Pallares-Mendez R., Bove A.M., Misuraca L., Anceschi U., Tuderti G., et al. Comparing outcomes of open and robot-assisted inguinal lymphadenectomy for the treatment of cn2 squamous cell carcinoma of the penis: a retrospective single-center analysis. Cancers (Basel). 2024;16(23):3921. DOI: 10.3390/cancers16233921
24. Nabavizadeh R., Petrinec B., Nabavizadeh B., Singh A., Rawal S., Master V. Inguinal lymph node dissection in the era of minimally invasive surgical technology. Urol Oncol. 2023;41(1):1–14. DOI: 10.1016/j.urolonc.2020.07.026
25. Hahn B.A., Richir M.C., Witkamp A.J., de Jong T., Krijgh D.D. Prevalence of lower extremity edema following inguinal lymphadenectomy: A systematic review and meta-analysis. JPRAS Open. 2024;43:187–99. DOI: 10.1016/j.jpra.2024.11.001
26. Butler J.S., Milliken D.A., Dina R., Eccles S.A., Maghami S.G., Jameson C., et al. Isolated groin recurrence in vulval squamous cell cancer (VSCC). The importance of node count. Eur J Gynaecol Oncol. 2010;31(5):510–3. PMID: 21061790
27. Sopracordevole F., Clemente N., Giorda G., Canzonieri V., Alessandrini L., Del Fabro A., et al. Number of nodes removed with inguinofemoral lymphadenectomy and risk of isolated groin recurrence in women with FIGO stage IB-II squamous cell vulvar cancer. Int J Gynecol Cancer. 2018;28(8):1600–5. DOI: 10.1097/IGC.0000000000001326
28. Baiocchi G., Cestari F.M., Rocha R.M., Faloppa C.C., Kumagai L.Y., Fukazawa E.M., et al. Does the count after inguinofemoral lymphadenectomy in vulvar cancer correlate with outcome? Eur J Surg Oncol. 2013;39(4):339–43. DOI: 10.1016/j.ejso.2013.02.012
29. Matteucci M., Bruzzone P., Pinto S., Covarelli P., Boselli C., Popivanov G.I., et al. A review of the literature on videoscopic and robotic inguinal-iliac-obturator lymphadenectomy in patients with cutaneous melanoma. J Clin Med. 2024;13(23):7305. DOI: 10.3390/jcm13237305
30. Lee T.S., Li I., Peric B., Saw R.P.M., Duprat J.P., Bertolli E., et al. Leg lymphoedema after inguinal and ilio-inguinal lymphadenectomy for melanoma: results from a prospective, Randomised Trial. Ann Surg Oncol. 2024;31(6):4061–70. DOI: 10.1245/s10434-024-15149-4
31. Yi X.L., Li X.N., Lu Y.L., Lu H.Y., Chen Y., Zeng L.X., et al. Laparoscopic simultaneous anterograde inguinal and pelvic lymphadenectomy for penile cancer: two planses, three holes, and six steps. Front Surg. 2024;11:1344269. DOI: 10.3389/fsurg.2024.1344269
32. Falcone M., Gül M., Peretti F., Preto M., Cirigliano L., Scavone M., et al. Inguinal lymphadenectomy for penile cancer: an interim report from a trial comparing open versus videoendoscopic surgery using a within-patient design. Eur Urol Open Sci. 2024;63:31–7. DOI: 10.1016/j.euros.2024.02.007
33. Tang S., Akers C., Alnajjar H., Ayres B., Baldini C., Embleton-Thirsk A., et al. A study protocol for a feasibility randomised controlled trial investigating videoendoscopic radical inguinal lymphadenectomy versus open radical inguinal lymphadenectomy in patients with penile cancer (VELRAD). Pilot Feasibility Stud. 2024;10(1):61. DOI: 10.1186/s40814-024-01474-8
34. Ozambela M. Jr, McCormick B.Z., Rudzinski J.K., Pieretti A.C., González G.M.N., Meissner M.A., et al. Robotic or open superficial inguinal lymph node dissection as staging procedures for clinically node negative high risk penile cancer. Urol Oncol. 2024;42(4):120.e1–e9. DOI: 10.1016/j.urolonc.2024.01.036
35. Luo J., Hu J., Mulati Y., Wu Z., Lai C., Kong D., et al. Developing and validating a nomogram for penile cancer survival: A comprehensive study based on SEER and Chinese data. Cancer Med. 2024;13(7):e7111. DOI: 10.1002/cam4.7111
36. Vreeburg M.T.A., de Vries H.M., van der Noort V., Horenblas S., van Rhijn B.W.G., Hendricksen K., et al. Penile cancer care in the Netherlands: increased incidence, centralisation, and improved survival. BJU Int. 2024;133(5):596–603. DOI: 10.1111/bju.16306
37. Brouwer O.R., Rumble R.B., Ayres B., Sánchez Martínez D.F., Oliveira P., Spiess P.E., et al. Penile cancer: EAU-ASCO collaborative guidelines update Q and A. JCO Oncol Pract. 2024;20(1):33–7. DOI: 10.1200/OP.23.00585
38. Liu Q., Han N.N., Liu K.J., Ru M.F., Li P.Q. Clinically application of laparoscope in inguinal lymphadissection of vulvar cancer. China J Endoscop. 2013;8:862–5.
39. Wyatt J., Powell S.G., Ahmed S., Arthur J., Altaf K., Ahmed S., et al. Inguinal lymph node metastases from rectal adenocarcinoma: a systematic review. Tech Coloproctol. 2023;27(11):969–78. DOI: 10.1007/s10151-023-02826-x
40. Li F.G. Clinical research of video endoscopic inguinal lymphadenectomyin vulva cancer. Modern J Integrat Trad Chin West Med. 2014;24:2692–4.
41. Xu J.Y., Yu T.X., Guan X.M., Ding B., Ren M.L., Shen Y. Long-term outcomes of vulvar or vaginal cancer patients undergoing laparoendoscopic single-site inguinal lymphadenectomy. J Minim Access Surg. 2024;20(2):180–6. DOI: 10.4103/jmas.jmas_268_22
42. Vásquez-Castillo A.C., Moreira J., Guarecuco Castillo J.E., Hamam F., Masri M.M. Inguinal intranodal lymphangioma in an adult: a clinical case report. Cureus. 2023;15(12):e50402. DOI: 10.7759/cureus.50402
43. Tan X., Cai T., Wang Y., Wu Z., Zhou Q., Guo S., et al. Regional lymph node mapping in patients with penile cancer undergoing radical inguinal lymph node dissection — a retrospective cohort study. Int J Surg. 2024;110(5):2865–73. DOI: 10.1097/JS9.0000000000001160
44. Senn B., Mueller M.D., Cignacco E.L., Eicher M. Period prevalence and risk factors for postoperative short-term wound complications in vulvar cancer: a cross-sectional study. Int J Gynecol Cancer. 2010;20:646–54. DOI: 10.1111/IGC.0b013e3181d92723
45. Zhang X., Sheng X., Niu J., Li H., Li D., Tang L., et al. Sparing of saphenous vein during inguinal lymphadenectomy for vulval malignancies. Gynecol Oncol. 2007;105(3):722–6. DOI: 10.1016/j.ygyno.2007.02.011
46. Hinten F., van den Einden L.C., Hendriks J.C., van der Zee A.G., Bulten J., Massuger L.F., et al. Risk factors for short- and long-term complications after groin surgery in vulvar cancer. Br J Cancer. 2011;105(9):1279–87. DOI: 10.1038/bjc.2011.407
47. Егоренков В.В., Моисеенко Ф.В., Волков Н.М., Молчанов М.С., Равкина М.С., Абдулоева Н.Х. и др. Эффективность использования эндовидеоскопической пахово-бедренной лимфаденэктомии в лечении метастатической меланомы кожи. Креативная хирургия и онкология. 2021;11(2):138–43. DOI: 10.24060/2076-3093-2021-11-2-138-143
Об авторах
К. В. МеньшиковРоссия
Меньшиков Константин Викторович — к.м.н., доцент, кафедра онкологии и клинической морфологии, отдел химиотерапии
Республика Башкортостан, Уфа
Б. Ф. Киямов
Россия
Киямов Булат Фаритович — отделение онкогинекологии
Республика Башкортостан, Уфа
Т. К. Гирфанов
Россия
Гирфанов Тимур Камилевич — отделение онкогинекологии
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Меньшиков К.В., Киямов Б.Ф., Гирфанов Т.К. Видеоэндоскопическая пахово-бедренная лимфаденэктомия при раке вульвы. Обзор литературы. Креативная хирургия и онкология. 2025;15(1):41-49. https://doi.org/10.24060/2076-3093-2025-15-1-41-49
For citation:
Menshikov K.V., Kiyamov B.F., Girfanov Т.К. Videoendoscopic Inguinofemoral Lymphadenectomy for Vulvar Cancer. Literature Review. Creative surgery and oncology. 2025;15(1):41-49. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-1-41-49
JATS XML


































