Перейти к:
Кросслинкинг биополимеров: применение и перспективы
https://doi.org/10.24060/2076-3093-2025-15-1-50-56
Аннотация
Кросслинкинг — это метод «сшивания» высокомолекулярных соединений за счет образования новых химических поперечных связей внутри и между макроцепями. При этом в качестве кросслинкеров могут выступать разнообразные агенты — химические соединения, ультрафиолетовое излучение и т. п. Известно, что кросслинкинг биотканей способствует повышению их механической прочности, увеличению структурной плотности и снижению проницаемости биокаркаса. Целью данного обзора является характеристика возможностей применения технологии поперечного сшивания в различных отраслях медицины: офтальмологии, травматологии, урологии, гастроэнтерологии, онкологии, биоинженерии и др. Проведен обзор отечественных и зарубежных публикаций с использованием базы данных и ресурсов поисковых систем научных электронных библиотек: PubMed, elibrary.ru, Google Scholar, Science Direct, а также библиотечного фонда Башкирского государственного медицинского университета за период с 1994 по 2023 г. Исследование доступных литературных источников позволяет заключить, что метод ультрафиолетового кросслинкинга в настоящее время широко применяется в офтальмологии, а различные модификации кросслинкинга имеют перспективы применения в медицине и в смежных отраслях, могут стать основой для создания биоинженерных продуктов и оригинальных медицинских технологий, направленных на повышение эффективности лечения различных заболеваний человека.
Ключевые слова
Для цитирования:
Бикбов М.М., Кабиров И.Р., Халимов А.Р., Неряхин А.Д., Шмелькова П.Н., Гайнуллина Д.Х., Гумерова Л.С., Тухбатуллин А.А., Ахунзянов А.А., Надеждина Е.А. Кросслинкинг биополимеров: применение и перспективы. Креативная хирургия и онкология. 2025;15(1):50-56. https://doi.org/10.24060/2076-3093-2025-15-1-50-56
For citation:
Bikbov M.M., Kabirov I.R., Khalimov A.R., Neryakhin A.D., Shmelkova P.N., Gainullina D.Kh., Gumerova L.S., Tukhbatullin A.A., Akhunzyanov A.A., Nadezhdina E.A. Biopolymer crosslinking: Application and prospects. Creative surgery and oncology. 2025;15(1):50-56. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-1-50-56
ВВЕДЕНИЕ
Кросслинкинг — метод сшивания биополимеров за счет формирования новых поперечных связей между цепочками макромолекул [1][2]. Одно из первых упоминаний о кросслинкинге в научной литературе относится к 1936 году, когда H. Phillips в журнале Nature описал результаты восстановления и укрепления структуры растянутой животной кожи. В ходе исследования было обнаружено, что при использовании альдегида в качестве окисляющего агента происходит образование новых N=CH и дисульфидных связей между полипептидными цепями макромолекул кожи, что способствует уплотнению материала [3].
Исследования, посвященные ультрафиолетовому (УФ) кросслинкингу в офтальмологии, относятся к концу 80-х годов прошлого века. Так, в 1988 году S. Zigman и соавторы выявили процесс сшивания растворимых белков хрусталика при облучении глаза ультрафиолетом длиной волны 365 нм [4]. Y. Kato с коллегами (1994) описали рибофлавин-индуцированную модификацию коллагена под воздействием УФ-излучения диапазона А [5]. В 1998 году УФ-кросслинкинг роговицы был впервые предложен в качестве потенциального способа лечения кератэктазий [6]. Клиническое применение УФ-кросслинкинга роговицы началось после опубликования статьи G. Wollensak и его коллег в American Journal of Ophthalmology в 2003 году [7]. В настоящее время технология УФ-кросслинкинга роговицы успешно применяется в лечении различных заболеваний, таких как кератоконус, кератомаляции, ятрогенные кератэктазии, язвенные поражения роговой оболочки и др. Данный метод доказал свою эффективность в лечении дегенеративной патологии роговой оболочки глаза, при этом отдельно стоит отметить малоинвазивный характер хирургического вмешательства [8]. Существенный вклад в развитие технологии УФ-кросслинкинга роговицы был внесен научной школой Уфимского НИИ глазных болезней под руководством профессора М. М. Бикбова [9–13].
Виды кросслинкинга
Кросслинкинг может быть осуществлен за счет химической реакции, физического воздействия, ферментативного сшивания или комбинации данных методов (рис. 1). Химический кросслинкинг является следствием реакции модификации функциональных групп органических соединений, вызываемой, как правило, окисляющими агентами.
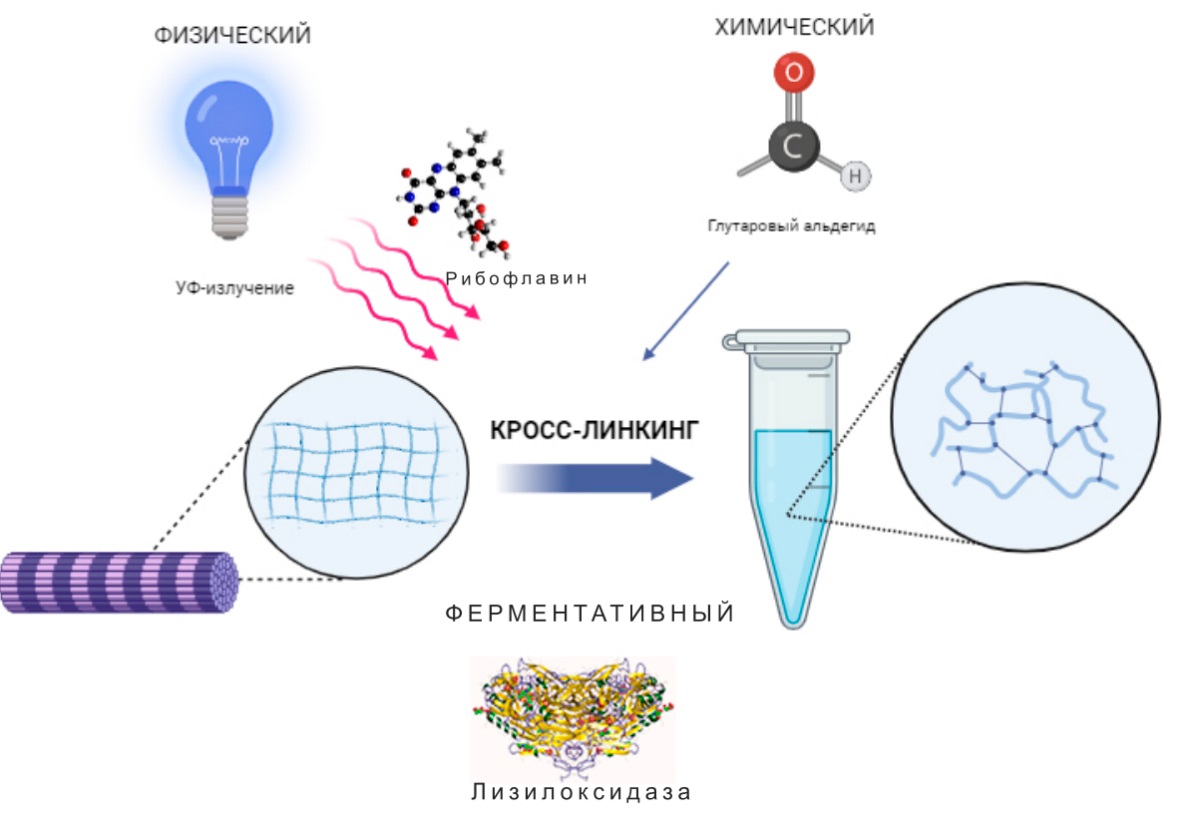
Рисунок 1. Виды кросслинкинга биологических полимеров
Figure 1. Types of biopolymer crosslinking
Физическое сшивание может происходить под влиянием различных видов излучения, включая радиационное воздействие, температурных колебаний или высушивания биополимеров [14].
Ферментативный кросслинкинг представлен процессом изменения структуры органических биополимеров под воздействием белковых соединений. В отличие от описанных выше методов перекрестного сшивания энзимопосредованный кросслинкинг отличается высокой специфичностью, каталитической эффективностью и отсутствием побочных продуктов [15].
Технология кросслининга в травматологии и ортопедии
H. Gu и соавт. изучали влияние последовательного цикла «замораживания-размораживания» тканей и методов сшивания на свойства животной коллагеновой мембраны. Мембрана была получена из раствора бычьего коллагена I типа после очищения от клеточного компонента и лиофилизации. Затем был проведен двойной кросслинкинг УФ-излучением с применением глутарового альдегида (ГА) в качестве окисляющего агента. В результате авторами была получена гидрофильная, плотная и эластичная пленка [16].
M. Saito и K. Marumo в своей работе доказали, что на прочность костей влияет количество образованных поперечных сшивок между коллагеном и окружающими его белками. Авторы предположили, что нарушение процессов ферментативного кросслинкинга протеинов костной ткани является одной из основных причин остеопороза [17].
В исследовании, проведенном P. Cornette и соавт., изучено влияние рибофлавина, обработанного УФ-излучением, на структуру и биомеханические свойства тканей при травме суставных капсул плеча. Исследователи воздействовали на нативный материал связочного аппарата суставов, взятый у пациентов во время операций. Результаты показали, что процедура кросслинкинга увеличила жесткость соединительной ткани с сохранением структуры [18].
Технология кросслинкинга в фармакологии
Механизм поперечного сшивания используется в изготовлении лекарственных препаратов. Так, сшитые хитозановые микросферы были применены для контролируемого высвобождения активных веществ. При этом хитозан выступает в качестве фармацевтического эксципиента [19].
L. Ruixue с коллегами синтезировали методом кросслинкинга новый тип гидрогеля. В состав полученного гидрогеля входит кальцитонин-ген родственный пептид (CGRP, calcitonin gene-related peptide) с гиалуроновй кислотой (HA, hyaluronic acid). Образованный пептидный комплекс HA-c-CGRP вводили в костный дефект черепа крысы. Данный гидрогель способствовал пролиферации клеток костного мозга, так как обладал высокой биосовместимостью со стромальными клетками [20].
Исследователи из Бразилии использовали технологию кросслинкинга для создания пролекарственного вещества на основе углеводов. В исследовании N. S. V. Capanema был представлен синтез макромолекулы на основе полимера карбоксиметилцеллюлозы с доксорубицином гидрохлоридом в присутствии лимонной кислоты. Усовершенствованные гидрогели были применены для местного воздействия на меланому и использовались для доставки доксорубицина гидрохлорида в опухоль [21]. Это исследование показало значение инновационных подходов для разработки новых методов лечения рака с целью облегчения доставки лекарственных веществ непосредственно в опухоль.
Применение кросслинкинга в терапии опухолей
Исследование, проведенное учеными из Шанхайского университета, демонстрирует потенциал использования сшитых композитных гидрогелей и нановолокон для эффективного лечения меланомы. В процессе создания гидрогеля с нанопроволокнами силиката кальция и марганца использовано лазерное облучение с длиной волны 808 нм, при этом нанопроволокна сшиваются, образуя связи с матрицей гидрогеля. Это позволяет создать прочную и стабильную структуру композитного гидрогеля. Последний обладает контролируемым процессом высвобождения ионов двухвалентных металлов из нанопроволокон, что повышает фототермический терапевтический эффект в лечении меланомы in situ [22]. В другом исследовании специалисты из Шанхайского университета науки и техники установили, что производимые таким способом композитные нановолокна способны эффективно преобразовывать световую энергию в тепловую и обладают высокой биосовместимостью in vivo и in vitro [23].
Сшитые УФ-излучением гидрогели представляют собой материал, который способствует регенерации тканей, обладает гистосовместимостью, необходимой плотностью и прочностью. Такие гидрогели могут быть использованы при оперативных вмешательствах в виде раневых и антимикробных повязок, тканевых клеев и герметиков, быстродействующих гемостатических средств, ингибиторов образования рубцов и даже заместителей пораженных участков роговицы [24].
Гидрогели на основе полисахаридов с биоадгезивными, прокоагулянтными, антибактериальными и антиоксидантными свойствами предложены для первой помощи при кровотечениях и для ускорения заживления инфицированных ран. Модифицированные гидрогели создаются с использованием механизмов кросслинкинга, включая формирование динамических и фото-активируемых ковалентных связей, а также многочисленных водородных связей [25].
Кросслинкинг в заживлении ран
Фото-сшитые гидрогели на основе химически измененных полисахаридов можно использовать в качестве материала для заживления кожных ран. УФ-облучение (360 нм) смеси полисахаридов, нанесенной на раневую поверхность, обеспечивает образование полимерной пленки за счет создания новых поперечных связей. Полисахаридные мембраны, полученные таким образом, обладают структурной стабильностью, прочностью, растяжимостью и адгезивностью к раневой поверхности благодаря образованию химических связей как внутри полимера, так и между гидрогелем и белками раневой поверхности. Фото-кросслинкинг может происходить без использования химических фото-инициаторов, что снижает вероятность побочных реакций [26].
Применение технологии кросслинкинг в лечении патологий сосудов
Кросслинкинг коллагена также используется для создания трансплантационного материала для пластики сосудов. Поперечное сшивание применяется для замедления времени биодеградации и способствует восстановлению структурных нарушений в децеллюляризированных сосудах, а также уменьшает воспалительную реакцию отторжения. Данный метод увеличивает просвет и «податливость» трансплантируемых сосудов [27].
Рибофлавин-опосредованное УФ-сшивание трансплантатов сосудов используется для восстановления их биомеханической прочности и предотвращения «обнажения» коллагеновых волокон, что делает их более подходящими для использования в качестве сосудистых имплантов. В эксперименте артерии сшивали с использованием метиленового синего в концентрациях 0,01, 0,015, 0,02 %, время УФ-облучения составляло 20 минут, 1 час, 2 часа соответственно. В ходе исследования было показано, что эта методика улучшает гладкость поверхности и предельную механическую прочность имплантов [28].
При создании новых коллагеновых каркасов для ангиопластики был продемонстрирован опыт использования кросслинкинга, основанного на химической реакции процианидов и альдегидов. В результате было зарегистрировано улучшение механических свойств трансплантата, замедление постимплантационной кальцификации и минимизация иммунного ответа [29].
Механизм кросслинкинга с использованием бета-аминопроприонитрила применяется при констриктивном ремоделировании поврежденных артерий после трансплантации [30]. Данный химический агент оказывает ингибирующее действие на ферменты лизилоксидазу и дезоксипиридинолин, опосредующие физиологический ферментативный кросслинкинг в тканях организма человека, что приводит к контролируемой реакции биодеградации коллагенового каркаса вследствие уменьшения числа меж- и внутрифибриллярных поперечных связей. Использование бета-аминопроприонитрила сокращало неоинтимальную плотность, что способствовало к снижению риска рестеноза, в частности, после баллонной ангиопластики на 33 % [31].
Использование кросслинкинга в урологии
Инъекции коллагена, сшитого глутаровым альдегидом (ГА), используются в урологии как малоинвазивный метод лечения недержания мочи после простатэктомии [32] и пузырно-мочеточникового рефлюкса [33][34]. ГА образует молекулярные поперечные сшивки между компонентами соединительнотканного матрикса, формируя гидрогелевый матрикс с необходимыми биомеханическими свойствами, что используется для укрепления тканей.
Исследование, проведенное L. M. Shortliffe с коллегами, показало эффективность трансуретральной имплантации сшитого глутаральдегидом высокоочищенного бычьего коллагена для коррекции недержания мочи. Инъекции сшитого коллагена, введенные в область шейки мочевого пузыря или мочевого сфинктера, способствовали улучшению состояния у 9 из 17 пациентов. Отсутствие сообщений об осложнениях в данном исследовании является важным аспектом и может свидетельствовать о безопасности данной процедуры [32]. В работе T. D. Richardson и соавторов для лечения недостаточности внутреннего сфинктера у женщин также проведено введение коллагена, модифицированного с помощью химического кросслинкинга. При среднем периоде наблюдения 46 месяцев улучшение состояния наблюдалось у 83 % пациентов [33].
Исследования показывают, что коллаген, сшитый ГА, можно вводить в мочевыводящие пути для коррекции недержания мочи без последующих осложнений и рассматривать их в качестве малоинвазивной альтернативы хирургическому лечению [35]. Но эффективность инъекции коллагена в уретру ограничена и требует постоянного контроля. Это связанно с постепенной реабсорбцией белка и потерей эффекта наполнения подслизистой оболочки. Для того чтобы улучшить долгосрочные результаты и определить оптимальный способ применения коллагена в уретре, требуются дальнейшие исследования [36][37].
Технология кросслинкинга при патологиях желудочно-кишечного тракта
Показано, что механизм кросслинкинга используется для повышения совместимости ксенотрансплантатов подслизистой оболочки тонкой кишки. Сшивание карбодиимидом (кросс-связывание) соединительнотканной оболочки кишки было применено с целью ингибировать коагулянтные эффекты в слизистой оболочке. В настоящее время разрабатывается клинический подход, который позволит улучшить результаты трансплантации подслизистой оболочки тонкой кишки и уменьшить риски коагуляции в результате этой процедуры [38].
Исследование, проведенное D. Kumar, M. J. Benson и J. E. Bland, описывает применение инъекции модифицированного глутаровым альдегидом коллагена для лечения пациентов с хирургически некорригируемым недержанием кала. После инъекции у 11 из 17 пациентов наблюдалось заметное симптоматическое улучшение. Все пациенты переносили введение обработанного коллагена без побочных эффектов. Такая процедура высоко оценена специалистами как простой и хорошо переносимый способ лечения недержания кала, вызванного дисфункцией внутреннего сфинктера. Инъекция коллагена в перианальную область является малоинвазивным и безболезненным методом лечения недержания [39].
3D-моделирование с использованием кросслинкинга
L. R. Versteegden и соавт. в своей работе описывают создание эластических коллагеновых каркасов с помощью методов формования, замораживания и лиофилизации белковых фибрилл. Трансформированные коллагеновые конструкции сжимали, гофрировали и обрабатывали карбодиимидом для проведения химического кросслинкинга. Эта процедура повышала упругость получаемых каркасов [40][41].
Стереолитография — это направление трехмерной печати на основе лазера, в которой используется ультрафиолетовый или видимый свет. Техника заключается в послойном нанесении и сшивании светочувствительного полимера. В данной технологии применяются фотоинициирующие вещества, которые под воздействием световой энергии способствуют образованию полимерных слоев [42].
Для создания биокаркасов методом стереолитографии с видимым светом Z. Wang с коллегами, проводили реакцию химического кросслинкинга между полиэтиленгликолем с эозином Y и метакрилированным желатином. По мнению авторов, это открывает перспективы создания биосовместимых материалов и биомедицинских структур для разработки новых технологий и методов лечения в медицинской практике [43].
ЗАКЛЮЧЕНИЕ
Исследование доступных литературных источников позволяет заключить следующее.
- Расширяющиеся возможности использования эффектов кросслинкинга в медицине стали причиной его активного изучения и формирования новой стратегии реабилитации пациентов с различной патологией.
- Технология перекрестного связывания имеет потенциал для дальнейшего развития и модернизации, в связи с чем успешно интегрируется в различные сферы медицины и связанные с ней отрасли.
- Разработка и внедрение оригинальных биоинженерных продуктов, основанных на принципах поперечного сшивания, позволяет совершенствовать методы лечения различных заболеваний человека и значительно повысить их эффективность.
Список литературы
1. Нащекина Ю.А., Луконина О.А., Михайлова Н.А. Химические сшивающие агенты для коллагена: механизмы взаимодействия и перспективность применения в регенеративной медицине. Цитология. 2020;62(7):459–72. DOI: 10.31857/S0041377120070044
2. Raiskup F., Spoerl E. Corneal crosslinking with riboflavin and ultraviolet A. I. Principles. Ocul Surf. 2013;11(2):65–74. DOI: 10.1016/j.jtos.2013.01.002
3. Phillips H. Cross-linkage formation in keratins. Nature. 1936;138(327):121–2. DOI: 10.1038/138327a0
4. Zigman S., Paxhia T., Waldron W. Effects of near-UV radiation on the protein of the grey squirrel lens. Curr Eye Res. 1988;7(6):531–7. DOI: 10.3109/02713688809031808
5. Kato Y., Uchida K., Kawakishi S. Aggregation of collagen exposed to UVA in the presence of riboflavin: a plausible role of tyrosine modification. Photochem Photobiol. 1994;59(3):343–9. DOI: 10.1111/j.1751-1097.1994.tb05045.x
6. Spoerl E., Huhle M., Seiler T. Induction of cross-links in corneal tissue. Exp Eye Res. 1998;66:97–103. DOI: 10.1006/exer.1997.0410
7. Wollensak G., Spoerl E., Seiler T. Riboflavin/ultraviolet-a-induced collagen crosslinking for the treatment of keratoconus. Am. J. Ophthalmol. 2003 135(5):620–7. DOI: 10.1016/s0002-9394(02)02220-1
8. Seyedian M.A., Aliakbari S., Miraftab M., Hashemi H., Asgari S., Khabazkhoob M. Corneal collagen cross-linking in the treatment of progressive keratoconus: a randomized controlled contralateral eye study. Middle East Afr J Ophthalmol. 2015;22(3):340–5. DOI: 10.4103/0974-9233.159755
9. Бикбов М.М., Бикбова Г.М. Эктазии роговицы (патогенез, патоморфология, клиника, диагностика, лечение). М.; 2011.
10. Бикбов М.М., Шевчук Н.Е., Халимов А.Р. Влияние ультрафиолетового кросслинкинга на уровень цитокинов в слезной жидкости у пациентов с кератэктазиями. Цитокины и воспаление. 2015;14(2):54–7.
11. Бикбов М.М., Халимов А.Р., Усубов Э.Л. Ультрафиолетовый кросслинкинг роговицы. Вестник РАМН. 2016;71(3):224–32. DOI: 10.15690/vramn562
12. Бикбов М.М., Шевчук Н.Е., Халимов А.Р., Бикбова Г.М. Динамика уровня рибофлавина во влаге передней камеры глаза экспериментальных животных при стандартном насыщении стромы растворами для УФ-кросслинкинга роговицы. Вестник офтальмологии. 2016;132(6):29–35. DOI: 10.17116/oftalma2016132629-35
13. Бикбов М.М., Суркова В.К., Халимов А.Р., Усубов Э.Л. Результаты лечения пеллюцидной маргинальной дегенерации роговицы методом роговичного кросслинкинга. Вестник офтальмологии. 2017;133(3):58–64. DOI: 10.17116/oftalma2017133358-64
14. Zigman S., Paxhia T., Waldron W. Effects of near-UV radiation on the protein of the grey squirrel lens. Curr Eye Res. 1988;7(6):531–7. DOI: 10.3109/02713688809031808
15. Dodda J.M., Azar M.G., Sadiku R. Crosslinking trends in multicomponent hydrogels for biomedical applications. Macromol Biosci. 2021;21(12):e2100232. DOI: 10.1002/mabi.202100232
16. Gu H., He L., Liu L., Jin Y.C. Construction of dermal skeleton by double cross-linking with glutaraldehyde and ultraviolet radiation. Zhonghua Shao Shang Za Zhi. 2008;24(2):114–7. PMID: 18785411
17. Saito M., Marumo K. Effects of collagen crosslinking on bone material properties in health and disease. Calcif Tissue Int. 2015;97(3):242–61. DOI: 10.1007/s00223-015-9985-5
18. Cornette P., Jaabar I.L., Dupres V., Werthel J.D., Berenbaum F., Houard X., et al. Impact of collagen crosslinking on dislocated human shoulder capsules-effect on structural and mechanical properties. Int J Mol Sci. 2022;23(4):2297. DOI: 10.3390/ijms23042297
19. Shweta A., Pahuja S. Pharamaceutical relevance of cross-linked chitosan in microparticulate drug delivery. International Research Journal of Pharmacy. 2013;4:45–51.
20. Ruixue L., Yang S., Zhengwei C., Yang L., Jian S., Wei B., et al. Highly bioactive peptide-HA photo-crosslinking hydrogel for sustained promoting bone regeneration. Chem Engin J. 2021;415:129015. DOI: 10.1016/j.cej.2021.129015
21. Capanema N.S.V., Mansur A.A.P., Carvalho S.M., Carvalho I.C., Chagas P., de Oliveira L.C.A., et al. Bioengineered carboxymethyl cellulose-doxorubicin prodrug hydrogels for topical chemotherapy of melanoma skin cancer. Carbohydr Polym. 2018;195:401–12. DOI: 10.1016/j.carbpol.2018.04.105
22. Zhao J., Zhu Y., Ye C., Chen Y., Wang Sh., Zou D., et al. Photothermal transforming agent and chemotherapeutic co-loaded electrospun nanofibers for tumor treatment. Int J Nanomedicine. 2019;14:3893–909. DOI: 10.2147/IJN.S202876
23. Ma H., Peng Y., Zhang S., Zhang Y., Min P. Effects and progress of photo-crosslinking hydrogels in wound healing improvement. Gels. 2022;8(10):609. DOI: 10.3390/gels8100609
24. Zou C.Y., Lei X.X., Hu J.J., Jiang Y.L., Li Q.J., Song Y.T., et al. Multi-crosslinking hydrogels with robust bio-adhesion and pro-coagulant activity for first-aid hemostasis and infected wound healing. Bioact Mater. 2022;16:388–402. DOI: 10.1016/j.bioactmat.2022.02.034
25. Mao H., Zhao S., He Y., Feng M., Wu L., He Y., et al. Multifunctional polysaccharide hydrogels for skin wound healing prepared by photoinitiator-free crosslinking. Carbohydr Polym. 2022;285:119254. DOI: 10.1016/j.carbpol.2022.119254
26. Wang J., Kong L., Gafur A., Peng X., Kristi N., Xu J., et al. Photooxidation crosslinking to recover residual stress in decellularized blood vessel. Regen Biomater. 2021;8(2):rbaa058. DOI: 10.1093/rb/rbaa058. PMID: 33738112
27. Schneider K.H., Rohringer S., Kapeller B., Grasl C., Kiss H., Heber S., et al. Riboflavin-mediated photooxidation to improve the characteristics of decellularized human arterial small diameter vascular grafts. Acta Biomater. 2020;116:246–58. DOI: 10.1016/j.actbio.2020.08.037. PMID: 32871281
28. Munger K.A., Downey T.M., Haberer B., Pohlson K., Marshall L.L., Utecht R.E. A novel photochemical cross-linking technology to improve luminal gain, vessel compliance, and buckling post-angioplasty in porcine arteries. J Biomed Mater Res B Appl Biomater. 2016;104(2):375–84. DOI: 10.1002/jbm.b.33373. PMID: 25823876
29. Wang X., Ma B., Chang J. Preparation of decellularized vascular matrix by co-crosslinking of procyanidins and glutaraldehyde. Biomed Mater Eng. 2015;26(1–2):19–30. DOI: 10.3233/BME-151548. PMID: 26484552
30. Brasselet C., Durand E., Addad F., Al Haj Zen A., Smeets M.B., Laurent-Maquin D., et al. Collagen and elastin cross-linking: a mechanism of constrictive remodeling after arterial injury. Am J Physiol Heart Circ Physiol. 2005;289(5):H2228–33. DOI: 10.1152/ajpheart.00410.2005
31. Zhai W., Zhang H., Wu C., Zhang J., Sun X., Zhang H., et al. Crosslinking of saphenous vein ECM by procyanidins for small diameter blood vessel replacement. J Biomed Mater Res B Appl Biomater. 2014;102(6):1190–8. DOI: 10.1002/jbm.b.33102
32. Shortliffe L.M., Freiha F.S., Kessler R., Stamey T.A., Constantinou C.E. Treatment of urinary incontinence by the periurethral implantation of glutaraldehyde cross-linked collagen. J Urol. 1989;141(3):538–41. DOI: 10.1016/s0022-5347(17)40885-8
33. Richardson T.D., Kennelly M.J., Faerber G.J. Endoscopic injection of glutaraldehyde cross-linked collagen for the treatment of intrinsic sphincter deficiency in women. Urology. 1995;46(3):378–81. DOI: 10.1016/S0090-4295(99)80223-4
34. Frey P., Gudinchet F., Jenny P. GAX 65: new injectable cross-linked collagen for the endoscopic treatment of vesicoureteral reflux—a double-blind study evaluating its efficiency in children. J Urol. 1997;158(3 Pt 2):1210–2. PMID: 9258175
35. Fang M., Yuan J., Peng C., Li Y. Collagen as a double-edged sword in tumor progression. Tumour Biol. 2014;35(4):2871–82. DOI: 10.1007/s13277-013-1511-7
36. Iselin C.E. Periurethral collagen injections for incontinence following radical prostatectomy: does the patient benefit? Curr Opin Urol. 1999;9(3):209–12. DOI: 10.1097/00042307-199905000-00003
37. Appell R.A. Collagen injection therapy for urinary incontinence. Urol Clin North Am. 1994;21(1):177–82. PMID: 8284841
38. Glynn J.J., Polsin E.G., Hinds M.T. Crosslinking decreases the hemocompatibility of decellularized, porcine small intestinal submucosa. Acta Biomater. 2015;14:96–103. DOI: 10.1016/j.actbio.2014.11.038
39. Kumar D., Benson M.J., Bland J.E. Glutaraldehyde cross-linked collagen in the treatment of faecal incontinence. Br J Surg. 1998;85(7):978–9. DOI: 10.1046/j.1365-2168.1998.00751.x
40. Versteegden L.R., van Kampen K.A., Janke H.P., Tiemessen D.M., Hoogenkamp H.R., Hafmans T.G., et al. Tubular collagen scaffolds with radial elasticity for hollow organ regeneration. Acta Biomater. 2017;52:1–8. DOI: 10.1016/j.actbio.2017.02.005
41. Versteegden L.R., Hoogenkamp H.R., Lomme R.M., Van Goor H., Tiemessen D.M., Geutjes P.J., et al. Design of an elasticized collagen scaffold: A method to induce elasticity in a rigid protein. Acta Biomater. 2016;15(44):277–85. DOI: 10.1016/j.actbio.2016.08.038
42. Lin H., Tang Y., Lozito T.P., Oyster N., Kang R.B., Fritch M.R., et al. Projection stereolithographic fabrication of BMP-2 gene-activated matrix for bone tissue engineering. Sci Rep. 2017;7(1):11327. DOI: 10.1038/s41598-017-11051-0
43. Wang Z., Kumar H., Tian Z., Jin X., Holzman J.F., Menard F., et al. Visible light photoinitiation of cell-adhesive gelatin methacryloyl hydrogels for stereolithography 3D bioprinting. ACS Appl Mater Interfaces. 2018;10(32):26859–69. DOI: 10.1021/acsami.8b06607
Об авторах
М. М. БикбовРоссия
Бикбов Мухаррам Мухтарамович — д.м.н., профессор, кафедра офтальмологии с курсом оптического приборостроения
Республика Башкортостан, Уфа
И. Р. Кабиров
Россия
Кабиров Ильдар Раифович — к.м.н., кафедра урологии и онкологии
Республика Башкортостан, Уфа
А. Р. Халимов
Россия
Халимов Азат Рашидович — д.б.н., научно-инновационный отдел
Республика Башкортостан, Уфа
А. Д. Неряхин
Россия
Неряхин Александр Дмитриевич — студент 5 курса, педиатрический факультет
Республика Башкортостан, Уфа
П. Н. Шмелькова
Россия
Шмелькова Полина Николаевна — студентка 5 курса, педиатрический факультет
Республика Башкортостан, Уфа
Д. Х. Гайнуллина
Россия
Гайнуллина Диана Халиловна — студентка 5 курса, педиатрический факультет
Республика Башкортостан, Уфа
Л. С. Гумерова
Россия
Гумерова Лейла Сергеевна — студентка 5 курса, педиатрический факультет
Республика Башкортостан, Уфа
А. А. Тухбатуллин
Россия
Тухбатуллин Альберт Альфредович — студент 5 курса, педиатрический факультет
Республика Башкортостан, Уфа
А. А. Ахунзянов
Россия
Ахунзянов Азат Алмазович — студент 5 курса, педиатрический факультет
Республика Башкортостан, Уфа
Е. А. Надеждина
Россия
Надеждина Екатерина Андреевна — студентка 6 курса, педиатрический факультет
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Бикбов М.М., Кабиров И.Р., Халимов А.Р., Неряхин А.Д., Шмелькова П.Н., Гайнуллина Д.Х., Гумерова Л.С., Тухбатуллин А.А., Ахунзянов А.А., Надеждина Е.А. Кросслинкинг биополимеров: применение и перспективы. Креативная хирургия и онкология. 2025;15(1):50-56. https://doi.org/10.24060/2076-3093-2025-15-1-50-56
For citation:
Bikbov M.M., Kabirov I.R., Khalimov A.R., Neryakhin A.D., Shmelkova P.N., Gainullina D.Kh., Gumerova L.S., Tukhbatullin A.A., Akhunzyanov A.A., Nadezhdina E.A. Biopolymer crosslinking: Application and prospects. Creative surgery and oncology. 2025;15(1):50-56. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-1-50-56
JATS XML


































