Перейти к:
Комбинированная таргетная терапия ингибиторами BRAF и MEK в сочетании с иммунотерапией (атезолизумаб + вемурафениб + кобиметиниб) при метастатической меланоме кожи (клинический случай)
https://doi.org/10.24060/2076-3093-2025-15-2-75-82
Аннотация
Введение. Меланома кожи является высокоагрессивным злокачественным новообразованием с высоким риском метастазирования. Современные методы лечения включают хирургическое вмешательство, иммунотерапию и таргетную терапию, направленную на мутации в сигнальных путях MAPK/ERK, в частности BRAF V600E. Несмотря на эффективность двойных режимов (ингибиторы BRAF и MEK), быстро развивающаяся лекарственная устойчивость остается проблемой, что обусловило интерес к комбинированной иммуно-таргетной терапии. Цель: оценить эффективность и переносимость тройной комбинации Атезолизумаб + Вемурафениб + Кобиметиниб у пациента с метастатической меланомой кожи, BRAF V600E-положительной, после неудачи предшествующих линий терапии. Материалы и методы. Приведен детализированный клинический случай пациента с метастатической меланомой кожи, у которого после операции и первой линии терапии комбинацией Дабрафениб + Траметиниб была зафиксирована стабилизация заболевания в течение 27 месяцев. После последующего прогрессирования были применены вторая и третья линии терапии: Пембролизумаб, затем Пембролизумаб + Ленватиниб, однако они оказались недостаточно эффективными. Четвертая линия терапии: комбинация Атезолизумаб + Вемурафениб + Кобиметиниб — показала выраженный положительный эффект. Результаты и обсуждение. После шести месяцев терапии тройной комбинацией отмечено полное метаболическое регрессирование ранее выявленных очагов по данным ПЭТ-КТ, включая внутригрудные лимфатические узлы и метастатические очаги в легких. Терапия продолжена, переносимость удовлетворительная, нежелательные явления 3–4-й степени отсутствуют. Заключение. Клинический случай демонстрирует перспективность применения комбинированной схемы Атезолизумаб + Вемурафениб + Кобиметиниб у предлеченного пациента с метастатической меланомой, обладающей мутацией BRAF V600E. Данный подход может быть эффективным у пациентов с ранее развившейся резистентностью к BRAF/MEK-ингибиторам и ингибиторам контрольных точек иммунного ответа. Полученные данные подтверждают актуальность персонализированного подхода в лечении меланомы и необходимость дальнейших исследований в этой области.
Ключевые слова
Для цитирования:
Аскаров В.Е., Султанбаев А.В., Меньшиков К.В., Чалов В.С., Султанбаева Н.И., Меньшикова И.А. Комбинированная таргетная терапия ингибиторами BRAF и MEK в сочетании с иммунотерапией (атезолизумаб + вемурафениб + кобиметиниб) при метастатической меланоме кожи (клинический случай). Креативная хирургия и онкология. 2025;15(2):171-178. https://doi.org/10.24060/2076-3093-2025-15-2-75-82
For citation:
Askarov V.E., Sultanbaev A.V., Menshikov K.V., Chalov V.S., Sultanbaeva N.I., Menshikova I.A. Combination BRAF/MEK Inhibitor Targeted Therapy and Immunotherapy (atezolizumab + vemurafenib + cobimetinib) for Metastatic Cutaneous Melanoma: Clinical Case. Creative surgery and oncology. 2025;15(2):171-178. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-2-75-82
ВВЕДЕНИЕ
Меланома кожи представляет собой злокачественное новообразование, возникающее из меланоцитов и характеризующееся агрессивным биологическим поведением и высоким потенциалом метастазирования [1]. Согласно данным GLOBOCAN, ежегодно регистрируется свыше 325 000 новых случаев меланомы, из которых более 57 000 заканчиваются летально [2]. В развитых странах заболеваемость продолжает расти, особенно среди лиц со светлой кожей, проживающих в регионах с высокой солнечной активностью [3]. Ультрафиолетовое (УФ) облучение считается основным экзогенным фактором канцерогенеза при меланоме. Под действием УФ-излучения в меланоцитах накапливаются мутации, нарушающие контроль клеточного цикла, пролиферации и апоптоза [4–6].
Особенно важны в патогенезе мутации в генах BRAF, NRAS, KIT, NF1 и других сигнальных каскадах MAPK/ERK и PI3K/AKT [7][8]. Мутации в гене BRAF встречаются приблизительно в 40–60 % случаев меланомы, причем наиболее распространенной является BRAF V600E — замена валина на глутаминовую кислоту в кодоне 600 [9]. Эта мутация ассоциирована с молодым возрастом, большим числом невусов, первичной локализацией на туловище и высокой УФ-экспозицией [10][11]. Исследования показали, что пациенты с BRAF-мутацией демонстрируют особый биологический и клинический фенотип опухоли [12]. Мутации NRAS встречаются в 15–20 % случаев, особенно при узловых формах меланомы, ассоциированных с длительным солнечным воздействием и большей толщиной опухоли [13]. Меланомы без мутации в BRAF или NRAS называются double wild-type и часто характеризуются мутациями в NF1 и KIT [14][15].
Диагностика меланомы включает клинико-дерматологическое обследование, дерматоскопию и иммуногистохимические исследования. Одним из наиболее чувствительных и специфичных маркеров является транскрипционный фактор SOX10, экспрессируемый практически во всех формах меланомы, включая десмопластические и веретенообразные подтипы. Его чувствительность достигает 100 %, а специфичность — 93 % [16]. С учетом молекулярных особенностей опухоли за последнее десятилетие произошло значительное расширение терапевтического арсенала за счет таргетной терапии и иммунотерапии [17]. Переломным моментом стало внедрение ингибиторов BRAF (вемурафениб, дабрафениб) и MEK (траметиниб, кобиметиниб, биниметиниб), которые при комбинированном применении существенно улучшили показатели выживаемости [18][19]. Так, комбинация дабрафениб + траметиниб по сравнению с монотерапией продемонстрировала достоверное увеличение общей выживаемости (ОВ) и выживаемости без прогрессирования (ВБП), медиана ВБП достигала 11 месяцев, а 5-летняя ОВ — 34 % [20]. Похожими характеристиками обладает комбинация вемурафениб + кобиметиниб и энкорафениб + биниметиниб [21].
Однако на фоне таргетной терапии довольно быстро развивается лекарственная устойчивость — в среднем через 6–8 месяцев [22]. Среди предполагаемых механизмов устойчивости называют повторную активацию MAPK-пути, мутации в MEK1/2, PIK3CA и экспрессию альтернативных рецепторов роста [23][24]. В связи с этим было предложено использовать комбинированную иммуно- и таргетную терапию. Исследование IMspire150 стало первым, где была продемонстрирована эффективность тройной комбинации атезолизумаб + вемурафениб + кобиметиниб: медиана ВБП достигла 15,1 месяца против 10,6 при двойной терапии, а профиль токсичности оказался приемлемым [25]. Результаты IMspire150 были подтверждены и другими исследованиями, включая SECOMBIT и DREAMseq, где оценивались различные стратегии последовательного и комбинированного применения иммуно- и таргетных агентов [26][27]. Так, в DREAMseq было показано, что инициальная иммунотерапия (Ниволумаб + Ипилимумаб) с последующим переходом на таргетную терапию обеспечивает более длительную ОВ, чем наоборот [27].
Иммуноонкологические препараты (ингибиторы PD-1 и CTLA-4) продемонстрировали революционные результаты в лечении метастатической меланомы. Комбинация Ниволумаб + Ипилимумаб обеспечивает медиану ОВ свыше 60 месяцев, хотя сопровождается высокой токсичностью (3–4-я степень — у 55 % пациентов) [28][29]. Пембролизумаб, другой ингибитор PD-1, в рамках исследования KEYNOTE-006 показал двухлетнюю выживаемость около 55 %, особенно у пациентов с высокой экспрессией PD-L1 [30]. При прогрессии на иммунотерапии перспективным вариантом является комбинация Пембролизумаб + Ленватиниб, как показано в исследовании LEAP-004, где общая эффективность составила 21,4 % [31]. Современные исследования поднимают важность учета иммуноопосредованного «сетпоинта» опухоли — баланса между иммунной атакой и защитой опухоли, зависящего от опухолевой микросреды, экспрессии PD-L1, мутационной нагрузки и инфильтрации лимфоцитами [32][33].
Микроокружение меланомы включает иммунные клетки, сосуды, фибробласты, и его характеристики влияют на ответ на терапию. Например, высокая экспрессия VEGF может снижать эффективность иммунотерапии, поэтому ангиостатические агенты вроде Ленватиниба потенциально усиливают ее эффект [34]. Согласно рекомендациям NCCN (2024) и ESMO (2022), выбор терапии должен быть индивидуализирован с учетом мутационного профиля, стадии заболевания, выраженности симптомов и предпочтений пациента [35].
МАТЕРИАЛЫ И МЕТОДЫ
Пациент А. в 2018 году стал отмечать появление опухоли на коже волосистой части головы в заушной области слева. Постепенно отмечал изменение свойств опухоли увеличение в размерах, появление зуда. С января 2019-го отметил появление опухоли на задней поверхности шеи. Обратился в поликлинику по месту жительства, где было проведено обследование. Пациент был направлен в Республиканский онкологический диспансер, где образования были верифицированы и выставлен диагноз: меланома кожи заушной области, волосистой части головы стадия 3 а группа 2 T1aN1M0. 15 мая 2019 г. пациенту было выполнено расширенное истечение опухоли кожи заушной области слева. Произведен поиск мутации генов BRAF. Выявлена мутация в гене BRAF V600E. Согласно клиническим рекомендациям пациенту назначен курс лекарственной терапии препаратами Дабрафениб и Траметиниб. 31 июля 2019 г. пациент начал получать терапию. После третьего курса терапии больной был направлен на контрольное обследование — ПЭТ / КТ, где было отмечено уменьшение размеров и уровня активности в корне правого легкого (лимфатический узел) (рис. 1).
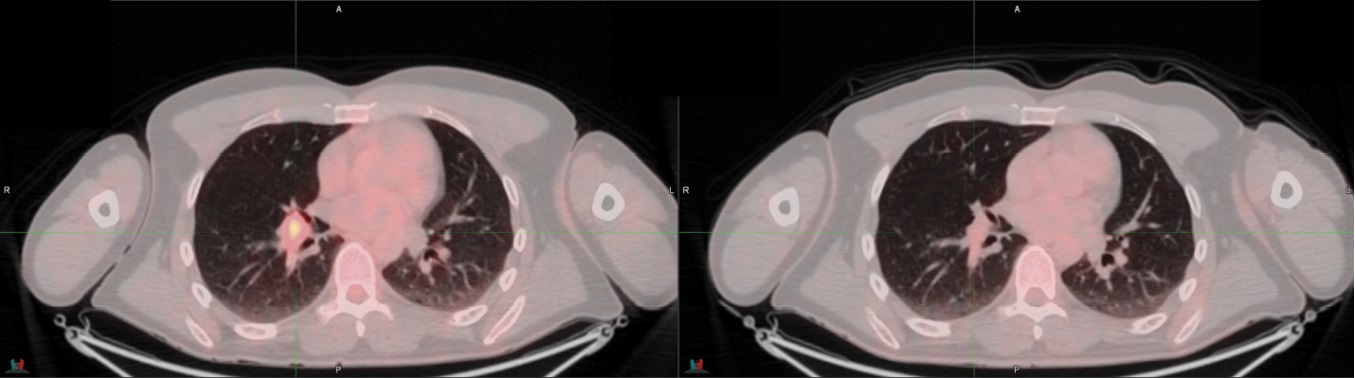
Рисунок 1. Метастатическое поражение лимфатического узла корня правого легкого
Figure 1. Lymph node metastasis in the right lung hilum
Другие внутригрудные лимфатические узлы неактивны. Пациент продолжил терапию в прежнем режиме. После девятого курса терапии пациент был вновь направлен на контрольное обследование (ПЭТ / КТ), где отмечена стабилизация заболевания со снижением метаболической активности (рис. 2).
Пациенту было рекомендовано продолжить терапию в режиме «Дабрафениб и Траметиниб». После 14-го курса терапии по данным контрольного обследования отмечено в динамике появление низкой активности в немногочисленных лимфатических узлах первого и второго уровня шеи. А также появление зоны активности послеоперационной области. Пациент был направлен на консилиум, где принято решение продолжить терапию в прежнем режиме. По окончанию 19-го курса проведен контроль в динамике, где зафиксирована стабилизация заболевания. Пациент продолжил лечение в прежней схеме, и после 26-го курса была вновь оценена динамика. По данным позитронной-эмиссионной томографии, отмечена отрицательная динамика в виде роста размеров и активности единичного лимфоузла шеи слева вероятнее МТС (рис. 3), в остальном регресс активности в немногочисленных лимфоузлах шеи, сохраняются слабо активные лимфоузлы корня правого легкого.
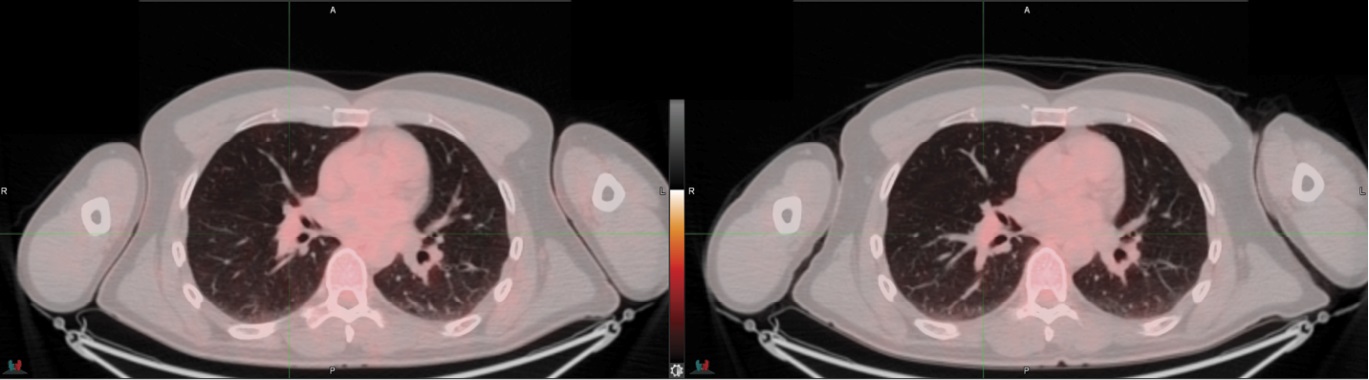
Рисунок 2. Снижение уровня накопления радиофармпрепарата
Figure 2. Reduced radiopharmaceutical uptake
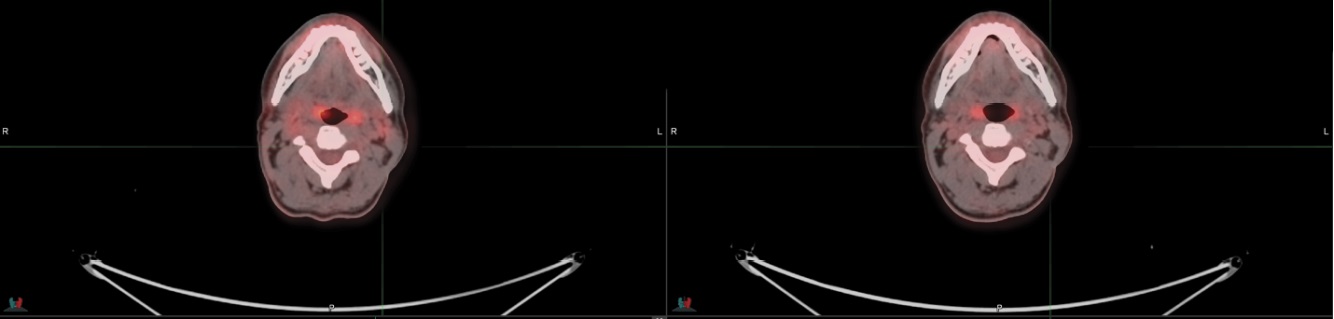
Рисунок 3. Появление очага в лимфоузлах шеи
Figure 3. New lesion in cervical lymph nodes
Было принято решение назначить анти-PD-1 терапию Пембролизумабом. 28 сентября 2022 г. больной получил первый курс второй линии терапии. По окончании третьего курса была проведена оценка эффективности лечения, где выявлена прогрессия заболевания в виде увеличения лимфоузлов шеи слева с повышением метаболической активности (рис. 4).
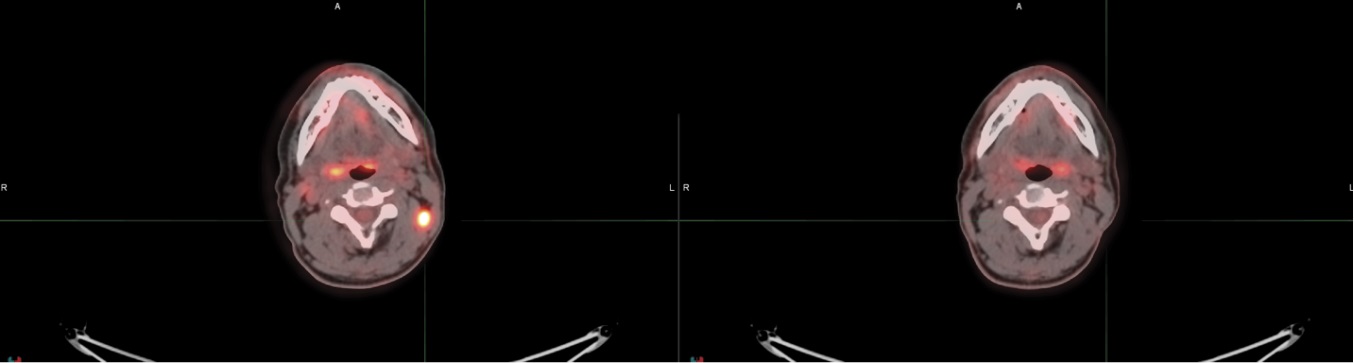
Рисунок 4. Повышение уровня активности очага в лимфоузлах шеи
Figure 4. Increased metabolic activity in cervical lymph nodes
Проведена биопсия лимфатического узла. Патолого-анатомически подтверждён метастаз пигментной меланомы в исследованном узле. 9 февраля 2023 г. пациенту проведена экстирпация метастатических пораженных лимфоузлов шеи. После чего консилиумом было решено добавить к Пембролизумабу Ленватиниб. После четырех курсов данной схемы терапии по данным ПЭТ-КТ отмечено появление очагов в правом легком с низкой метаболической активностью. Для уточнения характера выявленных очагов была проведена компьютерная томография, где было подтверждено прогрессирование заболевания в виде появления метастатических очагов в легком. Онкологическим консилиумом Республиканского онкологического диспансера было предложено лечение: Атезолизумаб + Вемурафениб + Кобиметиниб. После шести месяцев терапии на контрольном обследовании данных о наличии очагов с патологическим метаболизмом 18F-ФДГ, характерных для неопластического процесса, не выявлено, в сравнении с предыдущим исследованием отмечается снижение активности внутригрудных лимфатических узлов. Регресс ранее визуализируемых очагов в легких. Пациент продолжил терапию в прежнем режиме. В настоящее время пациент продолжает получать терапию Атезолизумаб + Вемурафениб + Кобиметиниб. Нежелательных явлений, требующих коррекции дозировки или отмены препарата, не выявлено.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Меланома кожи с мутацией BRAF V600E представляет собой особую клинико-биологическую подгруппу опухолей, для которой за последние годы разработаны различные терапевтические подходы, включая таргетные препараты и иммуноонкологические средства [7][9][17]. Пациенту, описанному в настоящем наблюдении, была проведена радикальная хирургическая резекция с последующим применением таргетной терапии комбинацией Дабрафениб + Траметиниб, что соответствует современным рекомендациям по ведению пациентов с мутацией BRAF V600E на стадии III и IV [18][19][35].
Как показано в исследовании COMBI-AD, адъювантное применение Дабрафениба с Траметинибом у пациентов с полностью удаленной меланомой стадии III приводит к значимому снижению риска рецидива и увеличению общей выживаемости: через 3 года она составила 86 % [20]. У описанного пациента стабилизация заболевания сохранялась более 2 лет, что подтверждает данные литературы о длительном клиническом контроле на фоне двойной таргетной терапии [21].
Однако, как и в большинстве случаев, в течение третьего года лечения у пациента было зарегистрировано прогрессирование заболевания, что может быть связано с формированием лекарственной устойчивости к ингибиторам BRAF и MEK. Предполагается, что повторная активация MAPK-пути, мутации в MEK1/2, а также компенсация через PI3K-AKT путь являются основными причинами вторичной резистентности [22–24]. Вторая линия лечения включала назначение Пембролизумаба — ингибитора PD-1, эффективность которого подтверждена в исследовании KEYNOTE-006, где при распространенной меланоме медиана общей выживаемости составила 32,7 месяца [30]. Однако у пациента было отмечено раннее прогрессирование после начала иммунотерапии, что, вероятно, обусловлено иммунологическим «холодным» фенотипом опухоли или угнетающим микроклиматом опухолевой микросреды [32][33].
В качестве третьей линии был применен режим «Пембролизумаб + Ленватиниб». Данная комбинация показала перспективные результаты в исследовании LEAP-004 (фаза II), особенно у пациентов с прогрессированием после PD-1 терапии: общая эффективность составила 21,4 %, а медиана ВБП — 4,2 месяца [31]. Однако и этот подход оказался недостаточно эффективным в конкретном клиническом случае, что диктует необходимость более агрессивной и комбинированной стратегии.
В 2023 году пациенту было назначено лечение в режиме «Атезолизумаб + Вемурафениб + Кобиметиниб», основанное на данных рандомизированного клинического исследования IMspire150, где тройная терапия показала значимое преимущество по медиане выживаемости без прогрессирования (15,1 против 10,6 месяца при двойной терапии), а также более высокий общий ответ (ORR) [25]. Этот подход признан эффективным при наличии активной мутации BRAF и удовлетворительного соматического статуса пациента [26].
Отдельного внимания заслуживает вопрос о выборе последовательности терапии при BRAF-положительной меланоме. Исследование DREAMseq (фаза III) продемонстрировало преимущество начала лечения с иммунотерапии (Ниволумаб + Ипилимумаб), а затем — переход к таргетным препаратам. Однако при агрессивном клиническом течении, выраженном симптомокомплексе или быстро растущих метастазах обосновано первичное применение таргетной терапии [27]. Также следует учитывать важность оценки микросреды опухоли, уровня экспрессии PD-L1 и мутационной нагрузки при прогнозировании ответа на иммунотерапию [32–34]. Интеграция биомаркеров и динамического мониторинга ответа на лечение в реальной клинической практике остается ключевым направлением развития персонализированной онкологии.
Таким образом, представленный случай демонстрирует весь спектр современных терапевтических стратегий при метастатической меланоме и подчеркивает необходимость индивидуального подбора лечения с учетом молекулярно-генетических характеристик опухоли, динамики ответа и развития резистентности. Использование комбинированной терапии, как показано в IMspire150, дает реальные шансы на долгосрочный контроль заболевания у тщательно отобранных пациентов [25].
Пациенту с BRAF-положительной меланомой, согласно клиническим рекомендациям, была проведена радикальная операция с последующим назначением таргетной терапии комбинацией Дабрафениб + Траметиниб. На фоне проводимого лечения отмечалась длительная стабилизация заболевания — около 27 месяцев. Эти данные согласуются с результатами исследования COMBI-AD, где сообщается, что адъювантная терапия данной комбинацией у пациентов с BRAF-мутированной меланомой стадии III приводит к 3-летней общей выживаемости 86 % [20]. Также в этом исследовании было установлено, что нежелательные явления были, как правило, обратимыми и контролируемыми [20].
После прогрессирования заболевания во время таргетной терапии пациенту был назначен Пембролизумаб. Этот препарат представляет собой гуманизированное моноклональное антитело IgG4, направленное против рецептора PD-1 и блокирующее взаимодействие с его лигандами PD-L1 и PD-L2 [30]. Как показано в исследовании KEYNOTE-006, применение Пембролизумаба приводит к значительному улучшению общей выживаемости по сравнению с Ипилимумабом [30]. Однако у описанного пациента прогрессирование было зафиксировано на ранних сроках иммунотерапии, что, вероятно, связано с иммуносупрессивной опухолевой микросредой [33]. Следующим этапом лечения стала комбинация Пембролизумаб + Ленватиниб. Эффективность данной схемы была продемонстрирована во II фазе исследования LEAP-004, где комбинированная терапия у предлеченных пациентов с метастатической меланомой привела к объективному ответу у 21,4 % пациентов [31]. Однако у данного пациента отмечалась дальнейшая отрицательная динамика, включая появление метастатических очагов в легких.
В связи с прогрессированием заболевания было принято решение о переходе на схему «Атезолизумаб + Вемурафениб + Кобиметиниб». Согласно данным клинического исследования IMspire150, эта тройная комбинация обеспечила медиану выживаемости без прогрессирования 15,1 месяца против 10,6 месяца в группе двойной таргетной терапии (Вемурафениб + Кобиметиниб), при этом профиль токсичности оставался приемлемым [25]. Данное исследование подтвердило преимущества добавления иммунотерапии к таргетному режиму у пациентов с ранее не леченной BRAF-мутированной меланомой [25]. Таким образом, клиническое течение у данного пациента в целом соответствует текущим научным данным.
Согласно исследованию DREAMseq, для пациентов с BRAF-мутированной меланомой возможны различные подходы к выбору последовательности терапии: от инициальной иммунотерапии до первичной таргетной терапии [27]. Учитывая агрессивность заболевания и необходимость быстрого ответа, у нашего пациента стартовая тактика с таргетной терапии была оправдана.
ЗАКЛЮЧЕНИЕ
Пациент с положительной мутацией BRAF, у которого была проведена радикальная операция, после которой он получал терапию комбинацией Дабрафениб + Траметиниб. Отмечена стабилизация заболевания на протяжении 27 месяцев. Позже, когда лечение не достигло ожидаемого эффекта, пациент был переведен на следующую линию терапии: Пембролизумаб. Затем после прогрессирования добавлен был Ленватиниб. Но после очередной прогрессии заболевания пациенту было предложено комбинированное лечение Атезолизумаб + Вемурафениб + Кобиметиниб, которое показало лучшие результаты в клиническом исследовании IMspire-150. Пациент получает по настоящее время данную комбинацию, с хорошей переносимостью и стабильной динамикой.
Список литературы
1. Siegel R.L., Miller K.D., Wagle N.S., Jemal A. Cancer statistics, 2023. CA Cancer J Clin. 2023;73(1):17–48. DOI: 10.3322/caac.21763
2. Arnold M., Singh D., Laversanne M., Vignat J., Vaccarella S., Meheus F., et al. Global burden of cutaneous melanoma in 2020 and projections to 2040. JAMA Dermatol. 2022;158(5):495–503. DOI: 10.1001/jamadermatol.2022.0160
3. Whiteman D.C., Green A.C., Olsen C.M. The growing burden of invasive melanoma: projections of incidence rates and numbers of new cases in six susceptible populations through 2031. J Invest Dermatol. 2016;136(6):1161–71. DOI: 10.1016/j.jid.2016.01.035
4. Hayward N.K., Wilmott J.S., Waddell N., Johansson P.A., Field M.A., Nones K., et al. Whole-genome landscapes of major melanoma subtypes. Nature. 2017;545(7653):175–80. DOI: 10.1038/nature22071
5. Wessely A., Steeb T., Berking C., Heppt M.V. How neural crest transcription factors contribute to melanoma heterogeneity, cellular plasticity, and treatment resistance. Int J Mol Sci. 2021;22(11):5761. DOI: 10.3390/ijms22115761
6. Cancer Genome Atlas Network. Genomic classification of cutaneous melanoma. Cell. 2015;161(7):1681–96. DOI: 10.1016/j.cell.2015.05.044
7. Kozyra P., Pitucha M. Revisiting the role of B-RAF Kinase as a therapeutic target in melanoma. Curr Med Chem. 2024;31(15):2003–20. DOI: 10.2174/0109298673258495231011065225
8. Diaz M.J., Tran J.T., Choo Z.N., Root K.T., Batchu S., Milanovic S., et al. Genomic subtypes of cutaneous melanoma have distinct metabolic profiles: A single-cell transcriptomic analysis. Arch Dermatol Res. 2023;315(10):2961–5. DOI: 10.1007/s00403-023-02690-7
9. Bauer J., Büttner P., Murali R., Okamoto I., Kolaitis N.A., Landi M.T., et al. BRAF mutations in cutaneous melanoma are independently associated with age, anatomic site of the primary tumor, and the degree of solar elastosis at the primary tumor site. Pigment Cell Melanoma Res. 2011;24(2):345–51. DOI: 10.1111/j.1755-148X.2011.00837.x
10. Beleaua M.A., Jung I., Braicu C., Milutin D., Gurzu S. SOX11, SOX10 and MITF gene interaction: a possible diagnostic tool in malignant melanoma. Life (Basel). 2021;11(4):281. DOI: 10.3390/life11040281
11. Sun J., Carr M.J., Khushalani N.I. Principles of targeted therapy for melanoma. Surg Clin North Am. 2020;100(1):175–88. DOI: 10.1016/j.suc.2019.09.013
12. Kakadia S., Yarlagadda N., Awad R., Kundranda M., Niu J., Naraev B., et al. Mechanisms of resistance to BRAF and MEK inhibitors and clinical update of US Food and Drug Administration-approved targeted therapy in advanced melanoma. Onco Targets Ther. 2018;11:7095–107. DOI: 10.2147/OTT.S182721
13. Ascierto P.A., Ribas A., Larkin J., McArthur G.A., Lewis K.D., Hauschild A., et al. Impact of initial treatment and prognostic factors on postprogression survival in BRAF-mutated metastatic melanoma treated with dacarbazine or vemurafenib ± cobimetinib: a pooled analysis of four clinical trials. J Transl Med. 2020;18(1):294. DOI: 10.1186/s12967-020-02458-x
14. Robert C., Grob J.J., Stroyakovskiy D., Karaszewska B., Hauschild A., Levchenko E., et al. Five-year outcomes with dabrafenib plus trametinib in metastatic melanoma. N Engl J Med. 2019;381(7):626–36. DOI: 10.1056/NEJMoa1904059
15. Dummer R., Ascierto P.A., Gogas H.J., Arance A., Mandala M., Liszkay G., et al. Overall survival in patients with BRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2018;19(10):1315–27. DOI: 10.1016/S1470-2045(18)30497-2
16. Guha A., Jain P., Fradley M.G., Lenihan D., Gutierrez J.M., Jain C., et al. Cardiovascular adverse events associated with BRAF versus BRAF/ MEK inhibitor: Cross-sectional and longitudinal analysis using two large national registries. Cancer Med. 2021;10(12):3862–72. DOI: 10.1002/cam4.3938
17. Gutzmer R., Stroyakovskiy D., Gogas H., Robert C., Lewis K., Protsenko S., et al. Atezolizumab, vemurafenib, and cobimetinib as firstline treatment for unresectable advanced BRAFV600 mutation-positive melanoma (IMspire150): primary analysis of the randomised, doubleblind, placebo-controlled, phase 3 trial. Lancet. 2020;395(10240):1835– 44. DOI: 10.1016/S0140-6736(20)30934-X
18. Swetter S.M., Johnson D., Albertini M.R., Barker C.A., Bateni S., Baumgartner J., et al. NCCN Guidelines® Insights: Melanoma: Cutaneous, Version 2.2024. J Natl Compr Canc Netw. 2024;22(5):290–8. DOI: 10.6004/jnccn.2024.0036
19. Larkin J., Chiarion-Sileni V., Gonzalez R., Grob J.J., Cowey C.L., Lao C.D., et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med. 2015;373(1):23–34. DOI: 10.1056/NEJMoa1504030
20. Ott P.A., Hodi F.S., Robert C. CTLA-4 and PD-1/PD-L1 blockade: new immunotherapeutic modalities with durable clinical benefit in melanoma patients. Clin Cancer Res. 2013;19(19):5300–9. DOI: 10.1158/1078-0432.CCR-13-0143
21. Robert C., Long G.V., Brady B., Dutriaux C., Di Giacomo A.M., Mortier L., et al. Five-year outcomes with nivolumab in patients with wildtype BRAF advanced melanoma. J Clin Oncol. 2020;38(33):3937–46. DOI: 10.1200/JCO.20.00995
22. Dummer R., Flaherty K.T., Robert C., Arance A., B de Groot J.W., Garbe C., et al. COLUMBUS 5-year update: a randomized, open-label, phase III trial of encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF. Future Oncol. 2023;19(16):1091–8. DOI: 10.2217/fon-2022-1258
23. Ascierto P.A., Dummer R., Gogas H.J., Arance A., Mandala M., Liszkay G., et al. Contribution of MEK inhibition to BRAF/MEK inhibitor combination treatment of BRAF-mutant melanoma: part 2 of the randomized, open-label, phase III COLUMBUS Trial. J Clin Oncol. 2023;41(29):4621–31. DOI: 10.1200/JCO.22.02322
24. Wahid M., Jawed A., Mandal R.K., Dar S.A., Akhter N., Somvanshi P., et al. Recent developments and obstacles in the treatment of melanoma with BRAF and MEK inhibitors. Crit Rev Oncol Hematol. 2018;125:84–8. DOI: 10.1016/j.critrevonc.2018.03.005
25. Steininger J., Gellrich F.F., Schulz A., Westphal D., Beissert S., Meier F. Systemic therapy of metastatic melanoma: on the road to cure. Cancers (Basel). 2021;13(6):1430. DOI: 10.3390/cancers13061430
26. Meirson T., Asher N., Bomze D., Markel G. Safety of BRAF+MEK inhibitor combinations: severe adverse event evaluation. Cancers (Basel). 2020;12(6):1650. DOI: 10.3390/cancers12061650
27. Chanda M., Cohen M.S. Advances in the discovery and development of melanoma drug therapies. Expert Opin Drug Discov. 2021;16(11):1319–47. DOI: 10.1080/17460441.2021.1942834
28. Jespersen H., Bjursten S., Ny L., Levin M. Checkpoint inhibitorinduced sarcoid reaction mimicking bone metastases. Lancet Oncol. 2018;19(6):e327. DOI: 10.1016/S1470-2045(18)30252-3
29. Казьмин А.И., Черницын К.И., Мошуров И.П. Стойкий полный ответ на терапию пембролизумабом у пациентки с метастатической меланомой с поражением костей. Онкология. Журнал им. П.А. Герцена. 2019;8(3):221–5. DOI: 10.17116/onkolog2019803115221
30. Amaral T., Ottaviano M., Arance A., Blank C., Chiarion-Sileni V., Donia M., et al. Cutaneous melanoma: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2025;36(1):10–30. DOI: 10.1016/j.annonc.2024.11.006
31. Luke J.J., Flaherty K.T., Ribas A., Long G.V. Targeted agents and immunotherapies: Optimizing outcomes in melanoma. Nat Rev Clin Oncol. 2017;14(8):463–82. DOI: 10.1038/nrclinonc.2017.43
32. Menzer C., Menzies A.M., Carlino M.S., Reijers I., Groen E.J., Eigentler T., et al. Targeted therapy in advanced melanoma with rare BRAF mutations. J Clin Oncol. 2019;37(33):3142–51. DOI: 10.1200/JCO.19.00489
33. Chen D.S., Mellman I. Elements of cancer immunity and the cancerimmune set point. Nature. 2017;541(7637):321–30. DOI: 10.1038/nature21349
34. Satala D., Satala G., Karkowska-Kuleta J., Bukowski M., Kluza A., Rapala-Kozik M., et al. Structural insights into the interactions of candidal enolase with human vitronectin, fibronectin and plasminogen. Int J Mol Sci. 2020;21(21):7843. DOI: 10.3390/ijms21217843
35. Sullivan R.J., Atkins M.B. Molecular targeted therapy for patients with BRAF-mutant melanoma: advances and perspectives. Am Soc Clin Oncol Educ Book. 2020;40:219–29. DOI: 10.1200/EDBK_279947
Об авторах
В. Е. АскаровРоссия
Аскаров Вадим Евгеньевич — онкологическое отделение противоопухолевой лекарственной терапии
Республика Башкортостан, Уфа
А. В. Султанбаев
Россия
Султанбаев Александр Валерьевич — к.м.н., отдел противоопухолевой лекарственной терапии
Республика Башкортостан, Уфа
К. В. Меньшиков
Россия
Меньшиков Константин Викторович — к.м.н., доцент, кафедра онкологии и клинической морфологии, отдел химиотерапии
Республика Башкортостан, Уфа
В. С. Чалов
Россия
Чалов Виталий Сергеевич — отделение радиотерапии
Республика Башкортостан, Уфа
Н. И. Султанбаева
Россия
Султанбаева Надежда Ивановна — отделение противоопухолевой лекарственной терапии № 1
Республика Башкортостан, Уфа
И. А. Меньшикова
Россия
Меньшикова Ирина Асхатовна — к.м.н., доцент, кафедра биологической химии
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Аскаров В.Е., Султанбаев А.В., Меньшиков К.В., Чалов В.С., Султанбаева Н.И., Меньшикова И.А. Комбинированная таргетная терапия ингибиторами BRAF и MEK в сочетании с иммунотерапией (атезолизумаб + вемурафениб + кобиметиниб) при метастатической меланоме кожи (клинический случай). Креативная хирургия и онкология. 2025;15(2):171-178. https://doi.org/10.24060/2076-3093-2025-15-2-75-82
For citation:
Askarov V.E., Sultanbaev A.V., Menshikov K.V., Chalov V.S., Sultanbaeva N.I., Menshikova I.A. Combination BRAF/MEK Inhibitor Targeted Therapy and Immunotherapy (atezolizumab + vemurafenib + cobimetinib) for Metastatic Cutaneous Melanoma: Clinical Case. Creative surgery and oncology. 2025;15(2):171-178. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-2-75-82


































