Перейти к:
Элемент Кюри: опыт применения радия-223 у пациентов с костными метастазами при кастрационно-резистентном раке предстательной железы
https://doi.org/10.24060/2076-3093-2025-15-3-211-219
Аннотация
Введение. Радионуклидная терапия костных метастазов дихлоридом радия‑223 одобрена для пациентов с кастрационно-резистентным раком предстательной железы. Активно внедряемая в клиническую практику таргетная терапия позволяет улучшить показатели общей выживаемости, снизить болевые ощущения с возможностью отмены сильнодействующих анальгезирующих препаратов, уменьшить либо отсрочить риски возникновения потенциально серьезных осложнений, таких как патологические переломы и компрессия спинного мозга. Цель исследования: оценить эффективность данного препарата. Материалы и методы. С 2023 года в Клинике Башкирского государственного медицинского университета радионуклидную терапию получили 43 пациента с метастатическим кастрационно-резистентным раком предстательной железы. Перед каждым введением дихлорида радия‑223 проводился мониторинг показателей крови и простатического специфического антигена, оценка функционального статуса и болевого синдрома. Пациенты были разделены на группы в зависимости от применения дихлорида радия‑223 в качестве второй, третьей либо четвертой линии терапии. Эффективность препарата оценивалась с помощью контрольной остеосцинтиграфии. Результаты и обсуждение. У 62,7% пациентов, завершивших курс радионуклидной терапии, отмечена стабилизация процесса, что согласуется с данными ключевых публикаций крупнейшего мирового регистра. Общая выживаемость была выше в группе, получавшей терапию в качестве второй линии, по сравнению с группами из более поздних линий. В процессе лечения у 58% пациентов снизился болевой синдром, а в общей группе уровень щелочной фосфатазы снизился на 16,4%, что согласуется с данными рандомизированного исследования III фазы ALSYMPCA. Заключение. Данное исследование вносит вклад в накопление доказательной базы по оптимизации применения дихлорида радия‑223 в рутинной онкологической практике, демонстрируя клиническую эффективность препарата. Поскольку дихлорид радия‑223 противопоказан при висцеральных метастазах и рекомендован в качестве второй линии терапии, важна преемственность в работе специалистов и своевременная маршрутизация пациентов для раннего назначения.
Ключевые слова
Для цитирования:
Павлов В.Н., Байков Д.Э., Иткулов А.Ф., Кагарманова А.Ш., Антипина А.А., Гильметдинов Р.Р. Элемент Кюри: опыт применения радия-223 у пациентов с костными метастазами при кастрационно-резистентном раке предстательной железы. Креативная хирургия и онкология. 2025;15(3):211-219. https://doi.org/10.24060/2076-3093-2025-15-3-211-219
For citation:
Pavlov V.N., Baikov D.E., Itkulov A.F., Kagarmanova A.Sh., Antipina A.A., Gilmetdinov R.R. Curie Element: Experience of Radium-223 Use in Patients With Bone Metastases in Castration-Resistant Prostate Cancer. Creative surgery and oncology. 2025;15(3):211-219. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-3-211-219
ВВЕДЕНИЕ
Рак предстательной железы (РПЖ) доминирует в структуре онкологической заболеваемости мужского населения, занимая первое место в 112 странах и составляя 15 % всех злокачественных новообразований у мужчин [1]. Согласно данным GLOBOCAN 2022, РПЖ остается ведущей причиной смерти от злокачественных опухолей у мужчин в 25 % государств, демонстрируя пятилетнюю выживаемость 97 % при локализованных формах (T1–T2) и менее 30 % при развитии костных метастазов [2]. В Российской Федерации РПЖ занимает второе место в структуре онкозаболеваемости мужчин (14,5 % случаев), уступая лишь новообразованиям трахеи, бронхов и легких (17,4 %) [3]. Согласно Национальному онкологическому регистру 2023 г. доля пациентов с диагнозом РПЖ III–IV стадий снизилась до 37,8 % (против 40,4 % в 2018 г.) благодаря внедрению программ ранней диагностики, включая ПСА-скрининг и МРТ-визуализацию [4].
С течением времени неизбежно возникает устойчивость к кастрации, и, несмотря на применение химиотерапии, средняя продолжительность жизни пациентов с метастатическим кастрационно-резистентным раком предстательной железы (мКРРПЖ) редко превышает 3 года [5]. Костные метастазы проявляются выраженными болями, хрупкостью костного каркаса, патологическими переломами [6].
Круг препаратов, воздействующих непосредственно на костные метастатические эмболы, ограничен. В настоящее время при лечении рака предстательной железы активно применяются цитотоксические (таксаны) и гормональные противоопухолевые антиандрогенные препараты. При наличии обширного метастатического поражения незамедлительное назначение комбинированной терапии рассматривается как стандарт первой линии лечения [7]. Более современная узконаправленная на костные метастазы терапия исключает свойственное гормональным препаратам привыкание опухолевых клеток и применяется при прогрессировании на фоне терапии андроген-рецепторными ингибиторами или химиотерапии [8]. Одним из подобных таргетных препаратов является «Олапариб», зарегистрированный в Российской Федерации и применяемый с 2021 г., который избирательно воздействует на опухолевые клетки с дефектами в системе репарации ДНК, характерными для определенных молекулярных подтипов РПЖ [9].
В последние годы при терапевтическом лечении костных метастазов стали широко применяться такие радионуклидные препараты, как дихлорид радия-223 и лютеций-177, применяемый в рамках PSMA-таргетной терапии (направленной на простатический специфический мембранный антиген). Действие данных изотопов связано с созданием ими зон высокой плотности ионизации и радиационного возбуждения на своем пути, что приводит к различным типам нерепарируемых повреждений ДНК опухолевых клеток [10–13]. В отличие от дистанционной лучевой терапии, где цитотоксический эффект напрямую связан с поглощенной дозой ионизирующего излучения, радиофармпрепараты (РФП) имеют некоторые особенности. Альфа-/бета-излучатели обладают высокой линейной передачей энергии (которая представляет собой количество энергии, передаваемое на единицу объема), что обеспечивает избирательное поражение метастатических очагов при меньшем воздействии на здоровые структуры. Исторически в терапии мКРРПЖ использовались РФП первого поколения (β-излучатели) — это фосфор-32, стронция-89 хлорид и самарий-153 лексидронам. Их применение, однако, ограничивалось токсичностью и преобладанием паллиативного эффекта (купирование болевого синдрома), что способствовало разработке более селективных препаратов, таких как дихлорид радия-223 [14–16].
Дихлорид радия-223, относящийся к группе щелочноземельных металлов, доказал свою эффективность в новых многоцентровых исследованиях и рекомендован к применению в России и других крупных странах. Он включен в рекомендации Российского общества клинической онкологии (RUSCO) и Ассоциации онкологов России (АОР) в качестве второй линии терапии при мКРРПЖ [3][17]. Механизм его воздействия на костные метастазы связан со сродством к остеобластам, что, помимо прямого цитотоксического эффекта, вызывает его аккумулирование на поверхности кости подобно кальцию и стронцию. Это определяет его чувствительность к более уязвимым, метаболически активным частям костной структуры. По результатам ранее опубликованного рандомизированного исследования III фазы ALSYMPCA, медиана общей выживаемости (ОВ) больных, получавших дихлорид радия-223, составила 14,9 месяца, в группе плацебо — 11,3 месяца [18].
Целью данного исследования явилось оценить эффективность применения РФП дихлорида радия-223 у пациентов с костными метастазами РПЖ в качестве второй и последующих линий терапии.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективное исследование были включены 43 пациента с мКРРПЖ, которым на базе Клиники БГМУ в период с 21.03.2023 по 21.04.2025 было проведено от трех до шести введений РФП с интервалами в 4 недели согласно утвержденному Минздравом России режиму дозирования дихлорида радия-223. Объем введения РФП рассчитывался с учетом массы тела (кг), концентрации радиоактивности продукта (55 кБк) на контрольную дату и поправочным коэффициентом распада для коррекции физического распада радия хлорида.
Критериями отбора пациентов для проведения радионуклидной терапии (РНТ) являлись следующие данные: общая щелочная фосфатаза (ЩФ) — маркер резорбции костной ткани, ПСА, тестостерон, ЛДГ, АЛТ, АСТ, креатинин, Са, Fe, гемоглобин — выше 100 г/л, тромбоциты — выше 100×10⁹/л, нейтрофилы — выше 1,5×10⁹/л. Количество и локализацию костных метастазов оценивали по исследованиям остеосцинтиграфии (рис. 1).
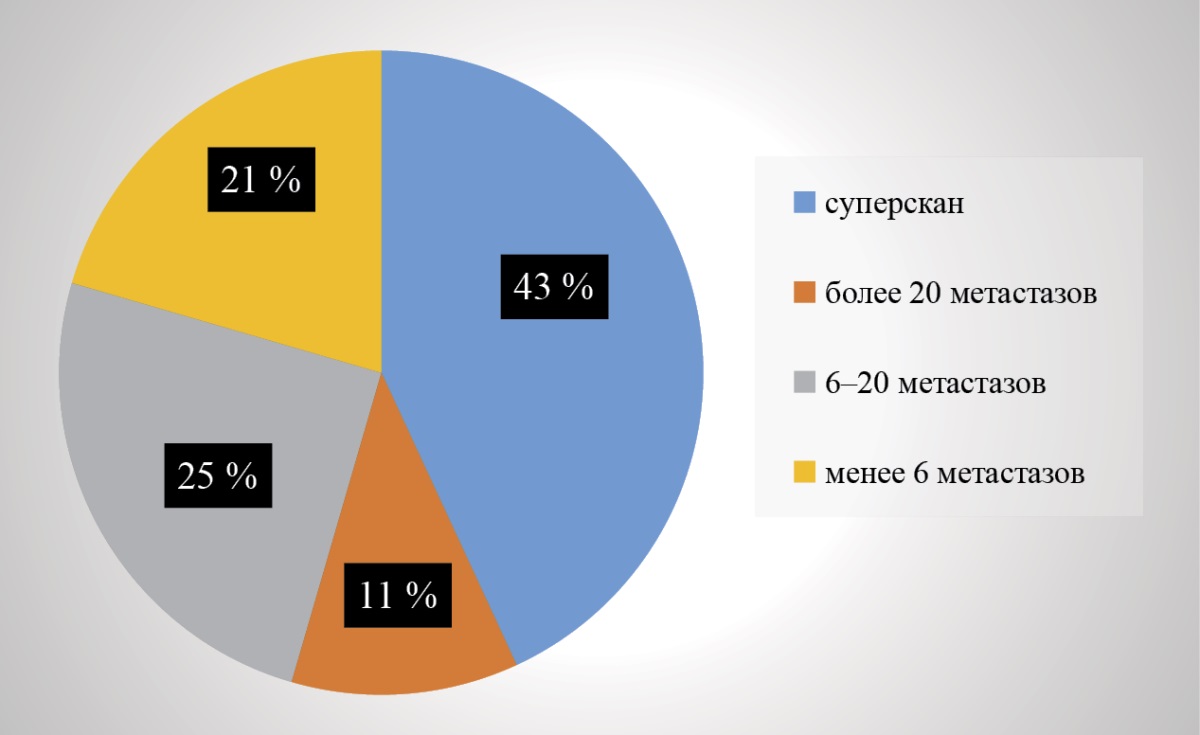
Рисунок 1. Распределение пациентов по количеству костных метастазов при первичном исследовании по данным остеосцинтиграфии
Figure 1. Distribution of patients by the number of bone metastases at the initial examination according to bone scintigraphy data
Помимо костных метастазов и дегенеративных изменений, в 4 (9,3 %) случаях был выявлен остеомиелит нижней челюсти, связанный с предшествующей терапией бисфосфонатами. Кроме того, 2 (4,7 %) пациента состоят на диспансерном учете у онколога по поводу рака толстой кишки.
В соответствии с клиническими рекомендациями RUSCO (2023) пациентам с высоким риском прогрессирования РПЖ (сумма по шкале Глисона > 7, уровень ПСА > 20 нг/мл, местнораспространенные формы) перед назначением дихлорида радия-223 требовалась комплексная диагностика (КТ органов брюшной полости, МРТ органов малого таза с контрастированием). Выявление висцеральных метастазов (в печени, легких) при инструментальной верификации являлось абсолютным противопоказанием к применению дихлорида радия-223 ввиду его селективного воздействия исключительно на остеобластические очаги [17].
Средний возраст пациентов составил от 53 до 71 (65,7 ± 7,9) года. Средний балл по кумулятивной гериатрической шкале коморбидности (CISR-G) для пациентов 65 лет и старше составил 12,8 ± 4,7. Средняя степень злокачественности по Глисону по данным гистологии при первичной верификации в общей группе составляла 7,5 ± 0,9 балла. Исследуемая клиническая группа неоднородна, с наличием различий: в интервалах от начала гистологической верификации РПЖ до выявления первичных костных метастазов; в объемах поражения костной структуры; в степени выраженности болевого синдрома (ECOG), сопутствующей патологии; в проводимом ранее лечении и переносимости совместного применения химиотерапии.
Статистическую обработку данных выполнили с использованием программного пакета MedCalc (v 23.1.7, Бельгия). Для параметрических данных рассчитывались средние значения, для непараметрических (значения ПСА, ЩФ, тестостерона в исследуемой группе пациентов имеют «выбросы») — отдельно рассчитывалась медиана. Нормальность распределения оценивалась критерием Шапиро — Уилка. Для расчета кривой общей выживаемости с использованием метода Каплана — Майера для каждого пациента определяли период наблюдения с даты начала лечения дихлоридом радия-223 с последующим определением статуса пациента.
Дихлорид радия-223 применялся во 2-й линии терапии у 14 (32,6 %) пациентов, в 3 линии — у 18 (41,9 %), в 4-й линии — у 11 (25,6 %). Ожидаемо, что пациенты в третьей и четвертой линий терапии, пройдя большое количество курсов цитотоксического и гормонального лечения, лучевую терапию, являются более ослабленными в сравнении с пациентами во второй линии терапии (табл. 1).
Клинико-анамнестические данные и лабораторные маркеры | Общее количество пациентов (n = 43) | Применение радия-223 во 2-й линии (n = 14) | Применение радия-223 в 3-й линии (n = 18) | Применение радия-223 в 4-й линии (n = 11) |
Оценка общего состояния по шкале ECOG | 1,2 ± 0,8 (0–3) | 0,9 ± 0,5 (0–2) | 1,2 ± 0,8 (0–3) | 1,8 ± 0,6 (1–3) |
Средний балл по визуальной аналоговой шкале боли (ВАШ) | 5,8 ± 1,7 (3–9) | 5,3 ± 2,0 (3–9) | 5,6 ± 1,8 (3–9) | 6,9 ± 1,6 (3–9) |
Средний уровень ПСА, медиана | 115,76 ± 276,34 (0,02–1918,00)35,4 | 173,66 ± 503,07 (0,02–1918,00) 14,35 | 47,53 ± 62,81 (0,01–208,00) 15,7 | 142,27 ± 5,35 (9,56–501,6) 51,4 |
Уровень щелочной фосфатазы, медиана | 530,48 ± 975,68 (38,6–4423,0) 112,5 | 324,83 ± 452,12 (38,6–1209,0) 94,0 | 377,72 ± 1034,70 (42,0–4423,0) 88,0 | 461,38 ± 614,70 (54,9–2116,0) 198,3 |
Уровень тестостерона, медиана | 0,64 ± 1,86 (0–92) 0,3 | 0,43 ± 0,40 (0–1,2) 0,3 | 2,11 ± 6,5 (0–1,4) 0,3 | 1,31 ± 3,56 (0–92) 0,2 |
Средний показатель гемоглобина | 125,0 ± 35,9 (39–324) | 138,3 ± 52,5 (106–324) | 118,2 ± 23,7 (39–147) | 117,6 ± 16,2 (101–146) |
Средний показатель тромбоцитов | 254,4 ± 100,5 (113–564) | 245,8 ± 78,1 (113–369) | 236,6 ± 106,3 (135–513) | 293,6 ± 116,1 (124–564) |
Средний показатель нейтрофилов, абс. значения | 4,4 ± 2,1 (1,5–10,3) | 4,1 ± 2,2 (1,5–10,3) | 3,9 ± 1,4 (2,0–6,4) | 5,5 ± 2,5 (2,0–10) |
Таблица 1. Данные пациентов при первичном отборе на радионуклидную терапию дихлоридом радия-223 для таргетного лечения мКРРПЖ
Table 1. Patient data at initial selection for radionuclide therapy with radium-223 dichloride for targeted therapy of castration-resistant prostate cancer
Перед каждым циклом терапии дихлоридом радия-223 осуществлялся комплекс диагностических процедур: 1) лабораторный мониторинг — оценка гематологических параметров, уровня ПСА, ЩФ в сыворотке крови; 2) функциональный статус — определение общего состояния пациента по шкале ECOG; 3) субъективные показатели — заполнение опросника FACT-P для оценки качества жизни и визуально-аналоговой шкалы (ВАШ) для количественной характеристики болевого синдрома. Контрольная остеосцинтиграфия выполнялась через 4–6 недель по завершении курса лечения. Динамика метастатического процесса оценивалась по степени фиксации РФП в костных структурах в процессе шести введений дихлорида радия-223 и в отсроченном периоде.
РЕЗУЛЬТАТЫ
Терапию дихлоридом радия-223 пациенты переносили удовлетворительно. Полный курс РНТ завершили 32 человека (74,4 %), что свидетельствует о хорошей переносимости препарата ослабленными пациентами. После 3–5 введений пришлось прервать курс лечения: 4 пациентам (9,3 %) в связи с висцеральным метастазированием (печень — 2 случая, легкие — 1 случай, головной мозг — 1 случай); 2 пациентам (4,7 %) после развития гематологической токсичности (на фоне применения доцетаксела в предшествующих линиях терапии), в 1 случае (2,3 %) после повышения температуры тела на 3 день после введения РФП, в 4 случаях (9,3 %) в связи ухудшением течения сопутствующего заболевания (III–IV по шкале ASA — американского общества анестезиологов) (рис. 2). У данных пациентов обращает на себя внимание исходно более высокое (в несколько раз) повышение уровня ЩФ в сравнении с пациентами, которые прошли полный курс РНТ.
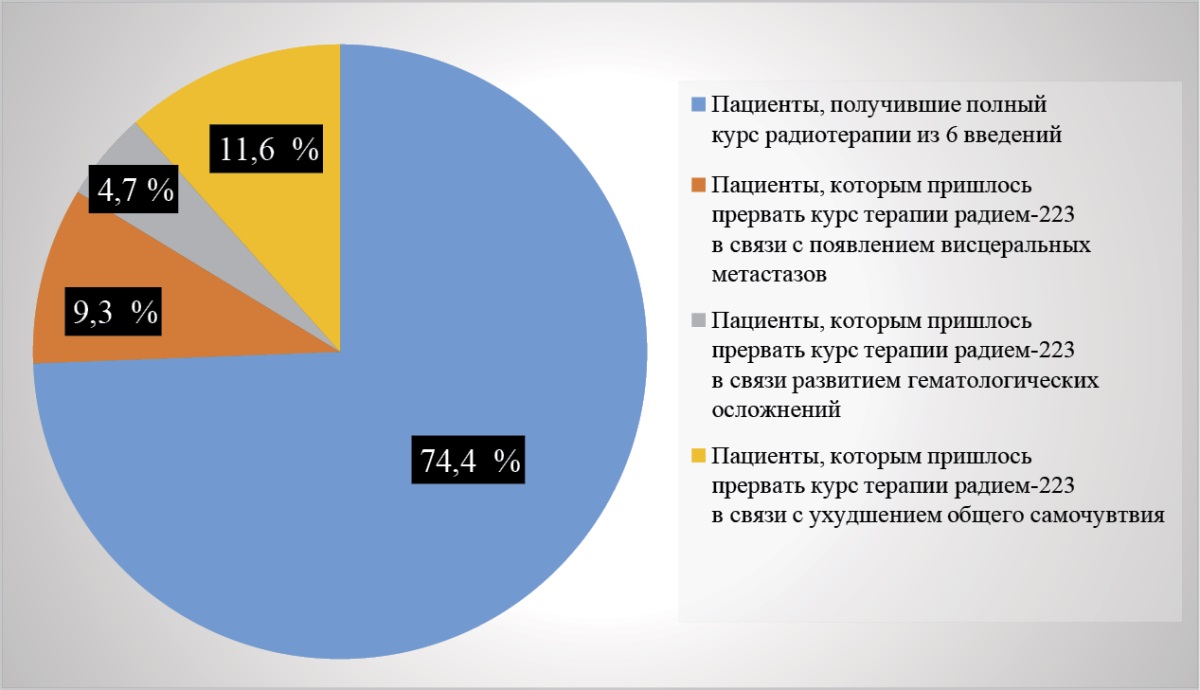
Рисунок 2. Распределение пациентов по количеству введенных инъекций дихлорида радия-223
Figure 2. Distribution of patients by the number of radium-223 dichloride injections administered
Прогрессирование заболевания определялось по повышению уровней ЩФ, ПСА, отрицательной динамике по данным общего анализа крови и биохимии в сочетании с ухудшением общего состояния и отрицательной динамикой на визуализирующих методах исследования (сцинтиграфия костей, по данным КТ/МРТ). Во всех линиях терапии был отмечен рост ПСА. При этом, поскольку дихлорид радия-223 является остеотропным альфа-эмиттером и напрямую не ингибирует продуцирование ПСА, его рост в процессе лечения не является показателем неэффективности терапии [19]. У пациентов до лечения медиана ЩФ составила 112,5 Ед/л, среднее значение (530,48 Ед/л) было искажено экстремально высокими значениями у 6 пациентов в связи с исходно высокими значениями. Медиана ЩФ после лечения снизилась на 16,4 % (со 112,5 до 94 Ед/л), что подтверждает эффективность терапии в общей группе пациентов (рис. 3).
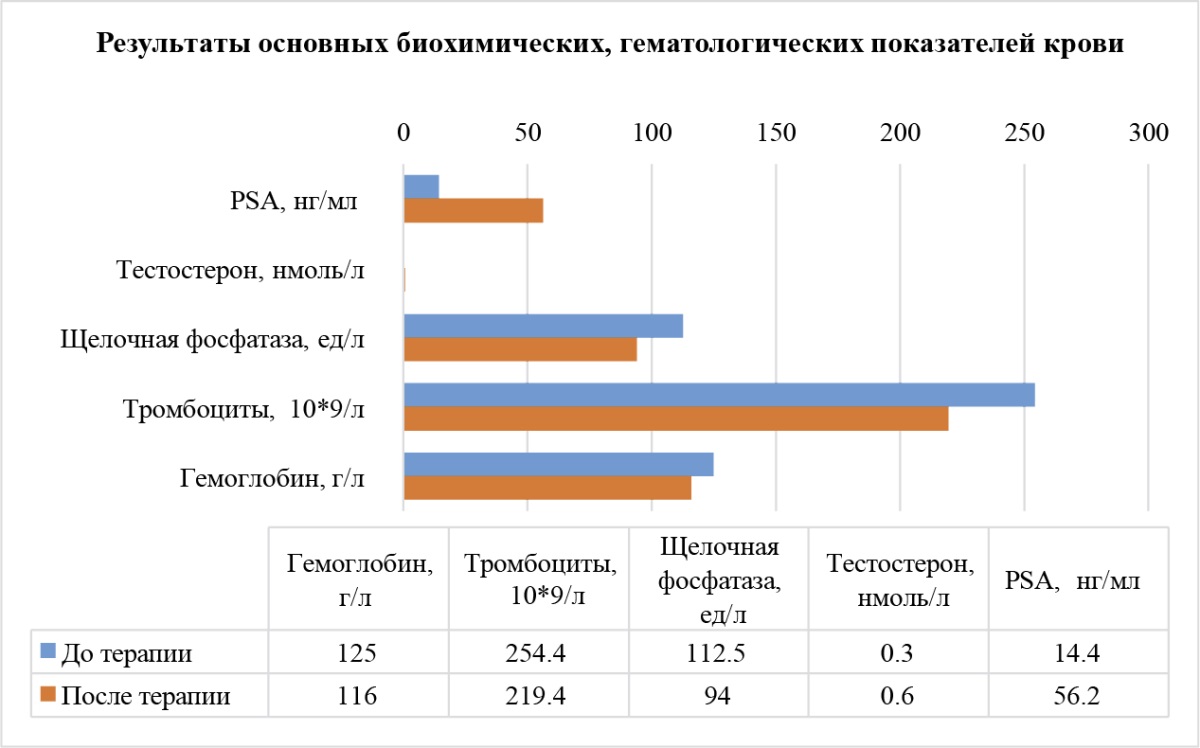
Рисунок 3. Динамика основных биохимических и гематологических показателей у пациентов до начала терапии дихлоридом радия-223 и при последнем визите
Figure 3. Dynamics of the main biochemical and hematological parameters in patients prior to the onset of radium-223 dichloride therapy and upon the latest visit
По данным остеосцинтиграфии у 8 пациентов (18,6 %) зафиксирован частичный метаболический ответ, сохраняющийся на протяжении 6–21 мес. после первого введения дихлорида радия-223. Стабилизация процесса наблюдается у 28 пациентов (65,1 %). Прогрессирование заболевания зафиксировано в 7 случаях (16,3 %), среди них во 2-й линии — у 1 пациента (2,3 %), в 3-й линии — у 3 пациентов (7 %), в 4-й линии — у 3-й пациентов (7 %). Наиболее показательная динамика наблюдалась у пациентов, имеющих менее 20 вторичных костных очагов (рис. 4).
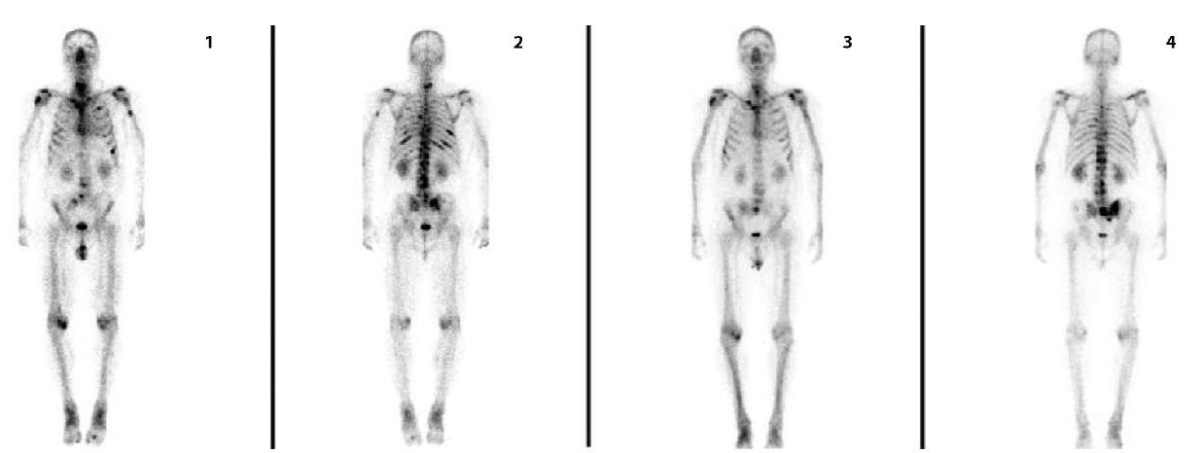
Рисунок 4. Пациент Б., 57 лет, с мКРРПЖ. По поводу метастатической ацинарной аденокарциномы (Глисон 4+3) проводилась ранее дистанционная лучевая терапия, курсы химиотерапии таксанами и гормональными препаратами с последующим развитием кастрационной резистентности. Проведен полный курс РНТ. Представлены первичные (1–2) и контрольные (3–4) сцинтиграммы: отмечается разнонаправленная динамика в виде снижения фиксации РФП в большинстве вторичных костных очагов, повышение фиксации РФП в левой подвздошной кости. В последующем было выявлено прогрессирование заболевания в виде метастазирования в регионарные лимфатические узлы — пациент в процессе терапии лютецием-177
Figure 4. Patient B., 57 years old, with castration-resistant prostate cancer. For metastatic acinar adenocarcinoma (Gleason 4+3), external beam radiation therapy, courses of chemotherapy with taxanes and hormonal drugs with subsequent development of castration resistance were previously performed. A full course of radionuclide therapy was performed. Primary (1–2) and control (3–4) scintigrams are presented: multidirectional dynamics are noted in the form of a decrease in the fixation of radiopharmaceutical agent in most secondary bone foci, an increase in the fixation of radiopharmaceutical agent in the left iliac bone. Subsequently, disease progression was detected in the form of metastasis to regional lymph nodes. The patient is undergoing lutetium-177 therapy
На сегодняшний день стабилизация заболевания по данным остеосцинтиграфии, общим и биохимическим показателям сохраняется у 27 пациентов (62,7 %), прошедших все шесть введений РФП. Снижение медианы ЩФ в общей группе пациентов на 16,4 % (тест Уилкоксона, p = 0,047) и увеличение доли пациентов с нормальным уровнем ЩФ (χ² с поправкой Йейтса, p = 0,041) подтверждают эффективность терапии. Регрессионный анализ показал, что принадлежность к группе после лечения ассоциирована со снижением ЩФ на 18,5 Ед/л (p = 0,03). Широкий межквартильный размах (62,0–183,7) отражает вариабельность ответа.
На фоне терапии дихлоридом радия-223 зафиксировано снижение интенсивности болевого синдрома, ассоциированного с остеобластическими метастазами. У 58 % пациентов (n = 25) отмечена положительная динамика, выражавшаяся в уменьшении потребности в анальгетической терапии. В подгруппе пациентов, получавших опиоидные анальгетики (n = 5, 11,6 %), также зарегистрировано статистически значимое уменьшение боли (по шкале ВАШ ≥ 2 баллов), что позволило снизить дозировку препаратов.
Медиана общей выживаемости (ОВ) среди 43 пациентов не была достигнута (максимальное время наблюдения на данный момент — 21 месяц). К концу наблюдения 68,3 % пациентов (95 % ДИ: 38,7–97,9 %) оставались живыми. Показатель общей выживаемости у пациентов во второй линии терапии составил 85,7 % к 7-му месяцу наблюдения (95 % ДИ: 63,2–100 %), сохраняясь на этом уровне до конца исследования. В третьей линии показатель составил 94,1 % (95 % ДИ: 83,2–100 %) к 7-му месяцу и снизился до 64,5 % (95 % ДИ: 38,1–90,9 %) к 19-му месяцу наблюдения. В четвертой линии терапии медиана общей выживаемости не была достигнута в течение 12 месяцев наблюдения. Через 4–21 мес. после первого введения дихлорида радия-223 от прогрессирования по основному диагнозу и сопутствующим заболеваниям смерть наступила у 9 (20,9 %) пациентов. Частота завершения лечения радием-223 в виде 6 введений РФП была выше в группе пациентов во 2-й линии (85,7 %) и 3-й линии (94,4 %) и была намного ниже в 4-й линии (27,3 %).
ОБСУЖДЕНИЕ
Полученные нами результаты применения дихлорида радия-223 сопоставимы с данными ключевых публикаций крупнейшего мирового регистра REASSURE (Radium-223 alpha Emitter Agent in Non-intervention Safety Study in mCRPC Population for Long-term Evaluation), в котором частота прерывания курса радионуклидной терапии составила до 30–40 % [20–24]. Так, в большинстве исследований прослеживается тенденция к лучшим исходам при применении дихлорида радия-223 на более ранних этапах, до значительного истощения костного мозга множественными линиями химиотерапии [25][26]. Наши результаты (особенно снижение завершения курса в группе четвертой линии и лучшая общая выживаемость во второй линии терапии) являются важным подтверждением этого клинического наблюдения в исследуемой когорте. Высокий показатель завершения курса радионуклидной терапии (74,4 %) объясняется тщательным отбором пациентов (исключение при висцеральных метастазах) и регулярным мониторингом клинических и общесоматических показателей. В четвертой линии завершение полного курса лечения составило лишь 27,3 %, что подчеркивает необходимость интеграции ПСМА-ПЭТ/КТ и молекулярно-генетического тестирования (HRR-мутации) в клиническую практику для улучшения стратификации пациентов, раннего выявления костных метастазов и оперативного включения радионуклидной терапии в алгоритмы лечения [27].
Среди пациентов в исследуемой группе особый интерес представляют случаи с наличием остеомиелита нижней челюсти (9,3 %) — фактором, требующим осторожности при назначении дихлорида радия-223 после предшествующей терапии бисфосфонатами [28]. Риски развития осложнений связаны с механизмом действия дихлорида радия-223, который вызывает гибель опухолевых клеток в костных метастазах, что при ремоделировании костной структуры может приводить к местному воспалению, создавая при определенных условиях среду для реактивации скрытой инфекции. Опираясь на данные ключевого исследования PEACE III от 2021 г., при наличии отягощенного стоматологического анамнеза проводилась индивидуализация решений для пациентов [29–31].
Снижение медианы показателей ЩФ на 16,4 % и увеличение доли пациентов с нормальной ЩФ полностью согласуются с данными в исследовании ALSYMPCA, где нормализация уровня ЩФ наблюдалась у 33 % пациентов в группе дихлорида радия-223 против 16 % в группе плацебо (p < 0,001), что подтверждает биологическую активность препарата в исследуемой когорте. Наше наблюдение о связи высокого исходного уровня ЩФ с риском прерывания терапии также согласуется с данными, что высокий базовый уровень ЩФ является негативным прогностическим фактором при мКРРПЖ и может указывать на более агрессивное заболевание [19].
Также в исследовании ALSYMPCA одним из ключевых преимуществ применения дихлорида радия-223 являлось улучшение контроля боли и снижение потребности в анальгетиках — наши данные (58 % со снижением боли) хорошо вписываются в этот контекст, подтверждая значимый паллиативный эффект препарата на практике [19].
Наблюдаемые показатели стабилизации костного процесса (62,7–65,1 %), снижения уровня ЩФ (16,4 %, p = 0,047) и улучшения контроля болевого синдрома (58,0 %) находятся в ожидаемом диапазоне, подтверждая биологическую активность и клиническую пользу препарата в рутинной практике.
ЗАКЛЮЧЕНИЕ
Важным вкладом настоящего исследования является четкая демонстрация зависимости исхода лечения от выбора дихлорида радия-223 в качестве второй линии терапии, что ассоциировано с достоверно более высокой общей выживаемостью (85,7 % в сравнении с 64,5 % в третьей линии к 19-му месяцу наблюдения) и существенно более высокой вероятностью завершения полного курса из шести введений (85,7 % во второй линии в сравнении с 27,3 % в четвертой линии). Этот результат, наряду с выявленными прогностическими факторами (количество костных очагов менее 20, исходный уровень ЩФ), подчеркивает критическую важность своевременного назначения дихлорида радия-223 в соответствии с действующими рекомендациями (RUSCO, EAU, NCCN): при отсутствии висцеральных метастазов, до развития значительной опухолевой нагрузки в костях и истощения костного мозга множественными предшествующими линиями терапии.
Установленные показатели эффективности и безопасности применения дихлорида радия-223 у 43 пациентов с мКРРПЖ на базе Клиники БГМУ демонстрируют высокую степень согласованности с данными ключевого международного исследования ALSYMPCA и крупнейшего международного регистра REASSURE при применении дихлорида радия-223 в реальной клинической практике. Приемлемый профиль безопасности препарата, даже у больных с ограниченными функциональными резервами, подтверждается большой долей пациентов (74,4 %), завершивших полный курс из шести введений РФП. Клиническая эффективность препарата проявляется в: статистически значимом снижении медианы уровня щелочной фосфатазы на 16,4 % (p = 0,047), что коррелирует с подавлением остеобластической активности; уменьшении интенсивности и редукции болевого синдрома у 58,0 % пациентов, что позитивно влияет на качество жизни больных и улучшает комплаенс.
Список литературы
1. Bray F., Laversanne M., Sung H., Ferlay J., Siegel R. L., Soerjomataram I., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229–63. DOI: 10.3322/caac.21834
2. Filho A.M., Laversanne M., Ferlay J., Colombet M., Piñeros M., Znaor A., et al. The GLOBOCAN 2022 cancer estimates: Data sources, methods, and a snapshot of the cancer burden worldwide. Int J Cancer. 2025;156(7):1336–46. DOI: 10.1002/ijc.35278
3. Каприн А.Д., Алексеев Б.Я., Матвеев В.Б., Пушкарь Д.Ю., Говоров А.В., Горбань Н.А. и др. Рак предстательной железы. Современная онкология. 2021;23(2):211–47. DOI: 10.26442/18151434.2021.2.200959
4. Национальный онкологический регистр РФ. Статистика заболеваемости раком предстательной железы в 2023 г. URL: https://oncology-registry.ru (дата обращения: 10.07.2024).
5. James N.D., Tannock I., N’Dow J., Feng F., Gillessen S., Ali S.A., et al. The Lancet Commission on prostate cancer: planning for the surge in cases. Lancet. 2024;403(10437):1683–722. DOI: 10.1016/S0140-6736(24)00651-2
6. Satcher R.L., Zhang X.H. Evolving cancer-niche interactions and therapeutic targets during bone metastasis. Nat Rev Cancer. 2022;22(2):85–101. DOI: 10.1038/s41568-021-00406-5
7. Пушкарь Д.Ю., Каприн А.Д., Важенин А.В., Алексеев Б.Я., Говоров А.В., Васильев А.О. Лечение распространенных форм рака предстательной железы. Методические рекомендации № 26. М.: АБВ-пресс; 2020.
8. de Bono J., Mateo J., Fizazi K., Saad F., Shore N., Sandhu S., et al. Olaparib for metastatic castration-resistant prostate cancer. New Engl J Med. 2020;382(22):2091–102. DOI: 10.1056/NEJMoa1911440
9. Saad F., Thiery-Vuillemin A., Wiechno P., Alekseev B., Sala N., Jones R., et al. Patient-reported outcomes with olaparib plus abiraterone versus placebo plus abiraterone for metastatic castration-resistant prostate cancer: a randomised, double-blind, phase 2 trial. Lancet Oncol. 2022;23(10):1297–307. DOI: 10.1016/S1470-2045(22)00498-3
10. Guo X., Li S. Bone metastases of prostate cancer: Molecular mechanisms, targeted diagnosis and targeted therapy (Review). Oncol Rep. 2025;53(4):46. DOI: 10.3892/or.2025.8879
11. Song H., Sgouros G. Alpha and beta radiation for theragnostics. PET Clin. 2024;19(3):307–23. DOI: 10.1016/j.cpet.2024.03.006
12. LeVee A., Lin C.Y., Posadas E., Figlin R., Bhowmick N.A., Di Vizio D., et al. Clinical utility of olaparib in the treatment of metastatic castration-resistant prostate cancer: a review of current evidence and patient selection. Onco Targets Ther. 2021;14:4819–32. DOI: 10.2147/OTT.S315170
13. O’Sullivan J.M., Carles J., Cathomas R., Gomez-Iturriaga A., Heinrich D., Kramer G., et al. Radium-223 within the evolving treatment options for metastatic castration-resistant prostate cancer: recommendations from a European expert working group. Eur Urol Oncol. 2020;3(4):455–63. DOI: 10.1016/j.euo.2019.02.007
14. Sartor O., de Bono J., Chi K.N., Fizazi K., Herrmann K., Rahbar K., et al. Lutetium-177-PSMA-617 for metastatic castration-resistant prostate cancer. New Engl J Med. 2021;385(12):1091–103. DOI: 10.1056/NEJMoa2107322
15. Hofman M.S., Emmett L., Sandhu S., Iravani A., Joshua A.M., Goh J.C., et al. [177Lu]Lu-PSMA-617 versus cabazitaxel in patients with metastatic castration-resistant prostate cancer (TheraP): a randomised, open-label, phase 2 trial. Lancet. 2021;397(10276):797–804. DOI: 10.1016/S0140-6736(21)00237-3
16. Iagaru A.H., Mittra E., Colletti P.M., Jadvar H. Bone-targeted imaging and radionuclide therapy in prostate cancer. J Nucl Med. 2016;57(Suppl 3):19S–24S. DOI: 10.2967/jnumed.115.170746
17. Носов Д.А., Волкова М.И., Гладков О.А., Карабина Е.В., Крылов В.В., Матвеев В.Б. и др. Практические рекомендации по лечению рака предстательной железы. Злокачественные опухоли. 2022;12(3s2):607–26. DOI: 10.18027/2224-5057-2022-12-3s2-607-626
18. Parker C., Finkelstein S.E., Michalski J.M., O’Sullivan J.M., Bruland O, Vogelzang N.J., et al. Efficacy and safety of radium-223 dichloride in symptomatic castration-resistant prostate cancer patients with or with out baseline opioid use from the phase 3 ALSYMPCA Trial. Eur Urol. 2016;70(5):875–83. DOI: 10.1016/j.eururo.2016.06.002
19. Вязьмин В.В., Шумилина Н.Ю., Зуков Р.А. Оптимизация критериев отбора и оценки эффективности терапии радием-223 у больных раком предстательной железы. Эффективная фармакотерапия. 2021;17(2):22–8. DOI: 10.33978/2307-3586-2021-17-2-22-28
20. Taich L., Zhao H., Stock S. R., Howard L. E., De Hoedt A. M., Terris M. K., et al. Radium-223 utilization patterns and outcomes in clinical practice. Urol Pract. 2022;9(5):405–13. DOI: 10.1097/UPJ.0000000000000316
21. George D.J., Agarwal N., Sartor O., Sternberg C.N., Tombal B., Saad F., et al. Real-world patient characteristics associated with survival of 2 years or more after radium-223 treatment for metastatic castrationresistant prostate cancer (EPIX study). Prostate Cancer Prostatic Dis. 2022;25(2):306–13. DOI: 10.1038/s41391-021-00488-0
22. Chiang P., Chiang P., Chen I.A., Chen Y.T., Wang H.J., Cheng Y.T., et al. Treatment outcomes with radium-223 in docetaxel-naïve versus docetaxel-treated metastatic castration-resistant prostate cancer patients: Real-world evidence from Taiwan. Medicine. 2023;102(5):e32671. DOI: 10.1097/MD.0000000000032671
23. Romero-Laorden N., Lorente D., de Velasco G., Lozano R., Herrera B., Puente J., et al. Prospective assessment of bone metabolism biomarkers and survival in metastatic castration-resistant prostate cancer patients treated with radium-223: The PRORADIUM study. Eur Urol Oncol. 2024;7(3):447–55. DOI: 10.1016/j.euo.2023.09.015
24. Miyoshi Y., Tsutsumi S., Yasui M., Kawahara T., Uemura K. I., Hayashi N., et al. A novel prediction model for the completion of six cycles of radium-223 treatment and survival in patients with metastatic castration-resistant prostate cancer. World J Urol. 2021;39(9):3323–8. DOI: 10.1007/s00345-021-03639-z
25. Matsumoto T., Hori Y., Shiota M., Blas L., Nakamura M., Seki N., et al. Effectiveness and safety of radium-223 dichloride in patients with castration-resistant prostate cancer and bone metastases in real-world practice: A multi-institutional study. Int J Urol. 2023;30(2):139–46. DOI: 10.1111/iju.15078
26. Stattin P., Westerberg M., Lissbrant I.F., Eriksson M.H., Kjellman A., Ullén A., et al. Real world outcomes in patients with metastatic, castration-resistant prostate cancer treated with radium-223 in routine clinical practice in Sweden. Clin Genitourin Cancer. 2023;21(1):107. e1–e9. DOI: 10.1016/j.clgc.2022.09.002
27. Hameed M.Y., Gul M., Chaudhry A., Muzaffar H., Sheikh M., Chee W., et al. From oncogenesis to theranostics: the transformative role of PSMA in prostate cancer. Cancers. 2024;16(17):3039. DOI: 10.3390/cancers16173039
28. Ahdi H.S., Wichelmann T.A., Pandravada S., Ehrenpreis E.D. Medication-induced osteonecrosis of the jaw: a review of cases from the Food and Drug Administration Adverse Event Reporting System (FAERS). BMC Pharmacol. Toxicol. 2023;24(1):15. DOI: 10.1186/s40360-023-00657-y
29. Trieu J., Chang M., Rojas V., Varada N., Cao Y., Anderson M., et al. Lower fracture rates in patients treated with radium-223, abiraterone or enzalutamide, when given concurrently with bone health agents: a real-world analysis. Clin Genitourin Cancer. 2022;20(5):399–403. DOI: 10.1016/j.clgc.2022.04.015
30. McDermott R.S., Greene J., McCaffrey J., Parker I., Helanova S., Baird A.M., et al. Radium-223 in combination with enzalutamide in metastatic castration-resistant prostate cancer: a multi-centre, phase II open-label study. Ther Adv Med Oncol. 2021;13:17588359211042691. DOI: 10.1177/17588359211042691
31. Reis G., Dos Santos Moreira-Silva E.A., Silva D.C.M., Thabane L., Milagres A.C., Ferreira T.S., et al. Effect of early treatment with fluvoxamine on risk of emergency care and hospitalisation among patients with COVID-19: the TOGETHER randomised, platform clinical trial. Lancet Glob Health. 2022;10(1):e42–51. DOI: 10.1016/S2214-109X(21)00448-4
Об авторах
В. Н. ПавловРоссия
Павлов Валентин Николаевич — д.м.н., профессор, академик РАН, кафедра урологии и онкологии
Республика Башкортостан, Уфа
Д. Э. Байков
Россия
Байков Денис Энверович — д.м.н, профессор, кафедра общей хирургии, трансплантологии и лучевой диагностики
Республика Башкортостан, Уфа
А. Ф. Иткулов
Россия
Иткулов Артур Фиргатович — специализированный консультативно-диагностический центр
Республика Башкортостан, Уфа
А. Ш. Кагарманова
Россия
Кагарманова Альфия Шавкатовна — лаборатория радионуклидной диагностики
Республика Башкортостан, Уфа
А. А. Антипина
Россия
Антипина Алина Андреевна — лаборатория радионуклидной диагностики
Республика Башкортостан, Уфа
Р. Р. Гильметдинов
Россия
Гильметдинов Руслан Рафаэлевич — лаборатория радионуклидной диагностики
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Павлов В.Н., Байков Д.Э., Иткулов А.Ф., Кагарманова А.Ш., Антипина А.А., Гильметдинов Р.Р. Элемент Кюри: опыт применения радия-223 у пациентов с костными метастазами при кастрационно-резистентном раке предстательной железы. Креативная хирургия и онкология. 2025;15(3):211-219. https://doi.org/10.24060/2076-3093-2025-15-3-211-219
For citation:
Pavlov V.N., Baikov D.E., Itkulov A.F., Kagarmanova A.Sh., Antipina A.A., Gilmetdinov R.R. Curie Element: Experience of Radium-223 Use in Patients With Bone Metastases in Castration-Resistant Prostate Cancer. Creative surgery and oncology. 2025;15(3):211-219. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-3-211-219


































