Перейти к:
Управление рисками при операциях на лимфатическом аппарате у пациентов маммологического профиля
https://doi.org/10.24060/2076-3093-2025-15-3-220-227
Аннотация
Введение. Хирургическое стадирование — обязательный атрибут лечения рака молочной железы. Для исключения или подтверждения метастатического поражения лимфоколлекторов может использоваться биопсия сигнального лимфатического узла. Несмотря на малую инвазивность вмешательства, хирурги продолжают сталкиваться с нежелательными событиями в послеоперационном периоде. Цель исследования: рассмотреть возможности снижения риска послеоперационных осложнений при проведении малоинвазивных вмешательств на лимфатическом аппарате. Материалы и методы. Нами проанализирована медицинская документация 114 пациентов, которые перенесли биопсию сигнального лимфатического узла. Оценена частота послеоперационных осложнений у пациентов в группах с сортировкой по количеству удаленных лимфатических узлов. Основываясь на опыте борьбы с лимфореей, сформирована группа из 28 пациентов, которым биопсия сигнального лимфатического узла выполнялась с использованием оптического усиления, методики двойной коагуляции, и дополнена щадящими принципами электрохирургического пособия. Результаты и обсуждение. Уменьшение количества удаляемых узлов снижало вероятность осложнений, в том числе сером. При разделении пациентов на подгруппы в зависимости от количества удаляемых лимфатических узлов выявлены случаи метастатического поражения большего количества коллекторов, чем разрешающая способность метода. С учетом полученных данных постановка вопроса об отказе от проведения лимфодиссекции в случае выявления метастатического поражения сигнального лимфатического узла делает необходимым удаление минимум двух лимфатических узлов, оптимальным числом следует считать три удаленных лимфатических узла. Оперативные вмешательства, в соответствии с этими принципами, а также соблюдением вышеописанных методик, были сопряжены с меньшими рисками осложнений. Заключение. Разработка новых технических решений в хирургической практике открывает широкие перспективы для улучшения качества жизни больных. Однако деэскалация хирургического лечения обязана быть последовательной и безопасной. В противном случае все преимущества хорошо выполненной операции нивелируются чрезмерным онкологическим риском.
Ключевые слова
Для цитирования:
Букин Э.М., Малашенко В.Н., Рыбачков В.В., Васин А.Б., Голощапова Н.С., Рощин И.Н., Акимова А.К. Управление рисками при операциях на лимфатическом аппарате у пациентов маммологического профиля. Креативная хирургия и онкология. 2025;15(3):220-227. https://doi.org/10.24060/2076-3093-2025-15-3-220-227
For citation:
Bukin E.M., Malashenko V.N., Rybachkov V.V., Vasin A.B., Goloshchapova N.S., Roschin I.N., Akimova A.E. The Managing of Lymphatic Surgery Risks in Breast Cancer Patients. Creative surgery and oncology. 2025;15(3):220-227. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-3-220-227
ВВЕДЕНИЕ
Поступательная деэскалация хирургической тактики при лечении рака молочной железы — тенденция, которая прослеживается в большинстве научных изысканий современности [1]. Сложность каждого такого шага обусловлена обеспокоенностью об онкологической безопасности. На другой чаше весов необходимость заботы о социализации пациента после проведенного вмешательств, и значимость второго пункта увеличивается год от года [2][3].
Хирургическое стадирование — обязательный атрибут лечения рака молочной железы [4]. С учетом спектра возможных осложнений, а также множества работ, доказывающих онкологическую целесообразность, лучшим выбором для исключения или подтверждения метастатического поражения лимфатических узлов является биопсия сигнального лимфатического узла (БСЛУ) [5]. Методика продемонстрировала высокие показатели чувствительности и специфичности. Безопасность выполнения операций подтверждается более чем тридцатилетним опытом использования. Однако детальное рассмотрение рекомендаций по выполнению, оставляет открытыми вопросы о том, какие именно лимфатические узлы считать сигнальными? Зависит ли чувствительность от количества удаленных узлов? Когда биопсия сигнального лимфатического узла превращается в завершенную аксиллярную лимфаденэктомию (АЛД)? Унифицированная схема вмешательства не подразумевает ответы на эти вопросы, что влечет, в том числе, онкологические риски.
Существуют исследования, которые описывают случаи раннего рецидива заболевания в подмышечных лимфатических узлах после выполнения биопсии сигнального лимфатического узла. Наиболее вероятные причины подобного исхода: недостаточный объем диссекции и низкое качество предоперационной оценки состояния лимфоколлектора. Анализ первого пункта затрудняет тот факт, что разные по объему вмешательства имеют одно и то же номенклатурное название. На наш взгляд, важно четко понимать, какие объемы лечения относятся к радикальной программе, и следовать наиболее целесообразному, с точки зрения выгоды для пациента, плану операции.
Второй пункт вероятных неудач биопсии сигнального лимфатического узла требует более подробного обсуждения. Существуют работы, посвященные полному отказу от проведения операций на лимфатическом аппарате в пользу контроля неинвазивными методиками обследования. Основной их постулат говорит о том, что у пациентов из группы низкого риска рецидива отказ от хирургического вмешательства не приведет к результатам худшим, чем проведение биопсии сигнального лимфатического узла в этой группе. Действительно, подобный подход при его реализации мог бы сократить хирургическую агрессию у пациентов с раком молочной железы. Однако в настоящее время исследования не достигли конечной точки анализа профиля безопасности [6]. При детальном изучении литературных источников мы сталкиваемся с уже давно существующими исследованиями, посвященными отказу от лимфаденэктомии в пользу наблюдения у пациентов из старшей возрастной группы с гормонопозитивными опухолями низкой пролиферативной активности. Камнем преткновения в подобных работах становится их реализация в стационарах вне рамок клинических испытаний. По данным исследования, проведенного на базе Ярославской областной онкологической больницы, более 16 % пациентов с клинической первой и второй стадией, отсутствием поражения лимфатических узлов и условно благоприятным иммуногистохимическим подтипом опухоли впоследствии сталкивались с рестадированием за счет метастатического поражения лимфатических узлов. При этом каждая пятая пациентка имела опухоль молочной железы менее 1,5 см. Связано это в первую очередь с тем, что ультразвуковое исследование обладает высокой чувствительностью при достаточно крупном размере метастатического поражения, притом эта цифра сильно коррелирует с квалификацией врача-диагноста. К примеру, у пациентов со злокачественными опухолями люминального типа «А» метастазы в лимфатических узлах долгое время могут находиться вне диагностического окна ультразвуковых методик. Иными словами, для отказа от вмешательств на подмышечной области требуется быть уверенными в точности предоперационного обследования. В настоящее время использование только ультразвуковой диагностики нельзя назвать достаточно безопасной альтернативой биопсии сигнального лимфатического узла.
Практика двойного прочтения маммограмм давно зарекомендовала себя как методика выбора при оценке состояния молочных желез. Наличие задокументированного исследования, с содержанием которого может ознакомиться любой специалист, увеличивает его точность и позволяет проводить «работу над ошибками». Магнитно-резонансная томография (МРТ) и позитронно-эмиссионная компьютерная томография (ПЭТ-КТ) — методы, которые показывают высокую разрешающую способность при диагностике поражения лимфоколлектора. При необходимости результаты обследования могут быть проверены референсными центрами с получением заключения, отвечающего всем стандартам онкологической целесообразности. В современных работах авторы сообщают о способности выявления метастатического поражения лимфатических узлов, не превышающего 5,2 мм, с точностью для ПЭТ-КТ — 88,6 %, МРТ — 95,7 %, ПЭТ-КТ и МРТ совместно 96,1 % [7]. Обратная сторона медали связана с тем, что указанная тактика оставляет нерешенными вопросы доступности и экономической целесообразности. Время ожидания исследований при их назначении может сыграть отрицательную прогностическую роль в судьбе пациента. Рак молочной железы — это нозология с лидирующей позицией заболеваемости у женщин, что обуславливает большой поток пациентов. Для отказа от операций на лимфатическом аппарате в пользу проведения МРТ и ПЭТ-КТ требуются запредельные мощности диагностической службы, и на сегодняшний день подобная тактика выглядит неправдоподобной.
Подавляющее число исследований посвящено сравнению биопсии сигнального лимфатического узла с классической лимфаденэктомией уровня D2 [8][9]. Несмотря на большую разницу в количестве осложнений при сравнении методик, хирурги продолжают сталкиваться с нежелательными событиями в послеоперационном периоде вне зависимости от выбранного подхода [10][11]. Развитие осложнений в значительной степени влияет на экономические затраты на лечение и реабилитацию пациентов. При проведении лимфодиссекция уровня D2 патогенез большинства нежелательных явлений изучен в достаточной степени. Развитие лимфедемы сопряжено в первую очередь с самим фактом удаления узлов, отвечающих за отведение лимфы, в том числе от верхней конечности. Взаимопотенцирующие постмастэктомический и Web-синдромы имеют прямую взаимосвязь с повреждением нервного волокна, залегающего в толще клетчатки. Агрессивная хирургическая техника при невозможности реабилитационных мероприятий вследствие первичного отека, болевого синдрома и парестезии приводит к формированию фиброзно измененных участков мягких тканей, резко ограничивающих подвижность верхней конечности.
Выполнение биопсии сигнального лимфатического узла при должной подготовке хирурга редко приводит к большой операционной травме и не подразумевает удаление «случайных» узлов, сопряженных с системой верхней конечности. Возникающие же осложнения по своему профилю мало отличаются от стандартной лимфаденэктомии, что свидетельствует о существовании схожих звеньев в патогенезе их развития. Лимфорея и формирование сером послеоперационной раны являются неразлучными спутниками вмешательств на молочной железе у пациентов со злокачественными опухолями этой локализации. Многие специалисты не рассматривают это явление как осложнение в связи с тем, что той или иной степени выраженности истечение лимфы возникает у подавляющего числа пациентов. Однако множество научных работ, посвященных этой тематике, говорят о прямой ее взаимосвязи с риском развития лимфедемы верхней конечности и постмастэктомического синдрома. Особо часто с подобными неблагоприятными последствиями операций сталкиваются пациенты из групп риска. Большое количество сопутствующих заболеваний, изменения в реологических свойствах крови, влияние опухоли на свертывающую систему могут резко усилить отрицательный потенциал лимфореи. Небольшой объем вмешательства в таком случае теряет свой протективный эффект и требует дополнительной профилактики возникновения осложнений.
Цель исследования: рассмотреть возможности снижения риска послеоперационных осложнений при проведении малоинвазивных вмешательств на лимфатическом аппарате.
МАТЕРИАЛЫ И МЕТОДЫ
Нами была проанализирована медицинская документация 114 пациенток, которые перенесли БСЛУ в качестве первого этапа лечения рака молочной железы в период с 2021 по 2022 год. Статистические подсчеты выполнены в программе Statistica 10. Пациентки были разделены на группы в зависимости от количества удаленных лимфатических узлов. Группа А — 1 удаленный лимфатический узел (15 пациенток), группа В — 2 удаленных лимфатических узла (40 пациенток), группа С — 3 удаленных лимфатических узла (54 пациентки), группа D — 4 и более удаленных лимфатических узлов (5 пациенток). В группе А было выявлено метастатическое поражение лимфатических узлов у 3 пациенток (подгруппа А1), в 2 случаях выполнена завершающая лимфаденэктомия уровня D2 в соответствии с клиническими рекомендациями. По данным гистологического заключения: в одном случае выявлено метастатическое поражение 5 лимфатических узлов. В группе В метастатическое поражение 1 лимфатического узла определялось в 3 случаях (подгруппа В1), после выполнения завершающей лимфаденкэтомии у одной пациентки выявлено поражение в 1 лимфатическом узле. Метастатическое поражение 2 сигнальных лимфатических узлов (подгруппа В2) определялось в 2 случаях, после выполнения завершающей лимфаденкэтомии, по данным гистологического заключения, в одном случае был выявлен дополнительно 1 метастатически пораженный лимфатический узел. В группе С метастатическое поражение 1 сигнального лимфатического узла определялось у 3 пациенток (подгруппа С1), 2 сигнальных лимфатических узлов у 3 пациенток (подгруппа С2). Всем пациенткам с метастатическим поражением выполнена завершающая лимфаденэктомия. При анализе историй болезни подгруппы С1 — у одной пациентки в удаленной клетчатке обнаружено 2 лимфатических узла с метастатическим поражением, у остальных пациенток — без метастатического поражения. В подгруппе С2 — в удаленной клетчатке без метастатического поражения. В группе D не было выявлено пораженных лимфатических узлов (табл. 1).
Количество удаленных сигнальных л/у | Всего пациенток 114 | |||||||||||
1 СЛУ (гр А) | 2 СЛУ (гр B) | 3 СЛУ (гр С) | 4 СЛУ (гр D) | |||||||||
Метастатическое поражение | Без МТС | Удалены при БСЛУ | Удалены после АЛД | Без МТС | Удалены при БСЛУ | Удалены после АЛД | Без МТС | Удалены при БСЛУ | Удалены после АЛД | Без МТС | Удалены при БСЛУ | Удалены после АЛД |
Пациентки | 12 | 2 | 1 | 35 | 3 | 2 | 50 | 3 | 1 | 5 | 0 | 0 |
Таблица 1. Разделение пациенток по группам в зависимости от объема лимфодиссекции
Table 1. Division of patients into groups depending on the volume of lymph node dissection
Примечание: МТС — метастазы, БСЛУ — биопсия сигнального лимфатического узла, АЛД — аксиллярная лимфаденэктомия.
Note: MTS — metastasis, SLNB — sentinel lymph node biopsy, ALD — axillary lymphadenectomy.
Из таблицы видно, что недостаточная по объему биопсия сигнальных лимфатических узлов при отказе от полноценной лимфодиссекции может повлечь снижение онкологической безопасности в связи с возможностью наличия неудаленных метастазов.
Для снижения частоты возможных осложнений нами рассмотрены способы борьбы с формированием послеоперационных сером как самого частого нежелательного явления [12–14]. А также рассмотрены возможности для уменьшения вероятности возникновения лимфедемы верхней конечности в послеоперационном периоде [15]. Основываясь на опыте борьбы с лимфореей с использований приборов для оптического увеличения и методик пломбирования лимфатических сосудов у пациенток при выполнении подмышечной лимфаденэктомии, сформирована проспективная группа из 28 пациенток, которым в период с января по сентябрь 2024 г. выполнена БСЛУ [16]. Совместно с этим все пациентки прошли одномоментную органосохранную операцию на молочной железе.
Из исследования исключены пациентки, которым объем вмешательства был расширен до подмышечной лимфаденэктомии. Интраоперационно лимфатические узлы выделялись с использованием бинокулярного увеличения электрохирургическим методом строго с соблюдением ограничения выходной мощности не более 30 Вт. При этом выделенные лимфатические сосуды подвергались пломбированию методикой двойной коагуляции. Объем диссекции во всех случаях был не менее двух (группа E — 11 пациенток) и не превышал трех лимфатических узлов (группа F — 17 пациенток). Сигнальные лимфатические узлы определялись радиоизотопным методом. При наличии данных о накоплении радиофармпрепарата только в двух сигнальных лимфатических узлах интраоперационно проводилась пальпация зон лимфооттока [17]. Пальпируемые интраоперационно плотные лимфатические узлы были показанием к их удалению и переводу пациенток из группы «E» в группу «F». Для уточнения взаимосвязей с лимфатическими сосудами области верхней конечности использовался визуальный осмотр с оптическим усилением клетчатки с лимфатическими узлами. При получении данных о возможной принадлежности лимфатического узла к коллекторам верхней конечности — от его биопсии отказывались [18].
РЕЗУЛЬТАТЫ
При разделении пациенток на подгруппы в зависимости от количества пораженных лимфатических узлов во время выполнении БСЛУ выявлены случаи метастатического поражения большего количества коллекторов, чем существующая разрешающая способность метода. Чувствительность методики зависела от количества первично резецированных лимфатических узлов.
Количество пациенток с поражением не менее 1 лимфатического узла — 14 человек, что составляет 15 % от выборки (сумма всех пациенток подгрупп А1, В1, В2, С1, С2), не менее 2 лимфатических узлов — 7 человек — 7,98 % (1 пациентка подгруппы А1, 1 пациентка подгруппы В1, 2 пациентки подгруппы В2 и 3 пациентки подгруппы С2), не менее 3 лимфатических узлов — 3 человека — 3,42 % (1 пациентка подгруппы А1, 1 — подгруппы В2, 1 — подгруппы С1), более 4 лимфатических узлов — 1 человек — 1,14 % (пациентка подгруппы А1).
В 7,9 % от общей выборки операция по удалению лишь одного сигнального лимфатического узла (группа А) остается нерадикальной ввиду сохранения метастатического поражения других лимфоколлекторов. При сравнении вероятности нерадикального лечения в группах А и С мы получили статистически значимое отличие (метод хи-квадрат, p = 0,037). Стоит заметить, что достоверных различий в группах А и В не было получено (метод хи-квадрат, p = 0,21), равно как и в группах В и С (метод хи-квадрат, p = 0,321). Статистические отличия между группами С и D отсутствовали полностью (метод хи-квадрат, p = 1) (рис. 1).
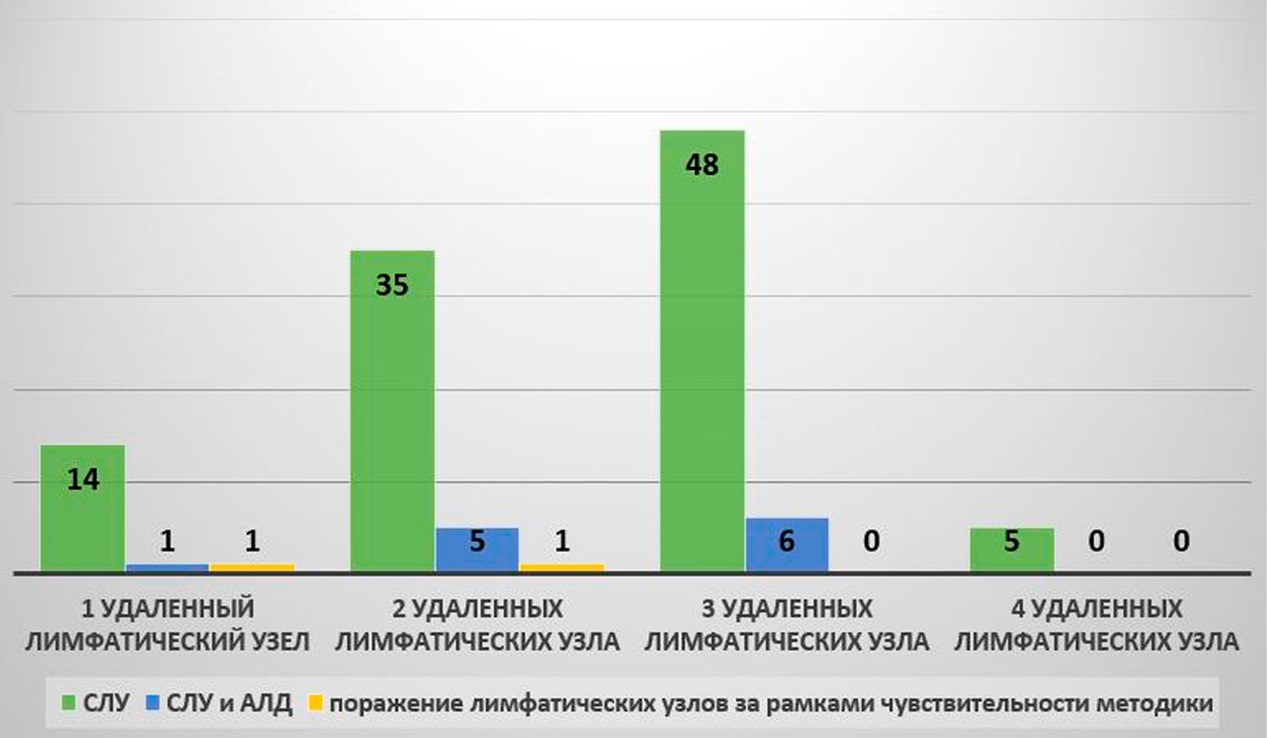
Рисунок 1. Количество пораженных лимфатических узлов в подгруппах
Figure 1. Number of affected lymph nodes in subgroups
Анализ послеоперационных осложнений в подгруппах показал, что наиболее частым нежелательным явлением была серома послеоперационной раны, что потребовало проведения пункций, а в 30 % случаев — назначения антибактериальной терапии, что соответствует 1 ст. по Clavien — Dindo. Количество осложнений в группах росло в зависимости от количества удаленных лимфатических узлов. В группе А — 1 человек (6 %), в группе В — 7 человек (17,5 %), в группе С — 12 человек (22 %), в группе D — 4 человека (80 %). Коэффициент корреляции Спирмена статистически значим, степень корреляции признака умеренно положительная (rs = 0,469) Кроме того, часть пациенток отметила возникновение парестезий в области задней поверхности плеча, а также онемение боковой поверхности грудной стенки: группа С — 2 человека, группа D — 1 человек. Сроки госпитализации также зависели от наличия осложнений.
В отдаленном периоде в группе D выявлен 1 случай развития лимфедемы верхней конечности 1 ст. В группе исследования отмечалось значительное снижение количества послеоперационных сером. Необходимость проведения пункционной эвакуации возникла в 1 случае в группе F, что составляет 3,5 % от общего числа группы и 5,8 % от числа пациенток группы F. При сравнении с эквивалентными по количеству удаленных лимфатических узлов группами контроля (группы B и С) инструментом хи-квадрат различия признаны статистически значимыми (p = 0,0475). При этом повторные манипуляции в исследуемой группе не потребовались. Признаки развития постмастэктомического синдрома отсутствовали (рис. 2).

Рисунок 2. Анализ течения послеоперационного периода
Figure 2. Analysis of the course of the postoperative period
ОБСУЖДЕНИЕ
Анализ литературы показывает, что среди осложнений на ранних сроках послеоперационного периода после проведения БСЛУ наибольший процент составляет серома послеоперационной раны. Также значимую роль играют присоединение инфекции, нарушение кожной чувствительности задней поверхности плеча и предплечья, болевой синдром, ограничение подвижности в плечевом суставе [19–21]. В позднем периоде наибольший дискомфорт пациентам доставляет лимфедема верхней конечности [22]. При этом утверждение, что отказ от классической аксиллярной лимфаденэктомии значительно уменьшает ее вероятность, является доказанным и не требует проверки. Сравнение профиля осложнений показывает, что в среднем частота лимфедемы при уменьшении объемов вмешательства сокращается в 3–4 раза, проявления постмастэктомического и WEB-синдромов — в 3 раза. Однако проведение БСЛУ не исключает их развития [23].
Для снижения рисков следует ограничить хирургическую агрессию при проведении вмешательства [24]. Подобная практика требует оценки онкологической целесообразности. В предоперационный период мы должны исключить вероятность поражения лимфатических узлов, пользуясь дополнительными методами визуализации. С учетом времени, отведенного для обследования пациентов, а также сложности подготовки специалистов мультиинструменталов, сделать это в современных реалиях достаточно сложно. Что касается самой операции: в клинических рекомендациях информация о необходимом объеме диссекции отсутствует. Данные литературы также противоречивы. Существуют исследования, результаты которых говорят об отсутствии отличий в показателях выживаемости без прогрессирования вне зависимости от количества удаляемых лимфатических узлов [25]. Однако при сравнении количества метастатически пораженных лимфатических узлов после проведения БСЛУ, дополненной аксилярной лимфодиссекцией, мы видим, что размер «окна» радикально выполненного вмешательства тем шире, чем больше количество удаленных во время первичной операции лимфатических узлов. Различия между результатами описательной и аналитической статистик мы связываем с возможно малым числом наблюдений. Как итог, с учетом полученных данных, постановка вопроса об отказе от проведения лимфодиссекции у пациента в случае выявления метастатического поражения сигнального лимфатического узла делает необходимым удаление не менее двух лимфатических узлов, оптимальным числом следует считать три удаленных лимфатических узла. Дальнейшее расширение объемов диссекции при проведении БСЛУ мы считаем нецелесообразным в связи с ростом числа осложнений и отсутствием диагностической ценности.
Кроме того, в соответствии с полученными нами результатами логичным является заключение, что уменьшение количества удаляемых узлов снижает вероятность возникновения осложнений. Специалисты сообщают о перспективах развития картирования лимфатической системы верхней конечности с определением регионарных точек лимфооттока в подмышечной впадине [26][27]. Методика позволяет увеличить точность забора материала, а также выполнить единовременные реконструктивные вмешательства [28][29]. Другая сторона медали — значительное увеличение сложности, трудоемкости и стоимости: оставляют мало возможностей для проведения подобного исследования на ежедневной основе [30]. Визуальная оценка с оптическим усилением не требует затрат и может помочь в принятии решения о таргетной биопсии лимфатических узлов. Отказ же от удаления лимфатических узлов, связанных с лимфатической системой верхней конечности, вероятно, снизит частоту развития лимфедем. Однако анализ отдаленных осложнений требует большего времени для оценки.
ЗАКЛЮЧЕНИЕ
Борьба за социализацию пациентов онкологического профиля — предмет внимания каждого специалиста. Отсутствие сложностей в лечении увеличивает его комплаентность и улучшает прогноз. Разработка новых технических решений в хирургии лимфоколлекторов открывает широкие перспективы для улучшения качества жизни больных. Однако зачастую высокотехнологичная операция оказывается затратной как в плане расходного материала, так и в плане человеческих ресурсов, что сильно влияет на снижение вероятности ее применения в рутинной практике. Использование современного электрохирургического оборудования в сочетании с оптическим усилением позволяет не только снизить риск осложнений, но и не приводит к увеличению затрат на лечение. При этом простота воспроизведения методики сокращает кривую обучения и позволяет использовать ее на постоянной основе в условиях специализированного стационара.
Другой возможный путь влияния на нежелательные явления в послеоперационном периоде — снижение хирургической агрессии. Гипотеза о том, что уменьшение объемов вмешательства положительно сказывается на риске осложнений — доказана и логична. Практикующие хирурги небезосновательно полагают, что отсутствие дополнительных переменных в «уравнении» лечения положительно сказывается на его результатах, но не всегда самый простой путь является приемлемым. Из проведенного исследования мы увидели, что уменьшение объемов операции в определенных пределах влияет на чувствительность методики и меняет ее изначальный профиль безопасности. Таким образом, деэскалация хирургического лечения обязана быть последовательной и подкрепляться усилением в диагностической работе диспансерно-поликлинического звена. В противном случае все преимущества хорошо выполненной операции нивелируются чрезмерным онкологическим риском.
Список литературы
1. Семиглазов В.Ф., Криворотько П.В., Жильцова Е.К., Канаев С.В., Труфанова Е.С., Крживицкий П.И. и др. Двадцатилетний опыт изучения биопсии сигнальных лимфатических узлов при раке молочной железы. Опухоли женской репродуктивной системы. 2020;16(1):12–20. DOI: 10.17650/1994-4098-2020-16-1-12-20
2. Zomkowski K., Wittkopf P.G., Baungarten Hugen Back B., Bergmann A., Dias M., Sperandio F.F. Pain characteristics and quality of life of breast cancer survivors that return and do not return to work: an exploratory cross-sectional study. Disabil Rehabil. 2021;43(26):3821–6. DOI: 10.1080/09638288.2020.1759150
3. Lau K., Patel S., Rogers K., Smith S., Riba M. Cancer-related lymphedema and psychological distress. Curr Psychiatry Rep. 2024;26(11):635– 42. DOI: 10.1007/s11920-024-01543-y
4. Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.) Злокачественные новообразования в России в 2021 году (заболеваемость и смертность). М.; 2022.
5. Xiang J., Huang S., Tuo Y., Wang Y. Effect of breast-conserving surgery combined with sentinel lymph node biopsy and axillary preservation on the recurrence, metastasis, complications and cosmetic results of early breast cancer patients. Gland Surg. 2020;9(4):1019–25. DOI: 10.21037/gs-20-584
6. Gentilini O.D., Botteri E., Sangalli C., Galimberti V., Porpiglia M., Agresti R., et al. Sentinel lymph node biopsy vs no axillary surgery in patients with small breast cancer and negative results on ultrasonography of axillary lymph nodes: the SOUND randomized clinical trial. JAMA Oncol. 2023;9(11):1557–64. DOI: 10.1001/jamaoncol.2023.3759
7. Sae-Lim C., Wu W.P., Chang M.C., Lai H.W., Chen S.T., Chou C.T., et al. Reliability of predicting low-burden (≤2) positive axillary lymph nodes indicating sentinel lymph node biopsy in primary operable breast cancer — a retrospective comparative study with PET/CT and breast MRI. World J Surg Oncol. 2024;22(1):12. DOI: 10.1186/s12957-023-03297-y
8. Huang Y.Y., Toh P.Y., Hunt C., Lin J.T.W., Kamyab R., Ponniah A.K. Breast cancer treatment-related arm lymphoedema and morbidity: A 6-year experience in an Australian tertiary breast centre. Asia Pac J Clin Oncol. 2022;18(1):109–17. DOI: 10.1111/ajco.13523
9. Mathias B.J., Sun J., Sun W., Zhou J.M., Fulp W.J., Laronga C., et al. Surgeon bias in the management of positive sentinel lymph nodes. Clin Breast Cancer. 2021;21(1):74–79. DOI: 10.1016/j.clbc.2020.07.010
10. Spiekerman van Weezelenburg M.A., Bakens M.J.A.M., Daemen J.H.T., Aldenhoven L., van Haaren E.R.M., Janssen A., et al. Prevention of seroma formation and its sequelae after axillary lymph node dissection: an up-to-date systematic review and guideline for surgeons. Ann Surg Oncol. 2024;31(3):1643–52. DOI: 10.1245/s10434-023-14631-9
11. Letellier M.E., Ibrahim M., Towers A., Chaput G. Incidence of lymphedema related to various cancers. Med Oncol. 2024;41(10):245. DOI: 10.1007/s12032-024-02441-2
12. Gupta S., Gupta N., Kadayaprath G., Neha S. Use of sentinel lymph node biopsy and early physiotherapy to reduce incidence of lymphedema after breast cancer surgery: an institutional experience. Indian J Surg Oncol. 2020;11(1):15–8. DOI: 10.1007/s13193-019-01030-4
13. Slavu I.M., Tulin A., Filipoiu F., Dogaru A., Munteanu O., Anca Monica O.M., et al. Axillary lymphadenectomy: safe dissection through a correct technique. Cureus. 2024 Jan 17;16(1):e52434. DOI: 10.7759/cureus.52434
14. Богданов А.В., Куракина И.С., Нохрин Д.Ю. Профилактика длительной и обильной лимфореи при раке молочной железы. Онкология. Журнал им. П.А. Герцена. 2020;9(3):34–40. DOI: 10.17116/onkolog2020903134
15. Li H., Li W.B., Sun Z.X., Yu J., Lv P.Y., Li C.X., et al. Analysis of the risk factors of breast cancer-related lymphedema and construction and evaluation of a prediction model. Lymphat Res Biol. 2023;21(6):565– 73. DOI: 10.1089/lrb.2022.0058
16. Navarro A.S., Ciurcur E., Gangloff D., Jouve E., Lusque A., Meresse T. Axillary node dissection in outpatient procedure, is it feasible and safe? J Gynecol Obstet Hum Reprod. 2021;50(5):101931. DOI: 10.1016/j.jogoh.2020.101931
17. Noguchi M., Morioka E., Noguchi M., Inokuchi M., Kurose N., Shioya A., et al. The role of axillary reverse mapping in intraoperative nodal palpation during sentinel lymph node biopsy. Breast J. 2021;27(8):651–6. DOI: 10.1111/tbj.14260
18. Жукова Л.Г., Андреева Ю.Ю., Завалишина Л.Э., Закиряходжаев А.Д., Королева И.Р., Назаренко А.В. и др. (сост.) Рак молочной железы: Клинические рекомендации. М.; 2021.
19. Jørgensen M.G., Toyserkani N.M., Thomsen J.B., Sørensen J.A. Surgical-site infection following lymph node excision indicates susceptibility for lymphedema: A retrospective cohort study of malignant melanoma patients. J Plast Reconstr Aesthet Surg. 2018;71(4):590–6. DOI: 10.1016/j.bjps.2017.11.026
20. Marco E., Trépanier G., Chang E., Mauti E., Jones J.M., Zhong T. Postmastectomy functional impairments. Curr Oncol Rep. 2023;25(12):1445–53. DOI: 10.1007/s11912-023-01474-6
21. Melhem J., Amarin M., Odeh G., Al-Bustami N., Al-Lauzy H., Ayoub R. Intercostobrachial nerve (ICBN) preservation versus sacrifice in axillary dissection: randomized controlled Trial. Am J Clin Oncol. 2021;44(5):206–9. DOI: 10.1097/COC.0000000000000809
22. Johnson A.R., Kimball S., Epstein S., Recht A., Lin S.J., Lee B.T., et al. Lymphedema incidence after axillary lymph node dissection: quantifying the impact of radiation and the lymphatic microsurgical preventive healing approach. Ann Plast Surg. 2019;82(4S Suppl 3):S234–41. DOI: 10.1097/SAP.0000000000001864
23. Isik A., Soran A., Grasi A., Barry N., Sezgin E. Lymphedema after sentinel lymph node biopsy: Who is at risk? Lymphat Res Biol. 2022;20(2):160–3. DOI: 10.1089/lrb.2020.0093
24. Brunelle C.L., Jackson K., Shallwani S.M., Hunley J.H., Kennedy A., Fench S., et al. Evidence-based recommendations regarding risk reduction practices for people at risk of or with breast cancer-related lymphedema: consensus from an expert panel. Med Oncol. 2024;41(11):298. DOI: 10.1007/s12032-024-02510-6
25. Percy D.B., Pao J.S., McKevitt E., Dingee C., Kuusk U., Warburton R. Number of nodes in sentinel lymph node biopsy for breast cancer: Are surgeons still biased? J Surg Oncol. 2018;117(7):1487–92. DOI: 10.1002/jso.25010
26. Abbas Y., Hamdy O. Axillary reverse mapping in breast cancer: An overview. Breast Dis. 2023;42(1):137–46. DOI: 10.3233/BD-220040
27. Noguchi M., Inokuchi M., Yokoi-Noguchi M., Morioka E., Haba Y. The involvement of axillary reverse mapping nodes in patients with nodepositive breast cancer. Eur J Surg Oncol. 2023;49(10):106937. DOI: 10.1016/j.ejso.2023.05.012
28. Johnson A.R., Fleishman A., Granoff M.D., Shillue K., Houlihan M.J., Sharma R., et al. Evaluating the impact of immediate lymphatic reconstruction for the surgical prevention of lymphedema. Plast Reconstr Surg. 2021;147(3):373e–81e. DOI:10.1097/PRS.0000000000007636
29. Cook J.A., Sasor S.E., Loewenstein S.N., DeBrock W., Lester M., Socas J., et al. Immediate lymphatic reconstruction after axillary lymphadenectomy: a single-institution early experience. Ann Surg Oncol. 2020;28(3):1381–7. DOI: 10.1245/s10434-020-09104-2
30. Ranzenberger L.R., Pai R.B. Lymphoscintigraphy. 2024 Mar 6. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan. PMID: 33085360.
Об авторах
Э. М. БукинРоссия
Букин Эдуард Максимович — кафедра онкологии с гематологией
Ярославль
В. Н. Малашенко
Россия
Малашенко Виктор Николаевич — д.м.н., профессор, кафедра онкологии с гематологией
Ярославль
В. В. Рыбачков
Россия
Рыбачков Владимир Викторович — д.м.н., профессор, кафедра госпитальной хирургии
Ярославль
А. Б. Васин
Россия
Васин Александр Борисович
Ярославль
Н. С. Голощапова
Россия
Голощапова Наталья Сергеевна — поликлиническое отделение
Ярославль
И. Н. Рощин
Россия
Рощин Игорь Николаевич — отделение торакальной хирургии
Ярославль
А. К. Акимова
Россия
Акимова Анастасия Евгеньевна — отделение опухолей молочной железы и кожи
Ярославль
Рецензия
Для цитирования:
Букин Э.М., Малашенко В.Н., Рыбачков В.В., Васин А.Б., Голощапова Н.С., Рощин И.Н., Акимова А.К. Управление рисками при операциях на лимфатическом аппарате у пациентов маммологического профиля. Креативная хирургия и онкология. 2025;15(3):220-227. https://doi.org/10.24060/2076-3093-2025-15-3-220-227
For citation:
Bukin E.M., Malashenko V.N., Rybachkov V.V., Vasin A.B., Goloshchapova N.S., Roschin I.N., Akimova A.E. The Managing of Lymphatic Surgery Risks in Breast Cancer Patients. Creative surgery and oncology. 2025;15(3):220-227. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-3-220-227


































