Перейти к:
Современные методы внутрисосудистой визуализации и имплантации коронарных рассасывающихся каркасов (стентов)
https://doi.org/10.24060/2076-3093-2019-9-2-95-99
Аннотация
Введение. Использование внутрисосудистых методов визуализации, в частности внутрисосудистое ультразвуковое исследование, позволяет уменьшить число повторных реваскуляризаций. Метод оптический когерентной томографии (ОСТ) благодаря высокой разрешающей способности позволяет с большей точностью выявлять и оценивать краевую диссекцию, тромбоз в стенте, пролапс тканей, перелом и малпозицию страт. Целью настоящей работы является оценка влияния рутинного использования ОСТ на долгосрочный прогноз пациентов при установке скаффолдов.
Материалы и методы. В период 2014–2015 гг. проведено 32 стентирования с применением рассасывающихся внутрисосудистых каркасов (Absorb, Abbot Vascular) с последующей визуализацией и оценкой оптической когерентной томографией. В контрольной группе (n = 16) скаффолды установлены без ОСТ, при традиционной рентгеноконтрастной визуализации. Анализ совокупности следующих исходов: повторная экстренная реваскуляризация в целевой артерии, смерть от сердечных причин, инфаркт миокарда и данные визуализации ОСТ через 12 месяцев после операции (степень рестеноза в каркасе) — был взят в качестве конечной точки.
Результаты. Суммарно было установлено 55 BVS, 22 в группе с ОСТ и 23 в контрольной группе. В группе с ОСТ в 8 случаях из 16 (50 %) выявлены субоптимальные результаты: 1 диссекция и пролапс атеросклеротической бляшки — установка второго BVS и постдилатация; одно эксцентричное раскрытие скаффолда — модель под острый тромбоз, устранена постдилатацией, в 6 остальных — недораскрытие стента. Однократно на ОСТ была выявлена диссекция интимы после предилатации, стабилизированная установкой второго скаффолда. По результатам контрольного обследования пациентов через 12 месяцев установлено, что в контрольной группе рестенозов в каркасе было выявлено в 3,215 раза больше.
Заключение. Несмотря на свою революционность, метод внутрисосудистой реставрации с применением рассасывающихся коронарных каркасов требует тщательной подготовки и интраоперационного контроля. Результаты нашего исследования говорят о предпочтительности использования методик внутрисосудистой визуализации для оценки степени раскрытия, наличия зон диссекции, тромбоза и эксцентричности скаффолда.
Ключевые слова
Для цитирования:
Николаева И.Е., Загитов И.Г., Бузаев И.В., Рисберг Р.Ю. Современные методы внутрисосудистой визуализации и имплантации коронарных рассасывающихся каркасов (стентов). Креативная хирургия и онкология. 2019;9(2):95-99. https://doi.org/10.24060/2076-3093-2019-9-2-95-99
For citation:
Nikolaeva I.E., Zagitov I.G., Buzaev I.V., Risberg R.Yu. Current Techniques of Intravascular Imaging and Implantation of Bioresorbable Coronary Vascular Scaffolds (Stents). Creative surgery and oncology. 2019;9(2):95-99. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-2-95-99
Введение
Появление биорезорбируемых внутрисосудистых каркасов (скаффолдов) в арсенале рентген-хирургии называют началом новой эры в интервенционной кардиологии [1, 2]. Однако скаффолды также неидеальны. Самым критичным недостатком мы считаем недостаточную радиальную жесткость материала, что может быть причиной перелома каркаса скаффолда [3]. Это особенно важно, учитывая то, что полимер молочной кислоты, из которого сделан скаффолд, является рентгеннегативным, и оперирующий хирург не может увидеть сам каркас. Поэтому логично возникают вопросы о выборе оптимальной тактики установки скаффолдов. Недораскрытие стентов, малпозиция страт, пролапс тканей через ячейки стентов приводят к увеличению случаев тромбозов и рестенозов в стенте [4]. Использование внутрисосудистых методов визуализации, в частности внутрисосудистое ультразвуковое исследование, позволяет уменьшить число повторных реваскуляризаций [5-7]. Было выявлено, что оптическая когерентная томография (ОСТ) при стентировании улучшает клинический исход [8]. Кроме того, метод ОСТ ввиду высокой разрешающей способности позволяет с наивысшей точностью оценивать, выявлять следующие явления: тромбоз в стенте, краевая диссекция, пролапс тканей, перелом и малпозицию страт [9-12]. Перечисленные выше работы проводились в сравнении с установкой традиционных стентов.
В журнале Eurointerverntion (2015) Allahwala и соавт. указывают, что и при тщательной подготовке, предилатацию, точный выбор целевого сосуда, постдилатацию выявляют на основании показаний ОСТ, что служит для оптимизации установки скаффолда [13].
В данном исследовании мы стремились установить влияние рутинного использования ОСТ на долгосрочный прогноз пациентов при установке скаффолдов. Совокупность исходов: смерть от сердечных причин, повторная экстренная реваскуляризация в целевой артерии, инфаркт миокарда, а также данные визуализации ОСТ через 12 месяцев после операции (степень рестеноза в каркасе) — были взяты в качестве конечной точки.
В нашем исследовании предпочтение ОСТ отдавалось в связи с более высокой разрешающей способностью и с большей избирательностью исследования [14].
Материалы и методы
За период 2014-2015 гг. нами проведено 32 стентирования с применением рассасывающихся внутрисосудистых каркасов (Absorb, Abbot Vascular) с последующей визуализацией и оценкой оптической когерентной томографией. В контрольной группе (n = 16) скаффолды установлены без ОСТ, при традиционной рентгеноконтрастной визуализации. В таблице 1 предоставлены демографические характеристики групп пациентов.
Таблица 1. Структура групп пациентов по демографическим показателям и наличию сопутствующих заболеваний
Table 1. Patient groups distribution by demographic indicators and concomitant diseases
|
Группа |
Возраст |
Сахарный диабет |
ХСН |
ПИКС |
АКШ, МКШ |
Артерия |
№ скаффолдов |
|---|---|---|---|---|---|---|---|
| Контроль |
59,6, 8,73 (95 % CI: 55,3;63,9) |
6/16, 37,5 % |
I 25 %, II 62,5 %, III 12,5 % |
31,25 % | 12,5 % |
ПМЖВ 68,75; ОА 31,25 %; ПКА 18,75 % |
23, в среднем 1,4375 |
| ОСТ |
61,3, 9,2 (95 % CI: 56,8; 65,8) |
7/16, 43,75 %
|
I 18,8 %, II 68,7 %, III 12,5 % |
37,5 % | 12,5 % |
ПМЖВ 87,5 %; ОА 6,25 %, ПКА 12,5 % |
22, в среднем 1,375 |
Примечания: ХСН — хроническая сердечная недостаточность, ПИКС — постинфарктный кардиосклероз, АКШ — аортокоронарное шунтирование, МКШ — маммаро-коронарное шунтирование.
Note: ХСН — chronic heart failure, ПИКС — post-infarction cardiosclerosis, АКШ — coronary artery bypass surgery, МКШ — mammarocoronary bypass surgery.
Была собрана экспериментальная группа (n = 16), ОСТ в которой была проведена 2- или 3-кратно. Первая ОСТ перед установкой скаффолда для точной оценки рефренного диаметра и анатомической допустимости установки скаффолда и повторная ОСТ после установки скаффолда для оценки качества установки: полноты раскрытия, наличия перелома и миграции страт скаффолда, пролапса тканей через решетки стента, наличия тромбоза, диссекции. В случае выявления данных осложнений проводилось их устранение с последующим повторным ОСТ контролем.
Контроль осуществлялся в 2 этапа:
- через 3 месяца после операции проведен опрос по телефону пациентов с использованием бланка опроса по стандарту;
- через 12 месяцев после операции все пациенты госпитализируются для проведения коронарографии, оптической когерентной томографии в динамике. Определения:
- пролапс тканей выражался в процентном соотношении остаточной площади поперечного сечения просвета сосуда к площади поперечного сечения скаффолда;
- недораскрытие стента — уменьшение минимальной площади скаффолда (MLA) вследствие пролабирования через решетки стента, приводящего к потере до 80 % MLA от референсного диаметра целевого сосуда. Диссекция определялась по классификации NHLBI [12].
Результаты
Суммарно было установлено 55 BVS, 22 в группе с ОСТ и 23 в контрольной группе. В группе с ОСТ в 8 случаях из 16 (50 %) выявлены субоптимальные результаты: 1 диссекция и пролапс атеросклеротической бляшки — установка второго BVS и постдилатация; одно эксцентричное раскрытие скаффолда — модель под острый тромбоз, устранена постдилатацией, в 6 остальных — недораскрытие стента. Однократно на ОСТ была выявлена диссекция интимы после предилатации, стабилизированная установкой второго скаффолда. В экспериментальной группе однократно наблюдались явления начинающегося тромбоза в стенте в виде дефекта наполнения, разрешившегося после коррекции АСТ дозой клексана 0,4 мл.
В раннем послеоперационном периоде мы не наблюдали осложнений по конечной точке, все пациенты выписаны планово.
Один пациент из контрольной группы через 2 суток после выписки был госпитализирован с острым инфарктом миокарда, на коронарографии — тромбоз в скаффолде, смерть после чрескожного коронарного вмешательства (ЧКВ). На вскрытии выявлено эксцентричное, щелевидное раскрытие BVS, что и послужило причиной тромбоза. Впоследствии, спустя 3 месяца, по стандартизированному бланку нами был проведен телефонный опрос пациентов. В результате из 31 пациентов не было выявлено ни одного результата по конечной точке.
Через 12 месяцев пациенты были госпитализированы с целью проведения контрольной коронарографии. В контрольной группе в 3 случаях из 12 выявлен рестеноз в каркасе, в 1 случае стеноз за каркасом. В группе с ОСТ не выявлено случаев рестеноза, в 1 случае выявлена усиленная гиперплазия неоинтимы, не требующая повторного стентирования на момент коронарографии. Наш анализ показал, что в контрольной группе рестенозов в каркасе было выявлено в 3,215 раза больше. Статистические результаты приведены в таблице 2.
Таблица 2. Данные ангиографического контроля
Table 2. Angiography control data
|
Группа |
Вызвано |
Нормальная эндотелизация |
Рестеноз в каркасе |
Стенозы в других сегментах |
|---|---|---|---|---|
|
Контроль |
15/15 |
9/15 |
3/15, 20 % HR 3,125 |
3/15 |
|
ОСТ |
16/16 |
12/13 |
1/16, 6,25 % |
4/16 |
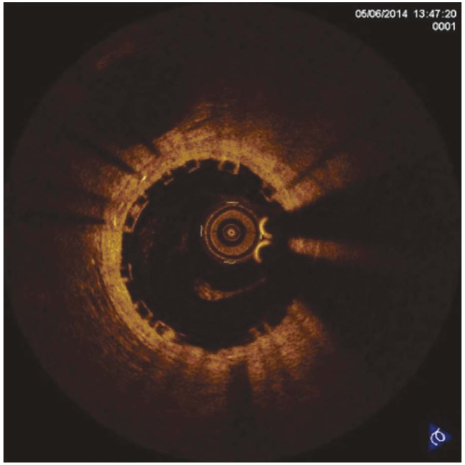
Рисунок 1. Оптическая когерентная томография. Оценка степени прилегания страт стента к стенке сосуда
Figure 1. Optical coherence tomography. Assessment of stent struts apposition to vessel wall
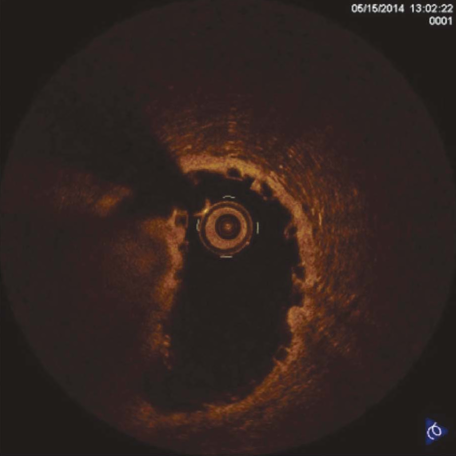
Рисунок 2. Оптическая когерентная томография. Эксцентричность раскрытия скаффолда
Figure 2. Optical coherence tomography. Scaffold expansion eccentricity
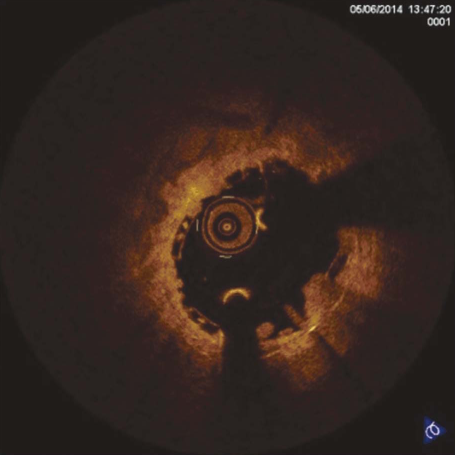
Рисунок 3. Оптическая когерентная томография. Наличие пролапса тканей между страт
Figure 3. Optical coherence tomography. Tissue prolapse between struts
Заключение
Несмотря на свою революционность, метод внутрисосудистой реставрации с применением рассасывающихся коронарных каркасов требует тщательной подготовки и интраоперационного контроля.
Результаты нашего исследования говорят о предпочтительности использования методик внутрисосудистой визуализации для оценки степени раскрытия, наличия зон диссекции, тромбоза и эксцентричности скаффолда.
Список литературы
1. Serruys P.W., Garcia-Garcia H.M., Onuma Y. From metallic cages to transient bioresorbable scaffolds: change in paradigm of coronary revascularization in the upcoming decade? Eur Heart J. 2012 Jan;33(1):16–25b. DOI: 10.1093/eurheartj/ehr384
2. Плечев В.В., Ишметов В.Ш., Абдрахманов Р.Э., Благодаров С.И., Зиязетдинов Р.Н., Утенская И.Д. Опыт применения скаффолдов «absorb» в отделении рентгенэндоваскулярных диагностики и лечения клиники БГМУ. Креативная хирургия и онкология. 2014;(1–2):25–7. DOI: 10.24060/2076-3093-2014-0-1-2-25-27
3. Ruiz-Salmeron R.J., Pereira S., de Araujo D. Bioresorbable vascular scaffold collapse causes subacute thrombosis. J Invasive Cardiol. 2014;26(7):E98–9. PMID: 24993999
4. Grundeken M.J., Garcia-Garcia H.M., Kumsars I., Lesiak M., Kayaert P., Dens J., et al. Segmental comparison between a dedicated bifurcation stent and balloon angioplasty using intravascular ultrasound and three-dimensional quantitative coronary angiography: A subgroup analysis of the Tryton IDE randomized trial. Catheter Cardiovasc Interv. 2017;89(2):E53–63. DOI: 10.1002/ccd.26527
5. Shin D.H., Hong S.J., Mintz G.S., Kim J.S., Kim B.K., Ko Y.G., et al. Effects of intravascular ultrasound-guided versus angiography-guided new-generation drug-eluting stent implantation: meta-analysis with individual patient-level data from 2,345 randomized patients. JACC Cardiovasc Interv. 2016;9(21):2232–9. DOI: 10.1016/j.jcin.2016.07.021
6. Maehara A., Ben-Yehuda O., Ali Z., Wijns W., Bezerra H.G., Shite J., et al. Comparison of stent expansion guided by optical coherence tomography versus intravascular ultrasound: The ILUMIEN II study (Observational Study of Optical Coherence Tomography [OCT] in patients undergoing fractional flow reserve [FFR] and percutaneous coronary intervention). JACC Cardiovasc Interv. 2015;8(13):1704–14. DOI: 10.1016/j.jcin.2015.07.024
7. Kim J.S., Kang T.S., Mintz G.S., Park B.E., Shin D.H., Kim B.K., et al. Randomized comparison of clinical outcomes between intravascular ultrasound and angiography-guided drug-eluting stent implantation for long coronary artery stenoses. JACC Cardiovasc Interv. 2013;6(4):369–76. DOI: 10.1016/j.jcin.2012.11.009
8. Prati F., Romagnoli E., Burzotta F., Limbruno U., Gatto L., La Manna A., et al. Clinical Impact of OCT Findings During PCI: The CLI-OPCI II Study. JACC Cardiovasc Imaging. 2015 Nov;8(11):1297– 305. DOI: 10.1016/j.jcmg.2015.08.013
9. Fujino Y., Bezerra H.G., Attizzani G.F., Wang W., Yamamoto H., Chamié D., et al. Frequency-domain optical coherence tomography assessment of unprotected left main coronary artery disease-a comparison with intravascular ultrasound. Catheter Cardiovasc Interv. 2013;82(3):E173–83. DOI: 10.1002/ccd.24843
10. Fujino Y., Attizzani G.F., Bezerra H.G., Wang W., Tahara S., Yamamoto H., et al. Serial assessment of vessel interactions after drugeluting stent implantation in unprotected distal left main coronary artery disease using frequency-domain optical coherence tomography. JACC Cardiovasc Interv. 2013;6(10):1035–45. DOI: 10.1016/j. jcin.2013.05.015
11. Chin Yong A., Wei Chieh J.T. Coronary perforation complicating percutaneous coronary intervention — a case illustration and review. ASEAN Heart J. 2013;21(2):3. DOI: 10.7603/s40602-013-0002-9
12. Takarada S., Imanishi T., Liu Y., Ikejima H., Tsujioka H., Kuroi A., et al. Advantage of next-generation frequency-domain optical coherence tomography compared with conventional time-domain system in the assessment of coronary lesion. Catheter Cardiovasc Interv. 2010;75(2):202–6. DOI: 10.1002/ccd.22273
13. Allahwala U.K., Cockburn J.A., Shaw E., Figtree G.A., Hansen P.S., Bhindi R. Clinical utility of optical coherence tomography (OCT) in the optimisation of Absorb bioresorbable vascular scaffold deployment during percutaneous coronary intervention. EuroIntervention. 2015;10(10):1154–9. DOI: 10.4244/EIJV10I10A190
14. Brown A.J., McCormick L.M., Hoole S.P., West N.E. Coregistered intravascular ultrasound and optical coherence tomography imaging during implantation of a bioresorbable vascular scaffold. JACC Cardiovasc Interv. 2013;6(7):e41–2. DOI: 10.1016/j.jcin.2013.03.018
Об авторах
И. Е. НиколаеваРоссия
Николаева Ирина Евгеньевна — к.м.н., главный врач, главный внештатный кардиолог Министерства здравоохранения Республики Башкортостан
И. Г. Загитов
Россия
Загитов Ильгиз Гайфуллович — врач отделения РХМДИЛ № 1
И. В. Бузаев
Россия
Бузаев Игорь Вячеславович — к.м.н., зав. отделением рентген-хирургических методов диагностики и лечения № 1, доцент кафедры госпитальной хирургии
Р. Ю. Рисберг
Россия
Рисберг Роман Юрьевич — к.м.н., врач отделения РХМДИЛ № 1
Рецензия
Для цитирования:
Николаева И.Е., Загитов И.Г., Бузаев И.В., Рисберг Р.Ю. Современные методы внутрисосудистой визуализации и имплантации коронарных рассасывающихся каркасов (стентов). Креативная хирургия и онкология. 2019;9(2):95-99. https://doi.org/10.24060/2076-3093-2019-9-2-95-99
For citation:
Nikolaeva I.E., Zagitov I.G., Buzaev I.V., Risberg R.Yu. Current Techniques of Intravascular Imaging and Implantation of Bioresorbable Coronary Vascular Scaffolds (Stents). Creative surgery and oncology. 2019;9(2):95-99. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-2-95-99


































