Перейти к:
ИОХВ при формировании колоректальных анастомозов и С-реактивный белок как маркер развития инфекционных осложнений
https://doi.org/10.24060/2076-3093-2019-9-3-171-176
Аннотация
Введение. Инфекция области хирургического вмешательства (ИОХВ) достигает 30 % у пациентов после колоректальных операций. Особенностью инфекционных осложнений после колоректальных операций является превалирование глубоких форм ИОХВ, характеризующихся стертой клинической картиной и трудностями в своевременной диагностике. Актуальным является выявление наиболее раннего маркера развития инфекционных осложнений и его порогового значения.
Материалы и методы. Проведено проспективное исследование результатов резекции толстой кишки с формированием толстокишечных анастомозов у 135 больных. Пациенты были разделены на 2 группы, в зависимости от способа наложения анастомоза. Исследован уровень С-реактивного белка до операции и на 3, 5, 7-е сутки после операции.
Результаты и обсуждение. ИОХВ выявлены у 32 пациентов (23,7 %). Сравнивая частоту обнаружения ИОХВ в группах, получили статистически значимое различие в пользу механического анастомоза: 9 пациентов (15,2 %) против 23 пациентов (30,3 %), р = 0,0164. Выявлены статистически значимые отличия между уровнем СРБ у пациентов с ИОХВ и у пациентов без ИОХВ во все сроки послеоперационного периода. При уровне СРБ выше 100,5 мг/л (нижняя граница 0,95 доверительного интервала — ДИ) достоверно возрастает частота развития ИОХВ.
Заключение. Механический анастомоз достоверно сокращает частоту развития ИОХВ в послеоперационном периоде на 15,1 %. Уровень СРБ выше 100,5 мг/л с третьих суток послеоперационного периода можно считать достоверным предиктором развития ИОХВ.
Ключевые слова
Для цитирования:
Грушевская Е.А., Мехтиев Н.М., Гришина Е.Е., Тимербулатов М.В. ИОХВ при формировании колоректальных анастомозов и С-реактивный белок как маркер развития инфекционных осложнений. Креативная хирургия и онкология. 2019;9(3):171-176. https://doi.org/10.24060/2076-3093-2019-9-3-171-176
For citation:
Grushevzkaya E.A., Mekhtiev N.M., Grishina E.E., Timerbulatov M.V. SSI Following Construction of Colorectal Anastomoses and C-Reactive Protein as Marker for Infectious Complications. Creative surgery and oncology. 2019;9(3):171-176. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-3-171-176
Введение
Инфекция области хирургического вмешательства (ИОХВ), несомненно, является актуальной проблемой и достигает 30 % у пациентов после колоректальных операций [1].
Несостоятельность анастомоза в колоректальной хирургии составляет примерно от 9,5 до 11 % случаев, является одной из наиболее частых причин развития ИОХВ и повторных операций [2, 3].
Частота развития несостоятельности кишечного анастомоза зависит от качества наложения анастомоза, способа наложения и уровня анастомоза. Чем ниже уровень накладываемого анастомоза, тем выше вероятность развития его несостоятельности [4, 5].
К факторам риска развития ИОХВ при формировании колоректальных анастомозов также относят: мужской пол, нутритивный статус, курение и употребление алкоголя, наличие дивертикулярной болезни ободочной кишки, химио- и лучевую терапию, стадию опухолевого процесса, длительность операции, интраоперационную кровопотерю [6-8].
Глубокие формы ИОХВ являются наиболее тяжелыми и чаще всего связаны с несостоятельностью анастомоза. Очевидно, что раннее их выявление позволяет предотвратить тяжелые септические осложнения и напрямую повлиять на результаты лечения.
К сожалению, выявление ИОХВ, особенно глубоких форм, у пациентов с колоректальными анастомозами редко происходит ранее пятых суток послеоперационного периода, что связанно со стертой клинической симптоматикой, невысокой информативностью основных используемых лабораторных показателей (лейкоцитоза крови) [9].
Золотым стандартом ранней диагностики несостоятельности толстокишечного анастомоза является компьютерная томография с внутривенным или внутри- кишечным контрастированием. Недостатками данного метода являются экономическая составляющая и лучевая нагрузка для пациентов.
Литературные данные свидетельствуют об эффективности исследования С-реактивного белка (СРБ) как раннего точного маркера ИОХВ, в т. ч. связанной с несостоятельностью анастомоза [10].
Материалы и методы
Проведено проспективное исследование результатов резекции толстой кишки с формированием толстокишечных анастомозов у 135 больных на базе колопроктологического отделения ГБУЗ РБ ГКБ 21 в период с 2015 по 2018 год. Пациенты были разделены на 2 группы в зависимости от способа наложения анастомоза. В 59 случаях сформирован механический, а в 76 — ручной анастомоз. Ручной анастомоз формировали двухрядными швами, первый ряд по способу Пирогова — Матещука, второй — серозно-мышечный непрерывный. В качестве шовного материала использовали викрил 3.0. Аппаратный анастомоз при правосторонней гемоколонэктомии накладывали с помощью линейного сшивающего аппарата Сovidien DST на 30 или 45 мм, при остальных объемах оперативного пособия использовался циркулярный сшивающий аппарат «Govidien» CEEA DST.
Критерием включения был первичный анастомоз на толстой кишке, наложенный в плановом порядке. Исключением стали пациенты с III-IV стадией рака, пациенты, оперированные в экстренном порядке, пациенты с наложенными превентивными кишечными стомами, пациенты с предшествующей с химио-, лучевой терапией.
Средний возраст больных составил 63,7 года. Во всех случаях больным проводилась механическая очистка кишечника путем его тотального промывания накануне операции фортрансом. В обеих группах проводилась антибиотикопрофилактика амоксициллин + клавула- нат по 2,4 г.
После формирования анастомоза брали материал для посева с брюшины анастомоза стерильным ватным тампоном методом мазка. Материал исследовали на наличие кишечной палочки по общепринятой методике. Также брали посев из просвета толстой кишки.
Было проведено исследование уровня СРБ у 97 больных, перенесших различные типы резекций толстой кишки. Кровь на С-реактивный белок исследовали до операции и на 3, 5, 7-е сутки после операции. Описательную статистику для качественных показателей вычисляли как количество и процент пациентов для каждого значения показателя. Соответствие вида распределения закону нормального распределения проводилось с помощью критериев Колмогорова — Смирнова и Шапиро — Уилка. Описательную статистику для количественных показателей вычисляли как число наблюдений, среднее арифметическое значение, среднеквадратическое отклонение, медиану, интерквартиль- ный размах, минимум и максимум. Статистические гипотезы рассматривались как двусторонние с уровнем значимости 0,05. Для сравнения групп использовался точный тест Фишера.
Проведен факторный анализ ANOVA соотношения уровня СРБ и количества ИОХВ при формировании колоректальных анастомозов для определения пороговой величины СРБ в послеоперационном периоде. Для сравнения уровня СРБ в различные сроки послеоперационного периода применялся критерий Уилкоксона. Сравнение уровня СРС в группах выполнялось с помощью метода Манна — Уитни. Обработка данных произведена с использованием программы Stat Soft Statistica 10,0.
Результаты
ИОХВ в послеоперационном периоде были выявлены всего у 32 пациентов (23,7 %). Структура операций в группах представлена в таблице 1.
|
Объем операции |
Аппаратный анастомоз N = 59, n (%) |
Ручной анастомоз N = 76, n (%) |
Всего N = 135, n (%) |
p |
|---|---|---|---|---|
|
Правосторонняя гемиколэктомия |
5 (8,5) |
9 (12) |
14 (10,6) |
0,5816 |
|
Левосторонняя гемиколэктомия |
10 (17) |
14 (18) |
24 (18) |
0,5045 |
|
Резекция сигмовидной кишки |
31 (52,5) |
38 (50) |
69 (51) |
0,8625 |
|
Передняя резекция прямой кишки |
13 (22) |
15 (20) |
28 (21) |
0,8315 |
Таблица 1. Виды операций
Table 1. Operation types
Чаще всего выполняли резекции левой половины ободочной кишки (левосторонняя гемиколэктомия — 18 %, резекция сигмовидной кишки — 51 %, прямой кишки — 20,4 %, правой половины — 10,6 %). Более 2/3 больных были оперированы по поводу рака, остальные — по поводу дивертикулярной болезни ободочной кишки, долихосигмы.
Время операции, интраоперационные осложнения и длительность госпитализации не отличались в группах (табл. 2). ИОХВ в послеоперационном периоде выявлена у 9 пациентов (15,2 %), которым накладывали механический анастомоз. В группе больных, которым формировали анастомоз ручным способом, ИОХВ была выявлена у 23 больных (30,3 %). Сравнивая частоту обнаружения ИОХВ в группах, получили статистически значимое различие в пользу механического анастомоза: 9 пациентов (15,2 %) против 23 пациентов (30,3 %), р = 0,0164 (рис. 1).
|
Результаты лечения |
Аппаратный анастомоз N = 59 |
Ручной анастомоз N = 76 |
Всего N = 135 |
p |
|---|---|---|---|---|
|
Среднее время операции, мин |
150 ± 16,7 |
183 ± 11,4 |
177 ± 14,5 |
0,3050 |
|
Интраоперационные осложнения, абс. |
2 |
5 |
7 |
0,4676 |
|
Послеоперационный койко-день, сут |
13,5 ± 2,2 |
15,6 ± 1,2 |
13,5 ± 2 |
0,3057 |
|
Послеоперационные осложнения, абс. |
9 |
23 |
32 |
0,0164 |
Таблица 2. Непосредственные результаты оперативного лечения
Table 2. Immediate surgery outcomes

Рисунок 1. Структура инфекций области хирургического вмешательства в исследуемых группах
Figure 1. Structure of surgical site infections in groups studied
Обсемененность микроорганизмами брюшины в области механического анастомоза намного менее выражена по сравнению с ручным анастомозом, обсеме- ненность которого не многим отличается от просвета толстой кишки (рис. 2).

Рисунок 2. Сравнительные результаты исследования микробной обсемененности ана· стомозов и просвета толстой кишки сразу после формирования анастомоза (в КОЕ/г)
Figure 2. Comparative result of microbial content examination of anastomoses and co· lonic lumen immediately after anastomosis was constructed (cfu/g)
Выявлены статистически значимые отличия между уровнем СРБ у пациентов с ИОХВ и у пациентов без ИОХВ во все сроки послеоперационного периода (рис. 3).
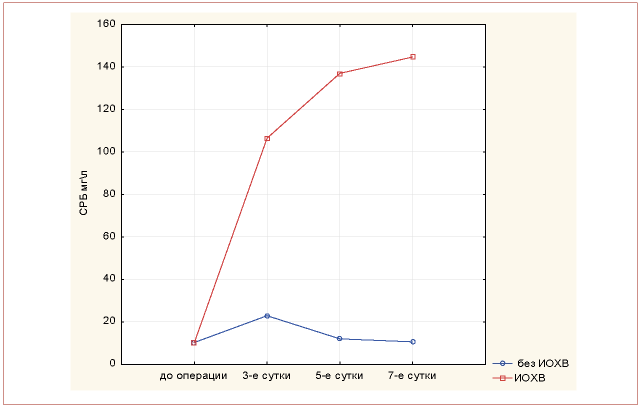
Рисунок 3. Уровень СРБ у пациентов с ИОХВ и нормальным течением послеоперационного периода (р < 0,05)
Figure 3. CRP level in patients with SSI and normal course of postop period (p < 0.05)
Факторный анализ ANOVA соотношения уровня СРБ на третьи сутки послеоперационного периода и частоты ИОХВ (рис. 4) показал, что при уровне СРБ выше 100,5 мг/л (нижняя граница 0,95 доверительного интервала — ДИ) достоверно возрастает частота развития ИОХВ. Поэтому уровень СРБ более 100 мг/л начиная с третьих суток после колоректальных операций необходимо рассматривать как наличие или начало развития ИОХВ.

Рисунок 4. Диаграмма факторного анализа, отражающая пороговый уровень СРБ, при котором достоверно увеличивается частота ИОХВ на третьи сутки послеоперационного периода
Figure 4. Factorial analysis diagram reflecting the CRP threshold level when SSI incidence increases significantly on day 3 postop
Обсуждение результатов
По данным различных авторов, при хирургическом лечении колоректального рака послеоперационные осложнения развиваются в 21 % случаев, а осложнения, связанные с развитием ИОХВ, в 12,4 % случаев [11, 12]. Таким образом, ИОХВ в колоректальной хирургии является на сегодняшний день наиболее актуальной проблемой [13], тем более что инфекционные осложнения после колоректальных операций развиваются в 4 раза чаще [14] по сравнению с операциями на других органах брюшной полости. Это обстоятельство связано с типом операций, которые определяются как условно загрязненные, возрастными особенностями пациентов (преимущественно старше 65 лет), техническими особенностями операций: высокой вероятностью интра- и послеоперационного кровотечения и несостоятельности анастомоза [15].
При формировании межкишечных анастомозов в колоректальной хирургии используются 2 метода: механический (аппаратный) и ручной. Основными требованиями при любом способе являются герметичность, прочность анастомозов, сохранение жизнеспособности тканей в зоне анастомоза, асептичность методики. По литературным и нашим данным, этим требованиям в большой степени соответствует механический анастомоз, включая асептичность техники, поскольку просвет кишки вскрывается только в проксимальной культе и на короткое время, что значительно сокращает период возможной контаминации. Дистальная культя толстой кишки после деваскуляризации без вскрытия просвета прошивается, и вероятность инфицирования минимальная.
Во время формирования анастомоза особое внимание уделяется профилактике интраоперационного инфицирования прилежащего брюшинного покрова, для чего тщательно изолируются проксимальная и дистальная культи салфетками, пропитанными водным раствором хлоргексидина, проводится их смена, удаление после пересечения толстой кишки и замена на стерильные. Однако и при наложении механических анастомозов невозможно избежать инфицирования, когда требуются минимальные проколы для введения отдельных деталей механического считывающего устройства. В то же время при ручном анастомозе, несмотря на закрытие просвета кишки жомом, всегда есть вероятность инфицирования из просвета проксимальной и дистальной культи.
Таким образом, наше исследование подтверждает, что способ формирования межкишечного анастомоза при резекциях толстой кишки является значимым фактором риска развития ИОХВ, и при этих операциях предпочтение следует отдавать механическим анастомозам.
Учитывая необходимость в существовании наиболее раннего, точного, удобного в использовании диагностического маркера, способного сигнализировать о развитии глубоких форм ИОХВ, связанных с несостоятельностью анастомоза на начальном этапе, до появления клинических симптомов, представляется актуальным определение порогового значения СРБ. Уровень СРБ, по литературным данным, увеличивается на 3-4-е сутки послеоперационного периода на фоне развития системной воспалительной реакции при инициации инфекционного процесса в брюшной полости [16]. Надо заметить, что литературные данные, представляющие пороговый уровень СРБ при колоректальных операциях, значительно разнятся. Ряд исследований определяет прогностически значимый уровень СРБ от 130 мг/л и выше [17]. Результаты нашей работы позволяют значение СРБ более 100 мг/л начиная с третьих суток после колоректальных операций, рассматривать как наличие или начало развития ИОХВ.
Заключение
Формирование механического толстокишечного анастомоза достоверно сокращает частоту развития ИОХВ в послеоперационном периоде на 15,1 %. Уровень СРБ выше 100,5 мг/л с третьих суток после колоректальных операций можно считать достоверным предиктором развития ИОХВ.
Информация о конфликте интересов.
Конфликт интересов отсутствует.
Информация о спонсорстве.
Данная работа не финансировалась.
Список литературы
1. Elia-Guedea M., Cordoba-Diaz de Laspra E., Echazarreta-Gallego E. Colorectal surgery and surgical site infection: is a change of attitude necessary? Int J Colorectal Dis. 2017;32(7):967–74. DOI: 10.1007/ s00384-017-2801-0
2. Zawadzki M., Krzystek-Korpacka M., Rząca M. Risk factors in reoperations in colorectal surgery. Pol Przegl Chir. 2019;91(4):13–8. DOI: 10.5604/01.3001.0013.1922
3. Jiang W., Feng M.Y., Dong X.Y. Risk factor analysis on anastomotic leakage after laparoscopic surgery in rectal cancer patient with neoadjuvant therapy and establishment of a nomogram prediction model. Zhonghua Wei Chang Wai Ke Za Zhi. 2019;22(8):748–54. DOI: 10.3760/cma.j.issn.1671-0274.2019.08.009
4. McDermott F.D., Heeney A., Kelly M.E., Steele R.J., Carlson G.L., Winter D.C. Systematic review of preoperative, intraoperative and postoperative risk factors for colorectal anastomotic leaks. Br J Surg. 2015;102(5):462–79. DOI: 10.1002/bjs.9697
5. European Society of Coloproctology collaborating group. The relationship between method of anastomosis and anastomotic failure after right hemicolectomy and ileo -caecal resection: an international snapshot audit. Colorectal Dis. 2017;19(8):e296–311. DOI: 10.1111/ codi.13646
6. Frasson M., Flor-Lorente B., Rodríguez J.L., Granero-Castro P., Hervás D., Alvarez Rico M.A., et al. Risk factors for anastomotic leak after colon resection for cancer: multivariate analysis and nomogram from a multicentric, prospective, national study with 3193 patients. Ann Surg. 2015;262(2):321–30. DOI: 10.1097/SLA.0000000000000973
7. Mroczkowski P., Dalicho S., Bruns C.J. Risk factors for colorectal anastomotic leaks. Chirurg. 2015;86(5):499–500. DOI: 10.1007/s00104- 015-3023-z
8. Chadi S.A., Fingerhut A., Berho M., DeMeester S.R., Fleshman J.W., Hyman N.H., et al. Emerging trends in the etiology, prevention, and treatment of gastrointestinal anastomoticleakage. J Gastrointest Surg. 2016;20(12):2035–51. DOI: 10.1007/s11605-016-3255-3
9. Su’a B.U., Mikaere H.L., Rahiri J.L. Systematic review of the role of biomarkers in diagnosing anastomotic leakage following colorectal surgery. Br J Surg. 2017;104(5):503–12. DOI: 10.1002/bjs.10487
10. Adamina M., Steffen T., Tarantino I., Beutner U., Schmied B.M., Warschkow R. Meta-analysis of the predictive value of C-reactive protein for infectious complications in abdominal surgery. Br J Surg. 2015;102(6):590–8. DOI: 10.1002/bjs.9756
11. Quintana J.M., Anton-Ladislao A., Lázaro S., Gonzalez N., Bare M., Garcia-Gutierrez S. Predictors of readmission and reoperation in patients with colorectal cancer. Supportive Care Cancer. 2019 Sep 4. DOI: 10.1007/s00520-019-05050-2
12. Artinyan A., Orcutt S.T., Anaya D.A., Richardson P., Chen G.J., Berger D.H. Infectious postoperative complications decrease longterm survival in patients undergoing curative surgery for colorectal cancer: a study of 12,075 patients. Ann Surg. 2015;261(3):497–505. DOI: 10.1097/SLA.0000000000000854
13. Kay D., Bhakta A., Patel J.A. Novel technique to reduce the incidence of SSI after colorectal surgery. Am Surg. 2019;85(7):695–9. PMID: 31405410
14. Hennessey D.B., Burke J.P., Ni-Dhonochu T., Shields C., Winter D.C., Mealy K. Risk factors for surgical site infection followingcolorectal resection: a multi-institutional study. Int J Colorectal Dis. 2016;31(2):267–71. DOI: 10.1007/s00384-015-2413-5
15. Keenan J.E., Speicher P.J., Thacker J.K., Walter M., Kuchibhatla M., Mantyh C.R. The preventive surgical site infection bundle in colorectal surgery: an effective approach to surgical site infection reduction and health care cost savings. JAMA Surg. 2014;149(10):1045–52. DOI: 10.1001/jamasurg.2014.346
16. McSorley S.T., Khor B.Y., MacKay G.J. Examination of a CRP first approach for the detection of postoperative complications in patients undergoing surgery for colorectal cancer: A pragmatic study. Medicine (Baltimore). 2017;96(7):e6133. DOI: 10.1097/MD.0000000000006133
17. Juvany M., Guirao X., Oliva J.C. Role of combined post-operative venous lactate and 48 hours C-reactive protein values on the etiology and predictive capacity of organ-space surgical site infection after elective colorectal operation. Surg Infect (Larchmt). 2017;18(3):311–8. DOI: 10.1089/sur.2016.172
Об авторах
Е. А. ГрушевскаяРоссия
Грушевская Екатерина Александровна — ассистент кафедры факультетской хирургии
Н. М. Мехтиев
Россия
Мехтиев Намик Мурадович — д.м.н., профессор кафедры факультетской хирургии
Е. Е. Гришина
Россия
Гришина Елена Евгеньевна — к.м.н., доцент кафедры факультетской хирургии
М. В. Тимербулатов
Россия
Тимербулатов Махмуд Вилевич — д.м.н., зав. кафедрой факультетской хирургии
Рецензия
Для цитирования:
Грушевская Е.А., Мехтиев Н.М., Гришина Е.Е., Тимербулатов М.В. ИОХВ при формировании колоректальных анастомозов и С-реактивный белок как маркер развития инфекционных осложнений. Креативная хирургия и онкология. 2019;9(3):171-176. https://doi.org/10.24060/2076-3093-2019-9-3-171-176
For citation:
Grushevzkaya E.A., Mekhtiev N.M., Grishina E.E., Timerbulatov M.V. SSI Following Construction of Colorectal Anastomoses and C-Reactive Protein as Marker for Infectious Complications. Creative surgery and oncology. 2019;9(3):171-176. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-3-171-176


































