Перейти к:
Экстракция экзосом из плазмы крови пациентов с мультиформной глиобластомой
https://doi.org/10.24060/2076-3093-2019-9-3-234-238
Аннотация
Введение. Мультиформная глиобластома (GBM) является наиболее распространенной и агрессивной формой первичной злокачественной опухоли головного мозга у взрослых с плохим прогнозом. Было показано, что экзосомы являются полезными неинвазивными биомаркерами для диагностики и прогноза опухолей, включая GBM. Экзосомы играют роль в качестве биологических носителей, которые могут выполнять различные задачи через различные сигнальные пути канцерогенеза, такие как PI3K/AKT, SOX2, PTEN, ERK и STAT3.
Материалы и методы. Экзосомы были выделены из плазмы крови, отобранной у пациентов с диагнозом GBM до хирургической резекции.
Результаты и обсуждение. Экзосомы, полученные из плазмы крови больных с GBM, имели размеры 40–100 нм и сферическую форму, что соответствует морфологическим характеристикам экзосом. Сочетание ультрафильтрации и двойного ультрацентрифугирования позволяет получить образцы экзосом из плазмы крови без примесей частиц более 100 нм, а форма и размер этих везикул соответствуют характеристикам экзосом, выделенных из других биологических жидкостей.
Заключение. Описанный здесь экспериментальный протокол для экстракции экзосом из плазмы крови пациентов с GBM является эффективным методом обеспечения чистоты экзосом. Использование этого метода дает возможности для будущих исследований относительно роли экзосом в патогенезе GBM, и его можно было бы в равной степени использовать для исследований c другими патологиями человека.
Ключевые слова
Для цитирования:
Гареев И.Ф., Бейлерли О.А., Zhao Sh., Yang G., Sun J., Бейлерли А.Т., Сафин Ш.М. Экстракция экзосом из плазмы крови пациентов с мультиформной глиобластомой. Креативная хирургия и онкология. 2019;9(3):234-238. https://doi.org/10.24060/2076-3093-2019-9-3-234-238
For citation:
Gareev I.F., Beylerli O.A., Zhao Sh., Yang G., Sun J., Beilerli A.T., Safin Sh.M. Extraction of Exosomes from Glioblastoma Multiforme Patients’ Blood Plasma. Creative surgery and oncology. 2019;9(3):234-238. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-3-234-238
Введение
Экзосомы представляют собой мембранные везикулы размером с вирусы, секретируемые как нормальными, так и патологическими клетками, и они присутствуют во всех жидкостях организма, включая кровь [1, 2]. Образование и высвобождение экзосом являются АТФ-зависимыми, и, таким образом, экзосомы являются продуктами живых клеток. Экзосомы отличаются от других внеклеточных везикул не только небольшими размерами и определенным биогенезом, но также и другими характерными свойствами, такими как морфология, плавучая плотность на градиентах сахарозы и наличием профиля специфических поверхностных белков [3]. Молекулярный «груз» экзосом представляет особый интерес, поскольку он обогащен компонентами, полученными из плазматической мембраны родительской клетки. Везикулярное содержимое экзосом включает нуклеиновые кислоты, ферменты, цито- кины, а также различные растворимые компоненты, которые отражают цитоплазматическое содержание родительской клетки [4, 5]. Экзосомные мембраны обогащены тетраспанинами, которые организованы в обогащенные тетраспанином мембранные домены (TEMs) и, как полагают, играют ключевую роль в биогенезе эк- зосом [6]. Тетраспанины, такие как CD81, CD83, CD9, CD63, CD37, CD53 и CD151, широко используются в качестве маркеров экзосом, хотя экзосомы, полученные из разных типов клеток, могут нести только некоторые, но не все из этих тетраспанинов. Экзосомы также несут компоненты эндосомного сортировочного комплекса, ответственного за транспорт (ESCRT), и различные вспомогательные молекулы, такие как ALIX и TSG101 [7]. Они также часто используются в качестве экзосо- мальных маркеров [8]. Комплекс ESCRT участвует в сортировке клеточных компонентов в экзосомы и в выделении экзосом из родительских клеток. Этот процесс биогенеза состоит из скоординированной серии этапов, включающих множество молекул, и выполняется всеми клетками, секретирующими экзосомы [9].
Существует значительный интерес к изучению физических и молекулярных характеристик экзосом с целью их использования в диагностических или терапевтических целях. Такие анализы сначала требуют, чтобы экзосомы были обогащены и изолированы от окружающего биологического материала, который представляет собой сложную смесь клеток и клеточного дебриса, белка, нуклеиновых кислот и липидов [10]. Кроме того, возможность агрегации экзосом в более крупные везикулы или, наоборот, расщепление везикул в более мелкие микровезикулы делает экстракцию экзосом и их функциональную характеристику сложной и проблематичной. Тем не менее, учитывая, что биосинтез экзосом включает в себя активную, а не пассивную секрецию из клеток, представляется разумным рассматривать экзосомы в качестве особых «представителей» клеточного фенотипа и генотипа родительской клетки. Исходя из этих предпосылок, циркулирующие экзосомы становятся биомаркерами, которые несут потенциально полезную информацию о состоянии родительской клетки, в частности клеток GBM.
Успех исследований экзосом в качестве биомаркеров зависит от методов качественной экстракции. В данной работе мы описываем в общих чертах экстракцию экзосом из плазмы больных GBM, что позволит проводить дальнейшие этапы, такие как использование просвечивающей электронной микроскопии (размер и морфология), анализа отслеживания мелких частиц (размер и концентрация) и вестерн-блоттинга (наличие экзосомных маркеров) в качестве стандартных методов для характеристики экзосом [11].
Материалы и методы
Материалы
- Стерильные наконечники для дозаторов.
- Стерильные пробирки Эппендорфа 1,5 и 2 мл.
- Охлаждаемая, высокоскоростная бенчтоп-центрифуга.
- Напольная ультрацентрифуга Optima™ XPN-90.
- Пробирки для ультрацентрифуги 25 мл.
- Абсолютный этиловый спирт.
- Фосфатно-солевой буфер (PBS).
- Дистиллированная вода.
- Аналитические весы
Методы
Для выбора пациентов следует отметить, что несколько факторов, таких как возраст, пол, текущие схемы лечения и многие другие, могут влиять на состав экзо- сом в крови и, следовательно, должны быть приняты во внимание до сбора образцов.
Сбор и обработка крови
- Производим забор 10 мл периферической крови с помощью венопункции в пробирки для сбора крови с этилендиаминтетрауксусной кислотой (ЭДТА) и осторожно смешиваем.
- Центрифугируем данные пробирки для сбора крови при 1000 Xgв течение 20 мин при комнатной температуре, чтобы осадить клетки крови. Используя дозатор со стерильными наконечниками, переносим плазменную фракцию (4-5 мл) в коническую пробирку на 25 мл. Разводим плазму с 10 мл 1 Xфосфатно-солевого буфера (PBS). Удаляем клетки крови (эритроциты и лейкоциты, также известные как мононуклеарные клетки периферической крови (РВМС)) надлежащим образом в маркированные контейнеры для биологически опасных отходов.
- Храним образцы плазмы при 4 °С в течение короткого срока (2-3 дня) или при -80 °С для длительного хранения.
Примечание. Перед дальнейшей обработкой доводим образцы замороженной плазмы до 4 °С.
Экстракция экзосом из плазмы крови
- Переносим 700 мкл размороженного образца плазмы в подходящую 2 мл пробирку Эппендорфа для центрифугирования. Заполняем пробирку равным объемом 700 мкл PBS, чтобы разбавить образец и предотвратить коллапс тонкостенных пробирок во время процедуры центрифугирования.
- Центрифугируем данный образец при 3000 х g в течение 10 мин при 4 °С, чтобы удалить криопреципитат.
- Переносим верхний слой образца без осадка в новые 2 мл пробирки Эппендорфа и центрифугируем при 10 000 х g в течение 30 мин при 4 °С, чтобы удалить клеточный мусор.
- Проводим очистку 25 мл пробирок для ультрацентрифугирования с помощью абсолютного этилового спирта и дистиллированной воды, далее просушив пробирки.
- Переносим верхний слой образца без осадка в объеме 1 мл в 25 мл пробирки.
- Проводим проверку массы каждого образца на аналитических весах, добавляя PBS для выравнивания массы.
Примечание. Максимальное количество образцов для ультрацентрифугирования 6. Каждый образец должен соответствовать массе противоположно стоящего образца в роторе для исключения ошибок и поломки техники.
- Ультрацентрифугируем очищенную плазму при 100 000 х g в течение 70 минут при 4 °С для удаления крупных везикул. После тщательно удаляем супернатант. Ресуспендируем полученные гранулы в 1 мл PBS в данной пробирке.
- Повторяем шаг 6.
- Ультрацентрифугируем при 100 000 х g в течение 70 мин при 4 °C.
- Удаляем супернатант и ресуспендируем гранулы экзосом в 100 мкл PBS в пробирках для ультрацентрифугирования и переносим с помощью дозатора в новые 1,5 мл пробирки Эппендорфа.
Примечание. Если невозможно перейти непосредственно к следующему этапу, сохраняем осадок, содержащий экзосомы, при 4 °С в течение 1-2 дней.
Результаты и обсуждение
Экзосомы — это небольшие мембранные везикулы эндосомального происхождения диаметром от 30 до 100 нм. Они секретируются различными типами клеток, нормальными или патологическими. В свое время экзосомы для клетки рассматривали как способ избавиться от ненужного «мусора», например «устаревших» белков. Однако теперь доказано, что эти везикулы больше, чем просто «мусорные ящики», и играют важную роль в межклеточной коммуникации. Экзосомы, таким образом, используются для передачи информации (микроРНК, вирусы) и других материалов, таких как белки, из одной клетки в другую. Опухолевые клетки играют особо важную роль в производстве экзосом. Экзосомы опухолевых клеток способны дистанционно участвовать в образовании предметастатических «ниш». Тем самым экзосомы являются ценным источником информации GBM, раскрывая стадию и прогрессирование опухоли и, следовательно, могут стать потенциальными биомаркерами при данном онкологическом заболевании человека. К тому же, поскольку экзосомы являются основным средством межклеточной коммуникации, они, вероятно, также могут участвовать в лечении при различных заболеваниях, включая GBM. Экзосомы имеют низкую токсичность, высокую стабильность в кровообращении и высокую эффективность доставки в клетки-мишени. В недавних исследованиях указывается применение экзосом в качестве персонализированных целевых транспортных средств для доставки лекарств [12, 13]. Морфологические характеристики везикул, включая их размер, могут быть важной диагностической характеристикой. Основная часть везикул, полученных из плазмы крови больных с GBM, имела размеры 40-100 нм и сферическую форму, что соответствует морфологическим характеристикам экзосом (рис. 1).
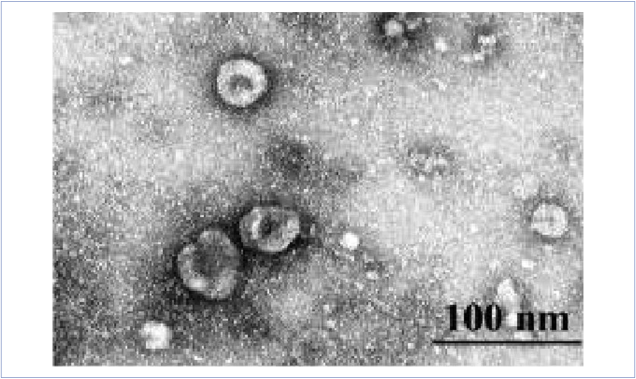
Рисунок 1. Экзосомы, выделенные из плазмы крови больных с GBM. Изображение показывает микровезикулы диаметром 60 нм. Трансмиссионная электронная микроскопия, негативное контрастирование 2 % водным раствором уранилацетата
Figure 1. Exosomes isolated from GBM patients' blood plasma. 60nm-diameter microvesicles. Transmission electron microscopy, negative contrast with 2% aqueous solution of uranyl acetate
Таким образом, сочетание ультрафильтрации и двойного ультрацентрифугирования позволяет получить образцы экзосом из плазмы крови без примесей частиц более 100 нм, а форма и размер этих везикул соответствуют характеристикам экзосом, выделенных из других биологических жидкостей [14-17].
Заключение
Исследования экзосом с их внутренним содержимым, таким как микроРНК или длинные некодирующие PHK(lncRNAs), при онкологии, сердечно-сосудистых заболеваниях, иммунных заболеваниях представляют новые возможности для новых открытий с целью понимания патогенеза, разработки генной терапии и потенциальных диагностических и прогностических биомаркеров. Анализ микроРНК или lncRNAs при раковых заболеваниях имеет свои уникальные особенности, такие как идентификация определенных некодирующих РНК, идентификация мишени(-ей) l и изучение взаимодействия между микроРНК или lncRNAs и их мишенями. Другим прорывом, который мы сейчас видим, является исследование микроРНК и lncRNAs в циркулирующих экзосомах, которые в настоящее время благодаря различным методам изоляции доступны и позволяют изучать их в качестве биомаркеров при GBM. Описанный здесь экспериментальный протокол для экстракции экзосом из плазмы пациентов с GBM является эффективным методом обеспечения чистоты экзосом. Использование этого метода дает возможности для будущих исследований относительно роли экзосом в патогенезе GBM, и его можно было бы в равной степени использовать для исследований с другими патологиями человека.
Информация о конфликте интересов.
Конфликт интересов отсутствует.
Список литературы
1. Tian W., Liu S., Li B. Potential role of exosomes in cancer metastasis. Biomed Res Int. 2019;2019:4649705. DOI: 10.1155/2019/4649705
2. Osaki M., Okada F. Exosomes and their role in cancer progression. Yonago Acta Med. 2019;62(2):182–90. DOI: 10.33160/yam.2019.06.002
3. Zhang H., Wang L., Li C., Yu Y., Yi Y., Wang J., et al. Exosomeinduced regulation in inflammatory bowel disease. Front Immunol. 2019;10:1464. DOI: 10.3389/fimmu.2019.01464
4. Lema D.A., Burlingham W.J. Role of exosomes in tumour and transplant immune regulation. Scand J Immunol. 2019 Jul 8:e12807. DOI: 10.1111/sji.12807
5. Kelemen E., Danis J., Göblös A., Bata-Csörgő Z., Széll M. Exosomal long non-coding RNAs as biomarkers in human diseases. EJIFCC. 2019;30(2):224–36. PMID: 31263395
6. Wang X., Zhong W., Bu J., Li Y., Li R., Nie R., et al. Exosomal protein CD82 as a diagnostic biomarker for precision medicine for breast cancer. Mol Carcinog. 2019;58(5):674–85. DOI: 10.1002/mc.22960
7. Laidlaw K.M.E., MacDonald C. Endosomal trafficking of yeast membrane proteins. Biochem Soc Trans. 2018;46(6):1551–58. DOI: 10.1042/ BST20180258
8. Chutipongtanate S., Greis K.D. Multiplex biomarker screening assay for urinary extracellular vesicles study: a targeted label-free proteomic approach. Sci Rep. 2018;8(1):15039. DOI: 10.1038/s41598-018-33280-7
9. Bowers K. RNA interference-mediated inhibition of ESCRT in mammalian cells. Methods Mol Biol. 2019;1998:305–18. DOI: 10.1007/978- 1-4939-9492-2_22
10. Sharma S., Scholz-Romero K., Rice G.E., Salomon C. Methods to enrich exosomes from conditioned media and biological fluids. Methods Mol Biol. 2018;1710:103–15. DOI: 10.1007/978-1-4939-7498-6_8
11. Koritzinsky E.H., Street J.M., Star R.A., Yuen P.S. Quantification of exosomes. J Cell Physiol. 2017;232(7):1587–90. DOI: 10.1002/jcp.25387
12. Luarte A., Bátiz L.F., Wyneken U., Lafourcade C. Potential therapies by stem cell-derived exosomes in CNS diseases: focusing on the neurogenic niche. Stem Cells Int. 2016;2016:5736059. DOI: 10.1155/2016/5736059
13. Moon J.M., Xu L., Giffard R.G. Inhibition of microRNA-181 reduces forebrain ischemia-induced neuronal loss. J Cereb Blood Flow Metab. 2013;33(12):1976–82. DOI: 10.1038/jcbfm.2013.157
14. Elsharkawi F., Elsabah M., Shabayek M., Khaled H. Urine and serum exosomes as novel biomarkers in detection of bladder cancer. Asian Pac J Cancer Prev. 2019;20(7):2219–24. DOI: 10.31557/APJCP.2019.20.7.2219
15. Zhou N., Li C., Zhou Y., Liu J., Su X., Qin H., et al. Potential markers from serum-purified exosomes for detecting oral squamous cell carcinoma metastasis. Cancer Epidemiol Biomarkers Prev. 2019 Jul 26;pii: cebp.1122.2018. DOI: 10.1158/1055-9965.EPI-18-1122
16. Doyle L.M., Wang M.Z. Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosome isolation and analysis. Cells. 2019;8(7):E727. DOI: 10.3390/cells8070727
17. Malla B., Aebersold D.M., Dal Pra A. Protocol for serum exosomal miRNAs analysis in prostate cancer patients treated with radiotherapy. J Transl Med. 2018;16(1):223. DOI: 10.1186/s12967-018-1592-6
Об авторах
И. Ф. ГареевРоссия
Гареев Ильгиз Фанилевич — аспирант кафедры нейрохирургии и медицинской реабилитации с курсом ИДПО
тел.: +7 9374952927
О. А. Бейлерли
Россия
Бейлерли Озал Арзуман оглы — аспирант кафедры урологии с курсом ИДПО, тел.: +79875980003
Sh. Zhao
Россия
Shiguang Zhao — профессор, зав. кафедрой нейрохирургии
G. Yang
Россия
Guang Yang — врач-нейрохирург, ассистент кафедры нейрохирургии
J. Sun
Россия
Jingxian Sun — аспирант кафедры нейрохирургии
А. Т. Бейлерли
Россия
Бейлерли Аферин Таги кызы — клинический ординатор 2 года обучения кафедры акушерства и гинекологии №1
Ш. М. Сафин
Россия
Сафин Шамиль Махмутович — д.м.н., профессор, зав. кафедрой нейрохирургии и медицинской реабилитации с курсом ИДПО
Рецензия
Для цитирования:
Гареев И.Ф., Бейлерли О.А., Zhao Sh., Yang G., Sun J., Бейлерли А.Т., Сафин Ш.М. Экстракция экзосом из плазмы крови пациентов с мультиформной глиобластомой. Креативная хирургия и онкология. 2019;9(3):234-238. https://doi.org/10.24060/2076-3093-2019-9-3-234-238
For citation:
Gareev I.F., Beylerli O.A., Zhao Sh., Yang G., Sun J., Beilerli A.T., Safin Sh.M. Extraction of Exosomes from Glioblastoma Multiforme Patients’ Blood Plasma. Creative surgery and oncology. 2019;9(3):234-238. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-3-234-238


































