Перейти к:
Клинический и патологоанатомический анализ причин внезапной смерти после планового хирургического лечения
https://doi.org/10.24060/2076-3093-2020-10-2-154-161
Аннотация
Введение. Увеличение частоты онкологической патологии, внедрение новых хирургических методов, улучшающих качество и продолжительность жизни, приводят к постоянному росту проводимых некардиохирургических операций у пациентов пожилого возраста. Принимая во внимание тенденцию общего старения населения, кумуляцию коморбидных пациентов, рост пациентов с имплантированными медицинскими девайсами, оценка основных факторов риска развития периоперационных нежелательных событий становится более актуальной.
Материалы и методы. В этой статье на примере клинического случая пожилого пациента представлена распространенность проблемы, подходы к оценке периоперационного риска, методы выявления факторов риска на предоперационном этапе и значение информирования пациента об имеющемся риске.
Результаты и их обсуждение. По результатам патологоанатомического исследования выявлено: атеросклероз коронарных артерий IV стадии 3-й степени. Стеноз просвета левой и правой коронарных артерий до 60–80 %. Разрушение и расслоение поверхности атеросклеротической бляшки в левой коронарной артерии с кровоизлиянием в основание («нестабильная бляшка»). Ишемическая дистрофия миокарда, очаги неравномерного кровенаполнения миокарда. Анализ клинического случая, обзор доступной литературы и американских и европейских руководств по оценке кардиологических рисков пациентов нехирургического профиля демонстрируют необходимость разработки новой версии национальных рекомендаций по периоперационной оценке риска. При такой доработке, по-видимому, необходимо опираться не только на имеющиеся международные рекомендации, но и на результаты последних метаанализов, посвященных прогностической роли стресс-тестов, рутинной коронарной ангиографии и превентивной реканализации миокарда перед хирургическим вмешательством.
Заключение. Таким образом, можно резюмировать, что имеющиеся клинические рекомендации и шкалы оценки рисков не содержат готовых рецептов на все случаи жизни, а могут быть только основой для принятия решения в конкретных клинических ситуациях и не обеспечивают достаточную протекцию пациентов в операционной.
Ключевые слова
Для цитирования:
Самородов А.В., Ураков А.Л., Золотухин К.Н., Дашкин Р.Р., Исмагилов Н.Г., Абубакирова А.И., Пахомова З.Р., Мухаметшина З.Р. Клинический и патологоанатомический анализ причин внезапной смерти после планового хирургического лечения. Креативная хирургия и онкология. 2020;10(2):154-161. https://doi.org/10.24060/2076-3093-2020-10-2-154-161
For citation:
Samorodov A.V., Urakov A.L., Zolotukhin K.N., Dashkin R.R., Ismagilov N.G., Abubakirova A.I., Pakhomova Z.R., Mukhametshina Z.R. Clinical and Pathological Analysis of Sudden Death after Planned Surgery. Creative surgery and oncology. 2020;10(2):154-161. (In Russ.) https://doi.org/10.24060/2076-3093-2020-10-2-154-161
Введение
Увеличение частоты онкологической патологии, внедрение новых хирургических методов, улучшающих качество и продолжительность жизни (эндопротезирование суставов, устранение геморроидальных узлов, пластические операции и т. д.), приводят к постоянному росту числа некардиохирургических операций у пациентов старшей возрастной группы [1]. Однако любое хирургическое вмешательство сопряжено с определенными рисками. И если принимать во внимание тенденцию общего старения населения, кумуляцию коморбидных пациентов, рост числа пациентов с имплантированным медицинскими девайсами, оценка основных факторов риска развития периоперационных нежелательных событий становится более актуальной [2, 3]. В этой статье на примере клинического случая летального исхода пожилого пациента мы рассмотрим распространенность проблемы, подходы к оценке периоперационного риска, методы выявления факторов риска на предоперационном этапе и значение информирования об имеющемся риске пациента.
Материалы и методы
Клинический случай. Пациент Б., 69 лет, поступил в ГБУЗ РКБ им Г. Г. Куватова на плановое оперативное лечение с диагнозом: доброкачественная гиперплазия предстательной железы. Надлобковый мочепузырный свищ.
Анамнез заболевания: болеет более 4-х лет, никогда не наблюдался у специалистов, никого лечения не получал. В декабре 2019 года случилась острая задержка мочи, по поводу чего ему была выполнена экстренно эпицистостомия по месту жительства в центральной районной больнице. После дообследования пациент был маршрутизирован в ГБУЗ РКБ им Г. Г. Куватова для проведения высокотехнологической помощи — чреспузырной аденомэктомии.
Данные инструментальных и лабораторных методов исследования:
ЭКГ: синусовый ритм с ЧСС 70 в минуту. Трансторакальная эхокардиоскопия: уплотнение стенок аорты. Сократительная функция миокарда сохранена. Незначительная дилатация обоих желудочков. Диастолическая дисфункция ЛЖ по 1-му типу. Незначительная эксцентрическая гипертрофия миокарда ЛЖ. ФВ — 67 %.
УДС вен нижних конечностей: магистральной патологии вен нижних конечностей не выявлено.
ТРУЗИ: объем предстательной железы 224,2 см3. Консультация кардиолога: гипертоническая болезнь II, ст. 1, риск 3. На момент осмотра противопоказаний к оперативному вмешательству нет.
После стандартной премедикации пациент в 9.30 транспортирован в операционную. Установлен периферический катетер Vasofix Certo 16G (B. Braun, Германия). Индукция осуществлена в виде медленной внутривенной болюсной инъекции пропофола с интервалом 10 секунд в дозе 3,0 мг/кг массы тела. На фоне миоплегии после преоксигенации (O2 — 100 %) произведена интубация трахеи интубационной трубкой 8,0 без особенностей. Миорелаксация на этапах вводного и основного наркозов проводилась болюсным введением рокурония бромида. ИВЛ аппаратом Datex Ohmeda Aespire/5, после интубации трахеи подключили ингаляцию севофлурана в объемной дозе 1,5-2,5 %. Центральная аналгезия поддерживалась введением субнаркотических доз фентанила 2,0-2,5 мкг/кг.
После трехкратной обработки операционного поля спиртовым раствором хлоргексидина под эндотрахеальным наркозом разрез кожи над лоном 10 см. Послойно выделен надлобковый мочепузырный свищ до мочевого пузыря, иссечен, остро выделена предпузырная клетчатка. Тупым и острым путем выделена передняя стенка мочевого пузыря. Стенка мочевого пузыря взята на держалки. Мочевой пузырь вскрыт. Стенка мочевого пузыря взята на держалки, вскрыта, в полости мочевого пузыря определяется больших размеров средняя доля, пролабирующая в просвет мочевого пузыря. Решено выполнить чреспузырную аденомэктомию. Далее выполнено пальцевое вылущивание аденомы средней, правой и левой долей предстательной железы последовательно. Ревизия ложа. Шейка сформирована узловыми викриловыми швами № 3. Через уретру выведен катетер, гематурия ch 22, раздут баллон до 35 мл, натянут. Гемостаз адекватный. Через верхушку мочевого пузыря установлена цистостома (катетер Фолея ch 20). Уретральный катетер фиксирован лигатурой. Непрерывным двухрядным викриловым швом достигнута герметичность мочевого пузыря. Цистостома и уретральный катетер промыты, функционируют адекватно. Установлен страховой трубчатый дренаж через контрапертуру, фиксирован к коже. Рана ушита послойно. Адаптивные швы на кожу. Установлена ирригационная система. Ткань удаленной аденомы предстательной железы направлена на гистологическое исследование. Кровопотеря 700 мл. По окончании операции на операционном столе в 10:20 снижение артериального давления до 60/30 мм рт. ст., реанимационные мероприятия в течение 40 минут в полном объеме, без эффекта. В 11:10 констатирована смерть. Выставлен диагноз:
Основное заболевание: ИБС. Острая коронарная смерть: атеросклероз коронарных артерий IV стадии, 3 степени.
Осложнение основного заболевания: острая сердечно-сосудистая недостаточность, остановка сердца. Острое общее венозное полнокровие. Кровоизлияния в надпочечники, легкие, некроз эпителия канальцев почек. Темная жидкая кровь в сердце, аорте, просвете сосудов. Очаги неравномерного кровенаполнения миокарда. Отек головного мозга. Венозное полнокровие и паренхиматозная дистрофия внутренних органов.
Сопутствующие заболевания: ДГПЖ. Надлобковый мочепузырный свищ. Операция: Чреспузырная аденомэктомия. Атеросклероз аорты IV стадии, III степени.
Результаты патологоанатомического исследования. Сердечно-сосудистая система: Проба на воздушную эмболию отрицательная. В полости перикарда до 20 мл прозрачной жидкости желтого цвета. Эпикард блестящий, гладкий. Консистенция сердечной мышцы плотная. Кровенаполнение полостей сердца: в просвете правого и левого желудочков темная жидкая кровь в небольшом количестве. Толщина стенки желудочка левого 1,7 см, правого — 0,3 см. Толщина межжелудочковой перегородки 1,2 см, эндокард гладкий, блестящий. Правые и левые отделы сердца незначительно расширены. На разрезе миокард по передней и задней стенке левого желудочка коричневого цвета с участками светло-коричневого цвета, очагами неравномерного кровенаполнения, влажный, блестящий. Межжелудочковая перегородка с очагами неравномерного кровенаполнения. Папиллярные мышцы гипертрофированы. Клапаны сердца: фиброзные кольца и створки аортального и митрального клапанов уплотнены. Венечные артерии — устья проходимы, просвет зияет с наличием липидных пятен и полосок. Левая венечная артерия (огибающая и передняя межжелудочковая ветви): стенки утолщены, кальцинированы, интима с липидными полосками, пятнами и фиброзными бляшками. В огибающей ветви имеется нестабильная атеросклеротическая бляшка с разрывом покрышки и кровоизлиянием. Стеноз левой венечной артерии: передней межжелудочковой ветви до 75 % на различном протяжении, огибающей ветви до 80 %. Правая венечная артерия: стенки утолщены, кальцинированы, интима с липидными полосками, пятнами и фиброзными бляшками. Стеноз правой венечной артерии до 60 %. Аорта в просвете содержит жидкую кровь. В восходящем, грудном отделе интима желтого цвета, с липидными пятнами и полосками, фиброзными бляшками. В брюшном отделе с липидными пятнами и полосками, фиброзными бляшками, наличием единичных кальцинатов в стенке. В просвете верхней и нижней полых вен темная жидкая кровь. В сосудах нижних конечностей темная жидкая кровь, тромбы отсутствуют.
Результаты гистологического исследования
Головной мозг: периваскулярный и перицеллюлярный отек, полнокровие сосудов микроциркуляторного русла, дистрофические изменения клеток. Гипофиз — нормального гистологического строения.
Сердце: выраженный интерстициальный отек, паретическое расширение и полнокровие сосудов микроциркуляторного русла, полнокровие расширенных вен, фрагментация мышечных волокон, гипертрофия кардиомиоцитов. Определяются очаговые диапедезные кровоизлияния (рис. 1).
Также визуализируются очаги липидизации миокарда, межуточного склероза (рис. 2).
При окраске методом ШИК-реакции определяются участки неравномерного распределения гранул гликогена в кардиомиоцитах (рис. 3).
Стенки коронарных артерий с атеросклеротическими изменениями, фиброз средней оболочки с участками отложения кальцинатов. В просвете огибающей артерии имеется нестабильная атеросклеротическая бляшка, частично суживающая просвет, с расслоением и разрывом покрышки и кровоизлиянием в основание, наличием пенистых клеток, тромбоцитов, игольчатых структур кристаллов холестерина (рис. 4 А, Б).
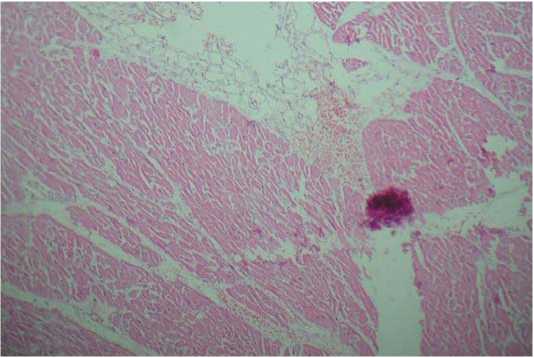
Рисунок 1. Миокард. х100
Figure 1. Myocard, х100
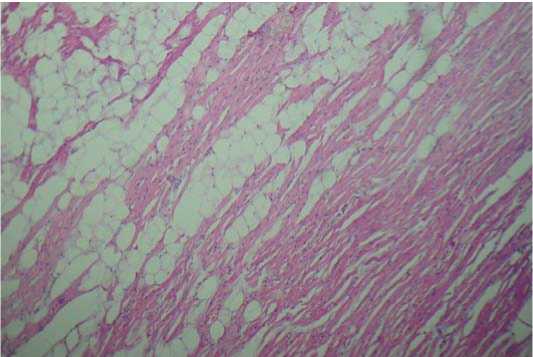
Рисунок 2. Липидизация («ожирение») миокарда — признак гипоксических повреждений. х400
Figure 2. Myocardial lipidisation ("obesity"), a signature of hypoxia, х400
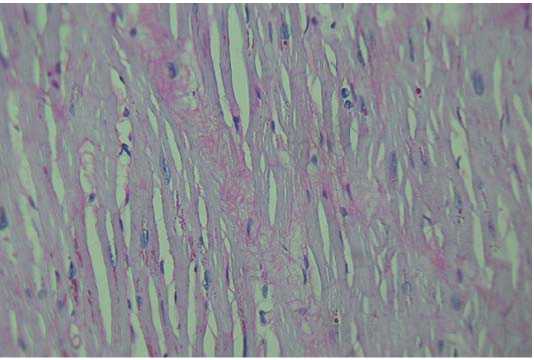
Рисунок 3. ШИК-реакция (неравномерное распределение гранул гликогена в кардиомиоцитах — признак ишемических повреждений)
Figure 3. PAS reaction (uneven glycogen accumulation in cardiomyocytes in ischemia)
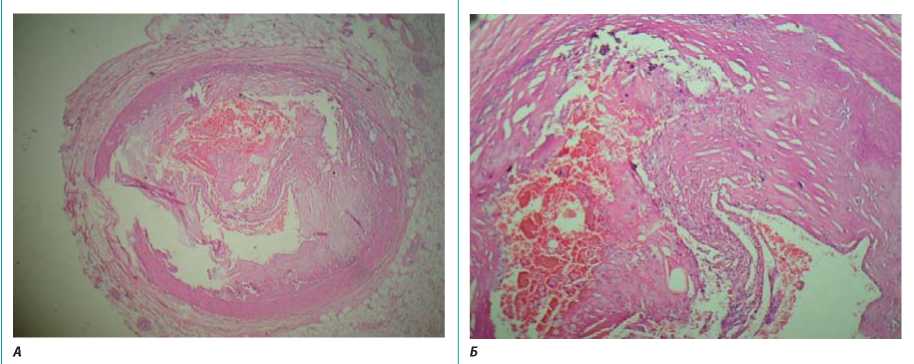
Рисунок 4. Левая коронарная артерия. А — х100, Б — х400
Figure 4. Left coronary artery. A — х100, Б — х400
Легкие: слабовыраженный отек. Полнокровие сосудов, стазы и сладж эритроцитов. Очаговые ателектазы и дистелектазы. Очаговые внутриальвеолярные кровоизлияния. В просвете отдельных альвеол клетки слущенного альвеолярного эпителия. Межальвеолярные перегородки местами очагово инфильтрированы лимфоцитами. Альвеолы местами эмфизематозно расширены, перегородки их истончены. Перибронхиальный и периваскулярный склероз. Бронхи и бронхиолы не спазмированы, эпителий местами десквамирован (рис. 5).
Почки: отек, полнокровие сосудов, стазы и сладж эритроцитов. Дистрофические, некробиотические и некротические изменения эпителия канальцев. В просвете канальцев гиалиновые цилиндры, участки «щитовидного» строения. Капсулы клубочков расширены, капилляры полнокровные. Очаги нефросклероза. Артериосклероз.
Надпочечники: отек, полнокровие, дистрофия и делипидизация клеток, очаговые кровоизлияния (рис. 6).
Результаты и обсуждение
Традиционно наиболее грозными интраоперационными кардиологическими осложнениями у пациентов некардиохирургического профиля являются нелетальный инфаркт миокарда (возможно, и с остановкой сердечной деятельности) и смерть [4]. Установлено, что показатель летальности у пациентов, перенесших инфаркт миокарда во время некардиохирургической операции, составляет 15-25 % [5] и 65 % [6] у пациентов после интраоперационной остановки сердечной деятельности. При этом инфаркт миокарда в периоперационном периоде является независимым предиктором сердечно-сосудистой смерти или повторного инфаркта миокарда в течение 6 месяцев после операции, а нелетальная остановка сердечной деятельности является фактором риска смерти на протяжении 5 лет после операции [7].
Логично предположить, что наиболее часто сердечно-сосудистая катастрофа случается у пациентов с исходной ишемической болезнью сердца. Что объясняется, с одной стороны, ростом количества пациентов с заболеваниями коронарных сосудов сердца, с другой стороны, увеличением продолжительности жизни, достаточной для развития других состояний, требующих хирургического вмешательства, вплоть до плановой ортопедической операции [8]. Однако результаты метаанализов, направленных на оценку риска развития инфаркта миокарда в периоперационном периоде плановой операции, демонстрирует 3,9 % (95 % ДИ от 3,3 до 4,6 %) вероятность развития кардиологического осложнения у пациентов с ишемической болезнью сердца [9]. При этом, по данным Lee и соавт., основные периоперационные кардиальные события происходят у 1,4 % (95 % ДИ от 1,0 до 1,8 %) пациентов в возрасте 50 лет и старше [10]. Пациенты, подвергнувшиеся экстренной хирургической операции, имеют более высокий риск серьезных периоперационных сердечных событий, чем пациенты, перенесшие плановую операцию, — 10 % (95 % ДИ 1,2-5,6) [11]. Принимая во внимание, что ежегодно около 100 миллионов взрослых во всем мире подвергаются некардиохирургической операции, а половина из этих пациентов относится к возрастной группе риска, можно предположить, что каждый год от 500 000 до 900 000 пациентов во всем мире потенциально подвержены развитию периоперационной сердечной смерти, нелетальных инфаркта миокарда и остановки сердечной деятельности [12]. Представляется достаточно интересным отсутствие клинических рекомендаций по оценке риска у пациентов старшей возрастной группы.
В доступной литературе имеется только одно исследование, в котором изучалась причина остановки сердца у пациентов, перенесших некардиохирургические операции. Sprung и соавт. провели анализ 223 случаев остановки сердца, которая происходила между вводным наркозом и палатой пробуждения у пациентов, и установили, что к летальному исходу в периоперационном периоде приводят либо кровотечение, либо кардиогенные причины. В исследованиях, посвященных периоперационной сердечной смерти, авторы объясняют причину инфаркта миокарда аритмией в 66 % случаев, сердечной недостаточностью в 34 % случаев. Однако нет информации о том, является ли ишемия, аритмия или существовавшая ранее кардиомиопатия причиной данной сердечной недостаточности, которая привела к смерти [13].
По результатам гистологического исследования у нашего пациента была найдена атеросклеротическая бляшка. Артериальный тромбоз является основной причиной большинства инфарктов миокарда «за пределами» операционных. По данным Palasubramaniam J. и др. [14], более чем у половины пациентов идентифицируется атеросклеротическая бляшка коронарных артерий и у 65-95 % пациентов находится внутрипросветный окклюзирующий тромб. Однако механизм развития инфаркта миокарда в условиях хирургического вмешательства может отличаться. Два исследования коронарной патологии, лежащей в основе периоперационного инфаркта миокарда со смертельным исходом, выявили, что у двух третей пациентов было значительное атеросклеротическое поражение именно левой коронарной артерии, у большинства пациентов бляшки были структурно цельными и только у одной трети пациентов находили интракоронарный тромб [15]. Эти данные свидетельствуют о том, что значительная доля смертельных периоперационных инфарктов миокарда может быть результатом увеличения потребности в кислороде миокарда в условиях фиксированных стенозов коронарных артерий [16]. При этом имеются результаты другого исследования с участием пациентов кардиохирургического профиля, где показано, что большинство нелетальных периоперационных инфарктов миокарда происходило в артериях без выраженных стенозов, а значит, события могли быть вызваны повреждением атеросклеротических бляшек и острым тромбозом коронарной артерии [17].
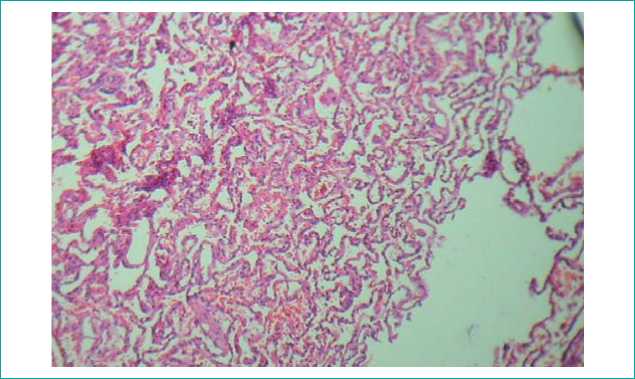
Рисунок 5. Точечные кровоизлияния легких. х100
Figure 5. Local pulmonary haemorrhages, х100
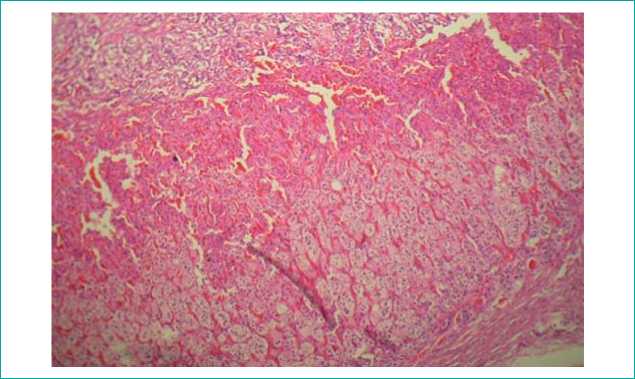
Рисунок 6. Кровоизлияния в корковом слое надпочечника. х100
Figure 6. Adrenal cortical layer haemorrhages х100
Хирургическое вмешательство с сопутствующей травмой, системным воспалительным ответом, анестезией и анальгезией, болью, гипотермией, кровотечением, анемией и нутритивной недостаточностью аналогично экстремальному стресс-тесту. Сочетание данных факторов провоцирует воспалительные, гиперкоагуляционные, стрессовые и гипоксические состояния, которые связаны с периоперационным повышением уровня тропонина, тромбозом артерий и смертностью [18, 19]. Увеличенный объем хирургической травмы может инициировать воспалительные и гиперкоагуляционные состояния, провоцировать выработку фактора некроза опухоли-а, IL-1, IL-6 и С-реактивного белка [20, 21], которые играют непосредственную роль в деструкции атеросклеротических бляшек [22]. В свою очередь, состояние гиперкоагуляции обуславливает активность ингибитора активатора плазминогена-1, фактора VIII и реактивность тромбоцитов, приводит к снижению активности антитромбина III, что способствует развитию острого коронарного тромбоза на фоне деструкции атеросклеротической бляшки [23]. Повышение уровня гормонов стресса — кортизола и адреналина приводит к относительному дефициту инсулина и увеличению уровня свободных жирных кислот, увеличению потребности миокарда в кислороде, изменению турбулентности движения крови по коронарным артериям, что может спровоцировать повреждение атеросклеротической бляшки и острый коронарный тромбоз. Немаловажным является тот факт, что анестезиологическое сопровождение оперативного вмешательства не в состоянии нивелировать все негативные последствия хирургической травмы и снизить последствия системного воспалительного ответа, что и произошло у нашего пациента [24].
Несмотря на то что ни одно исследование не подтвердило клиническую эффективность прогностических шкал кардиогенных рисков, предоперационная оценка сердечного риска должна проводиться. Индекс, предложенный Lee и соавт., является наиболее клинически отработанным и применяемым индексом риска. Он состоит из шести одинаково взвешенных факторов риска сердечно-сосудистых заболеваний: хирургия высокого риска (полостная, торакальная, сосудистая хирургия), ишемическая болезнь сердца и сердечная недостаточность в анамнезе, цереброваскулярные заболевания (инсульт или транзиторная ишемическая атака), применение инсулиновой терапии при диабете и уровень креатинина в сыворотке крови. Хотя есть много положительных аспектов индекса Lee, исследование, по результатам которого оно было рекомендовано в практику, имело очень принципиальные ограничения: отсутствие экстренной хирургии и хирургические случаи с ожидаемой продолжительностью пребывания менее 2 суток. Возвращаясь к нашему клиническому случаю, можно отметить, что наш пациент, согласно индексу Lee, не относился к группе высокого риска кардиогенных осложнений. Принимая во внимание низкую чувствительность индекса Lee, в качестве альтернативы в американских и европейских клинических рекомендациях предложено использовать другие шкалы оценки риска: NSQIP MICA, калькулятор хирургического риска ACS NSQIP, реконструированный RCRI [25]. Согласно данным рекомендациям среди неинвазивных тестов превосходной прогностической точностью по оценке периоперационной сердечной смерти характеризуется стресс-эхокардиография с добутамином. Однако ценность данного метода отмечалась только для пациентов, перенесших операцию на сосудах [26]. Эти результаты требуют осторожной интерпретации по следующим причинам: в большинстве исследований, включенных в метаанализ, использовались слабые методы (например, ретроспективный дизайн, неспособность слепых людей интерпретировать результаты теста для клинических предикторов риска); кумулятивная частота событий для большинства тестов была низкой; была значительная неоднородность по результатам исследования для отдельных тестов; и результаты теста были проанализированы с использованием одного порога (то есть результаты были дихотомизированы как положительные или отрицательные).
Заключение
Анализ клинического случая летального исхода, американских и европейских руководств по оценке кардиологических рисков пациентов некардиохирургического профиля демонстрирует необходимость разработки новой версии национальных рекомендаций по периоперационной оценке риска, особенно пациентов гериатрического профиля. В данной работе, по-видимому, необходимо будет опираться не только на имеющиеся международные рекомендации, но и на результаты последних метаанализов, посвященных прогностической роли стресс-тестов, рутинной коронарной ангиографии и превентивной реканализации миокарда перед плановым или экстренным хирургическим вмешательством. Настоящий анализ клинического случая еще раз демонстрирует, что имеющиеся рекомендации не содержат готовых рецептов на все случаи жизни, а могут быть только основой для принятия решения в конкретных клинических ситуациях и не обеспечивают достаточную протекцию пациентов в операционной.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Информированное согласие. Информированное согласие пациента на сбор, обработку и представление обезличенных результатов медицинского обследования/лечения получено прижизненно.
Информация о спонсорстве. Дaннaя рaбoтa не финaнсирoвaлaсь.
Список литературы
1. Campbell D., Boyle L., Soakell-Ho M., Hider P., Wilson L., Koea J., et al. National risk prediction model for perioperative mortality in non-cardiac surgery. Br J Surg. 2019;106(11):1549–57. DOI: 10.1002/bjs.11232
2. Ackland G.L., Abbott T.E.F., Cain D., Edwards M.R., Sultan P., Karmali S.N., et al. Preoperative systemic infl ammation and perioperative myocardial injury: prospective observational multicentre cohort study of patients undergoing non-cardiac surgery. Br J Anaesth. 2019;122(2):180–7. DOI: 10.1016/j.bja.2018.09.002
3. McNeely C., Markwell S., Filson K., Hazelrigg S., Vassileva C. Eff ect of hospital volume on prosthesis use and mortality in aortic valve operations in the elderly. Ann Th orac Surg. 2016;101(2):585–90. DOI: 10.1016/j.athoracsur.2015.07.010
4. Daniel V.T., Rushing A.P., Ingraham A.M., Ricci K.B., Paredes A.Z., Diaz A., et al. Association between operating room access and mortality for life-threatening general surgery emergencies. J Trauma Acute Care Surg. 2019;87(1):35–42. DOI: 10.1097/TA.0000000000002267
5. Lin H.S., Watts J.N., Peel N.M., Hubbard R.E. Frailty and post-operative outcomes in older surgical patients: a systematic review. BMC Geriatr. 2016;16(1):157. DOI: 10.1186/s12877-016-0329-8
6. Sprung J., Warner M.E., Contreras M.G., Schroeder D.R., Beighley C.M., Wilson G.A. Predictors of survival following cardiac arrest in patients undergoing noncardiac surgery: a study of 518 294 patients at a tertiary referral center. Anesthesiology. 2003;99(2):259–69. DOI: 10.1097/00000542-200308000-00006
7. Al-Oweidi A.S., Albabtain H., Kharabsheh S.M., Kimme P., Almustafa M., Seder S., et al. Prevalence and predictors of myocardial ischemia by preoperative myocardial perfusion single photon emission computed tomography in patients undergoing noncardiac surgery. Ann Saudi Med. 2017;37(6):461–8. DOI: 10.5144/0256-4947.2017.461
8. McEvoy J.W., Chen Y., Rawlings A., Hoogeveen R.C., Ballantyne C.M., Blumenthal R.S., et al. Diastolic blood pressure, subclinical myocardial damage, and cardiac events: implications for blood pressure control. J Am Coll Cardiol. 2016;68(16):1713–22. DOI: 10.1016/j.jacc.2016.07.754
9. Zhang L.J., Li N., Li Y., Zeng X.T., Liu M.Y. Cardiac biomarkers predicting MACE in patients undergoing noncardiac surgery: a meta-analysis. Front Physiol. 2019;9:1923. DOI: 10.3389/fphys.2018.01923
10. Lee T.H., Marcantonio E.R., Mangione C.M., Th omas E.J., Polanczyk C.A., Cook E.F., et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation 1999;100:1043–9. DOI: 10.1161/01.cir.100.10.1043
11. Smith T., Li X., Nylander W., Gunnar W. Th irty-day postoperative mortality risk estimates and 1-year survival in veterans health administration surgery patients. JAMA Surg. 2016;151(5):417–22. DOI: 10.1001/jamasurg.2015.4882
12. Smilowitz N.R., Gupta N., Ramakrishna H., Guo Y., Berger J.S., Bangalore S. Perioperative major adverse cardiovascular and cerebrovascular events associated with noncardiac surgery. JAMA Cardiol. 2017;2(2):181–7. DOI: 10.1001/jamacardio.2016.4792
13. Khubchandani J.A., Ingraham A.M., Daniel V.T., Ayturk D., Kiefe C.I., Santry H.P. Geographic diff usion and implementation of acute care surgery: an uneven solution to the National Emergency General Surgery Crisis. JAMA Surg. 2018;153(2):150–9. DOI: 10.1001/jamasurg.2017.3799
14. Palasubramaniam J., Wang X., Peter K. Myocardial infarction-from atherosclerosis to thrombosis. Arterioscler Th romb Vasc Biol. 2019;39(8):e176–85. DOI: 10.1161/ATVBAHA.119.312578
15. Magoon R., Makhija N., Das D. Perioperative myocardial injury and infarction following non-cardiac surgery: A review of the eclipsed epidemic. Saudi J Anaesth. 2020;14(1):91–9. DOI: 10.4103/sja.SJA_499_19
16. Helwani M.A., Amin A., Lavigne P., Rao S., Oesterreich S., Samaha E., et al. Etiology of Acute Coronary Syndrome aft er Noncardiac Surgery. Anesthesiology. 2018;128(6):1084–91. DOI: 10.1097/ALN.0000000000002107
17. Vester-Andersen M., Lundstrom L.H., Buck D.L., Moller M.H. Association between surgical delay and survival in high-risk emergency abdominal surgery. A population-based Danish cohort study. Scand J Gastroenterol. 2016;51(1):121–8. DOI: 10.3109/00365521.2015.1066422
18. Vrsalović M., Vrsalović Presečki A. Admission C-reactive protein and outcomes in acute aortic dissection: a systematic review. Croat Med J. 2019;60(4):309–15. DOI: 10.3325/cmj.2019.60.309
19. Buse G.L., Manns B., Lamy A., Guyatt G., Polanczyk C.A., Chan M.T.V., et al. Troponin T monitoring to detect myocardial injury aft er noncardiac surgery: a cost-consequence analysis. Can J Surg. 2018;61(3):185–94. DOI: 10.1503/cjs.010217
20. Habbab K.M., D’Aiuto F., Habbab M.A., Porter S.R. Molecular markers relevant to myocardial injury following dental extraction in patients with or without coronary artery disease. BDJ Open. 2019;5:9. DOI: 10.1038/s41405-019-0018-8
21. Michailidou M., Kulvatunyou N., Friese R.S., Gries L., Green D.J., Joseph B., et al. Time and cost analysis of gallbladder surgery under the acute care surgery model. J Trauma Acute Care Surg. 2014;76(3):710–4. DOI: 10.1097/TA.0000000000000117
22. Juan Wang, Guo-Juan Tan, Li-Na Han, Yong-Yi Bai, Miao He, Hong-Bin Liu. Novel biomarkers for cardiovascular risk prediction. J Geriatr Cardiol. 2017;14(2):135–50. DOI: 10.11909/j.issn.1671-5411.2017.02.008
23. Hansson G.K., Libby P., Tabas I. Inflammation and plaque vulnerability. J Intern Med. 2015;278(5):483–93. DOI: 10.1111/joim.12406
24. Rahat T., Nguyen T., Latif F. Role of prophylactic coronary revascularisation in improving cardiovascular outcomes during non-cardiac surgery: A narrative review. Neth Heart J. 2016;24(10):563–70. DOI: 10.1007/s12471-016-0871-1
25. Bilimoria K.Y., Liu Y., Paruch J.L., Zhou L., Kmiecik T.E., Ko C.Y., et al. Development and evaluation of the universal ACS NSQIP surgical risk calculator: a decision aid and informed consent tool for patients and surgeons. J Am Coll Surg. 2013;217:833–42. DOI: 10.1016/j.jamcollsurg.2013.07.385
26. Kertai M.D., Boersma E., Bax J.J., Heijenbrok-Kal M.H., Hunink M.G., L’Talien G.J., et al. A meta-analysis comparing the prognostic accuracy of six diagnostic tests for predicting perioperative cardiac risk in patients undergoing major vascular surgery. Heart. 2003;89:1327–34. DOI: 10.1136/heart.89.11.1327
Об авторах
А. В. СамородовРоссия
Самородов Александр Владимирович — д.м.н., кафедра анестезиологии и реаниматологии с курсом ИДПО.
А. Л. Ураков
Россия
Ураков Александр Ливиевич — д.м.н., профессор, кафедра общей и клинической фармакологии.
К. Н. Золотухин
Россия
Золотухин Константин Николаевич — к.м.н., анестезиолого-реанимационное отделение № 1.
Р. Р. Дашкин
Россия
Дашкин Равиль Ринатович — Республиканское патологоанатомическое бюро.
Н. Г. Исмагилов
Россия
Исмагилов Наиль Гарифулович — Республиканское патологоанатомическое бюро.
А. И. Абубакирова
Россия
Абубакирова Альфия Ирековна — отделение клинической фармакологии.
З. Р. Пахомова
Россия
Пахомова Зульфия Расимовна — клинико-диагностическая лаборатория.
З. Р. Мухаметшина
Россия
Мухаметшина Зульфия Раисовна — клинико-диагностическая лаборатория.
Рецензия
Для цитирования:
Самородов А.В., Ураков А.Л., Золотухин К.Н., Дашкин Р.Р., Исмагилов Н.Г., Абубакирова А.И., Пахомова З.Р., Мухаметшина З.Р. Клинический и патологоанатомический анализ причин внезапной смерти после планового хирургического лечения. Креативная хирургия и онкология. 2020;10(2):154-161. https://doi.org/10.24060/2076-3093-2020-10-2-154-161
For citation:
Samorodov A.V., Urakov A.L., Zolotukhin K.N., Dashkin R.R., Ismagilov N.G., Abubakirova A.I., Pakhomova Z.R., Mukhametshina Z.R. Clinical and Pathological Analysis of Sudden Death after Planned Surgery. Creative surgery and oncology. 2020;10(2):154-161. (In Russ.) https://doi.org/10.24060/2076-3093-2020-10-2-154-161
JATS XML


































