Перейти к:
Геномные и протеомные маркеры и перспективы их использования при раке шейки матки
https://doi.org/10.24060/2076-3093-2021-11-2-166-173
Аннотация
Гинекологические злокачественные новообразования представляют собой серьезную проблему для здоровья женщин всего мира. Среди этих проблем, в частности, рак шейки матки (РШМ), который является одним из наиболее часто встречаемых злокачественных новообразований репродуктивной сферы женского населения, вызванным неконтролируемым делением клеток и приводящим к поражению тканей шейки матки у женщин. С появлением новых технологий исследователи направляют свои усилия на поиск и разработку новых маркеров для ранней диагностики, а также оценки и мониторинга терапевтических методов лечения. Несмотря на многочисленные попытки исследователей раскрыть молекулярные механизмы развития РШМ, патогенез заболевания во многом остается неясным. Изучение потенциальных предикторов рака шейки матки имеет решающее значение для разработки эффективного лечения этого заболевания. В настоящее время для решения этой задачи применяются подходы системной биологии, основанные на высокопроизводительных технологиях. По- казано, что по сравнению с традиционными методами технология системной биологии предоставляет большой объем информации о прогностических биомаркерах и терапевтических целях для рака шейки матки. Поиск новых молекулярных маркеров с высокой чувствительностью и специфичностью продолжается с использованием технологии системной биологии. Такой подход поможет в совершенствовании ранней диагностики и в повышении эффективности лечения больных с уменьшением количества рецидивов. В настоящем обзоре представлены доступные на сегодняшний день, а также разрабатываемые биомаркеры для диагностики и прогноза рака шейки матки, основанные на клеточных и молекулярных методах.
Ключевые слова
Для цитирования:
Минязева Р.К., Батталова Г.Ю., Сахаутдинова И.В., Гилязова И.Р. Геномные и протеомные маркеры и перспективы их использования при раке шейки матки. Креативная хирургия и онкология. 2021;11(2):166-173. https://doi.org/10.24060/2076-3093-2021-11-2-166-173
For citation:
Minyazeva R.K., Battalova G.Y., Sakhautdinova I.V., Gilyazova I.R. Genomic and Proteomic Markers of Cervical Cancer: a Prospective Outlook. Creative surgery and oncology. 2021;11(2):166-173. (In Russ.) https://doi.org/10.24060/2076-3093-2021-11-2-166-173
Введение
Онкологические заболевания характеризуются аномальной неконтролируемой пролиферацией клеток из-за генетических и эпигенетических изменений, регулирующих рост, дифференцировку и гибель клеток. Рак шейки матки — основная причина смерти от гинекологического рака во многих странах. В 80–90 % случаев данное заболевание вызвано вирусом папилломы человека высокого риска (HR-HPV). Считается, что вирусная ДНК интегрируется в хромосомную ДНК клетки, активируя протоонкогены до онкогенов, и нарушает работу генов-супрессоров опухолей — это увеличивает скорость пролиферации клеток, что приводит к внутриэпителиальной неоплазии шейки матки (CIN) [1]. Различия в развитии заболеваний со схожими клиническими и патологическими характеристиками, вероятно, связаны с макромолекулярными вариациями, которые стали основным критерием клинической диагностики. Разработка биомаркеров, проводимая с использованием геномных и протеомных методов, открывает перспективы персонифицированной медицины, основанные на новых возможностях в диагностике, классификации и лечении заболеваний [2].
По частоте рак шейки матки (РШМ) многие годы занимает второе место среди злокачественных новообразований (ЗНО) органов репродуктивной системы, уступая лишь раку молочной железы, и первое — среди злокачественных опухолей у женщин 15–39 лет [3]. Заболеваемость и смертность от РШМ в России достаточно высоки — 22,57 и 4,7 на 100 тыс. населения соответственно (данные WHO за 2018 г.). По сравнению с другими ЗНО женской половой сферы (ЗНО тела матки, яичника) пик заболеваемости ЗНО шейки матки в 2018 г. определялся в более молодом возрасте 40–49 лет (42,8 на 100 тыс. соответствующего населения). Всемирная организация здравоохранения (ВОЗ) также сообщила, что рак шейки матки является четвертым наиболее распространенным онкологическим заболеванием среди женщин во всем мире; согласно оценкам 2018 г. ежегодно происходит 570 000 новых случаев заболевания и 311 000 случаев смерти. Согласно прогнозам, если масштабы скрининга и предоставления помощи не будут расширены в самое ближайшее время, то к 2040 г. это бремя возрастет до почти 460 000 случаев смерти, то есть почти на 50 % по сравнению с уровнями 2018 г. [4]. Профилактика и ранняя диагностика онкологических процессов наиболее эффективно снижают показатели заболеваемости и смертности от злокачественных опухолей, в том числе РШМ.
В течение многих десятилетий микроскопическое исследование образцов биопсии было основой скрининговых/диагностических методов, даже несмотря на то что данный метод является достаточно субъективным. В новых рекомендациях рассматриваются стратегии обследования, приемлемые для разных возрастных групп. Эти стратегии включают цитологические исследования, тестирование на наличие вирусов папилломы человека (ВПЧ) высокого онкогенного риска, последующее медицинское наблюдение за женщинами, прошедшими скрининг [5]. Между тем, несмотря на многочисленные технические инновации, разработанные для выявления рака на самых ранних стадиях его формирования, к сожалению, обнаружение многих видов рака на микроскопическом уровне часто оказывается слишком поздним для успешного вмешательства. Начальные изменения, которые могут возникнуть в некоторых клетках шейки матки, не являются злокачественными. Однако эти предраковые клетки вызывают дисплазию или плоскоклеточные интраэпителиальные поражения шейки матки (SIL).
Большинство дисплазий легкой степени регрессируют спонтанно менее чем за год (рис. 1).
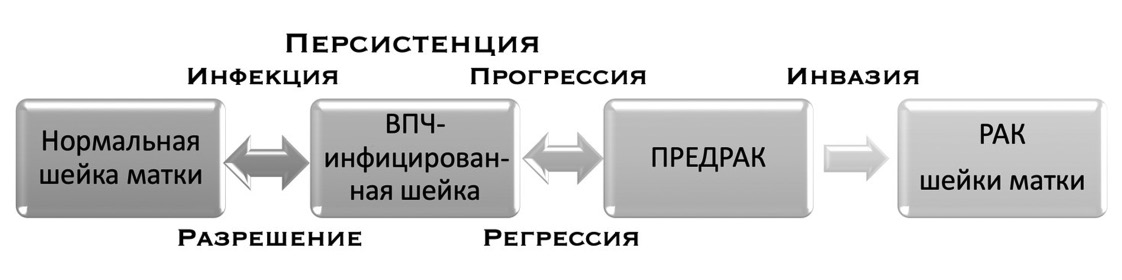
Рисунок 1. Стадии развития рака шейки матки
Figure 1. Sequence of cervical cancer
Однако часть инфекций ВПЧ высокого риска станет стойкой и без своевременного лечения перейдет к злокачественным поражениям и инвазивному раку шейки матки. Ряд признаков и симптомов рака шейки матки связаны в основном с более поздними стадиями инфекции (CIN 1, 2 и 3). Рак шейки матки является наиболее подходящим заболеванием для применения методов скрининга. Длительное время перехода от ранней атипии шейки матки к инвазивному раку дает возможность выявить предраковые состояния на стадии, когда доступно безопасное и эффективное лечение [6]. Хорошо известно, что не существует единого метода скрининга, который был бы высокочувствительным, очень специфичным, доступным и практичным. Исторически сложилось так, что некоторые скрининговые инструменты (мазки Папаниколау и кольпоскопия) успешно снижали смертность за счет выявления патологии на ранних стадиях. Несмотря на эти успехи, существует проблема гипердиагностики, неадекватной специфичности отдельных маркеров (раковый антиген-125, эмбриональный антиген карциномы), несоответствия и отсутствия аналитических инструментов для открытия новых методов исследования. Следовательно, существует очевидный интерес к идентификации маркеров, которые могли бы дополнить стандартную цитогистопатологическую оценку для определения присутствия раковых клеток в тканях.
Биомаркеры
По данным рабочей группы Национального института здравоохранения США (NIH) и консорциума биомаркеров, «биомаркер — это характеристика, которая может быть объективно оценена как индикатор нормальных патогенных процессов или фармакологической реакции на терапевтическое вмешательство» [7]. Основная цель поиска биомаркеров состоит не только в том, чтобы усовершенствовать терапию РШМ, но и должна быть направлена на улучшение методов индивидуальной оценки риска развития рака, а также выявление заболевания на самых ранних стадиях, при которых лечение будет наиболее эффективным [8]. Биомаркеры обычно обнаруживаются в крови, тканях или других жидкостях организма, что указывает на нормальные или патологические процессы или состояния. Биомаркер может быть измерен с помощью генетических, протеомных, клеточных или молекулярных технологий, обнаруженных в более высоких, чем обычно, количествах в жидкостях организма (кровь, моча) больных раком [9]. Идеальный тест на биомаркеры должен иметь 100 % чувствительность и специфичность, но ни один из доступных в настоящее время биомаркеров не обеспечивает этого [10].
Клиническая значимость онкомаркеров была продемонстрирована в нескольких исследованиях (табл. 1).
Таблица 1. Потенциальные сывороточные маркеры рака шейки матки
Table 1. Candidate serum markers of cervical cancer
Маркер рака | Предлагаемое использование | LOE* | Ссылки |
SSC-Ag | Выявление групп высокого риска с метастазами лимфатических узлов в клетках плоского эпителия шейки матки | III–IV | [28] |
Прогнозирование до лечения плоскоклеточного рака шейки матки | III–IV | [30] | |
Прогнозирование ответа на лечение | III–IV | [30] | |
CA-125 | Прогноз до лечения, в частности | III–IV | [28] |
Предоперационное прогнозирование наличия | III–IV | [28] | |
CEA
| Мониторинг заболевания, в частности аденокарциномы шейки матки | III–IV | [34] |
Предикция долечебного прогноза | III–IV | [30] | |
Предоперационное прогнозирование наличия | III–IV | [30] | |
Прогнозирование клинического ответа | IV | [34] | |
Цитокератины (TPA, TPS, Cyfra 21-1) | Предикция прогноза до лечения | III–IV | [30] |
Мониторинг заболевания после первичного лечения | III–IV | [13] |
Примечание. По данным практического руководства и рекомендаций Национальной академии клинической биохимии (NACB) по использованию онкомаркеров в клинике. * — LOE: уровень доказательности.
Note. As per National Academy of Clinical Biochemistry (NACB): practical guidelines and recommendations on clinical use of tumour markers. *— LOE: level of evidence.
Молекулярные биомаркеры
Основным патологическим событием, участвующим в канцерогенезе шейки матки, является интеграция в хромосомную ДНК хозяина вирусной ДНК HR-HPV, которая инициирует образование пренеопластических клеток путем появления клонов клеток с нарушением экспрессии вирусных онкогенов в базальных и парабазальных слоях клеток и, наконец, приводит к инвазивной карциноме шейки матки. Следовательно, анализы на основе ДНК могут быть разработаны и применены для демонстрации наличия ДНК, ответственной за рак шейки матки [11].
ДНК ВПЧ — единственный молекулярный маркер, разработанный для диагностики рака шейки матки. Молекулярные аномалии, такие как хромосомные аномалии, мутации ДНК, контрольные точки клеточного цикла, экспрессия онкогенов и генов-супрессоров опухолей, апоптотические маркеры, эпигенетическая регуляция (гиперметилирование), должны оцениваться как маркеры на основе их клинической применимости [12].
ДНК ВПЧ
Рак шейки матки — редкое осложнение распространенной инфекции шейки матки с типом HR-HPV (ВПЧ высокого риска). Для развития, поддержания и прогрессирования CIN3 (интраэпителиальная дисплазия шейки) необходима стойкая инфекция HR-HPV [13]. Обнаружение только теста ДНК ВПЧ используется в качестве основного метода скрининга, чтобы показать, что он более чувствителен, чем цитология, среди многочисленных клинических исследований. Поскольку тестирование на ВПЧ более чувствительно, чем цитология шейки матки при обнаружении CIN 2 и CIN 3, женщины с одновременными отрицательными результатами тестов (мазок Папаниколау и ВПЧ) могут быть уверены, что у них нет риска неидентифицированного CIN 2, CIN 3 или рака шейки матки [14][15]. Недавно M. Campitelli et al. (2012) сообщили, что мутация ВПЧ (вставка) представляет собой высокоспецифичный молекулярный маркер циркулирующей ДНК (цтДНК) у пациентов с ВПЧ-ассоциированным раком шейки матки. При использовании этого подхода цтДНК была обнаружена у большинства пациентов с раком шейки матки на I стадии, и было доказано, что концентрация цтДНК выявляет опухолевую нагрузку [16].
Биомаркеры на основе белков
Биомаркеры на основе белков важны в быстрорастущей области применения протеомных методов
в диагностической и прогностической медицине. Белковые биомаркеры могут облегчить раннее выявление начала заболевания на излечимой стадии и помочь отличить подгруппы пациентов, которые хорошо реагируют на определенные виды лечения, от тех, кто не отвечает на лечение [17]. Единственные одобренные FDA биомаркеры, доступные в настоящее время для клинического использования, — это биомаркеры на основе белка, имеющие эффективное диагностическое и прогностическое значение.
Антиген плоскоклеточной карциномы (SCC-Ag)
Антиген плоскоклеточной карциномы сыворотки (SCC Ag) представляет собой субфракцию ассоциированных с опухолью антигенов, связанных с плоскоклеточной карциномой, и широко используется в качестве маркера плоскоклеточного рака головы и шеи, легких и пищевода и других онкологических заболеваний. Наиболее распространенным гистологическим типом рака шейки матки является плоскоклеточная карцинома, на которую приходится более 70 % случаев рака шейки матки во всем мире [18]. Плоскоклеточный рак шейки матки составляет 85–90 % всех карцином шейки матки [18]. Повышенный уровень SCC антигена перед лечением связан с более поздней стадией, большим размером первичной опухоли [19], вовлечением регионарных лимфатических узлов [20], лимфоваскулярной [21] и глубокой стромальной инфильтрацией у больных раком шейки матки [22]. Долечебные уровни SCC Ag или риск стратификации могут выступать предикторами исхода лечения и коррелировать с показателем выживаемости у пациентов с раком шейки матки, что может помочь врачам в выборе тактики лечения [23]. Высокий уровень SCC Ag перед лечением предрасполагает к более высоким рискам развития местно-регионарного рецидива, отдаленных метастазов [24] и парааортального рецидива [25]. Для пациентов с высокими уровнями SCC Ag могут быть рассмотрены адъювантные методы лечения, такие как неоадъювантная химиотерапия, консолидирующая химиотерапия [26], брахитерапия с высокими дозами и дистанционная лучевая терапия [27].
Фрагменты цитокератина в сыворотке крови (CYFRA)
Цитокератины являются основными составляющими цитоскелета эпителиальных клеток и относятся к группе белков промежуточных фрагментов. CYFRA — это мера концентрации в сыворотке фрагментов цитокератина 19, кислой субъединицы цитокератина, которая экспрессируется в нормальном эпителии и в карциномах шейки матки. Повышенный уровень фрагментов цитокератина обнаружен у 42–52 % пациентов с плоскоклеточным раком шейки матки [28]. Как и в случае SCC, уровни фрагментов цитокератина также могут использоваться для оценки стадии заболевания, размера опухоли, глубины инвазии стромы, поражения лимфо-сосудистого пространства (компонента) и метастазов в лимфатические узлы при раке шейки матки [29].
Тканевый полипептидный антиген (TPA) и тканевый полипептид-специфический антиген (TPS) — это тип цитокератинов, используемых для предопределения прогноза во время лечения, а также для мониторинга заболевания после первичного лечения, но он требует дальнейшей оценки [30].
Эмбриональный антиген карциномы (CEA)
Эмбриональный антиген карциномы (CEA) представляет собой гликопротеин [31]. Раковый эмбриональный антиген (РЭА) был тщательно изучен в связи с его потенциальной ролью в качестве маркера раннего рака и прогностического индикатора. Интересно, что сначала он был использован в качестве маркера рака толстой кишки, а последующие исследования показали, что повышенные уровни CEA встречаются при многих других формах рака [32]. В дальнейшем было выявлено повышение уровня СЕА в сыворотке крови у пациенток со злокачественными гинекологическими заболеваниями [33]. Оценка уровней CEA не может быть процедурой скрининга, так как уровни CEA были повышены и при доброкачественных образованиях. Наиболее значительным применением CEA при гинекологическом раке будет лечение пациенток с раком яичников / шейки матки. При этом прогрессирующее увеличение процента значений CEA на поздних стадиях в отличие от стадий I–II (26–88 %) у пациенток с инвазивным плоскоклеточным раком шейки матки указывает на прогностическую ценность CEA как маркера рака шейки матки [34]. Также уровни CEA могут расцениваться как прогностический индикатор при аденокарциноме рака шейки матки для планирования лечения заболевания [35].
Другой новый маркер (мишень для разработки новых лекарств) — иммуносупрессивный кислый белок (IAP), уровень которого повышен в 43–51 % карцином шейки матки. Также обнаружили повышенные уровни IAP в сыворотке в 53 % случаев плоскоклеточного рака и в 40 % случаев аденокарциномы до лечения. Уровни IAP были связаны со стадией заболевания и метастазами в лимфатические узлы, поэтому он также может использоваться для предикции, прогноза и оценки эффективности лечения [36]. Циклооксигеназа-2 — ключевой фермент, участвующий в превращении арахидоновой кислоты в простагландины, в модуляции нескольких клеточных процессов, регуляции клеточного цикла, апоптозе, отложении внеклеточного матрикса и ангиогенезе [37]. Гиперэкспрессия циклооксигеназы-2 (ЦОГ-2) считается показателем метастатической инвазивности при различных злокачественных новообразованиях, включая карциному шейки матки [38]. Однако ЦОГ-2 является сильным предиктором плохого ответа на лучевую терапию или химиолучевую терапию независимо от гистологического типа [39].
Растворимый CD44 (sCD44)
CD44 является одним из интегральных мембранных белков, участвующих в онкогенезе. Они действуют как молекулы клеточной адгезии и как механизм самонаведения лимфоцитов (как клетка-клетка, так и клетка-матрица), а также участвуют в росте, распространении и инвазии опухоли [40]. Стандартный белок CD44, а также вариантные белки CD44v1-9 могут быть обнаружены как в ткани, так и в сыворотке больных раком шейки матки, поскольку они выделяются с клеточной поверхности. В случаях цервикальной внутриэпителиальной неоплазии (CIN) и микроинвазивной карциномы (MIC) наблюдается значительное увеличение уровней CD44, также окрашивание sCD44 показывает снижение прогрессии по мере увеличения поражений от CIN1 в CIN 3, а затем в MIC [41]. В 2014 году S. Dasari et al. сообщили, что растворимый белковый маркер CD44 можно использовать для дифференцировки случаев предраковых состояний и случаев злокачественной карциномы при раке шейки матки [42].
Другие белковые маркеры
Другое семейство белков с потенциальной эффективностью в качестве молекулярных маркеров или прогностических индикаторов — это семейство матриксных металлопротеиназ (MMP’s) и тканевых ингибиторов металлопротеиназ (TIMP’s). ММП относятся к семейству эндогенных протеаз, которые разрушают внеклеточный матрикс (включая коллаген, эластин и желатин) и считаются критическими для развития и инвазии опухолей. И ММР-2, и ММР-9 являются важными матриксными металлопротеиназами, о которых известно, что они участвуют в разрушении базальной мембраны, что является предпосылкой инвазии рака [43]. Tакже подтверждено, что экспрессия MMP-9 является у пациенток с раком шейки матки независимым прогностическим фактором, который может быть потенциальной диагностической и даже терапевтической мишенью для рака шейки матки [44].
Кроме того, гликопротеин-39 хряща человека оказался потенциальным биомаркером для выявления и лечения рака шейки матки [45]. Повышенные уровни сывороточного гликопротеина-39 хряща были обнаружены у 75 % пациентов с плоскоклеточным раком и у 78 % пациентов с аденокарциномой. При плоскоклеточном раке был значительно повышен уровень циркулирующих растворимых Fas (sFas) в сыворотке крови по сравнению с таковым у здоровых женщин [46].
Заключение
Исходя из вышесказанного, опухолевые маркеры являются важными инструментами, которые могут помочь клиницистам в ранней диагностике, прогнозировании ответа на терапию и мониторинге заболевания. Обнаружение и оценка клинической значимости новых биомаркеров, по прогнозам, сыграют значительную роль в изменении формы исследований рака, тем самым существенно повлияв на обнаружение и лечение многих видов рака, включая рак шейки матки. Геномные и протеомные технологии весьма перспективны для выявления новых биомаркеров, которые могут значительно повысить эффективность лечения рака. Исчерпывающее понимание каждого биомаркера будет важным для эффективной диагностики заболевания и определения направления при выборе подходящих терапевтических альтернатив.
Список литературы
1. Hu Z., Ma D. The precision prevention and therapy of HPV-related cervical cancer new concepts and clinical implications. Cancer Medicine 2018;7(10):5217–36. DOI: 10.1002/cam4.1501
2. Christensen J.T., Grønhøj C., Zamani M., Brask J., Kjær E., Lajer H., et al. Association between oropharyngeal cancers with known HPV and p16 status and cervical intraepithelial neoplasia: a Danish population-based study. Acta Oncologica. 2018;58(3):267–72. DOI: 10.1080/0284186X.2018.1546059
3. Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.). Состояние онкологической помощи населению России в 2019 году. М.: МНИОИ им. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020.
4. Global strategy to accelerate the elimination of cervical cancer as a public health problem. WHO; 2020. 52 p.
5. Дмитриади Т.А., Кит О.И., Бурцев Д.В. Скрининг рака шейки матки. Мировой опыт. Ситуация в России. Известия высших учебных заведений. Северо-Кавказский регион. Серия: естественные на- уки. 2017;4-2(196-2):26–32. DOI: 10.23683/0321-3005-2017-4-2-26-32
6. Valenti G., Vitale S.G., Tropea A., Biondi A., Laganà A.S. Tumor markers of uterine cervical cancer: a new scenario to guide surgical practice? Updates Surg. 2017;69:441–9. DOI: 10.1007/s13304-017-0491-3
7. Lees B., Erickson B.K., Huh W.K. Cervical cancer screening: evidence behind the guidelines. Obstet Gynecol. 2016;214(4):438–43. DOI: 10.1016/j.ajog.2015.10.147
8. Shah U.J., Nasiruddin M., Dar S.A., Khan K.A., Akhter M.R., Singh N., et al. Emerging biomarkers and clinical significance of HPV genotyping in prevention and management of cervical cancer. Microb Pathog. 2020;143:104131. DOI: 10.1016/j.micpath.2020.104131
9. Novikova T. Optical techniques for cervical neoplasia detection. Beilstein J Nanotechnol. 2017;8:1844–62. DOI: 10.3762/bjnano.8.186
10. Malati T. Tumour markers: An overview. Indian J Clin Biochem. 2007;22(2):17–31. DOI: 10.1007/BF02913308
11. Bahrami A., Hasanzadeh M., Shahidsales S., Farazestanian M., Hassanian S.M., Moetamani Ahmadi M., et al. Genetic susceptibility in cervical cancer: from bench to bedside. J Cell Physiol. 2018;233(3):1929–39. DOI: 10.1002/jcp.26019
12. Van Ostade X., Dom M., Tjalma W., Van Raemdonck G. Candidate biomarkers in the cervical vaginal fluid for the (self-)diagnosis of cervical precancer. Arch Gynecol Obstet. 2018;297(2):295–311. DOI: 10.1007/s00404-017-4587-2
13. Hu Z., Ma D. The precision prevention and therapy of HPV-related cervical cancer: new concepts and clinical implications. Cancer Med. 2018;7(10):5217–36. DOI: 10.1002/cam4.1501
14. Walker J.L., Wang S.S., Schiffman M., Solomon D. Predicting absolute risk of CIN3 during post-colposcopic follow-up: results from the ASCUS-LSIL Triage Study (ALTS). Am J Obstet Gynecol. 2006;195(2):341–8. DOI: 10.1016/j.ajog.2006.02.047
15. Castle P.E., Solomon D., Schiffman M., Wheeler C.M. Human papillomavirus type 16 infections and 2-year absolute risk of cervical precancer in women with equivocal or mild cytologic abnormalities. J Natl Cancer Inst. 2005;97(14):1066–71. DOI: 10.1093/jnci/dji186
16. Campitelli M., Jeannot E., Peter M., Lappartient E., Saada S., de la Rochefordière A., et al. Human papillomavirus mutational insertion: specific marker of circulating tumor DNA in cervical cancer patients. PLoS One. 2012;7(8):e43393. DOI: 10.1371/journal.pone.0043393
17. Kontostathi G., Zoidakis J., Anagnou N.P., Pappa K.I., Vlahou A., Makridakis M. Proteomics approaches in cervical cancer: focus on the discovery of biomarkers for diagnosis and drug treatment monitoring. Expert Rev Proteomics. 2016;13(8):731–45. DOI: 10.1080/14789450.2016.1210514
18. Matsuo K., Machida H., Mandelbaum R.S., Konishi I., Mikami M. Validation of the 2018 FIGO cervical cancer staging system. Gynecol Oncol. 2019;152:87–93. DOI: 10.1016/j.ygyno.2018.10.026
19. Choi K.H., Lee S.W., Yu M., Jeong S., Lee J.W., Lee J.H. Significance of elevated SCC-Ag level on tumor recurrence and patient survival in patients with squamous-cell carcinoma of uterine cervix following definitive chemoradiotherapy: a multi-institutional analysis. J Gynecol Oncol. 2019;30(1):e1. DOI: 10.3802/jgo.2019.30.e1
20. Xu F., Li Y., Fan L., Ma J., Yu L., Yi H., et al. Preoperative SCC-Ag and thrombocytosis as predictive markers for pelvic lymphatic metastasis of squamous cervical cancer in early FIGO stage. J Cancer. 2018;9:1660–66. DOI: 10.7150/jca.24049
21. Yang H., Hu H., Gou Y., Hu Y., Li H., Zhao H., et al. Combined detection of Twist1, Snail1 and squamous cell carcinoma antigen for the prognostic evaluation of invasion and metastasis in cervical squamous cell carcinoma. Int J Clin Oncol. 2018;23:321–8. DOI: 10.1007/s10147-017-1210-2
22. Xu D., Wang D., Wang S., Tian Y., Long Z., Ren X. Correlation between squamous cell carcinoma antigen level and the Clinicopathological features of early-stage cervical squamous cell carcinoma and the predictive value of squamous cell carcinoma antigen combined with computed tomography scan for lymph node metastasis. Int J Gynecol Cancer. 2017;27:1935–42. DOI: 10.1097/IGC.0000000000001112
23. Markovina S., Wang S., Henke L.E., Luke C.J., Pak S.C., DeWees T., et al. Serum squamous cell carcinoma antigen as an early indicator of response during therapy of cervical cancer. Br J Cancer. 2018;118:72–8. DOI: 10.1038/bjc.2017.390
24. Kubik S., Moszynska-Zielinska M., Fijuth J., Tomalczyk A., Jesionek- Kupnicka D., Ura L., et al. Assessment of the relationship between serum squamous cell carcinoma antigen (SCC-Ag) concentration in patients with locally advanced squamous cell carcinoma of the uterine cervix and the risk of relapse. Prz Menopauzalny. 2019;18(1):23–6. DOI: 10.5114/pm.2019.84153
25. Huang E.Y., Huang Y.J., Chanchien C.C., Lin H., Wang C.J., Sun L.M., et al. Pretreatment carcinoembryonic antigen level is a risk factor for Para-aortic lymph node recurrence in addition to squamous cell carcinoma antigen following definitive concurrent chemoradiotherapy for squamous cell carcinoma of the uterine cervix. Radiat Oncol. 2012;7:13. DOI: 10.1186/1748-717X-7-13
26. Mabuchi S., Isohashi F., Yokoi T., Takemura M., Yoshino K., Shiki Y., et al. A phase II study of postoperative concurrent carboplatin and paclitaxel combined with intensity-modulated pelvic radiotherapy followed by consolidation chemotherapy in surgically treated cervical cancer patients with positive pelvic lymph nodes. Gynecol Oncol. 2016;141:240–6. DOI: 10.1016/j.ygyno.2016.02.011
27. Wang W., Liu X., Meng Q., Zhang F., Hu K. Prophylactic extended-field irradiation for patients with cervical Cancer treated with concurrent Chemoradiotherapy: a propensity-score matching analysis. Int J Gynecol Cancer. 2018;28:1584–91. DOI: 10.1097/IGC.0000000000001344
28. Takeda M., Sakuragi N., Okamoto K., Todo Y., Minobe S.I., Nomura E., et al. Preoperative serum SCC, CA125 and CA19-9 levels and lymph node status in squamous cell carcinoma of the uterine cervix. Acta Obstet Gynecol Scand. 2002;81(5):451–7. DOI: 10.1034/j.1600-0412.2002.810513.x
29. Fu J., Wang W., Wang Y., Liu C., Wang P. The role of squamous cell carcinoma antigen (SCC Ag) in outcome prediction after concurrent chemoradiotherapy and treatment decisions for patients with cervical cancer. Radiat Oncol. 2019;14(1):146. DOI: 10.1186/s13014-019-1355-4
30. Farzaneh F., Shahghassempour S., Noshine B., Arab M., Yaseri M., Rafizadeh M., et al. Application of tumor markers SCC-Ag, CEA, and TPA in patients with cervical precancerous lesions. Asian Pac J Cancer Prev. 2014;15(9):3911–4. DOI: 10.7314/apjcp.2014.15.9.3911
31. Kotowicz B., Fuksiewicz M., Jonska-Gmyrek J., Bidzinski M., Kowalska M. The assessment of the prognostic value of tumor markers and cytokines as SCCAg, CYFRA 21.1, IL-6, VEGF and sTNF receptors in patients with squamous cell cervical cancer, particularly with early stage of the disease. Tumour Biol. 2016;37(1):1271–8. DOI: 10.1007/s13277-015-3914-0
32. Konishi T., Shimada Y., Hsu M., Tufts L., Jimenez-Rodriguez R., Cercek A., et al. Association of preoperative and postoperative serum carcinoembryonic antigen and colon cancer outcome. JAMA Oncol. 2018;4(3):309–15. DOI: 10.1001/jamaoncol.2017.4420
33. Lin Y.H., Wu C.H., Fu H.C., Chen Y.J., Chen Y.Y., Ou Y.C., et al. Prognostic significance of elevated pretreatment serum levels of CEA and CA-125 in epithelial ovarian cancer. Cancer Biomark. 2020;28(3):285–92. DOI: 10.3233/CBM-201455
34. Molina R., Filella X., Lejarcegui J.A., Pahisa J., Torné A., Rovirosa A., et al. Prospective evaluation of squamous cell carcinoma and carcinoembryonic antigen as prognostic factors in patients with cervical cancer. Tumour Biol. 2003;24(3):156–64. DOI: 10.1159/000073846
35. Huang G., Chen R., Lu N., Chen Q., Lv W., Li B. Combined Evaluation of Preoperative Serum CEA and CA125 as an independent prognostic biomarker in patients with early-stage cervical adenocarcinoma. Onco Targets Ther. 2020;13:5155–64. DOI: 10.2147/OTT.S250614
36. Campbell J.D., Yau C., Bowlby R., Liu Y., Brennan K., Fan H., et al. Genomic, pathway network, and immunologic features distinguishing squamous carcinomas. Cell Rep. 2018;23(1):194–212.e6. DOI: 10.1016/j.celrep.2018.03.063
37. Gadducci A., Guerrieri M.E., Greco C. Tissue biomarkers as prognostic variables of cervical cancer. Crit Rev Oncol Hematol. 2013;86(2):104–29. DOI: 10.1016/j.critrevonc.2012.09.003
38. Xie R., Yang Y., Zhang H., Liu H., Guo J., Qin H., et al. c-Myb and its Effector COX-2 as an indicator associated with prognosis and therapeutic outcome in colorectal cancer. J Cancer. 2019;10(7):1601–10. DOI: 10.7150/jca.27261
39. Karageorgopoulou S., Kostakis I.D., Gazouli M., Markaki S., Papadimitriou M., Bournakis E., et al. Prognostic and predictive factors in patients with metastatic or recurrent cervical cancer treated with platinum- based chemotherapy. Clinical Trial BMC Cancer. 2017;17(1):451. DOI: 10.1186/s12885-017-3435-x
40. Li W., Ma H., Zhang J., Zhu L., Wang C., Yang Y. Unraveling the roles of CD44/CD24 and ALDH1 as cancer stem cell markers in tumorigenesis and metastasis. Sci Rep. 2017;7(1):13856. DOI: 10.1038/s41598-017-14364-2
41. Fu Z., Zhang P., Luo H., Huang H., Wang F. CXCL12 modulates the radiosensitivity of cervical cancer by regulating CD44. Mol Med Rep. 2018;18(6):5101–8. DOI: 10.3892/mmr.2018.9554
42. Dasari S., Rajendra W., Valluru L. Evaluation of soluble CD44 protein marker to distinguish the premalignant and malignant carcinoma cases in cervical cancer patients. Med Oncol. 2014;31(9):139. DOI: 10.1007/s12032-014-0139-9
43. Sidorkiewicz I., Piskór B., Dąbrowska E., Guzińska-Ustymowicz K., Pryczynicz A., Zbucka-Krętowska M., et al. Plasma levels and tissue expression of selected cytokines, metalloproteinases and tissue inhibitors in patients with cervical cancer. Anticancer Res. 2019;39(11):6403–12. DOI: 10.21873/anticanres.13854
44. Li Y., Wu T., Zhang B., Yao Y., Yin G. Matrix metalloproteinase-9 is a prognostic marker for patients with cervical cancer. Med Oncol. 2012;29(5):3394–9. DOI: 10.1007/s12032-012-0283-z
45. Roslind A., Palle C., Johansen J.S., Christensen I.J., Nielsen H.J., Mosgaard B.J. Prognostic utility of serum YKL-40 in patients with cervical cancer. Scand J Clin Lab Invest. 2020;80(8):687–93. DOI: 10.1080/00365513.2020.1846209
46. Anggraeni T.D., Rustamadji P., Aziz M.F. Fas Ligand (FasL) in Association with Tumor-Infiltrating Lymphocytes (TILs) in early stage cervical cancer. Asian Pac J Cancer Prev. 2020;21(3):831–5. DOI: 10.31557/APJCP.2020.21.3.831
Об авторах
Р. К. МинязеваРоссия
Минязева Раушания Каримовна — кафедра акушерства и гинекологии № 1
Россия, Республика Башкортостан, Уфа
Г. Ю. Батталова
Россия
Батталова Гюзель Юрьевна — д.м.н., профессор, кафедра акушерства и гинекологии № 1, радиологическое отделение № 3
Россия, Республика Башкортостан, Уфа
И. В. Сахаутдинова
Россия
Сахаутдинова Индира Венеровна — д.м.н., кафедра акушерства и гинекологии № 1
Россия, Республика Башкортостан, Уфа
И. Р. Гилязова
Россия
Гилязова Ирина Ришатовна — к.б.н., кафедра медицинской генетики и фундаментальной медицины, лаборатория молекулярной генетики человека
Россия, Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Минязева Р.К., Батталова Г.Ю., Сахаутдинова И.В., Гилязова И.Р. Геномные и протеомные маркеры и перспективы их использования при раке шейки матки. Креативная хирургия и онкология. 2021;11(2):166-173. https://doi.org/10.24060/2076-3093-2021-11-2-166-173
For citation:
Minyazeva R.K., Battalova G.Y., Sakhautdinova I.V., Gilyazova I.R. Genomic and Proteomic Markers of Cervical Cancer: a Prospective Outlook. Creative surgery and oncology. 2021;11(2):166-173. (In Russ.) https://doi.org/10.24060/2076-3093-2021-11-2-166-173


































