Перейти к:
Эрибулин в реальной клинической практике при метастатическом раке молочной железы
https://doi.org/10.24060/2076-3093-2023-13-1-77-86
Аннотация
Рак молочной железы является наиболее распространенным видом рака у женщин как в Российской Федерации, так и в США. Эрибулин, новый ингибитор динамики микротрубочек, используется в США, Европе и других странах по всему миру для лечения пациенток с прогрессирующим или мРМЖ, которые резистентны для других линий терапии. Мезилат эрибулина представляет собой структурно упрощенный синтетический аналог галихондрина В, натурального продукта, выделенного из морской губки Halichondria okadai. Механизм действия эрибулина — подавление динамики микротрубочек. Он связывается с плюсовыми концами микротрубочек и подавляет рост микротрубочек в межфазных клетках, не влияя на фазу укорочения и секвестры тубулина в непродуктивные агрегаты, приводящие к G2/M блокировке клеточного цикла и, в конечном счете, апоптозу после длительной митотической блокировки. В реальной клинической практике лечение получают самые разнообразные пациентки с массой сопутствующей патологии и более низким функциональным статусом. Приведенные данные свидетельствуют, что эрибулин продемонстрировал сопоставимые результаты с исследованием EMBRACE для более широкой и разнообразной когорты пациентов. Дальнейшие исследования эрибулина в реальной клинической практике, безусловно, откроют новые возможности в терапии метастатического РМЖ.
Ключевые слова
Для цитирования:
Султанбаев А.В., Меньшиков К.В., Мусин Ш.И., Меньшикова И.А., Султанбаева Н.И., Попова Е.В., Аскаров В.Е. Эрибулин в реальной клинической практике при метастатическом раке молочной железы. Креативная хирургия и онкология. 2023;13(1):77-86. https://doi.org/10.24060/2076-3093-2023-13-1-77-86
For citation:
Sultanbaev A.V., Menshikov K.V., Musin Sh.I., Menshikova I.A., Sultanbaeva N.I., Popova E.V., Askarov V.E. Eribulin in Metastatic Breast Cancer: Actual Clinical Practice. Creative surgery and oncology. 2023;13(1):77-86. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-1-77-86
ВВЕДЕНИЕ
Рак молочной железы является наиболее распространенным видом рака у женщин как в Российской Федерации, так и в США. В 2018 году в США зарегистрировано более 260 000 новых случаев рака молочной железы (РМЖ) и более 40 000 смертей от данной патологии [1]. В США ожидается, что около 6 % пациентов будут иметь метастатический РМЖ [1], а у ряда пациенток с ранней стадией заболевания развиваются метастазы после первичного лечения. Метастатический рак молочной железы (мРМЖ) по-прежнему трудно поддается лечению, при этом 5-летняя выживаемость составляет около 27 % [1].
Эрибулин, новый ингибитор микротрубочек, используется в США, Европе и других странах по всему миру для лечения пациенток с прогрессирующим или мРМЖ, которые резистентны для других линий терапии [2–6]. В США эрибулин одобрен для пациенток с мРМЖ, которые ранее получали более двух линий химиотерапии, включая антрациклины и таксаны либо в качестве адъюванта, либо в качестве терапии метастатического рака [4]. В Европейском союзе эрибулин в настоящее время показан для лечения пациенток с местнораспространенным или мРМЖ, которые получили более одной линии терапии, включая антрациклины и таксаны либо в качестве адъюванта, либо в качестве терапии метастатического рака [7–10].
Мезилат эрибулина представляет собой структурно упрощенный синтетический аналог галихондрина В, натурального продукта, выделенного из морской губки Halichondria okadai [2]. Будучи членом класса противоопухолевых препаратов галихондрина, эрибулин является ингибитором динамики микротрубочек с уникальным механизмом действия на основе тубулина, который приводит к ингибированию фазы роста микротрубочек без какого-либо соответствующего ингибирования фазы укорочения [11–15].
Мезилат эрибулина (E7389) был разработан в научно-исследовательском институте компании Eisai. В 1985 году Хирата и Уэмура [16] первоначально выделили галихондрин В из естественной японской морской губки Halichondria okadai, а затем из других губок из семейств Axinella, Phakellia и Lissodendoryx [17]. Хотя молекула обладала сильной противоопухолевой активностью, ее получение из моря было затруднено, и Национальный институт рака финансировал сбор этих морских губок для исследований. Прорыв произошел в 1998 году, когда был получен синтетический аналог. Доктор Йошито Киши из Гарварда разработал полностью синтетический галихондрин B. Впоследствии синтетическая технология была лицензирована гарвардской компанией Eisai Research. Институт ВОЗ завершил синтез полученного препарата E7389 (NSC 707389) с аналогичной противоопухолевой активностью, но большей стабильностью [2]. Препарат был одобрен в течение 8 месяцев с момента его применения. Одобрение управления по контролю за продуктами и лекарствами (FDA) было получено 15 ноября 2010 для лечения мРМЖ [18]. Одобрение было основано на впечатляющих результатах исследования EMBRACE (исследование терапии мРМЖ эрибулином в сравнении с терапией по выбору врача). В настоящее время эрибулин одобрен в 40 странах по всему миру.
Мезилат эрибулина является синтетическим аналогом галихондрина В, который представляет собой крупный полиэфирный макролид, полученный из очень сильного природного ингибитора митотических канальцев. Он имеет молекулярную массу 826,0 (729,9 для свободного основания). Эмпирическая формула — C40H59NO11•CH4O3S. Это прозрачный бесцветный раствор.
Механизм действия: эрибулин действует, подавляя динамику микротрубочек. Он связывается с плюсовыми концами микротрубочек и подавляет рост микротрубочек в межфазных клетках, не влияя на фазу укорочения и секвестры тубулина в непродуктивные агрегаты, приводящие к G2/M блокировке клеточного цикла и, в конечном счете, апоптозу после длительной митотической блокировки [19]. Его механизм отличается от других ингибиторов микротрубочек, таких как алкалоиды барвинка и таксаны, которые влияют как на фазу укорочения, так и на фазу роста. В то время как алкалоиды барвинка связываются на обоих концах (альфа и бета), таксаны и эпитилоны связываются на бета-конце и, в частности, на внутренней стороне микротрубочки. Другой отличительной особенностью является то, что эрибулин связывается либо на границе раздела альфа- и бета-субъединиц микротрубочки или только бета-субъединицы, и,следовательно, в настоящее время широко изучается при лечении пациентов с таксанорезистентным раком молочной железы, возникающим из-за мутаций бета-тубулина.
Обзор клинических исследований
В исследовании I фазы у пациенток с распространенными солидными опухолями были изучены максимально переносимая доза, токсичность, ограничивающая дозу, и фармакокинетика эрибулина. Был сделан вывод, что при дозе 2 мг/м 2, вводимой в течение 1 часа, эрибулин обладал управляемым профилем токсичности, а увеличение дозы было связано с усилением нейтропении [20–22]. Основываясь на его механизме действия на микротрубочки и активности в клеточных линиях рака молочной железы, было выдвинуто предположение, что этот препарат может оказывать действие при рефрактерном раке молочной железы [23]. В японском исследовании 2-й фазы эрибулин применялся у пациенток с ранее предлеченным метастатическим раком молочной железы. Конечной точкой исследования была общая частота ответов (ЧОО), которая составила 21,3 %, с выживаемостью без прогрессирования (ВБП) 3,7 месяца и общей выживаемостью (ОВ) 11,1 месяца [24]. В исследовании III фазы, проведенном Cortes et al., эрибулин использовался у пациенток с местнораспространенным и метастатическим раком молочной железы, ранее получавших антрациклины, таксаны и капецитабин. ЧОО составила 14,1 %, со средней продолжительностью ответа 4,1 месяца, ВБП — 2,6 месяца, а ОВ — 10,4 месяца [25]. Нейтропения наблюдалась у 54 %, утомляемость — у 10 %, а периферическая нейропатия — у 6,9 % пациенток. В исследовании II фазы Linda и соавт. эрибулин применялся у пациенток с раком молочной железы, которые ранее лечились антрациклином и таксаном и получили результат по ОВ в течение 9 месяцев с аналогичной картиной токсичности нейропатии [26]. В исследовании landmark EMBRACE 762 пациентки были рандомизированы в группы либо эрибулина, либо любой другой монотерапии по выбору лечащего врача. У пациенток, получавших эрибулин, ОВ составляла 13,1 месяца по сравнению с 10,6 месяца в контрольной группе [27].
Ниже приведены данные III фазы клинического исследования эрибулина при метастатическом раке молочной железы EMBRACE, где сравнивался эрибулин с монотерапией по выбору исследователя. Включались пациентки с метастатическим РМЖ, которые ранее получали по крайней мере две линии химиотерапии по поводу прогрессирующего заболевания, но в общей сложности не более пяти цитотоксических режимов. В этом исследовании наблюдалось значительное улучшение ОВ в группе эрибулина по сравнению с терапией по выбору врача; это было подтверждено в обновленном анализе, запрошенном европейскими и американскими регулирующими органами. Медиана ОВ составила 13,2 месяца для эрибулина против 10,5 месяца для терапии по выбору врача (отношение рисков [ОР] 0,81; 95 % ДИ 0,67–0,96). Кроме того, эрибулин обладал приемлемым профилем безопасности, при этом наиболее частыми нежелательными явлениями были астения или утомляемость и нейтропения [28][29]. В результате этого исследования эрибулин был одобрен более чем в 50 странах в качестве монотерапии для пациенток с прогрессирующим РМЖ на фоне, по меньшей мере, двух режимов химиотерапии, причем предшествующая терапия включала антрациклины и таксаны в адъювантной терапии или терапии метастатического рака [30–34].
Ниже приводятся данные, получение в исследовании EMBRACE. Критерии включения: женский пол; возраст 18 лет и старше; гистологически или цитологически подтвержденный рак молочной железы; до трех предыдущих режимов химиотерапии и до двух предыдущих схем химиотерапии при прогрессирующем и/или метастатическом заболевании; предшествующая терапия антрациклином и таксаном; разрешение всех токсических эффектов, связанных с химиотерапией или облучением до I степени (за исключением стабильной сенсорной невропатии II степени и алопеции). Критерии исключения: предшествующее лечение капецитабином и лучевая терапия, охватывающая более 30 % костного мозга. Пациентки с HER2-позитивной опухолью могли получать HER2-таргетную терапию до или после лечения в исследовании, но не во время лечения в исследовании.
Это исследование III фазы, открытое, двухэтапное, многоцентровое (исследование № E7389-G000–301; ClinicalTrials.gov, идентификатор: NCT00337103), стратификация пациентов по географическому региону (Латинская Америка, Западная Европа/Австралия, Восточная Европа, Северная Америка, Азия или Южная Африка) и HER2-статусу (положительный, отрицательный или неизвестный). Пациентки были рандомизированы 1:1 с использованием центральной интерактивной системы голосового реагирования для получения эрибулина мезилата 1,4 мг/м 2 (эквивалент эрибулина 1,23 мг/м 2) внутривенно в течение 2–5 минут в 1-й и 8-й дни или капецитабина 1250 мг/м 2 внутрь 2 раза в день с 1-го по 14-й день, оба в 21-дневных циклах. Пациентки получали исследуемое лечение до прогрессирования заболевания, неприемлемой токсичности или запроса пациента/исследователя о прекращении. Токсичность капецитабина 3-й и 4-й степеней и определенная токсичность капецитабина 2-й степени устранялись путем прекращения лечения и/или снижения дозы и симптоматического лечения. Использование колониестимулирующих факторов и эритропоэтина было разрешено в соответствии с американскими рекомендациями Общества клинической онкологии или местными стандартами.
С сентября 2006 по сентябрь 2009 года 1102 пациентки были рандомизированы: 554 — в группу эрибулина и 548 — в группу капецитабина. Исходные демографические данные пациенток и характеристики заболевания были в целом хорошо сбалансированы; были небольшие различия в процентном соотношении пациенток, у которых были положительные рецепторы эстрогена и трижды негативные раки (46,8 против 50,7 % и 27,1 против 24,5 % для эрибулина и капецитабина соответственно). В целом у 68,5 % пациенток был HER2-отрицательный рак. 20, 52,0 и 27,2 % пациенток получали исследуемую терапию в качестве первой, второй и третьей линии лечения соответственно при прогрессирующем заболевании.
Медиана ОВ составила 15,9 месяца (95 % ДИ 15,2–17,6 месяца) в группе эрибулина по сравнению с 14,5 месяца (95 % ДИ 13,1–16,0 месяца) в группе капецитабина (рис. 1А), что соответствовало HR 0,88 (95 % ДИ 0,77–1,00; Р = 056). Медиана ВБП составила 4,1 месяца (95 % ДИ 3,5–4,3 месяца) в группе эрибулина и 4,2 месяца (95 % ДИ 3,9–4,8 месяца) в группе капецитабина (HR 1,08; 95 % ДИ 0,93–1,25; Р = 30; рис. 1B).
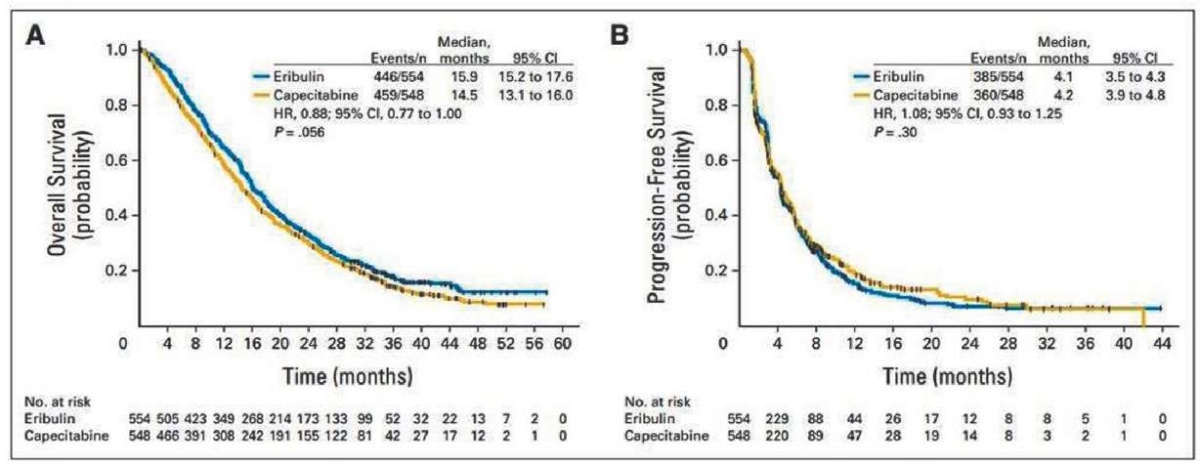
Рисунок 1. Кривая Каплана — Мейера для (А) общей выживаемости и (Б) выживаемости без прогрессирования. Одно-, двух- и трехлетняя выживаемость составила 64,4 и 58,0 % (Р 04), 32,8 и 29,8 % (Р 32) и 17,8 и 14,5 % (Р 18) для эрибулина и капецитабина соответственно [21]
Figure 1. Kaplan-Meier curve for overall survival (A) and progression-free survival (Б). One-year, two-year and three-year survival rate was 64.4 % and 58.0 % (P. 04), 32.8 % and 29.8 % (P. 32) and 17.8 % and 14.5 % (P. 18) for eribulin and capecitabine, respectively [21]
Согласно обзору исследователей, медиана ВБП составила 4,2 месяца (95 % ДИ, 3,9–4,3 месяца) и 4,1 месяца (95 % ДИ 3,7–4,5 месяца) для эрибулина и капецитабина соответственно (ОР 0,98; 95 % ДИ 0,86–1,11; Р = 74). ЧОО по результатам независимого обзора составила 11,0 % (95 % ДИ 8,5–13,9 %) и 11,5 % (95 % ДИ 8,9–14,5 %; P = 85) для эрибулина и капецитабина соответственно. ЧОО по результатам обзора исследователей составила 16,1 % (95 % ДИ 13,1–19,4 %) и 19,9 % (95 % ДИ 16,6–23,5 %; Р = 10) для эрибулина и капецитабина соответственно.
Следует отметить, что проведены и опубликованы данные по исследованиям эрибулина в реальной клинической практике. На одном из них хотелось бы остановиться. Был проведен ретроспективный анализ пациенток с мРМЖ. Врачи, приглашенные для участия в исследовании, были участниками Cardinal Health Oncology Provider Extended Network, это группа, состоящая из более чем 7000 специалистов в области онкологии и гематологии со всей территории США. Врачи, которые были отобраны для участия в этом исследовании, заполнили первоначальный запрос о возможности, указав, что они принимали участие в лечение пациенток с мРМЖ [35]. Чтобы быть включенным в исследование, пациентка должна была иметь подтвержденный диагноз мРМЖ и начать терапию эрибулином в период с 1 января 2011 до 31 декабря 2017 года.
В исследование были включены в общей сложности 513 пациенток. Данные были собраны 46 врачами, 69,6 % из которых специализировались по гематологии или онкологии. Средний возраст на момент начала терапии эрибулином в общей популяции пациенток составлял 59,0 лет (диапазон 26–86); 32,9 % были старше 65 лет. Большинство пациенток были европеоидами (64,9 %) и не испаноязычными (89,5 %); афроамериканские пациентки составляли 26,3 % исследуемой популяции. Эрибулин чаще всего применялся в третьей линии (78,0 %). Большинство пациенток (61,0 %) имели статус по ECOG 0 или 1 до начала терапии эрибулином. В целом 45,4 % пациенток были HR+/HER2-, и у 49,9 % был трижды негативный РМЖ. В подгруппе трижды негативного РМЖ большинство пациенток получали эрибулин в третьей линии (87,9 %). Примерно у двух третей пациенток с трижды негативным РМЖ статус по ECOG был 0 или 1. Как в общей когорте, так и в подгруппе трижды негативного РМЖ на момент начала терапии эрибулином у пациенток были констатированы висцеральные метастазы. Наиболее частыми органами для метастазирования были легкие и печень (66,7 и 57,3 % соответственно).
На момент среза данных 497 (96,9 %) пациенток в общей когорте и 248 (96,9 %) пациенток в подгруппе трижды негативного рака прекратили терапию эрибулином. Среди всех пациенток, прекративших лечение, средняя продолжительность терапии эрибулином составила 5,5 месяца (диапазон 0,03–21,5) и 5,4 месяца (диапазон 1,2–21,5) в подгруппе трижды негативного рака. Среди пациенток, которые прекратили лечение эрибулином, большинство прогрессировали как в общей когорте (78,1 %), так и в группе трижды негативного рака (84,3 %). Другие причины прекращения терапии в общей когорте и подгруппе триждынегативного рака включали снижение функционального статуса (4,0 и 2,4 %), госпитализация в хоспис (5,0 и 6,1 %), паллиативная помощь (3,4 и 0,4 %), завершение запланированной продолжительности терапии эрибулином (4,8 и 4,8 %), отказ пациента (2,2 и 1,2 %) и другие причины (1,4 и 0,4 %). Сообщалось о токсичности/непереносимости в качестве причины прекращения лечения у 1,0 % пациенток в целом и у 0,4 % пациенток с трижды негативным раком.
После прекращения терапии эрибулином 175 (34,1 %) всех пациенток и 99 (38,7 %) в группе трижды негативного рака получили следующую линию терапии. Среди пациенток, которые начали другую линию лечения, среднее время до начала следующей линии составило 8,1 месяца (диапазон 1,6–22,4) в целом и 8,3 месяца (диапазон 2,1–22,4) в подгруппе трижды негативного рака.
В общей группе пациенток ЧОО составила 54,4 % (95 % ДИ 50,0–58,7 %) (рис. 2). Всего 41 пациентка (8,0 %) имела полный ответ, 238 (46,4 %) имели частичный ответ, 88 (17,2 %) стабилизацию заболевания, а у 146 (28,5 %) зарегистрирована прогрессия.
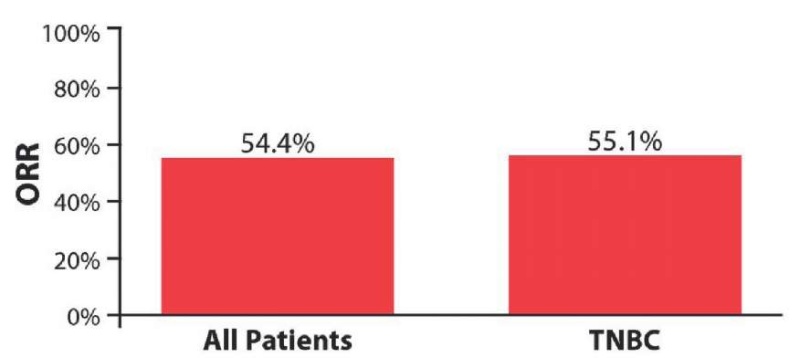
Рисунок 2. ЧОО в общей группе и подгруппе трижды негативного рака [23]
Figure 2. ORT in general group and triple-negative cancer subgroup [23]
Время достижения наилучшего ответа среди пациенток с частичным или полным ответом составило в среднем 3,0 месяца [ межквартильный диапазон (IQR) 2,2, 4,1]. Продолжительность наилучшего ответа среди 261 пациентки с полным или частичным ответом составила в среднем 4,5 месяца (IQR 2,9, 7,1). Для пациенток в подгруппе трижды негативного рака ЧОО была 55,1 % (95 % ДИ 48,8–61,2 %) (рис. 2). В общей сложности у 15 (5,9 %) пациенток с трижды негативным раком был зарегистрирован полный ответ, у 126 (49,2 %) — частичный ответ, 46 (18,0 %) имели стабилизацию заболевания и 69 (27,0 %) прогрессировали. Время достижения наилучшего ответа у пациенток с полным или частичным ответом составило в среднем 2,8 месяца (IQR 2,1, 3,9), а продолжительность наилучшего ответа у 132 пациенток с полным или частичным ответом и известными датами первоначального ответа и прогрессирования составила в среднем 4,2 месяца (IQR 2,8, 6,6).
На момент прекращения сбора данных 402 (78,4 %) пациентки, в том числе 219 (85,5 %) в подгруппе трижды негативного рака, прогрессировали на терапии эрибулином. На этапе в 6 месяцев 262 пациентки (51,2 %, 95 % ДИ 46,8–55,5 %) были живы и не имели прогрессирования в общей популяции, и по состоянию на 12-месячный рубеж 94 пациентки (19,2 %, 95 % ДИ 15,8–22,8 %) были живы и без прогрессирования (рис. 3).
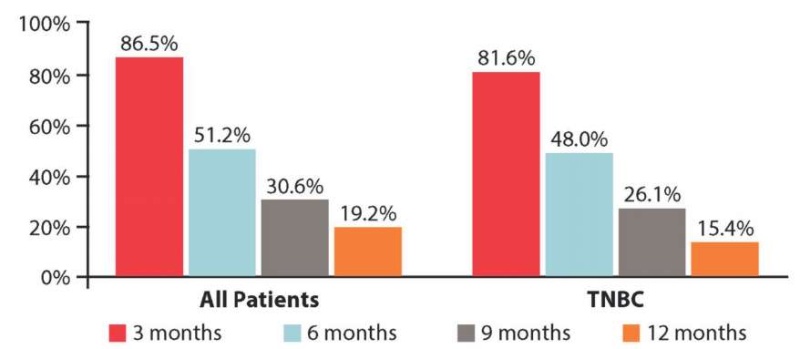
Рисунок 3. ВБП через 3, 6, 9 и 12 месяцев в общей группе и подгруппе трижды негативного рака [23]
Figure 3. PFS in 3, 6, 9 and 12 months in general group and triple-negative cancer subgroup [23]
Выживаемость без прогрессирования, оцененная с использованием метода Каплана — Мейера, представлена на рисунке 4. Медиана ВБП пациенток в общей популяции составила 6,1 месяца (95 % ДИ 5,8–6,6) (рис. 4а). В подгруппе трижды негативного рака 125 пациенток (48,0 %, 95 % ДИ 41,8–54,0 %) были живы и не прогрессировали на 6-месячном этапе и 38 (15,4 %, 95 % ДИ 11,3–20,2 %) были живы и не прогрессировали на 12-месячном этапе (рис. 2). Медиана ВБП у пациенток в подгруппе трижды негативного рака составила 5,8 месяца (95 % ДИ 5,1–6,4) (рис. 4в).
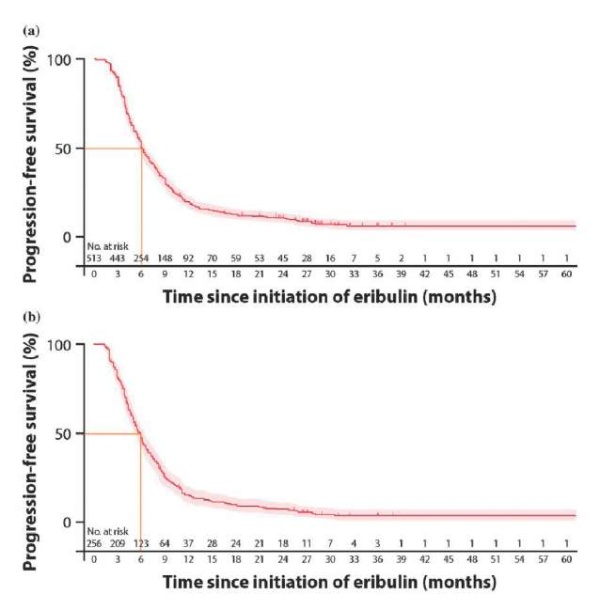
Рисунок 4. ВБП по методу Каплана — Мейера от начала приема эрибулина: a — у всех пациенток, b — в подгруппе трижды негативного рака [23]
Figure 4. PFS according to the Kaplan-Meier method from the beginning of eribulin administration: a — in all patients, b — in triple-negative cancer subgroup [23]
Также в этом исследовании проведена оценка ОВ. На момент среза данных 415 (80,9 %) пациенток в общей группе и 222 (86,7 %) в подгруппе трижды негативного рака умерли. На 12-месячном этапе 43,9 % (95 % ДИ 39,6–48,2 %) пациенток были живы в общей популяции, в то время как на 24-месячном этапе только 23,9 % (95 % ДИ 20,2–27,7 %). Медиана ОВ пациенток в общей популяции составила 10,6 месяца (95 % ДИ 9,9–11,7) (рис. 5а). В подгруппе трижды негативного — 40,3 % (95 % ДИ 34,3–46,3 %) были живы на 12-месячной отметке и 17,6 % (95 % ДИ 13,1–22,6 %) были живы на рубеже в 24 месяца. Медиана ОВ пациенток в подгруппе трижды негативного рака составила 9,8 месяца (95 % ДИ 8,6–11,0) (рис. 5b).
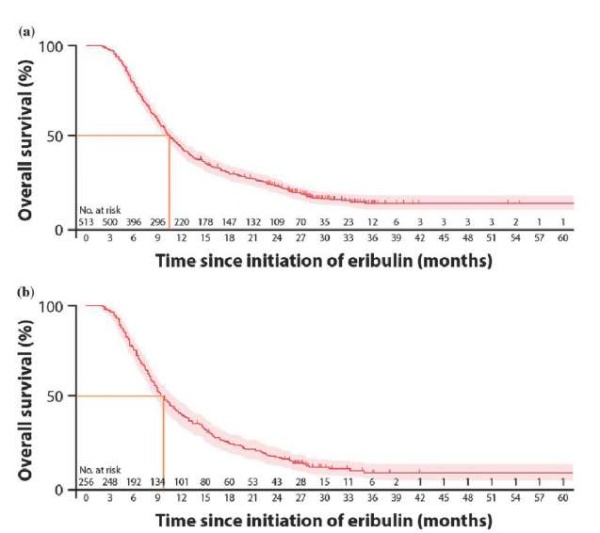
Рисунок 5. ОВ по методу Каплана — Мейера от начала приема эрибулина: a — у всех пациенток, b — в подгруппе трижды негативного рака [23]
Figure 5. OS according to the Kaplan-Meier method from the beginning of eribulin administration: a — in all patients, b — in the triple-negative cancer subgroup [23]
С количеством более чем в 500 пациенток, получавших эрибулин в соответствии с утвержденными в США показаниями, приведенное выше исследование представляет собой крупнейшее ретроспективное исследование эрибулина, проведенное в популяции США на сегодняшний день. Почти 80 % пациенток в этом исследовании получали эрибулин в качестве терапии третьей линии, а остальные получали препарат в более поздних линиях терапии. Некоторые ключевые различия между популяцией пациенток в исследовании и популяцией пациенток в исследовании EMBRACE включают расовое разнообразие (26,3 % афроамериканок в этом исследовании против 4 % в EMBRACE); функциональный статус (38,8 % со статусом ECOG 2 балла в этом исследовании по сравнению с 8 % со статусом ECOG 2 балла в EMBRACE); и доля пациенток с диагнозом трижды негативного рака (49,9 % в этом исследовании против 19 % в EMBRACE). Несмотря на эти различия, клиническая польза очевидна (ЧОО составила 54,4 % в этом исследовании по сравнению с 12 % в EMBRACE) [36].
В исследование, результаты которого были опубликованы в 2017 году в России, были включены 34 пациентки с прогрессирующим метастатическим РМЖ в соответствии с показаниями к применению препарата, зарегистрированного в РФ. Все пациентки имели морфологическую верификацию диагноза, удовлетворительную функцию печени, почек и костного мозга, статус по шкале ECOG от 0 до 2. Все пациентки получили предшествующую терапию с антрациклинами и таксанами по поводу местнораспространенного и/или метастатического РМЖ. По результатам исследования ЧОО составила 26,4 %, из них 26,4 % — частичный ответ, полного ответа не зарегистрировано. Контроль роста опухоли составил 58,8 %, из них 26,4 % было частичных ответом, 32,4 % — стабилизация. Прогрессирование болезни отмечено у 41,2 % пациенток. Также отмечено, что менее предлеченные пациентки имели лучшие результаты терапии эрибулином. ЧОО почти в 2 раза превосходила этот показатель по сравнению с пациентками, получавшими эрибулин в более поздних линиях. При назначении эрибулина в ранних линиях (1–3-я линии) ЧОО составила 33,3 %, если же эрибулин назначался начиная с четвертой линии и далее, ЧОО снижалась до 18,7 % [37][38]. Спектр нежелательных явлений соответствовал данным, полученным в исследовании EMBRACE.
Достаточно интересным представляется исследование эффективности и безопасности эрибулина в японской популяции. В постмаркетинговом исследовании в Японии сообщалось об эффективности и безопасности эрибулина в клинических условиях [39]. Данные об эффективности и безопасности эрибулина в качестве первой или второй линии лечения были собраны в реальных условиях только в Японии. Таким образом, проведено 2-летнее постмаркетинговое исследование у пациенток с HER2-негативным неоперабельным или рецидивирующим раком молочной железы в клинических условиях в Японии для оценки эффективности и безопасности эрибулина, в том числе у пациенток, использующих эрибулин в качестве лечения первой или второй линии. В исследование было включено 637 пациенток с диагнозом HER2-негативного рака молочной железы. Медианы ОВ и ВБП составили 15,6 и 4,2 месяца соответственно. Продолжительность ОВ 15,6 месяца в целом была аналогична тем, о которых сообщалось в предыдущих клинических исследованиях (11,3–17,4 месяца) [40–43]. Более того, более длительная ОВ, такая как 72,1 и 22,3 месяца, была зарегистрирована в реальной клинической практике, а не в этом исследовании [44][45]. Эти различия в результатах могут быть объяснены различиями в исходных характеристиках пациента и дизайне исследования. При анализе эффективности 632 из 637 пациенток были включены в анализ выживаемости после лечения эрибулином. Во всех группах лечения первой, второй и третьей или более поздней линии медиана ОВ (95 % ДИ) составила 15,6 (13,8–17,6), 22,8 (17,3–31,0), 16,3 (12,4–19,9) и 12,6 (11,2–15,1) месяца соответственно. В целом показатели 1- и 2-летней выживаемости составили 58,2 и 35,9 % соответственно. В группах первой, второй и третьей или более поздней линии лечения показатели выживаемости в течение 1 и 2 лет были выше и составили 71,6 против 48,3 %; 58,2 против 37,0 %; и 52,0 против 29,5 % соответственно [46].
ЗАКЛЮЧЕНИЕ
В последние годы становится все более очевидным, что клинические исследования при раке могут быть не столь репрезентативными для более широкого круга пациентов, поскольку в них участвуют более молодые, здоровые пациенты. В реальной клинической практике лечение получают самые разнообразные пациентки с массой сопутствующей патологии и более низким функциональным статусом. Приведенные данные свидетельствуют, что эрибулин продемонстрировал сопоставимые результаты с исследованием EMBRACE для более широкой и разнообразной когорты пациентов. Дальнейшие исследования эрибулина в реальной клинической практике, безусловно, откроют новые возможности в терапии метастатического РМЖ.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Funding. This work is not funded.
Список литературы
1. National Cancer Institute. SEER Cancer Statistics Factsheets: female breast cancer. [cited 2022 Oct 21]. Available from: http://seer.cancer.gov/statfacts/html/breast.html
2. Kawano S., Ito K., Yahata K., Kira K., Abe T., Akagi T., et al. A landmark in drug discovery based on complex natural product synthesis. Sci Rep. 2019;9(1):8656. DOI: 10.1038/s41598-019-45001-9
3. Dybdal-Hargreaves N.F., Risinger A.L., Mooberry S.L. Eribulin mesylate: mechanism of action of a unique microtubule-targeting agent. Clin Cancer Res. 2015;21(11):2445–52. DOI: 10.1158/1078-0432. CCR-14-3252
4. Halaven (eribulin mesylate) injection, for intravenous use [prescribing information]. Eisai Inc., 2016.
5. Wang X., Liu S., Xue Y. Treatment strategy and safety of Eribulin in advanced breast cancer. J Coll Physicians Surg Pak. 2022;32(1):122–4. DOI: 10.29271/jcpsp.2022.01.122. PMID: 34983165
6. O'Shaughnessy J., Kaklamani V., Kalinsky K. Perspectives on the mechanism of action and clinical application of eribulin for metastatic breast cancer. Future Oncol. 2019;15(14):1641–53. DOI: 10.2217/fon2018-0936
7. Halaven 0.44 mg/ml solution for injection [summary of product characteristics]. Hertfordshire: Eisai Europe Limited; 2017.
8. Pedersini R., di Mauro P., Amoroso V., Parati M.C., Turla A., Ghilardi M., et al. Efficacy of Eribulin mesylate in older patients with breast cancer: A pooled analysis of clinical trial and real-world data. J Geriatr Oncol. 2020;11(6):976–81. DOI: 10.1016/j.jgo.2020.03.021
9. López González A., Del Barco Berrón S., Grau I., Galan M., Castelo Fernández B., Cortés A., et al. Challenging endocrine sensitivity of hormone receptor-positive/HER2-negative advanced breast cancer with the combination of eribulin and endocrine therapy: the REVERT study. Cancers (Basel). 2022;14(23):5880. DOI: 10.3390/cancers14235880
10. Pellegrino B., Cavanna L., Boggiani D., Zamagni C., Frassoldati A., Schirone A., et al. Phase II study of eribulin in combination with gemcitabine for the treatment of patients with locally advanced or metastatic triple negative breast cancer (ERIGE trial). Clinical and pharmacogenetic results on behalf of the Gruppo Oncologico Italiano di Ricerca Clinica (GOIRC). ESMO Open. 2021;6(1):100019. DOI: 10.1016/j.esmoop.2020.100019
11. Olatunde O.Z., Yong J., Lu C. The progress of the anticancer agents related to the microtubules target. Mini Rev Med Chem. 2020;20(20):2165–92. DOI: 10.2174/1389557520666200729162510
12. Okouneva T., Azarenko O., Wilson L., Littlefield B.A., Jordan M.A. Inhibition of centromere dynamics by eribulin (E7389) during mitotic metaphase. Mol. Cancer Ther. 2008;7(7):2003–11. DOI: 10.1158/15357163.MCT-08-0095
13. Smith J.A., Wilson L., Azarenko O., Zhu X., Lewis B.M., Littlefield B.A., et al. Eribulin binds at microtubule ends to a single site on tubulin to suppress dynamic instability. Biochemistry. 2010;49(6):1331–7. DOI: 10.1021/bi901810u
14. Kenny L., Beresford M., Brown I., Misra V., Kristeleit H. Eribulin for the treatment of advanced breast cancer: A prospective observational registry study. Eur J Cancer Care (Engl). 2022;31(6):e13747. DOI: 10.1111/ecc.13747
15. Kashiwagi S., Asano Y., Goto W., Takada K., Morisaki T., Kouhashi R., et al. Validation of systemic and local tumour immune response to eribulin chemotherapy in the treatment of breast cancer. Anticancer Res. 2020;40(6):3345–54. DOI: 10.21873/anticanres.14317
16. Uemura D., Takahashi K., Yamamoto T., Katayama C., Tanaka J., Okumura Y., et al. Norhalichondrin A: An antitumor polyether macrolide from a marine sponge. J Am Chem Soc. 1985;107(16):4796–8. DOI: 10.1021/ja00302a042
17. Swami U., Chaudhary I., Ghalib M.H., Goel S. Eribulin — A review of preclinical and clinical studies. Crit Rev Oncol Hematol. 2012;81(2):163–84. DOI: 10.1016/j.critrevonc.2011.03.002
18. Donoghue M., Lemery S.J., Yuan W., He K., Sridhara R., Shord S., et al. Eribulin mesylate for the treatment of patients with refractory metastatic breast cancer: Use of a “physician’s choice” control arm in a randomized approval trial. Clin Cancer Res. 2012;18(6):1496–505. DOI: 10.1158/1078-0432.CCR-11-2149.
19. Jordan M.A., Kamath K., Manna T., Okouneva T., Miller H.P., Davis C., et al. The primary antimitotic mechanism of action of the synthetic halichondrin E7389 is suppression of microtubule growth. Mol Cancer Ther. 2005;4(7):1086–95. DOI: 10.1158/1535-7163.MCT-04-0345
20. Tan A.R., Rubin E.H., Walton D.C., Shuster D.E., Wong Y.N., Fang F., et al. Phase I study of eribulin mesylate administered once every days in patients with advanced solid tumors. Clin Cancer Res. 2009;15(12):4213–9. DOI: 10.1158/1078-0432.CCR-09-0360
21. de Nonneville A., Sabatier R., Gonçalves A., Extra J.M., Tarpin C., Launay S., et al. Safety and efficacy of eribulin for "real-world" older patients with metastatic breast cancer. J Geriatr Oncol. 2018;9(3):281–3. DOI: 10.1016/j.jgo.2017.11.003
22. Fukada I., Ito Y., Kondo N., Ohtani S., Hattori M., Tokunaga E., et al. A phase II study of sequential treatment with anthracycline and taxane followed by eribulin in patients with HER2-negative, locally advanced breast cancer (JBCRG-17). Breast Cancer Res Treat. 2021;190(3):425– 34. DOI: 10.1007/s10549-021-06396-0
23. Towle M.J., Salvato K.A., Budrow J., Wels B.F., Kuznetsov G., Aalfs K.K., et al. In vitro and in vivo anticancer activities of synthetic macrocyclic ketone analogues of halichondrin B. Cancer Res. 2001;61:1013– 21. PMID: 11221827
24. Aogi K., Iwata H., Masuda N., Mukai H., Yoshida M., Rai Y., et al. A phase II study of eribulin in Japanese patients with heavily pretreated metastatic breast cancer. Ann Oncol. 2012;23(6):1441–8. DOI: 10.1093/ annonc/mdr444
25. Cortes J., Vahdat L., Blum J.L., Twelves C., Campone M., Roché H., et al. Phase II study of the halichondrin B analog eribulin mesylate in patients with locally advanced or metastatic breast cancer previously reated with an anthracycline, a taxane, and capecitabine. J Clin Oncol. 2010;28(25):3922–8. DOI: 10.1200/JCO.2009.25.8467
26. Vahdat L.T., Pruitt B., Fabian C.J., Rivera R.R., Smith D.A., Tan-Chiu E., et al. Phase II study of eribulin mesylate, a halichondrin B analog, in patients with metastatic breast cancer previously treated with an anthracycline and a taxane. J Clin Oncol. 2009;27(18):2954–61. DOI: 10.1200/JCO.2008.17.7618
27. Cortes J., O'Shaughnessy J., Loesch D., Blum J.L., Vahdat L.T., Petrakova K., et al. Eribulin monotherapy versus treatment of physician's choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomised study. Lancet. 2011;377(9769):914–23. DOI: 10.1016/S0140-6736(11)60070-6
28. Twelves C., Cortes J., Vahdat L.T., Wanders J., Akerele C., Kaufman P.A. Phase III trials of eribulin mesylate (E7389) in extensively pretreated patients with locally recurrent or metastatic breast cancer. Clin Breast Cancer. 2010;10(2):160–3. DOI: 10.3816/CBC.2010.n.023
29. Greenhalgh J., Bagust A., Boland A., Oyee J., Trevor N., Beale S., et al. Eribulin for the treatment of advanced or metastatic breast cancer: a NICE single technology appraisal. Pharmacoeconomics. 2015;33(2):137–48. DOI: 10.1007/s40273-014-0214-2
30. Kaufman P.A., Awada A., Twelves C., Yelle L., Perez E.A., Velikova G., et al. Phase III open-label randomized study of eribulin mesylate versus capecitabine in patients with locally advanced or metastatic breast cancer previously treated with an anthracycline and a taxane. J Clin Oncol. 2015;33(6):594–601. DOI: 10.1200/JCO.2013.52.4892
31. Manso L., Moreno Antón F., Izarzugaza Perón Y., Delgado Mingorance J.I., Borrega García P., Echarri González M.J., et al. Safety of eribulin as third-line chemotherapy in HER2-negative, advanced breast cancer pre-treated with taxanes and anthracycline: OnSITE study. Breast J. 2019;25(2):219–25. DOI: 10.1111/tbj.13199
32. Sang D., Song L.H., Di L.J., Wang Y.L., Liu C.G., Guo Z.Q., et al. Multicenter real world study on the efficacy and safety of eribulin for the treatment of advanced breast cancer. Zhonghua Zhong Liu Za Zhi. 2022;44(4):364–9. DOI: 10.3760/cma.j.cn112152-20210226-00173
33. Hayashida T., Jinno H., Mori K., Sato H., Matsui A., Sakurai T., et al. Phase II trial of eribulin mesylate as a firstor second-line treatment for locally advanced or metastatic breast cancer: a multicenter, singlearm trial. BMC Cancer. 2018;18(1):701. DOI: 10.1186/s12885-0184628-7
34. Yamashita T., Kawaguchi H., Masuda N., Kitada M., Narui K., Hattori M., et al. Efficacy of the eribulin, pertuzumab, and trastuzumab combination therapy for human epidermal growth factor receptor 2-positive advanced or metastatic breast cancer: a multicenter, single arm, phase II study (JBCRG-M03 study). Invest New Drugs. 2021;39(1):217–25. DOI: 10.1007/s10637-020-00991-6
35. De Angelis C., Bruzzese D., Bernardo A., Baldini E., Leo L., Fabi A., et al. Eribulin in combination with bevacizumab as second-line treatment for HER2-negative metastatic breast cancer progressing after first-line therapy with paclitaxel and bevacizumab: a multicenter, phase II, single arm trial (GIM11-BERGI). ESMO Open. 2021;6(2):100097. DOI: 10.1016/j.esmoop.2021.100054
36. National Cancer Institute Surveillance, Epidemiology, and End Results (SEER) Cancer Stat Facts: Female Breast Cancer Subtypes. [cited 2020 June 4]. Available from: https://seer.cancer.gov/statfacts/html/breastsubtypes.html
37. Mougalian S.S., Kish J.K., Zhang J., Liassou D., Feinberg B.A. Effectiveness of eribulin in metastatic breast cancer: 10 years of real-world clinical experience in the United States. Adv Ther. 2021;38(5):2213–25. DOI: 10.1007/s12325-020-01613-6
38. Филоненко Д.В., Белоногов А.В. Опыт применения эрибулина в условиях реальной клинической практики. Злокачественные опухоли. 2017;7(4):21–8. DOI:10.18027/2224-5057-2017-7-4-21-28
39. Watanabe J., Ito Y., Ohsumi S., Mizutani M., Tashiro H., Sakurai K., et al. Safety and effectiveness of eribulin in Japanese patients with locally advanced or metastatic breast cancer: a post-marketing ob-servational study. Investig New Drugs. 2017;35:791–9. DOI: 10.1007/s10637-0170486-4
40. Maeda S., Saimura M., Minami S., Kurashita K., Nishimura R., Kai Y., et al. Efficacy and safety of eribulin as firstto third-line treatment in patients with advanced or metastatic breast cancer previously treated with anthracyclines and taxanes. Breast. 2017;32:66–72. DOI: 10.1016/j.breast.2016.12.017
41. Chen P.H., Yeh D.C., Tung H.H., Lin C.Y. Prognostic and predictive factors of eribulin in patients with heavily pre-treated metastatic breast cancer. Medicine (Baltimore). 2021;100(47):e27859. DOI: 10.1097/ MD.0000000000027859
42. Pivot X., Im S.A., Guo M., Marmé F. Subgroup analysis of patients with HER2-negative metastatic breast cancer in the second-line setting from a phase 3, open-label, randomized study of eribulin mesilate versus capecitabine. Breast Cancer. 2018;25(3):370–4. DOI: 10.1007/s12282017-0826-4
43. Inoue K., Saito T., Okubo K., Kimizuka K., Yamada H., Sakurai T., et al. Phase II clinical study of eribulin monotherapy in Japanese patients with metastatic breast cancer who had well-defined taxane resistance. Breast Cancer Res Treat. 2016;157:295–305. DOI: 10.1007/ s10549-016-3808-x
44. Watanabe J. Eribulin monotherapy improved survivals in patients with ER-positive HER2-negative metastatic breast cancer in the real world: a single institutional review. Springerplus. 2015;4:625. DOI: 10.1186/ s40064-015-1422-8
45. Kikuchi Y., Uchida Y., Shirakawa K., Kanauchi H., Niwa T., Nishioka K., et al. A multicenter, observational study of metastatic breast cancer patients who were treated with eribulin mesylate or taxane-based regimens. Asia Pac J Clin Oncol. 2018;14:e231–7. DOI: 10.1111/ajco.12863
46. Inoue K., Takahashi M., Mukai H., Yamanaka T., Egawa C., Sakata Y., et al. Effectiveness and safety of eribulin in Japanese patients with HER2negative, advanced breast cancer: a 2-year post-marketing observational study in a real-world setting. Invest New Drugs. 2020;38(5):1540–9. DOI: 10.1007/s10637-019-00890-5
Об авторах
А. В. СултанбаевРоссия
Султанбаев Александр Валерьевич — к.м.н., отдел противоопухолевой лекарственной терапии
Республика Башкортостан, Уфа
К. В. Меньшиков
Россия
Меньшиков Константин Викторович — к.м.н., доцент, кафедра онкологии с курсами онкологии и патологической анатомии ИДПО, отдел химиотерапии
Республика Башкортостан, Уфа
Ш. И. Мусин
Россия
Мусин Шамиль Исмагилович — к.м.н., хирургическое отделение № 6
Республика Башкортостан, Уфа
И. А. Меньшикова
Россия
Меньшикова Ирина Асхатовна — к.м.н., доцент, кафедра биологической химии
Республика Башкортостан, Уфа
Н. И. Султанбаева
Россия
Султанбаева Надежда Ивановна — отделение противоопухолевой лекарственной терапии № 1
Республика Башкортостан, Уфа
Е. В. Попова
Россия
Попова Екатерина Владимировна — амбулаторное отделение противоопухолевой лекарственной терапии (химиотерапии)
Республика Башкортостан, Уфа
В. Е. Аскаров
Россия
Аскаров Вадим Евгеньевич — амбулаторное отделение противоопухолевой лекарственной терапии (химиотерапии)
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Султанбаев А.В., Меньшиков К.В., Мусин Ш.И., Меньшикова И.А., Султанбаева Н.И., Попова Е.В., Аскаров В.Е. Эрибулин в реальной клинической практике при метастатическом раке молочной железы. Креативная хирургия и онкология. 2023;13(1):77-86. https://doi.org/10.24060/2076-3093-2023-13-1-77-86
For citation:
Sultanbaev A.V., Menshikov K.V., Musin Sh.I., Menshikova I.A., Sultanbaeva N.I., Popova E.V., Askarov V.E. Eribulin in Metastatic Breast Cancer: Actual Clinical Practice. Creative surgery and oncology. 2023;13(1):77-86. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-1-77-86


































