Перейти к:
Интраоперационная ICG-флуоресценция как способ профилактики послеоперационных стриктур уретеро-илеоанастомозов при робот-ассистированной радикальной цистэктомии
https://doi.org/10.24060/2076-3093-2023-13-2-97-104
Аннотация
Введение. Радикальная цистэктомия с отведением мочи признана «золотым стандартом» лечения мышечно-инвазивного рака мочевого пузыря. Одним из опасных осложнений в послеоперационном периоде выступает стриктура уретеро-илеоанастомоза. Данная патология может привести к гидроуретеронефрозу, почечной недостаточности, уросепсису. Одним из факторов развития стриктуры анастомоза выступает его ишемия. С целью снижения возможных ишемических повреждений осуществляются следующие манипуляции: бережная обработка тканей в зоне будущего анастомоза, сохранение периуретеральной адвентиции, минимальная мобилизация мочеточников перед имплантацией в кондуит. Перспективным направлением выступает интраоперационная оценка перфузии тканей мочеточника и кишечного сегмента с использованием ICG-флуоресценции.
Материалы и методы. Для исследования были отобраны 56 пациентов, перенесших робот-ассистированную радикальную цистэктомию с интракорпоральным отведением мочи в период с января 2021 по март 2022 гг. в клинике ФГБОУ ВО «Башкирский государственный медицинский университет». Пациенты были разделены на две группы: первая группа (22 пациента), которым интраоперационно применялся ICG, и вторая (34 пациента) — без использования флуоресценции. Медиана наблюдения составила 14 месяцев для первой группы и 12 месяцев — для второй. Критериями сравнения между группами выступили демографические показатели, периоперационные результаты (включая 30-и 90-дневные осложнения) и частота стриктур уретероилеоанастомозов. Группы сравнивались с использованием проверки равенства средних значений и критерия проверки выборочного распределения.
Результаты и обсуждения. Между пациентами обеих групп не было статистически значимых различий по времени операции, расчетной кровопотере и продолжительности госпитализации. Не было существенных различий в частоте 30-и 90-дневных осложнений и количеству повторных госпитализаций среди пациентов первой и второй групп (p = 0,477 и p = 0,089 соответственно). Наблюдалось статистически значимое снижение частоты развития стриктур уретеро-илеоанастомоза в первой группе по сравнению со второй (0/34 [0 %] и 7/68 [10,3 %], p = 0,020).
Заключение. Использование ICG-флуоресценции для оценки васкуляризации дистальных отделов мочеточника во время робот-ассистированной радикальной цистэктомии с интракорпоральным отведением мочи может снизить риск послеоперационных ишемических стриктур уретеро-илеоанастомоза.
Ключевые слова
Для цитирования:
Павлов В.Н., Урманцев М.Ф., Бакеев М.Р., Денейко А.С. Интраоперационная ICG-флуоресценция как способ профилактики послеоперационных стриктур уретеро-илеоанастомозов при робот-ассистированной радикальной цистэктомии. Креативная хирургия и онкология. 2023;13(2):97-104. https://doi.org/10.24060/2076-3093-2023-13-2-97-104
For citation:
Pavlov V.N., Urmantsev M.F., Bakeev M.R., Deneyko A.S. Intraoperative ICG-Fluorescence as a Method to Prevent Postoperative Strictures of Uretero-Ileal Anastomoses in Robot-Assisted Radical Cystectomy. Creative surgery and oncology. 2023;13(2):97-104. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-2-97-104
ВВЕДЕНИЕ
Радикальная цистэктомия с отведением мочи является «золотым стандартом» лечения мышечно-инвазивного рака мочевого пузыря с частотой периоперационных осложнений до 70 % [1][2]. Стриктура уретеро-илеоанастомоза является значительным осложнением после формирования неоцистиса с многочисленными потенциально неблагоприятными последствиями, среди которых выделяют боль, гидронефроз, обструкцию верхних мочевыводящих путей, уросепсис, мочекаменную болезнь и почечную недостаточность [3]. Лечение таких осложнений вызывает трудности и часто требует дальнейшего радикального вмешательства [3]. Частота возникновения доброкачественных уретеро-энтеральных стриктур при выполнении радикальной цистэктомии колеблется от 1,3 до 12,7 % при использовании техники прямого анастомоза [4–6].
Хотя точные механизмы формирования доброкачественной стриктуры мочеточниково-кишечного анастомоза неизвестны, считается, что это происходит преимущественно из-за ишемии и последующего рубцевания анастомоза [5]. Для минимизации ишемического повреждения мочеточников во время операции могут быть проведены следующие технические приемы: тщательная обработка тканей, сохранение периуретеральных адвентициальных тканей и минимальная мобилизация мочеточников перед наложением анастомоза с подвздошным сегментом. Однако, несмотря на тщательную хирургическую технику и соблюдение этих основных принципов, васкуляризация мочеточника может быть недостаточной, что приведет к формированию ишемической уретеро-энтеральной стриктуры.
Точная интраоперационная оценка васкуляризации дистального отдела мочеточника может быть затруднена и традиционно проводится во время общего визуального осмотра под стандартным освещением. Несмотря на сохранение периуретеральной адвентиции и тщательную обработку соседних тканей, оценка васкуляризации дистального отдела мочеточника остается субъективной и может быть неточной. Использование индоцианина зеленого (ICG — indocyanine green) с флуоресценцией в инфракрасном диапазоне стало ценным методом интраоперационной навигации и диагностики. ICG — одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США нетоксичный флуоресцентный экзогенный индикатор, визуализируемый с помощью инфракрасной камеры, но не обнаруживаемый в спектре видимого света [7]. Использование ICG стало популярным в эндовидеохирургии после внедрения технологии FireFly® (Intuitive Surgical, Саннивейл, Калифорния, США), интегрированной в роботизированную систему Da Vinci® (Калифорния, США). Режим визуализации в инфракрасном диапазоне активируется консольным хирургом по мере необходимости, обеспечивая плавный переход между белым и ближним инфракрасным светом, что позволяет обнаруживать флуоресценцию ICG в режиме реального времени [8]. Несмотря на увеличение частоты использования ICG в различных урологических робот-ассистированных операциях, нет опубликованных данных, касающихся использования этой технологии для оценки васкуляризации мочеточника во время робот-ассистированной радикальной цистэктомии (РАРЦ). По сравнению с исследованием, проведенным при освещении белым светом, использование ICG может способствовать улучшению интраоперационной оценки васкуляризации тканей, что приводит к лучшей идентификации и, следовательно, к иссечению нежизнеспособных сегментов дистального отдела мочеточника перед наложением уретеро-илеоанастомоза. В настоящем исследовании представлены результаты проведенной серии процедур РАРЦ, в которых ICG использовали для оценки васкуляризации дистального отдела мочеточника, перфузии мобилизованного кишечного сегмента и межкишечного анастомоза.
МАТЕРИАЛЫ И МЕТОДЫ
Для исследования были отобраны 56 пациентов, которым выполнялась РАРЦ в период с января 2021 по март 2022 г. в клинике ФГБОУ ВО «Башкирский государственный медицинский университет». Протокол исследования одобрен комитетом по биомедицинской этике ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России. Все пациенты подписали информированное согласие на участие в исследовании. Пациенты были разделены на две группы: 1-я группа (22 пациента (37 %)) — интраоперационно применялся ICG для оценки васкуляризации, 2-я группа (34 пациента (63 %)) — без использования ICG. Всего было выполнено 112 уретеро-илеоанастомозов, из них 44 (37 %) входили в группу с применением ICG и 68 (63 %) — в группу без ICG. Статистические различия в исходных характеристиках групп отсутствовали (табл. 1). Средний период наблюдения в группах с применением ICG и без его применения составил 14 и 12 месяцев соответственно.
Таблица 1. Характеристики пациентов
Table 1. Patient characteristics
1-я группа (с применением ICG) | 2-я группа (без применения ICG) | p-значение p-value | |
Средний возраст, лет (среднее квадратичное отклонение) Age, mean, yr (standard deviation) | 66 (±5,4) | 69 (±4,5) | <0,05 |
Средний индекс массы тела, кг/м² (среднее квадратичное отклонение) Body mass index, mean, kg/m² (standard deviation) | 27,1 (±2,5) | 26,5 (±3,8) | <0,05 |
Количество мужчин, n (%) Male, n (%) | 17 (77,3) | 26 (76,5) | <0,05 |
Степень ASA ASA classified | |||
ASA1, n (%) | 4 (18,2) | 9 (26,5) | <0,05 |
ASA2, n (%) | 13 (59,1) | 15 (44,1) | <0,05 |
ASA3, n (%) | 5 (22,7) | 10 (29,4) | <0,05 |
Всем пациентам выполнялась операция Бриккера с формированием гетеротопического неоцистиса. В 1-й группе пациентам после процедуры РАРЦ и расширенной тазовой лимфодиссекции левый мочеточник был проведен через ретромезентериальное окно на контрлатеральную сторону. ICG предварительно был разведен в соотношении 25 мг вещества на 10 мл дистиллированной воды. Непосредственно перед спатуляцией мочеточника и этапом наложения уретеро-илеоанастомоза внутривенно вводили 10 мл раствора ICG. Дистальные отделы мочеточников были исследованы с помощью оптического режима с флуоресценцией в ближнем инфракрасном диапазоне спектра. Визуальная оценка мочеточника проводилась во время артериальной и перфузионной фаз реакции ICG, так как вначале флуоресцируют мелкие периуретеральные артерии, а затем флуоресцирует стенка мочеточника по мере диффузии ICG в ткань. После инъекции красителя было затрачено 30 секунд для оценки артериального кровотока и 5 минут для визуализации степени перфузии тканей (рис. 1).
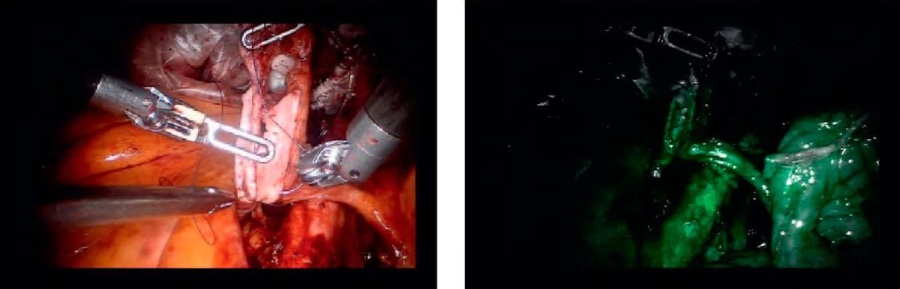
Рисунок 1. Дистальные отделы мочеточников в белом свете и при визуализации в ближнем инфракрасном диапазоне после внутривенного введения ICG
Figure 1. Distal ureters in white light and in near-infrared imaging after intravenous ICG injection
Дополнительно оценивалась мезентериальная перфузия в области илеокондуита и межкишечного анастомоза с целью оценки ишемии (рис. 2). Сегменты мочеточника без видимой флуоресценции или со слабой васкуляризацией были резецированы. Во 2-й группе пациентов процедуры РАРЦ, расширенной тазовой лимфаденэктомии выполнялись по стандартной методике с использованием шестипортового трансперитонеального доступа. Хорошо васкуляризованные дистальные отделы мочеточников спатулировались и использовались для наложения интракорпорального уретеро-уретеро-илеоанастомоза на JJ-стенты 6F с применением лигатуры Vicryl 5/0 (рис. 3). Было проведено сравнение пациентов обеих групп по демографическим и периоперационным показателям, включая 30- и 90-дневные осложнения, повторные госпитализации. Длины сегментов мочеточников, иссеченных в обеих группах, также оценивались и сравнивались. Послеоперационные осложнения классифицировали по системе Clavien-Dindo.
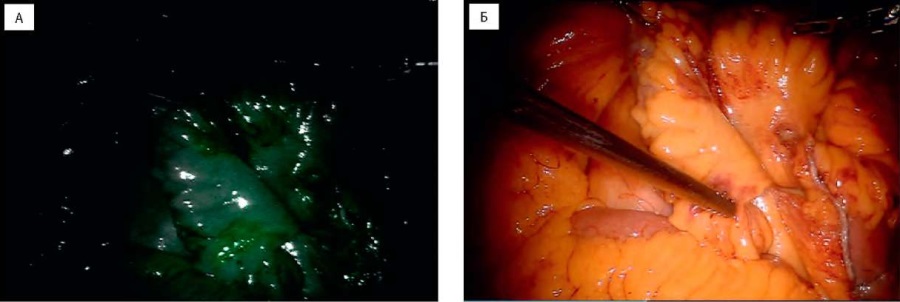
Рисунок 2. Мезентериальная ангиография после внутривенного ведения ICG. А — дистальный отдел подвздошной кишки при белом освещении; Б — дистальный отдел подвздошной кишки при ближней инфракрасной флуоресценции
Figure 2. Mesenteric angiography after intravenous ICG injection. A — distal ileum in white light; Б — distal ileum in near-infrared fluorescence
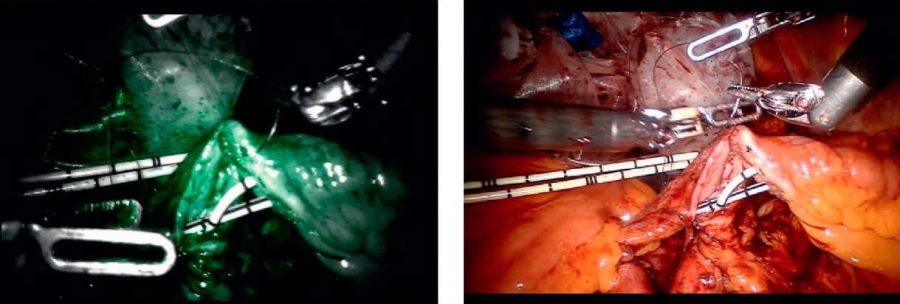
Рисунок 3. Оценка уретеро-илеоанастомоза в белом свете и в режиме визуализации в ближнем инфракрасном диапазоне после введения ICG. Наблюдается адекватное кровоснабжение мочеточников и сегмента подвздошной кишки
Figure 3. Assessment of uretero-ileal anastomosis in white light and in near-infrared imaging after ICG injection. Adequate blood supply to ureters and ileum is observed
Послеоперационное наблюдение за всеми пациентами включало регулярный осмотр в клинике с определением уровня креатинина в сыворотке крови и ультразвуковым исследованием органов брюшной полости и малого таза. Пациенты с клиническими или диагностическими признаками стриктуры анастомоза подлежали дополнительному инструментальному обследованию. Если имелись признаки образовавшейся стриктуры (отсутствие рефлюкса на пиелограмме и/или повышение уровня креатинина и/или прогрессирование гидронефроза), устанавливался чрескожный нефростомический дренаж для проведения антеградной пиелоуретерографии и «разгрузки» почки со стенозированным мочеточником.
РЕЗУЛЬТАТЫ
Между пациентами обеих групп не было статистически значимых различий по времени операции, расчетной кровопотере, среднему времени отхождения кишечных газов и продолжительности госпитализации (табл. 2). Не было существенных различий в частоте 30-и 90-дневных осложнений между пациентами обеих групп (1-я группа p = 0,451; 2-я группа p = 0,073) (табл. 3). Нежелательных лекарственных реакций вследствие введения ICG не наблюдалось, а использование ICG не повлияло на выбор метода деривации мочи.
Таблица 2. Периоперационные результаты
Table 2. Perioperative outcomes
1-я группа (с применением ICG) | 2-я группа (без применения ICG) | |
Среднее время операции, мин (среднее квадратичное отклонение) Operative time, min, mean (stantard deviation) | 190 (±51) | 170 (±65) |
Средняя интраоперационная кровопотеря, мл (среднее квадратичное отклонение) Estimated blood loss, ml, mean (standard deviation) | 270 (±124) | 280 (±135) |
Среднее время отхождения кишечных газов, дни (среднее квадратичное отклонение) Time to flatus, day, mean (standard deviation) | 4,1 (±2,1) | 4,0 (±2,5) |
Среднее время перехода к твердой пище, дни (среднее квадратичное отклонение) Time to oral solids, day, mean (standard deviation) | 2,5 (±0,5) | 2,8 (±0,6) |
Среднее время госпитализации, дни (среднее квадратичное отклонение) Length of stay, day, mean (standard deviation) | 11,0 (±1,5) | 12,0 (±2,0) |
Таблица 3. Послеоперационные осложнения
Table 3. Postoperative complications
Осложнение Complication | 30 дней 30 days | |
1-я группа (с применением ICG) | 2-я группа (без применения ICG) | |
I | 2 | 1 |
II | 3 | 5 |
III | 4 | 6 |
IV | - | - |
V | - | - |
90 дней 90 days | ||
I | 1 | 3 |
II | 3 | 3 |
III | - | 1 |
IV | - | - |
V | - | - |
p-значение p-value | 0,451 | 0,073 |
В целом в группе с использованием ICG длина резецированного мочеточника была больше, чем в группе без применения ICG (2,5 и 2,1 см, p = 0,003). Такие же результаты были и при боковом иссечении (слева: 2,5 и 1,9 см, p = 0,041; справа: 2,9 и 1,9 см, p = 0,007, 1-я и 2-я группа соответственно). Кроме того, в группе с применением ICG чаще удалялись длинные сегменты мочеточника (>5 см) по сравнению с группой без применения ICG (всего: 17 и 7 %, p < 0,05; слева: 15 и 8 %, p = 0,043; справа: 19 и 6 %, p = 0,008).
В группе с применением ICG не возникало стриктур уретеро-илеоанастомозов в течение среднего периода наблюдения в 14 месяцев. В то время как у 3 из 34 пациентов в группе без применения ICG за период наблюдения возникали стриктуры уретеро-илеоанастомозов. Общее количество стриктур в данной группе равнялось 7, что соответствует частоте возникновения стриктур 10,3 %, из которых 4 (5,9 %) возникли слева, 2 (2,9 %) локализовались справа и 1 (1,5 %) идентифицировалась билатерально. В группе пациентов, которым применялся ICG, наблюдалось статистически значимое снижение частоты возникновения послеоперационных стриктур уретеро-илеоанастомозов относительно группы пациентов без применения ICG (0/34 [ 0 %] и 7/68 [ 10,3 %], p = 0,015).
ОБСУЖДЕНИЕ
Адекватная васкуляризация дистальных отделов мочеточников играет важную роль в минимизации образования послеоперационных стриктур уретеро-илеоанастомозов. В настоящее время, несмотря на модификацию методик хирургии мочеточников, сохранение периуретральной ткани, бережную обработку и мобилизацию мочеточников, сохраняются высокие риски интраоперационной травматизации и последующей ишемии зоны анастомоза. Сообщаемая частота стриктур уретеро-илеоанастомозов в современных открытых и роботизированных сериях — до 12,7 % [5]. В то же время способ оперативного вмешательства не выступает предиктором снижения рисков послеоперационных стриктур, что подтверждается в зарубежных исследованиях [9][10].
В последние годы ICG-флуоресценция играет все более важную роль в робот-ассистированных урологических процедурах [11]. ICG используется для идентификации злокачественных новообразований при поражении почек [12][13], облегчения суперселективного пережатия артерий при робот-ассистированной частичной нефрэктомии [14], а также для визуализации сигнальных лимфатических узлов во время робот-ассистированной радикальной простатэктомии и цистэктомии [15–17]. Интрауретеральная инъекция ICG также может помочь в идентификации и уточнении локализации стриктур мочеточника при робот-ассистированной реконструкции мочеточника [18].
Зрительная оценка васкуляризации дистального отдела мочеточника в белом свете часто бывает субъективной и, следовательно, не позволяет достоверно утверждать об отсутствии ишемии в зоне будущего анастомоза. В настоящем исследовании было изучено использование ICG как средства объективного определения васкуляризации и перфузии дистальных отделов мочеточников перед выполнением уретеро-илеоанастомозов. Гипотеза исследования основывалась на том, что использование ICG позволяет более точно оценивать васкуляризацию дистальных отделов мочеточников, что отразится в снижении образования послеоперационных стриктур уретеро-илеоанастомозов.
В результате проведенного исследования отмечено значительное снижение частоты стриктур уретеро-илеоанастомозов после РАРЦ: 0 % в группе с интраоперационным применением ICG по сравнению с 10,3 % в группе без применения ICG-флуоресценции. Значительная разница в частоте стриктур уретеро-илеоанастомозов, несмотря на небольшой размер выборки, подчеркивает клиническую значимость данного метода в качестве инструмента для минимизации послеоперационных осложнений РАРЦ. У большинства пациентов в группе с применением ICG были резецированы короткие сегменты мочеточников (<3 см). В то же время между обеими группами не было статистически значимых отличий в частоте удаления коротких сегментов. Резекция более длинных сегментов мочеточника (>5 см) наблюдалась у 17 % пациентов в группе с применением ICG, а в группе без его применения — у 7 %. Расширенная резекция потенциально ишемизированных сегментов, которая выполняется под контролем интраоперационной ICG-флуоресценции, выступает основополагающим фактором в снижении рисков развития послеоперационных стриктур уретеро-илеоанастомозов.
По данным Chopra et al., частота возникновения стриктур уретеро-илеоанастомозов находится в пределах от 8 до 11 % [19]. В литературе описаны разные сроки формирования стриктуры уретеро-илеоанастомоза после радикальной цистэктомии. Достоверные периоды приведены в одном из крупных исследований, проведенном Anderson et al. В серии из 478 пациентов с раком мочевого пузыря 375 (78,5 %) была выполнена открытая радикальная цистэктомия, а 103 (21,5 %) — робот-ассистированная лапароскопическая радикальная цистэктомия. У 45 (9,4 %) пациентов была диагностирована послеоперационная стриктура уретеро-илеоанастомоза в среднем через 5,3 месяца после оперативного лечения. Исследователи отметили отсутствие разницы в частоте стриктур между открытой и роботизированной группами (8,5 % против 12,6 %, p = 0,21) [10]. В настоящем исследовании средние сроки наблюдения составляют 14 и 12 месяцев в группе с применением ICG и в группе без его применения соответственно. Анализируя данные мировой литературы, можно сказать, что такой период наблюдения достаточен для выявления большинства доброкачественных ишемических послеоперационных стриктур уретеро-илеоанастомозов.
ЗАКЛЮЧЕНИЕ
Применение интраоперационной ICG-визуализации выступает прогрессивным методом оценки васкуляризации дистальных отделов мочеточников при формировании уретеро-илеоанастомозов во время выполнения РАРЦ. В опыте показано достоверное снижение частоты послеоперационных стриктур, что объясняется резекцией ишемизированных участков уретера, идентифицированных по отсутствию флуоресценции красителя. Данная методика соответствует современным тенденциям онкохирургической помощи, которые нацелены на применение инновационных технологий с целью повышения эффективности лечения и безопасности пациента. Для подтверждения результатов требуется более длительное наблюдение и крупные когорты пациентов.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Работа выполнена за счет средств Программы стратегического академического лидерства Башкирского государственного медицинского университета (ПРИОРИТЕТ-2030).
Funding. This work was supported by the Bashkir State Medical University Strategic Academic Leadership Program (PRIORITY-2030).
Список литературы
1. Chang S. S., Bochner B. H., Chou R., Dreicer R., Kamat A. M., Lerner S. P., et al. Treatment of Non-Metastatic Muscle-Invasive Bladder Cancer: AUA/ASCO/ASTRO/SUO Guideline. J Urol. 2017; 198 (3): 552–9. DOI: 10.1016/j.juro.2017.04.086
2. Yu J., Lee J., Ha S., Baek J. W., Kim C. S., Park J. Y., et al. Impact of chart-derived frailty index on 1-year mortality aft er radical cystectomy in 1004 patients with bladder cancer. Ann Surg Oncol. 2023; DOI: 10.1245/s10434-023-13565-6
3. Lu X., Jiang H., Wang D., Wang Y., Chen Q., Chen S., et al. Early warning models to predict the 90-day urinary tract infection risk aft er radical cystectomy and urinary diversion for patients with bladder cancer. Front Surg. 2022; 8: 782029. DOI: 10.3389/fsurg.2021.782029
4. Liu Z., Zheng B., Hu Y., Li H., Qin X., Hu X., et al. Th e cause analysis of benign uretero-ileal anastomotic stricture aft er radical cystectomy and urinary diversion. Front Oncol. 2022; 12: 1070141. DOI: 10.3389/fonc.2022.1070141
5. Gaya J. M., Territo A., Basile G., Gallioli A., Martínez C., Turco M., et al. Optimizing decision-making process of benign uretero-enteric anastomotic stricture treatment aft er radical cystectomy. World J Urol. 2023; 41 (3): 733–8. DOI: 10.1007/s00345-023-04298-y
6. Carrion A., Hussein A. A., Eun D., Hosseini A., Gaya J. M., Abaza R., et al. Perioperative and functional outcomes of robot-assisted ureteroenteric reimplantation: a multicenter study of Seven Referral Institutions. Eur Urol Open Sci. 2022; 35: 47–53. DOI: 10.1016/j.euros.2021.11.005
7. Pathak R. A., Hemal A. K. Intraoperative ICG-fluorescence imaging for robotic-assisted urologic surgery : current status and review of literature. Int Urol Nephrol. 2019; 51 (5): 765–71. DOI: 10.1007/s11255-019-02126-0
8. Ramírez Backhaus M., Calatrava-Fons A., Gómez-Ferrer Á., Collado Serra A., Domínguez-Escrig J. L., Bertolo R., et al. ICG lymphography and fluorescence in pelvic lymphadenectomy for bladder and prostate cancer. Arch Esp Urol. 2019; 72 (8): 831–41. PMID: 31579042.
9. Chopra S., de Castro Abreu A. L., Berger A. K., Sehgal S., Gill I., Aron M., et al. Evolution of robot-assisted orthotopic ileal neobladder formation: a step-by-step update to the University of Southern California (USC) technique. BJU Int. 2017; 119 (1): 185–91. DOI: 10.1111/bju.13611
10. Anderson C. B., Morgan T. M., Kappa S., Moore D., Clark P. E., Davis R., et al. Ureteroenteric anastomotic strictures aft er radical cystectomy-does operative approach matter? J Urol. 2013; 189 (2): 541–7. DOI: 10.1016/j.juro.2012.09.034
11. Zeng S., Xing S., Xing W., Bai Z., Zhang J., Li Y., et al. Application of indocyanine green in combination with Da Vinci Xi robot in surgeries on the upper urinary tract: a case series study. J Clin Med. 2023; 12 (5): 1980. DOI: 10.3390/jcm12051980
12. Tobis S., Knopf J., Silvers C., Yao J., Rashid H., Wu G., et al. Near infrared fluorescence imaging with robotic assisted laparoscopic partial nephrectomy: initial clinical experience for renal cortical tumors. J Urol. 2011; 186 (1): 47–52. DOI: 10.1016/j.juro.2011.02.2701
13. Puliatti S., Eissa A., Checcucci E., Piazza P., Amato M., Ferretti S., et al. New imaging technologies for robotic kidney cancer surgery. Asian J Urol. 2022; 9 (3): 253–62. DOI: 10.1016/j.ajur.2022.03.008
14. Yang Y. K., Hsieh M. L., Chen S. Y., Liu C. Y., Lin P. H., Kan H. C., et al. Clinical benefits of indocyanine green fluorescence in robot-assisted partial nephrectomy. Cancers (Basel). 2022; 14 (12): 3032. DOI: 10.3390/cancers14123032
15. Xie D., Gu D., Lei M., Cai C., Zhong W., Qi D.,et al. Th e application of indocyanine green in guiding prostate cancer treatment. Asian J Urol. 2023; 10 (1): 1–8. DOI: 10.1016/j.ajur.2021.07.004
16. Павлов В. Н., Урманцев М. Ф., Бакеев М. Р. Возможности ICG-флуоресцентной визуализации лимфатических узлов при радикальной цистэктомии у пациентов с раком мочевого пузыря. Современная онкология. 2022; 24 (4): 454–7. DOI: 10.26442/18151434.2022.4.201874
17. Павлов В. Н., Урманцев М. Ф., Бакеев М. Р. Метод интраоперационной ICG-флуоресцентной визуализации лимфатических узлов при робот-ассистированной радикальной цистэктомии у пациентов с раком мочевого пузыря. Креативная хирургия и онкология. 2023; 13 (1): 5–12. DOI: 10.24060/2076-3093-2023-13-1-5-12
18. Lee M., Lee Z., Houston N., Strauss D., Lee R., Asghar A. M., et al. Collaborative of Reconstructive Robotic Ureteral Surgery (CORRUS). Robotic ureteral reconstruction for recurrent strictures aft er prior failed management. BJUI Compass. 2023; 4 (3): 298–304. DOI: 10.1002/bco2.224
19. Chopra S., Hussain F., Abreu A., Ahmadi N., Berger A., Gill I. et al. PD67-04 Early and late complications of robotic radical cystectomy and intracorporeal urinary diversion. J Urol. 2017; 197 (4s): e1277. DOI: 10.1016/j.juro.2017.02.2980
Об авторах
В. Н. ПавловРоссия
Валентин Николаевич Павлов, д. м. н., профессор, академик РАН
кафедра урологии с курсом ИДПО
Республика Башкортостан
Уфа
М. Ф. Урманцев
Россия
Марат Фаязович Урманцев, к. м. н., доцент
кафедра урологии с курсом ИДПО
Республика Башкортостан
Уфа
М. Р. Бакеев
Россия
Марат Радикович Бакеев, студент 5-го курса
Республика Башкортостан
Уфа
А. С. Денейко
Россия
Антон Сергеевич Денейко
урологическое отделение
Республика Башкортостан
Уфа
Рецензия
Для цитирования:
Павлов В.Н., Урманцев М.Ф., Бакеев М.Р., Денейко А.С. Интраоперационная ICG-флуоресценция как способ профилактики послеоперационных стриктур уретеро-илеоанастомозов при робот-ассистированной радикальной цистэктомии. Креативная хирургия и онкология. 2023;13(2):97-104. https://doi.org/10.24060/2076-3093-2023-13-2-97-104
For citation:
Pavlov V.N., Urmantsev M.F., Bakeev M.R., Deneyko A.S. Intraoperative ICG-Fluorescence as a Method to Prevent Postoperative Strictures of Uretero-Ileal Anastomoses in Robot-Assisted Radical Cystectomy. Creative surgery and oncology. 2023;13(2):97-104. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-2-97-104


































