Перейти к:
Дилатация легочного аутографта и ее факторы риска после классической процедуры Росса: ретроспективное одноцентровое исследование
https://doi.org/10.24060/2076-3093-2023-13-2-105-111
Аннотация
Введение. Протезирование аортального клапана (АК) легочным аутографтом (операция Росса) продемонстрировала отличные непосредственные и отдаленные результаты. Дилатация легочного аутографта в отдаленном периоде является основной причиной повторной операции.
Цель: изучить распространенность дилатации легочного аутографта и изучить факторы ее риска.
Материалы и методы. В период с апреля 2009 по декабрь 2022 гг. 158 больным выполнена операция Росса классическим способом. Критерии включения в исследования: возраст больных 18 лет и старше; больные, кому была выполнена операция классическим способом. Критерии исключения: пациенты моложе 18 лет, модифицированные методики операции Росса. Период наблюдения 104 (49–124) месяца.
Результаты и обсуждение. Медиана возраста больных составила 33 (25–43) года. Госпитальная летальность — 0,6 %. Периоперационное повреждение миокарда — 3,8 %. Нарушение проводимости, потребовавшее имплантации постоянного ЭКС, — 1,9 %, частота инсультов и острого почечного повреждения, потребовавшего гемодиализа, — 0,6 %. Десятилетняя свобода от реоперации на аутографте — 88,4. Десятилетняя свобода от реоперации по поводу аневризмы аорты — 92 %. Предикторами развития дилатации аутографта в отдаленном периоде стали: возраст (ОШ 0,942; 95 % ДИ 0,901–0,984, р = 0,008) и изначальный размер синусов Вальсальвы (ОШ 1,18; 95 % ДИ 1,027–1,215, р = 0,01).
Заключение. Десятилетняя свобода от реоперации на аутографте в связи с дилатацией аорты и свобода от дилатации аорты ≥ 45 мм составили 92 и 37,2 % соответственно. Главными предикторами развития дилатации аутографта в послеоперационном периоде являются изначальный диаметр синусов Вальсальвы и возраст.
Ключевые слова
Для цитирования:
Чернов И.И., Энгиноев С.Т., Екимов С.С., Рашидова Т.К., Абдулмеджидова У.К., Гулиев М.А., Зеньков А.А., Гамзаев А.Б. Дилатация легочного аутографта и ее факторы риска после классической процедуры Росса: ретроспективное одноцентровое исследование. Креативная хирургия и онкология. 2023;13(2):105-111. https://doi.org/10.24060/2076-3093-2023-13-2-105-111
For citation:
Chernov I.I., Enginoev S.T., Ekimov S.S., Rashidova T.K., Abdulmedzhidova U.K., Guliyev M.A., Ziankou A.A., Gamzaev A.B. Pulmonary Autograft Dilatation and its Risk Factors After Classical Ross Procedure: a Retrospective Single Center Study. Creative surgery and oncology. 2023;13(2):105-111. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-2-105-111
ВВЕДЕНИЕ
Протезирование аортального клапана (АК) легочным аутографтом (операция Росса) продемонстрировала отличные непосредственные и отдаленные результаты [1–3]. Несмотря на то что операция Росса показала лучшую выживаемость по сравнению с механическими и биологическими протезами [4–6], в последних американских рекомендациях по приобретенным порокам сердца от 2020 г. стоит класс рекомендаций IIb для пациентов 50 лет и моложе [7]. Однако необходимость повторной операции остается принципиальным ограничением процедуры Росса [8][9]. И дилатация легочного аутографта в отдаленном периоде является основной причиной повторной операции [10–12]. M. Liebrich и соавт. пришли к выводу, что дилатация корня аорты более злокачественна, чем дилатация средневосходящей части аорты [13]. В последующем дилатация аорты может привести с жизнеугрожающему состоянию — расслоению восходящей аорты [14]. В иностранной литературе опубликованы работы, посвященные диссекции аорты после процедуры Росса [15][16]. Однако в отечественной литературе данная проблема является малоизученной. В связи с этим является актуальным изучить факторы риска, приводящие к дилатации аорты после классической операции Росса. Целью данной работы было изучить распространенность дилатации легочного аутографта и факторы ее риска после операции Росса у молодых пациентов.
МАТЕРИАЛЫ И МЕТОДЫ
В период с апреля 2009 по декабрь 2022 г. 158 больным одним хирургом была выполнена операция Росса классическим способом. Всем больным в дооперационном периоде, интраоперационно и в послеоперационном периоде до выписки из стационара выполнялась эхокардиография. Всем больным 35 лет и старше выполнялась дооперационная коронарография. После выписки из стационара трансторакальная эхокардиография выполнялась по месту жительства или в нашей клинике. Часть пациентов, которые смогли приехать на повторное обследование, проходили его в нашей клинике, другая часть — по месту жительства. Сбор данной информации производился при помощи очной и заочной консультаций. При заочной консультации — при помощи отдела отдаленного мониторинга, где созванивались с пациентом или близким родственником. Критерии включения в исследование: возраст больных 18 лет и старше; больные, кому была выполнена операция классическим способом. Критерии исключения: пациенты моложе 18 лет, модифицированные методики операции Росса.
Хирургическая техника
Доступ к сердцу осуществлялся через срединную стернотомию. Во всех случаях использовали полное замещение корня аорты (full root replacement). Проксимальный анастомоз легочного аутографта накладывали с использованием непрерывного (3,8 % пациентов) или отдельных узловых швов (96,2 %). У больных с дилатацией фиброзного кольца АК использовали укрепление фиброзного кольца при помощи дакроновой полоски (8,2 % больных). Устья коронарных артерий имплантировались в легочный аутографт по методике «кнопок». Для реконструкции выводного тракта правого желудочка использовали свежеприготовленный легочный гомографт (Санкт-Петербургский банк гомографтов, Санкт-Петербург, Россия). После окончания искусственного кровообращения (ИК) проводили контрольную чреспищеводную эхокардиографию для оценки функции миокарда и клапанов, гемодинамики на аутографте в аортальной позиции и гомографте в выводном отделе правого желудочка. Длительность операции составила 215 (195–250) минут, время искусственного кровообращения — 137 (121–153) минут, время ишемии миокарда — 114 (102–126) минут (табл. 2). Комбинированные вмешательства выполнены у 25 (15,8 %) больных, коронарное шунтирование у 4 (2,5 %), хирургия митрального клапана у 12 (7,6 %), хирургия трикуспидального клапана у 2 (1,3 %) и протезирование восходящего отдела аорты у 7 (4,4 %) больных. Более подробно хирургическая техника описана нами в предыдущей статье [1].
Статистический анализ
Статистическую обработку материала выполняли с использованием пакета программного обеспечения IBM SPSS Statistics 26 (Chicago, IL, USA). Выполнена проверка всех количественных переменных на тип распределения с помощью критерия Колмогорова — Смирнова с поправкой Лиллиефорса. Количественные признаки, имеющие приближенно нормальное распределение, описывали в форме среднего значения и стандартного отклонения (M ± SD), в случае отличного от нормального распределения — в виде медианы и 25-го, 75-го процентиля (Me [Q1–Q3]). Время до первого клинического события: реоперации на аутографте, реоперации на аутографте по поводу аневризмы аорты, дилатации неаорты 45 мм и более, АР ≥ 2-й степени были оценены с использованием метода Каплана — Майера. Факторы риска дилатации легочного аутографта в отдаленном периоде были оценены с помощью регрессии Кокса. Статистически значимыми считали при p < 0,05.
РЕЗУЛЬТАТЫ
Всего классическим способом были прооперированы 158 больных. Медиана возраста больных составила 33 (25–43) года, минимальный возраст — 18 лет, максимальный возраст — 58 лет. Большинство прооперированных больных были мужского пола — 118 (74,7 %) пациентов. У 61 (38,6 %) больного имелась хроническая сердечная недостаточность III–IV ФК. Ранее перенесенные вмешательства на сердце — у 10 (6,3 %) больных. ФП зарегистрирована у 6 (3,8 %), а АГ диагностирована у 37 (23,4 %) пациентов. В основном больные имели сохранную ФВ ЛЖ — 60 (54–64) %, диаметр проксимальной части восходящего отдела аорты и синусов Вальсальвы составил 36 (30–40) и 35 ± 6 мм. У 92 (58,2 %) больных имелся двухстворчатый АК. Более подробные демографические и интраоперационные данные представлены в таблицах 1 и 2.
Таблица 1. Демографические и дооперационные характеристики пациентов
Table 1. Demographic and preoperative characteristics of patients
Параметры | Всего пациентов, n = 158 |
Возраст, лет (Me [Q1–Q3]) | 33 (25–43) |
Мужчины, n (%) | 118 (74,7) |
Индекс масса тела, кг/м² (Me [Q1–Q3]) | 25 (21–29) |
Площадь поверхности тела, м² (Me [Q1–Q3]) | 2 (2–2) |
ХСН 3–4 ФК по NYHA, n (%) | 61 (38,6) |
Сопутствующая патология, n (%) | |
ИБС | 16 (7,5) |
ХОБЛ | 7 (4,4) |
АГ | 37 (23,4) |
ФП | 6 (3,8) |
Сахарный диабет | 2 (1,3) |
Инсульт в анамнезе | 5 (3,2) |
Кардиохирургические «открытые» вмешательства на сердце в анамнезе | 10 (6,3) |
ИЭ | 44 (27,8) |
Эхокардиографические показатели | |
ФВ ЛЖ, % (Me [Q1–Q3]) | 60 (54–64) |
СДЛА, мм рт. ст. (Me [Q1–Q3]) | 30 (25–35) |
Размер проксимальной части восходящего отдела аорты, мм (Me [Q1–Q3]) | 36 (30–40) |
Размер синусов Вальсальвы, мм (M ± SD) | 35 ± 6 |
Двухстворчатый АК, n (%) | 92 (58,2) |
Диаметр ФК АК, мм (Me [Q1–Q3]) | 24 (22–26) |
Примечание: АК — аортальный клапан, ИБС — ишемическая болезнь сердца, ИЭ — инфекционный эндокардит, СДЛА — систолическое давление в легочной артерии, ХОБЛ — хроническая обструктивная болезнь легких, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность, ФК АК — фиброзное кольцо аортального клапана, ФВ ЛЖ — фракция выброса левого желудочка, ЭКС — электрокардиостимулятор, NYHA — New York Heart Association.
Таблица 2. Интраоперационные параметры
Table 2. Intraoperative parameters
Параметры | Всего пациентов, n = 158 |
Срединная стернотомия, n (%) | 156 (98,7) |
Длительность, мин | |
Операции, (Me [Q1–Q3]) | 215 (195–250) |
Искусственное кровообращение, (Me [Q1–Q3]) | 137 (121–153) |
Ишемия миокарда, (Me [Q1–Q3]) | 114 (102–126) |
Комбинированные вмешательства, n (%) | 25 (15,8) |
КШ | 4 (2,5) |
МК | 12 (7,6) |
ТК | 2 (1,3) |
Протезирование восходящего отдела аорты | 7 (4,4) |
Примечание: КШ — коронарное шунтирование, МК — митральный клапан, ТК — трикуспидальный клапан.
В раннем послеоперационном периоде умер 1 пациент (0,6 %) от геморрагического шока. Периоперационное повреждение миокарда составило 3,8 %, но при выписке из стационара у всех больных имелась такая же ФВ ЛЖ, как и при поступлении (55 (51–60) %) (табл. 3). Нарушение проводимости, потребовавшее имплантации постоянного ЭКС, составило 1,9 %, частота инсультов и острого почечного повреждения, потребовавшего гемодиализа, составили 0,6 % (табл. 4).
Таблица 3. Постоперационные показатели
Table 3. Postoperative parameters
Параметры | Всего пациентов, n = 158 |
Госпитальная летальность, % | 1 (0,6) |
Рестернотомия по поводу кровотечения, n (%) | 8 (5,1) |
Тампонада, n (%) | 2 (1,3) |
Периоперационное повреждение миокарда, n (%) | 6 (3,8) |
Имплантация постоянного ЭКС, n (%) | 3 (1,9) |
ПОФП, n (%) | 9 (5,7) |
Инсульт, n (%) | 1 (0,6) |
ОПН, n (%) | 1 (0,6) |
Время нахождения в реанимации, ч (Me [Q1–Q3]) | 21 (18–41) |
Период госпитализации, дней (Me [Q1–Q3]) | 12 (10–15) |
Примечание: ОПН — острая почечная недостаточность, ФВ ЛЖ — фракция выброса левого желудочка, ЭКС — электрокардиостимулятор.
Таблица 4. Эхокардиографические данные в раннем послеоперационном периоде
Table 4. Echocardiographic data in the early postoperative period
Параметры | Всего пациентов, n = 158 |
ФВ ЛЖ, % (Me [Q1–Q3]) | 55 (51–60) |
Пиковый градиент на НеоАК, мм рт. ст. (Me [Q1–Q3]) | 5 (4–7) |
Средний градиент на НеоАК, мм рт. ст. (M ± SD) | 4 ± 2 |
АР 0–1-й степени, n (%) 2-й cтепени, n (%) | 155 (98) 3 (2) |
Отдаленный период
Период наблюдения за пациентами составил 104 (49–124) месяца. В отдаленном периоде умерло 4 пациента. Причины летальных исходов у двух неизвестны, у одного печеночная недостаточность в связи с алкоголизмом и у одного — тромбоэмболия легочной артерии. В отдаленном периоде 16 пациентам понадобились повторные вмешательства на аутографте (10-летняя свобода от реоперации на аутографте составила 88,4 %) (рис. 1).
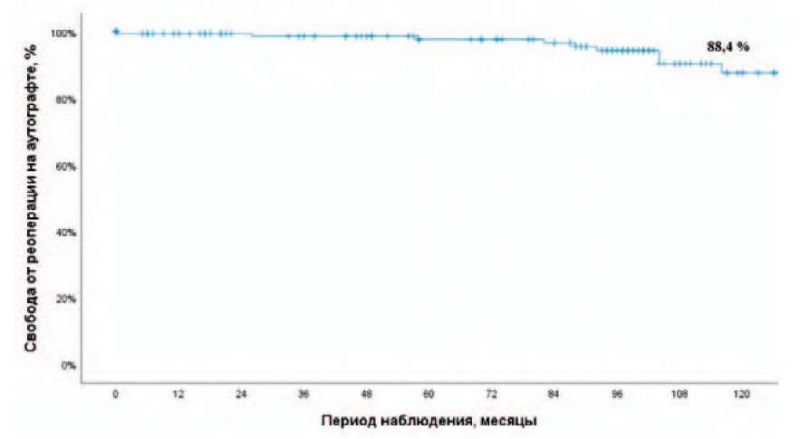
Рисунок 1. Свобода от реоперации на аутографте
Figure 1. Freedom from autograft reoperation
Оставшиеся под наблюдением пациенты:
Мес. | 0 | 12 | 24 | 36 | 48 | 60 | 72 | 84 | 96 | 108 | 120 |
Пациенты | 158 | 138 | 127 | 117 | 104 | 100 | 93 | 73 | 41 | 27 | 12 |
Из них у 15 пациентов возникла аневризма аорты с и без значимой аортальной регургитации (АР) (10 больным выполнена операция Дэвида, 3 больным — механический Бенталл Де Боно, 2 больным — пластика АК с супракоронарным протезированием). Таким образом 10-летняя свобода от реоперации по поводу аневризмы аорты составила 92 % (рис. 2), у 1 больного — значительная АР, выполнена пластика АК.
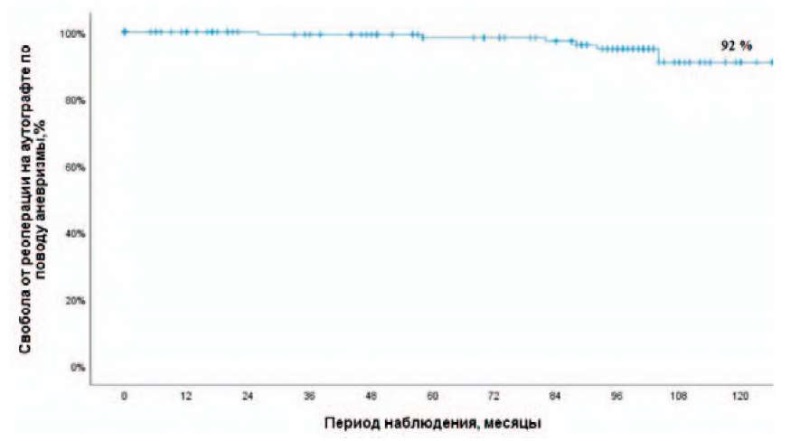
Рисунок 2. Свобода от реоперации по поводу аневризмы аорты
Figure 2. Ten-year freedom from reoperation for aortic aneurysm
Оставшиеся под наблюдением пациенты:
Мес. | 0 | 12 | 24 | 36 | 48 | 60 | 72 | 84 | 96 | 108 | 120 |
Пациенты | 158 | 138 | 127 | 124 | 117 | 104 | 100 | 93 | 73 | 41 | 28 |
В отдаленном периоде эхокардиографические протоколы были доступны у 117 (74 %) больных. Диаметр проксимальной части аорты составил 40 (36–44) мм, синусов Вальсальвы — 40 (36–44) мм. Дилатация (45 мм и более) синусов Вальсальвы или проксимальной части аорты через 10 лет была у 35 пациентов. Десятилетняя свобода от дилатации аорты составила 37,2 % (рис. 3). Средний градиент на аутографте — 3 (2–4) мм рт. ст., диаметр ФК АК — 24 (22–26) мм, 2 и более степени АР на аутографте у 30 (25,6 %) больных (табл. 5).
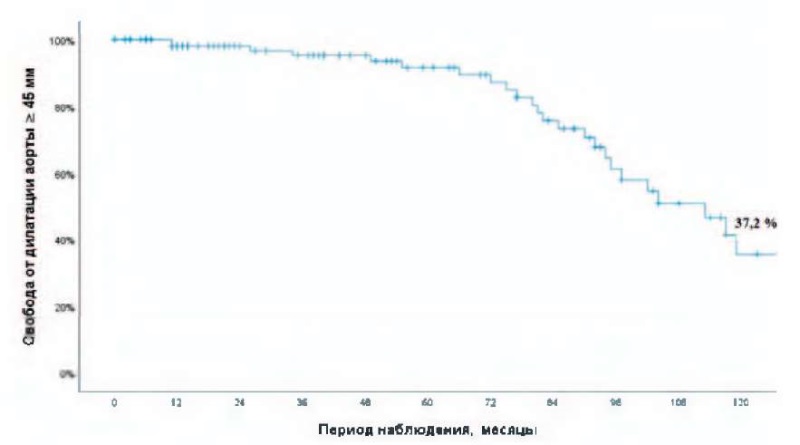
Рисунок 3. Свобода от дилатации аорты ≥ 45 мм
Figure 3. Freedom from aortic dilatation ≥ 45 mm
Оставшиеся под наблюдением пациенты:
Мес | 0 | 12 | 24 | 36 | 48 | 60 | 72 | 84 | 96 | 108 | 120 |
Пациенты | 117 | 94 | 73 | 67 | 56 | 46 | 40 | 31 | 23 | 19 | 13 |
Таблица 5. Эхокардиографические данные в отдаленном периоде наблюдения
Table 5. Long-term echocardiographic data
Параметры | Всего пациентов, n = 117 |
ФВ ЛЖ, % (Me [Q1–Q3]) | 59 (55–63) |
Пиковый градиент на НеоАК, мм рт. ст. (Me [Q1–Q3]) | 6 (4–8) |
Средний градиент на НеоАК, мм рт. ст. (Me [Q1–Q3]) | 3 (2–4) |
Размер ФК АК, мм (Me [Q1–Q3]) | 24 (22–26) |
АР ≥ 2 степени, n (%) | 30 (25,6) |
Размер проксимального отдела восходящего отдела аорты, мм (Me [Q1–Q3]) | 40 (36–44) |
Размер синусов Вальсальвы, мм (Me [Q1–Q3]) | 40 (36–44) |
ОБСУЖДЕНИЕ
Операция Росса считается современной операцией с отличной выживаемостью, низкой частотой эмболических осложнений и отличными гемодинамическими показателями [1–3]. Ряд исследований показал преимущества операции Росса над механическими и биологическим протезами в виде выживаемости, инсультов и свободы от реоперации [4–6]. Однако есть опасения, что легочный аутографт может расширяться в отдаленном периоде с развитием аортальной регургитации, особенно у больных с двухстворчатым АК [17][18]. По данным W. H. Ryan и его коллег в 59 % случаев дилатация аорты являлись причиной реоперации на легочном аутографте [19]. T. E. David и соавт. проанализировали отдаленные результаты 212 больных, кому была выполнена операция Росса. Максимальный диаметр аорты 45 мм и более через 16,4 года был у 17 пациентов, но только у 4 пациентов диаметр аорты превышал 50 мм, и им были выполнены повторные вмешательства с сохранением легочного аутографта [3]. Этими же авторами было показано, что аорта увеличивалась на 0,358 мм/год. По нашим данным, расширение аорты являлось самой частой причиной реоперации на легочном аортографте, из 16 пациентов, кому понадобились реоперации на аутографте, у 15 больных была дилатация аорты.
Несколько исследований подтвердили, что дооперационная аортальная регургитация, морфологически двухстворчатый АК являются независимыми факторами риска, приводящими к дилатации неаорты [20][21]. В немецком регистре операций Росса более высокая степень дилатации аорты и фиброзного кольца наблюдалась у больных с двухстворчатым АК [22]. В последующем это было подтверждено другими авторами [23]. Также было показано, что пациенты с недостаточностью двухстворчатого АК имеют более высокий риск аортальных событий в отдаленном периоде [24][25]. По данным N. Simon-Kupilik и ее соавт., фактором риска дилатации аутографта после операции Росса являются изначальные размеры синусов Вальсальвы [12]. Также по нашим данным факторами риска дилатации аутографта в отдаленном периоде являлись возраст и изначальные размеры синусов Вальсальвы (табл. 6).
Таблица 6. Анализ предикторов развития дилатации аутографта в отдаленном периоде
Table 6. Analysis of predictors of autograft dilatation in the long-term period
Факторы | Однофакторный | Многофакторный | ||||
ОШ | 95 % ДИ | р | ОШ | 95 % ДИ | р | |
Возраст | 0,953 | 0,916–0,993 | 0,020 | 0,942 | 0,901–0,984 | 0,008 |
Изначальный размер аорты синусов Вальсальвы | 1,091 | 1,011–1,177 | 0,025 | 1,118 | 1,027–1,215 | 0,01 |
В некоторых случаях при дилатации легочного аутографта с или без клапанной регургитации возможно выполнить операцию Дэвида [26]. В качестве профилактики дилатации аутографта были предложены различные модификации: окутывание дакроновым протезом или собственной аортой [27][28]. В последующем были опубликованы обнадеживающие пятилетние результаты модифицированной методики Росса с 97,4 % пятилетней выживаемостью и 100 % свободой от дилатации аорты в течение пяти лет. V. A. Starnes и соавт. сравнили классическую методику операции Росса с окутыванием протезом (модифицированная методика) у больных с двухстворчатым АК [29]. В данной статье были продемонстрированы преимущества модифицированной методики в виде снижения реоперации на АК, однако отдаленная выживаемость была одинакова. Хотя модифицированные методики предотвращают дилатацию аорты в отдаленным периоде, они также ограничивают мобильность (одно из важных преимуществ операции Росса). В некоторых экспериментальных работах сообщалось, что синтетический материал вызывает воспаление и фиброз стенки аутографта, что приводит к потере эластичности [30]. С 2014 г. для профилактики дилатации аорты в отдаленном периоде в нашей клинике были введены модифицированные методики (окутывание собственной аортой или дакроновым протезом).
ЗАКЛЮЧЕНИЕ
Наше исследование ограничено небольшим сроком отдаленного наблюдения, носит ретроспективный характер. Десятилетняя свобода от реоперации на аутографте в связи с дилатацией аорты и свобода от дилатации аорты ≥ 45 мм составила 92 и 37,2 % соответственно. Главными предикторами развития дилатации аутографта в послеоперационном периоде являются изначальный диаметр синусов Вальсальвы и возраст. И у пациентов с факторами риска дилатации аорты, на наш взгляд, необходимо выполнять модифицированные методики операции Росса.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Funding. This work is not funded.
Список литературы
1. Tsaroev B., Chernov I., Enginoev S., Mustaev M. Survival and freedom from reoperation after the Ross procedure in a Russian adult population: A single-center experience. JTCVS Open. 2022; 10: 140–7. DOI: 10.1016/j.xjon.2022.04.026
2. Flynn C. D., Bono J. H. De, Muston B., Rattan N., Tian D. H., Larobina M., et al. Systematic review and meta-analysis of long-term outcomes in adults undergoing the Ross procedure. Ann Cardiothorac Surgery. 2021; 10 (4): 411–9. DOI: 10.21037/acs-2021-rp-30
3. David T. E., Ouzounian M., David C. M., Lafreniere-Roula M., Manlhiot C. Late results of the Ross procedure. J Thorac Cardiovasc Surg. 2019; 157: 201–8. DOI: 10.1016/j.jtcvs.2018.06.037
4. Buratto E., Shi W. Y., Wynne R., Poh C. L., Larobina M., O’Keefe M., et al. Improved survival after the Ross procedure compared with mechanical aortic valve replacement. J Am Coll Cardiol. 2018; 71: 1337–44. DOI: 10.1016/j.jacc.2018.01.048
5. Mazine A., Rocha R. V., El-Hamamsy I., Ouzounian M., Yanagawa B., Bhatt D. L., et al. Ross procedure vs mechanical aortic valve replacement in adults: a systematic review and meta-analysis. JAMA Cardiol. 2018; 3: 978–87. DOI: 10.1001/jamacardio.2018.2946
6. Gofus J., Fila P., Drabkova S., Zacek P., Ondrasek J., Nemec P., et al. Ross procedure provides survival benefi tover mechanical valve in adults: a propensity-matched nationwide analysis. Eur J Cardio-Thoracic Surg. 2022; 61: 1357–65. DOI:10.1093/ejcts/ezac013
7. Otto C. M., Nishimura R. A., Bonow R. O., Carabello B. A., Erwin J. P. 3<sup>rd</sup>, Gentile F., et al. 2020 ACC/AHA guideline for the management of patients with valvular heart disease: executive summary: a report of the American college of cardiology / American heart association joint committee on clinical practice guidelines. Circulation. 2021; 143: e35–71. DOI: 10.1161/CIR.0000000000000932
8. Chambers J. C., Somerville J., Stone S., Ross D. N. Pulmonary autograft procedure for aortic valve disease: long-term results of the pioneer series. Circulation. 1997; 96: 2206–14. DOI: 10.1161/01.cir.96.7.2206
9. Elkins R. C., Lane M. M., McCue C. Pulmonary autograft reoperation: incidence and management. Ann Th orac Surg. 1996; 62: 450–5. PMID: 8694604.
10. Abeln K. B., Ehrlich T., Souko I., Brenner F., Schäfers H. J. Autograft reoperations after the Ross procedure. Eur J Cardiothorac Surg. 2023; 63 (5): ezad117. DOI: 10.1093/ejcts/ezad117
11. Romeo J. L. R., Papageorgiou G., da Costa F. F. D., Sievers H. H., Bogers A. J. J. C., El-Hamamsy I., et al. Long-term clinical and echocardiographic outcomes in young and middle-aged adults undergoing the Ross Procedure. JAMA Cardiol. 2021; 6 (5): 539–48. DOI: 10.1001/jamacardio.2020.7434
12. Bichell D. P. Autograft root dilation after the Ross procedure is not benign. World J Pediatr Congenit Heart Surg. 2021; 12 (4): 516–7. DOI: 10.1177/21501351211015927
13. Kalogerakos P. D., Zafar M. A., Li Y., Mukherjee S. K., Ziganshin B. A., Rizzo J. A., et al. Root dilatation is more malignant than ascending aortic dilation. J Am Heart Assoc. 2021; 10: e020645. DOI: 10.1161/JAHA.120.020645
14. Malaisrie S. C., Szeto W. Y., Halas M., Girardi L. N., Coselli J. S., Sundt T. M., et al. The American Association for Thoracic Surgery expert consensus document: Surgical treatment of acute type A aortic dissection. J Thorac Cardiovasc Surg. 2021; 162: 735–58.e2. DOI: 10.1016/j.jtcvs.2021.04.053
15. Siudalska H., Kuśmierczyk M., Różański J., Petryka-Mazurkiewicz J., Kumor M., Michałowska A. M., et al. Aortic dissection after the Ross procedure. Kardiol Pol. 2021; 79 (6): 702–3. DOI: 10.33963/kp.15957
16. Richey S., Fiore A. C., Huddleston C. B. Type A aortic dissection after the Ross procedure. Ann Thorac Surg. 2018; 106: e105–6. DOI: 10.1016/j.athoracsur.2018.02.042
17. Hahn R. T., Roman M. J., Mogtader A. H., Devereux R. B. Association of aortic dilation with regurgitant, stenotic and functionally normal bicuspid aortic valves. J Am Coll Cardiol. 1992; 19: 283–8. DOI: 10.1016/0735-1097(92)90479-7
18. Nistri S., Sorbo M. D., Marin M., Palisi M., Scognamiglio R., Thiene G. Aortic root dilatation in young men with normally functioning bicuspid aortic valves. Heart. 1999; 82: 19–22. DOI: 10.1136/hrt.82.1.19
19. Ryan W. H., Squiers J. J., Harrington K. B., Goodenow T., Rawitscher C., Schaffer J. M., et al. Long-term outcomes of the Ross procedure in adults. Ann Cardiothorac Surg. 2021; 10: 499–508. DOI: 10.21037/acs-2021-rp-fs-28
20. Fujita B., Aboud A., Sievers H. H., Ensminger S. State-of-the-art: Insights from the Ross Registry. JTCVS Tech. 2021; 10: 396–400. DOI: 10.1016/j.xjtc.2021.05.027
21. Nappi F., Iervolino A., Avtaar Singh S. S. The effectiveness and safety of pulmonary autograft as living tissue in Ross procedure: a systematic review. Transl Pediatr. 2022; 11 (2): 280–97. DOI: 10.21037/tp-21-351
22. Hanke T., Charitos E. I., Stierle U., Robinson D. R., Hemmer W., Moritz A., et al. The Ross operation — a feasible and safe option in the setting of a bicuspid aortic valve? Eur J Cardio-Thoracic Surg. 2010; 38: 333–9. DOI: 10.1016/j.ejcts.2010.01.064
23. Sharifulin R., Bogachev-Prokophiev A., Zheleznev S., Demin I., Pivkin A., Afanasyev A., et al. Factors impacting long-term pulmonary autograft durability after the Ross procedure. J Thorac Cardiovasc Surg. 2019; 157: 134–41.e3. DOI: 10.1016/j.jtcvs.2018.05.046
24. Girdauskas E., Disha K., Raisin H. H., Secknus M.-A., Borger M. A., Kuntze T. Risk of late aortic events aft er an isolated aortic valve replacement for bicuspid aortic valve stenosis with concomitant ascending aortic dilation. Eur J Cardio-Thoracic Surg. 2012; 42: 832–8. DOI: 10.1093/ejcts/ezs137
25. Girdauskas E., Disha K., Rouman M., Espinoza A., Borger M. A., Kuntze T. Aortic events after isolated aortic valve replacement for bicuspid aortic valve root phenotype: echocardiographic follow-up study. Eur J Cardio-Thoracic Surg. 2015; 48: e71–6. DOI: 10.1093/ejcts/ezv259
26. Чернов И. И., Энгиноев С. Т., Кондратьев Д. А., Зеньков А. А., Абдурахманов А. А., Тарасов Д. Г. Операция Дэвида после Росса: серия клинических случаев. Российский кардиологический журнал. 2021; 26 (S4): 4767. DOI: 10.15829/1560-4071-2021-4767
27. Skillington P. D., Mokhles M. M., Takkenberg J. J. M., Larobina M., O’Keefe M., Wynne R., et al. The Ross procedure using autologous support of the pulmonary autograft : techniques and late results. J Thorac Cardiovasc Surg. 2015; 149: S46–52. DOI: 10.1016/j.jtcvs.2014.08.068
28. Slater M., Shen I., Welke K., Komanapalli C., Ungerleider R. Modification to the Ross procedure to prevent autograft dilatation. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2005: 181–4. DOI: 10.1053/j.pcsu.2005.01.022
29. Starnes V. A., Elsayed R. S., Cohen R. G., Olds A. P., Bojko M. M., Mack W. J., et al. Long-term outcomes with the pulmonary autograft inclusion technique in adults with bicuspid aortic valves undergoing the Ross procedure. J Thorac Cardiovasc Surg. 2023; 165 (1): 43–52.e2. DOI: 10.1016/j.jtcvs.2021.01.101
30. Nappi F., Spadaccio C., Castaldo C., Di Meglio F., Nurzynska D., Montagnani S., et al. Reinforcement of the pulmonary artery autograft with a polyglactin and polydioxanone mesh in the Ross operation: experimental study in growing lamb. J Heart Valve Dis. 2014 Mar; 23 (2): 145–8. PMID: 25076542.
Об авторах
И. И. ЧерновРоссия
Игорь Ионович Чернов, к. м. н.
Астрахань
С. Т. Энгиноев
Россия
Сослан Тайсумович Энгиноев, к. м. н.
факультет последипломного образования (ФПО)
кафедра сердечно-сосудистой хирургии
кардиохирургическое отделение № 1
Астрахань
С. С. Екимов
Россия
Сергей Сергеевич Екимов
кардиохирургическое отделение № 1
Астрахань
Т. К. Рашидова
Россия
Тамара Кулумбековна Рашидова
кабинет функциональной и ультразвуковой диагностики
Астрахань
У. К. Абдулмеджидова
Россия
Узлипат Камаловна Абдулмеджидова
факультет последипломного образования (ФПО)
кафедра сердечно-сосудистой хирургии
Астрахань
М. А. Гулиев
Россия
Махарбек Артурович Гулиев
факультет последипломного образования (ФПО)
кафедра сердечно-сосудистой хирургии
Астрахань
А. А. Зеньков
Россия
Александр Александрович Зеньков, д. м. н.
кардиохирургическое отделение № 1
Астрахань
А. Б. Гамзаев
Россия
Алишир Баги Гамзаев оглы, д. м. н.
факультет дополнительного профессионального образования (ФДПО)
кафедра рентгенохирургических методов диагностики и лечения
Нижний Новгород
Рецензия
Для цитирования:
Чернов И.И., Энгиноев С.Т., Екимов С.С., Рашидова Т.К., Абдулмеджидова У.К., Гулиев М.А., Зеньков А.А., Гамзаев А.Б. Дилатация легочного аутографта и ее факторы риска после классической процедуры Росса: ретроспективное одноцентровое исследование. Креативная хирургия и онкология. 2023;13(2):105-111. https://doi.org/10.24060/2076-3093-2023-13-2-105-111
For citation:
Chernov I.I., Enginoev S.T., Ekimov S.S., Rashidova T.K., Abdulmedzhidova U.K., Guliyev M.A., Ziankou A.A., Gamzaev A.B. Pulmonary Autograft Dilatation and its Risk Factors After Classical Ross Procedure: a Retrospective Single Center Study. Creative surgery and oncology. 2023;13(2):105-111. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-2-105-111


































