Перейти к:
Особенности течения радиоиндуцированного рака молочной железы. Клиническое наблюдение
https://doi.org/10.24060/2076-3093-2023-13-3-254-259
Аннотация
Введение. Наиболее часто лимфома Ходжкина регистрируется в молодом возрасте от 20 до 40 лет, и до появления современных препаратов химиотерапии лучевая терапия оставалась предпочтительной опцией выбора. В дальнейшем риск появления радиоиндуцированного рака молочной железы после проведения радиотерапии СОД от 38 Гр увеличивался в 4,5 раза.
Материалы и методы. В публикации представлен клинический случай, демонстрирующий агрессивно протекавший рак молочной железы, развившийся через 43 года после проведенной лучевой терапии по поводу лимфомы Ходжкина.
Результаты и обсуждение. В 1990-е годы схемы химиотерапии для лечения лимфомы Ходжкина не обладали достаточной эффективностью для контроля заболевания, поэтому необходимой опцией являлось проведение лучевой терапии. Второе место в структуре смертности от лимфомы Ходжкина занимают вторичные радиоиндуцированные опухоли (26 %). Появление новых, более эффективных схем химиотерапии привело к уменьшению риска развития вторичных опухолей и, в частности, рака молочной железы.
Заключение. На сегодня с помощью современных методов химиотерапии и/или лучевой терапии удается вылечить до 75 % пациентов с лимфомой Ходжкина. В дальнейшем диспансерном наблюдении необходимо учитывать высокий риск развития вторичных злокачественных новообразований, особенно рака легкого и молочной железы.
Ключевые слова
Для цитирования:
Замилов М.М., Меньшиков К.В., Мусин Ш.И., Султанбаев А.В., Замилова Г.И., Нгуен А.Х. Особенности течения радиоиндуцированного рака молочной железы. Клиническое наблюдение. Креативная хирургия и онкология. 2023;13(3):254-259. https://doi.org/10.24060/2076-3093-2023-13-3-254-259
For citation:
Zamilov M.M., Menshikov K.V., Musin Sh.I., Sultanbaev A.V., Zamilova G.I., Nguyen A.H. Features of the Course of Radioinduced Breast Cancer. Clinical Observation. Creative surgery and oncology. 2023;13(3):254-259. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-3-254-259
ВВЕДЕНИЕ
Лучевая терапия является одним из важнейших инструментов в лечении злокачественных заболеваний. С начала XIX века постоянно изобретаются и модернизируются методы лучевой терапии, что приводит к увеличению показаний и возможностей для ее проведения. На сегодня около 60 % пациентов со злокачественными новообразованиями проводится лучевая терапия, как в комбинации с другими методами лечения, так и в монорежиме [1]. Несмотря на усовершенствование технической базы, которое привело к снижению лучевой токсичности, все же у большинства пациентов развиваются побочные эффекты, которые могут появиться как в первые несколько недель лечения (ранние осложнения), так и через несколько месяцев или лет (поздние осложнения). Также существует риск развития радиоиндуцированного рака, особенно в группе пациентов, которые проходили лучевую терапию в молодом возрасте.
Лимфома Ходжкина (ЛХ) обычно диагностируется у пациентов в возрасте от 20 до 40 лет. С помощью современных методов химиотерапии и/или лучевой терапии удается вылечить до 75 % пациентов [2–4].
По данным Стэнфордского университета, в структуре смертности больных от ЛХ второе место после прогрессирования (41 %) занимают вторичные опухоли (26 %), третье — сердечно-сосудистые заболевания (16 %) [2][3][5]. Среди вторичных опухолей наиболее часто развивается рак легкого, рак молочной железы, колоректальный рак. Дополнительным фактором риска развития вторичной опухоли является молодой возраст — менее 25 лет [6]. Рак молочной железы (РМЖ) чаще встречается по краю лучевого поля, риск развития выше у молодых пациенток: при облучении средостения в возрасте до 20 лет риск рака молочной железы в 18 раз выше популяционного, в возрасте 20–29 лет — в 6 раз, старше 30 лет — соответствует популяционному уровню. Интервал между установлением диагноза «лимфома Ходжкина» и развитием вторичного рака молочной железы составил 18,7 года, средний возраст женщин в момент постановки диагноза — 44 года [7].
В ретроспективном исследовании среди 12411 пациентов отмечается, что за срок наблюдения 15 лет кумулятивный риск развития вторичных опухолей составил 11,5 %, миелоидных лейкозов — 2,2 %, неходжкинских лимфом — 1,8 %, солидных опухолей — 7,5 % [8].
Высокий риск развития вторичных злокачественных новообразований и сердечно-сосудистых заболеваний, высокая летальность в течение 10 лет без прогрессирования основного заболевания делают лучевую терапию менее привлекательным вариантом лечения, поскольку необходимость достижения терапевтического эффекта не превышает по значимости последующие поздние осложнения [2].
Рак молочной железы в настоящее время является самой распространенной злокачественной опухолью у женского населения (11,7 %) и, несмотря на имеющийся прогресс в лечении этого заболевания, продолжает занимать лидирующие позиции среди причин женской смертности от злокачественных новообразований (рис. 1).
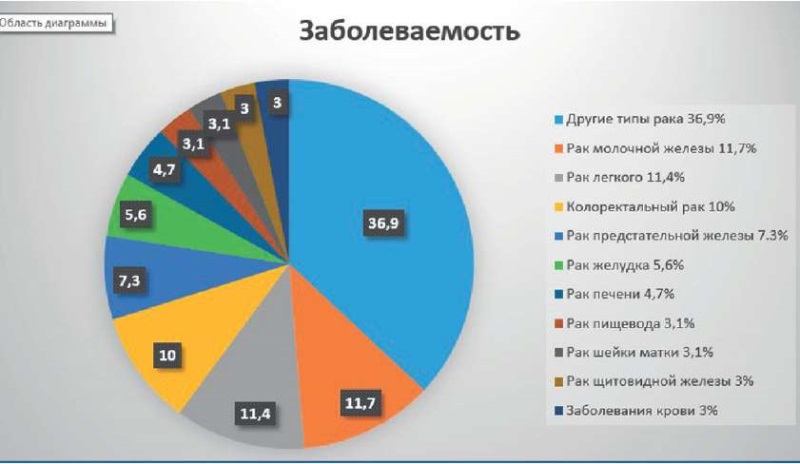
Рисунок 1. Распределение онкологической заболеваемости
среди различных видов рака [9]
Figure 1. Distribution of cancer incidence among different types of cancer [9]
В мире ежегодно РМЖ диагностируется более чем у 2,26 млн женщин [10]. Около 6 % пациенток на момент постановки диагноза имеют метастазы, средняя продолжительность жизни таких больных составляет 24 мес., а 5-летняя выживаемость — менее 30 % [11]. Согласно данным GLOBOCAN (Международного агентства по изучению рака), летальность от рака молочной железы за 2020 год составляет 6,9 % (рис. 2).
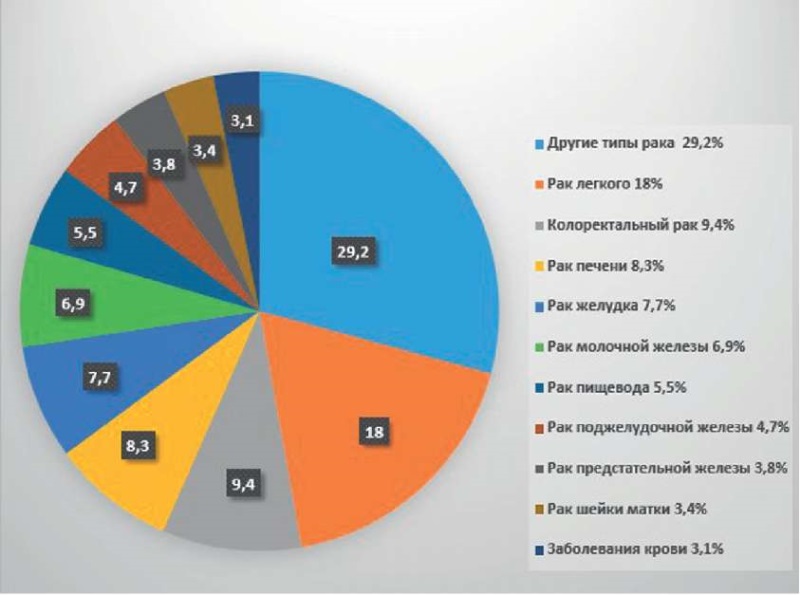
Рисунок 2. Распределение онкологической смертности
среди различных видов рака [9]
Figure 2. Distribution of cancer mortality among different types of cancer [9]
Следует учитывать такие высокие показатели заболеваемости и смертности от рака молочной железы у женщин при планировании тактики лечения у пациентов с лимфомой Ходжкина.
МАТЕРИАЛЫ И МЕТОДЫ
Приводим клинический пример пациентки С. В.Р., 1960 г. р., которой был установлен диагноз ЛХ в 1980 году. Пациентка перенесла 6 курсов химиотерапии в режиме ABVD (кумулятивная доза антрациклинов составила 510 мг доксорубицина), также проведен курс лучевой терапии на область средостения, над- и подключичных лимфоузлов, подмышечных лимфоузлов СОД 36 Гр.
В дальнейшем пациентка в течение трех лет находилась на диспансерном учете без признаков рецидива заболевания, затем на диспансеризацию не являлась.
В июне 2021 г. самостоятельно обнаружила у себя опухоль в правой молочной железе, в сентябре обратилась к онкологу, направлена в онкологический диспансер, где и был верифицирован диагноз. В ноябре 2021 г. пациентка перенесла радикальную мастэктомию с биопсией сигнального лимфоузла по поводу рака правой молочной железы. Морфологически у пациентки выявлена инфильтрирующая карцинома молочной железы, протоковый тип, высокой степени злокачественности, В исследованных лимфоузлах метастазов карциномы не выявлено. Иммунофенотип опухоли представлен как люминальный В HER2 отрицательный (РЭ положительные, HER2 отрицательный, Ki67 (клон SP6) индекс пролиферативной активности 60 %).
Окончательный диагноз представлен как рак правой молочной железы T3N0M0 ст. IIб гр. III.
Так как пациентка уже получила кумулятивную дозу доксорубицином в 1980 году, в декабре 2021 года пациентке проведен 1 курс адъювантной химиотерапии по схеме DC (доцетаксел 75 мг/м2 в/в в 1-й день + циклофосфамид 600 мг/м2 в/в в 1-й день 1 раз в 3 недели). Лечение перенесла с нежелательными явлениями в виде тошноты, рвоты, выраженной нейтропении (нейтрофилы 0,8×109/литр), от дальнейшего проведения химиотерапии отказалась. Консультирована химиотерапевтом, назначена антиэстрогенная терапия.
Получала гормональную терапию — тамоксифен 20 мг в сутки под контролем онколога по м/ж. Состояние оставалось стабильным на протяжении 6 месяцев. В мае 2022 года появились жалобы на боли в левом плече. В онкологическом диспансере проведено дообследование, по данным МРТ от 31.05.2022 года: определяется объемное образование лопатки 5×7×5 см с признаками литической деструкции (с распространением на суставную поверхность). Выраженные инфильтративно-воспалительные изменения прилежащих мышц 11×11 см.
14.06.2022 проведено оперативное вмешательство по удалению опухоли мягких тканей плечевого пояса. По результату гистологического исследования опухоль определена как метастаз рака молочной железы, умеренной степени злокачественности.
Через 3 недели пациентке начат курс химиотерапии паклитаксел 80 мг/м2, с июня по август проведено 3 курса химиотерапии без выраженных нежелательных явлений. На контрольном осмотре у пациента появились жалобы на боли в левой руке, пальпируются увеличенные подмышечные лимфоузлы слева. По данным МРТ от 29.07.2022 обнаружено прогрессирование опухоли в мягких тканях левого плечевого пояса, метастазы в подмышечные лимфоузлы и трехглавую мышцу плеча (рис. 3).
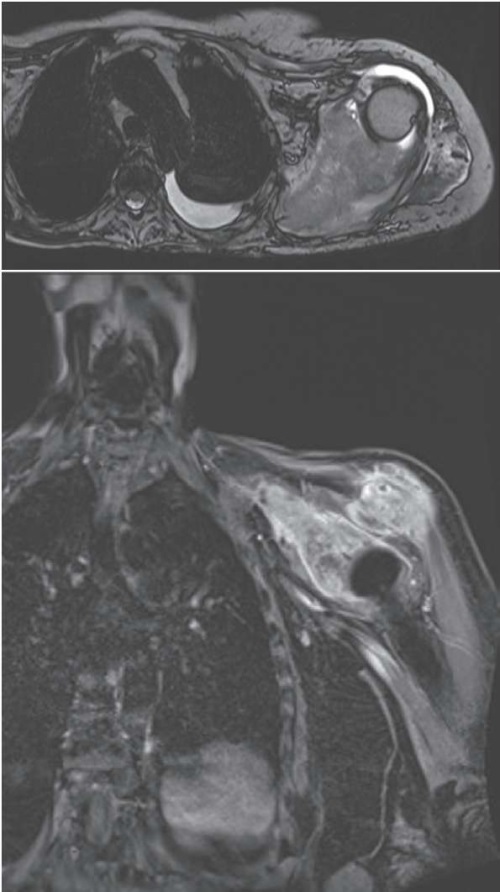
Рисунок 3. Состояние после удаления опухоли мягких тканей левого плечевого пояса.
Левая лопатка видоизменена опухолью
с бугристыми контурами размерами 135×76×109 мм,
вовлекающими прилежащие мышцы.
Тесно прилежит к акромиальному концу ключицы.
В левой подмышечной области определяются
увеличенные лимфатические узлы 28×20 мм
Figure 3. State after resection of the soft tissue tumor of the left shoulder girdle.
The left shoulder scapula is modified by a tumor
with bulging contours measuring 135×76×109 mm,
involving adjacent muscles.
It adheres closely to the acromial end of the clavicle.
Enlarged lymph nodes 28×20 mm
are detected in the left axillary region
1 августа проведен консилиум и с учетом прогрессирования заболевания пациентке назначен абемоциклиб 150 мг 2 раза в сутки + фулвестрант 500 мг в/м и курс лучевой терапии на метастатическую опухоль мягких тканей плечевого пояса с целью локального контроля и купирования болевого синдрома.
С 17.08.22 по 24.08.22 проведен курс лучевой терапии по паллиативной программе РОД 4 Гр/5 фр в неделю, СОД 24 Гр/6 фр на метастатический очаг (пораженная область плечевого пояса слева).
В конце августа у пациентки появились жалобы на головные боли, головокружение и изменение психоэмоционального фона. Проведено МРТ головного мозга, по данным которого диагностировано патологическое образование в левой лобной области размерами 21×30×32 мм, что расценено как метастаз в головной мозг. На фоне ухудшения состояния пациентка госпитализирована в паллиативное отделение на симптоматическое лечение. После стабилизации состояния произведена смена режима химиотерапии на схему гемцитабин 750–1000 мг/м² в 1-й, 8-й дни + карбоплатин AUC 3, проведен 1 курс в октябре 2022 года. После курса ХТ у пациентки наступило ухудшение состояния в виде нарастания слабости, очаговой неврологической симптоматики. 19.11.2022 пациентка скончалась.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В 1990-е годы лечение пациентов с ЛХ требовало проведения радикальных программ лучевой терапии, так как схемы химиотерапии не обладали достаточной эффективностью для контроля заболевания. Высокий уровень химиорезистентных форм при распространенных формах заболевания, низкая безрецидивная выживаемость диктовали необходимость использования (суб)радикальных программ лучевой терапии с высоким уровнем СОД от 36 Гр и выше. Риск появления радиоиндуцированного рака молочной железы после проведения радиотерапии СОД от 38 Гр в 4,5 раза выше по сравнению с группой получавших СОД менее 4 Гр. Постепенное увеличение доли пациентов, получавших только ХТ или комбинированное лечение для лечения ЛХ, за 20-летний срок наблюдения доказало меньший риск развития вторичных опухолей и, в частности, рака молочной железы [12][13].
В Республике Башкортостан к концу 2021 года состояло на учете 17 436 пациенток с диагнозом РМЖ. Из них в 20,3 % случаях заболевание было I стадии, 53,3 % приходилось на II стадию, 19,9 % с III, и в 6,5 % — IV стадии [14]. Летальность на первом году с момента постановки диагноза составляет 4,4 %.
В нашем клиническом наблюдении у пациентки рак молочной железы развился спустя 43 года после лечения ЛХ. Опухоль верифицирована как люминальный тип В, который характеризуется высоким метастатическим потенциалом. Получить полноценную адъювантную химиотерапию пациентке не удалось по причине выраженных нежелательных явлений, поэтому получала антиэстрогенную терапию тамоксифеном.
Согласно исследованию Национального института рака штата Мэриленд, США (2018), наилучшая общая выживаемость (ОВ) среди пациенток с раком молочной железы наблюдалась в группе с ЭР положительный/HER2 отрицательный (92,5 % за 4-летний период), за которым следовала группа женщин с ЭР положительный/HER2 положительный (90,3 %), для группы с подтипом ЭР отрицательный/HER2 положительный ОВ составляла 82,7 %, и наихудшая выживаемость (77,0 %) наблюдалась в группе тройного негативного подтипа РМЖ [15].
Таким образом, наша пациентка входила в группу с высоким уровнем ОВ (92,5 %). Тем не менее время от постановки первичного диагноза РМЖ до времени появления рецидива составило 8 месяцев.
Вероятность возникновения метастазов в головном мозге при люминальном типе В составляет 10–15 % случаев [16]. Следует отметить, что агрессивное течение РМЖ с люминальным типом В и отсутствие адекватного эффекта от всех видов лечения, вероятнее всего, связано с характером вторичного рака после предшествующей лучевой терапии. Учитывая относительную редкость таких клинических случаев, тема особенностей в лечении радиоиндуцированных опухолей требует дальнейшего изучения.
ЗАКЛЮЧЕНИЕ
На сегодня большинство пациентов с ЛХ приходится на возраст от 20 до 40 лет. С помощью системной химиотерапии и лучевой терапии удается вылечить до 75 % пациентов. Принимая во внимание достаточно молодой возраст пациентов, следует учитывать вероятность развития вторичных опухолей в течение жизни, особенно рака легкого и молочной железы. В нашем клиническом наблюдении рак молочной железы развился через 43 года после лечения ЛХ (системная химиотерапия + лучевая терапия) и болезнь протекала агрессивно, не реагируя на все используемые схемы лечения.
Такая группа пациентов после проведенной лучевой терапии требует ежегодного скрининга с целью исключения развития радиоиндуцированных опухолей.
Информированное согласие. Информированное согласие пациента на публикацию своих данных получено.
Informed consent. Written informed consent was obtained from the patient for publication of this case report and accompanying materials.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Sponsorship data. This work is not funded.
Список литературы
1. Abshire D., Lang M.K. The evolution of radiation therapy in treating cancer. Semin Oncol Nurs. 2018;34(2):151–7. DOI: 10.1016/j.soncn.2018.03.006
2. Даценко П.В., Паньшин Г.А. 30-летние результаты лучевой терапии и протокола COPP (MOPP) при лимфоме Ходжкина. Онкология. Журнал им. П.А. Герцена. 2014;3(4):30–37.
3. Mauch P.M., Kalish L.A., Marcus K.C., Shulman L.N., Krill E., Tarbell N.J., et al. Long-term survival in Hodgkin's disease relative impact of mortality, second tumors, infection, and cardiovascular disease. Cancer J Sci Am. 1995;1(1):33–42. PMID: 9166452
4. Hodgson D.C., Gilbert E.S., Dores G.M., Schonfeld S.J., Lynch C.F., Storm H., et al. Long-term solid cancer risk among 5-year survivors of Hodgkin's lymphoma. J Clin Oncol. 2007;25(12):1489–97. DOI: 10.1200/JCO.2006.09.0936
5. Меньшиков К.В., Пушкарев А.В., Султанбаев А.В., Пушкарев В.А., Шарифгалиев И.А. Радиоиндуцированная ангиосаркома влагалища: клинический случай. Креативная хирургия и онкология. 2020;10(2):143–8. DOI: 10.24060/2076-3093-2020-10-2-143-148
6. Turcotte L.M., Liu Q., Yasui Y., Henderson T.O., Gibson T.M., Leisenring W., et al. Chemotherapy and risk of subsequent malignant neoplasms in the childhood cancer survivor study cohort. J Clin Oncol. 2019;37(34):3310–9. DOI: 10.1200/JCO.19.00129
7. van Leeuwen F.E., Klokman W.J., Stovall M., Dahler E.C., van't Veer M.B., Noordijk E.M., et al. Roles of radiation dose, chemotherapy, and hormonal factors in breast cancer following Hodgkin's disease. J Natl Cancer Inst. 2003;95(13):971–80. DOI: 10.1093/jnci/95.13.971
8. Henry-Amar M. Second cancer after the treatment for Hodgkin's disease: a report from the International Database on Hodgkin's Disease. Ann Oncol. 1992;3 Suppl. 4:117–28. DOI: 10.1093/annonc/3.suppl_4.s117
9. Kashyap D., Pal D., Sharma R., Garg V.K., Goel N., Koundal D., et al. Global increase in breast cancer incidence: risk factors and preventive measures. Biomed Res Int. 2022;2022:9605439. DOI: 10.1155/2022/9605439
10. Wilkinson L., Gathani T. Understanding breast cancer as a global health concern. Br J Radiol. 2022;95(1130):20211033. DOI: 10.1259/bjr.20211033
11. Katsura C., Ogunmwonyi I., Kankam H.K., Saha S. Breast cancer: presentation, investigation and management. Br J Hosp Med (Lond). 2022;83(2):1–7. DOI: 10.12968/hmed.2021.0459
12. Eichenauer D.A., Becker I., Monsef I., Chadwick N., de Sanctis V., Federico M., et al. Secondary malignant neoplasms, progression-free survival and overall survival in patients treated for Hodgkin lymphoma: a systematic review and meta-analysis of randomized clinical trials. Haematologica. 2017;102(10):1748–57. DOI: 10.3324/haematol.2017.167478
13. Mazonakis M., Lyraraki E., Damilakis J. Second cancer risk assessments after involved-site radiotherapy for mediastinal Hodgkin lymphoma. Med Phys. 2017;44(7):3866–74. DOI: 10.1002/mp.12327
14. Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.) Состояние онкологической помощи населению России в 2022 году. М.: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2020. 239 с.
15. Howlader N., Cronin K.A., Kurian A.W., Andridge R. Differences in breast cancer survival by molecular subtypes in the United States. Cancer Epidemiol Biomarkers Prev. 2018;27(6):619–26. DOI: 10.1158/1055-9965.EPI-17-0627
16. Harbeck N., Penault-Llorca F., Cortes J., Gnant M., Houssami N., Poortmans P., et al. Breast cancer. Nat Rev Dis Primers. 2019;5(1):66. DOI: 10.1038/s41572-019-0111-2
Об авторах
М. М. ЗамиловРоссия
Замилов Марат Мунирович - отделение нейроонкологии
Республика Башкортостан, Уфа
К. В. Меньшиков
Россия
Меньшиков Константин Викторович - к.м.н., доцент, кафедра онкологии с курсами онкологии и патологической анатомии ИДПО, отдел химиотерапии
Республика Башкортостан, Уфа
Ш. И. Мусин
Россия
Мусин Шамиль Исмагилович - к.м.н., хирургическое отделение № 6
Республика Башкортостан, Уфа
А. В. Султанбаев
Россия
Султанбаев Александр Валерьевич - к.м.н., отдел противоопухолевой лекарственной терапии
Республика Башкортостан, Уфа
Г. И. Замилова
Россия
Замилова Гузель Ильдаровна - кафедра онкологии с курсами онкологии и патологической анатомии ИДПО
Республика Башкортостан, Уфа
А. Х. Нгуен
Россия
Нгуен Ан Хоа - отделение нейроонкологии
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Замилов М.М., Меньшиков К.В., Мусин Ш.И., Султанбаев А.В., Замилова Г.И., Нгуен А.Х. Особенности течения радиоиндуцированного рака молочной железы. Клиническое наблюдение. Креативная хирургия и онкология. 2023;13(3):254-259. https://doi.org/10.24060/2076-3093-2023-13-3-254-259
For citation:
Zamilov M.M., Menshikov K.V., Musin Sh.I., Sultanbaev A.V., Zamilova G.I., Nguyen A.H. Features of the Course of Radioinduced Breast Cancer. Clinical Observation. Creative surgery and oncology. 2023;13(3):254-259. (In Russ.) https://doi.org/10.24060/2076-3093-2023-13-3-254-259


































