Перейти к:
Оптическая неинвазивная диагностика новообразований кожи с использованием рамановской спектроскопии
https://doi.org/10.24060/2076-3093-2024-14-2-136-141
Аннотация
Введение. В последние десятилетия мы наблюдаем значительный рост заболеваемости раком кожи. Целью нашей работы является совершенствование специализированной техники и улучшение качества диагностики новообразований кожи. Материалы и методы. Основным методом исследования, который мы использовали в работе, был способ неинвазивной дифференциальной диагностики новообразований кожи, основанный на оптических методах исследования, в том числе метод спектроскопии комбинационного рассеяния, рамановской спектроскопии. Около 10 лет кафедрой онкологии на базе Самарского областного клинического онкологического диспансера (СОКОД) проводилось исследование, в которое вошли более полутысячи наблюдений. Для исследования были взяты образцы различных новообразований кожи, полученные при хирургическом лечении пациентов. При проведении экспериментальных испытаний получали определенный спектр, характеризующий различные доброкачественные и злокачественные образования кожи человека, в том числе меланому. Результаты. Результатом серии экспериментальных испытаний стало создание экспериментальной установки, абсолютно безопасной в применении. Обсуждение. Необходимо отметить, что важным является факт использования сопоставления индивидуальных характеристик спектра КР, которые получены при исследовании новообразования и здоровой кожи, для каждого пациента, что позволяет индивидуализировать метод. Высокий показатель точности 92% (с чувствительностью 89%, специфичностью 93%) очень важен для организации массового обследования, поскольку практически исключено возникновение ложных отрицательных результатов. Заключение. Принципиальная схема предложенного прибора не нуждается в использовании расходных материалов и различных реактивов, что понижает временные затраты и техническую трудоемкость при использовании способа. Метод рамановской спектроскопии новообразований кожи имеет возможность стать повсеместным и использоваться в лечебно-профилактических учреждениях любого профиля.
Ключевые слова
Для цитирования:
Каганов О.И., Логинова Ю.Г., Морятов А.А., Козлов С.В., Орлов А.Е., Братченко И.А., Джураев Б.Б. Оптическая неинвазивная диагностика новообразований кожи с использованием рамановской спектроскопии. Креативная хирургия и онкология. 2024;14(2):136-141. https://doi.org/10.24060/2076-3093-2024-14-2-136-141
For citation:
Kaganov O.I., Loginova I.G., Moryatov A.A., Kozlov S.V., Orlov A.E., Bratchenko I.A., Dzhuraev B.B. Raman Spectroscopy in Optical Non-Invasive Diagnostics of Skin Neoplasms. Creative surgery and oncology. 2024;14(2):136-141. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-2-136-141
ВВЕДЕНИЕ
Заболеваемость и смертность от злокачественных новообразований (ЗНО) стремительно увеличивается во всем мире, что является результатом роста численности и старения населения, также имеет значение увеличение факторов риска и социально-экономическое развитие.
По данным GLOBOCAN, за 2020 год было зарегистрировано более 19 миллионов новых случаев и около 10 миллионов смертельных случаев от злокачественных новообразований [1]. Рак является одной из главных причин заболеваемости и смертности в каждом регионе мира независимо от уровня развития. Таким образом, усиление профилактических мер, повышение уровня диагностики и лечения различных новообразований имеют решающее значение для глобальной борьбы со смертностью вне зависимости от экономического развития региона. По данным А. Д. Каприна, В. В. Старинского, А. О. Шахзадовой (2022), в России в 2021 году впервые было зарегистрировано 580 415 случаев заболеваемости ЗНО, что на 4,4 % больше, чем в 2020 году.
Рост заболеваемости и смертности от ЗНО отчасти связан с усовершенствованием диагностики и развитием специальной техники. В Российской Федерации злокачественные новообразования кожи по частоте встречаемости занимают у женщин второе место — 13,4 % (с меланомой — 15,6 %) после рака молочной железы (22,1 %), у мужчин — третье место — 9,8 % (с меланомой — 11,5 %) после опухолей легких (16,4 %) и предстательной железы (15,1 %).
По данным А. Д. Каприна, В. В. Старинского, А. О. Шахзадовой (2022), заболеваемость злокачественными новообразованиями кожи в период с 2011 по 2021 год увеличилась с 52,01 до 54,75 случая на 100 тыс. населения. Среднегодовой темп прироста составил более 2 %. Меланома является опаснейшим заболеванием данной группы. Несмотря на то что в структуре новообразований кожи ее доля составляет всего 17,6 %, темп прироста заболеваемости составляет 2,69 % и считается одним из наиболее высоких среди всех ЗНО, к тому же она служит причиной 70 % смертности у больных злокачественными новообразованиями кожи [2][3].
Доля больных меланомой, состоявших на учете в онкологических учреждениях России 5 лет и более с момента становления диагноза злокачественного новообразования, от числа состоявших на учете на конец отчетного года 5 лет назад в 2011–2021 гг., выросла с 68,8 до 72,6 %. При этом выявляемость на 1–2 стадиях выросла на 8,2 % за последние 10 лет [4].
ВВ Самарской области заболеваемость ЗНО за 2021 год составляет 14 486 (абсолютное число); «грубый» показатель заболеваемости на 100 тыс. населения составил 460,9 случая: мужского населения 465,5; женского населения 457,03 на 100 тыс. населения соответственно. На 1-м месте в структуре заболеваемости находятся новообразования кожи (13,5 %), включая меланому кожи, с показателем заболеваемости 8,97, что составляет 1,64 % всей выявляемой онкопатологии. При этом смертность составила 95,21 на 100 тыс. населения, из них от меланомы 1,53 на 100 тыс. [2].
На диаграммах (рис. 1) представлены заболеваемость и смертность от злокачественных новообразований кожи в Самарской области в период с 2011 по 2021 г. Можно заметить разницу в соотношении смертности и заболеваемости раком кожи, где наблюдается большой разрыв, и меланомой, где разрыв не так велик. Основной возраст данных пациентов был старше 50 лет. Доля выявляемости меланомы на 1–2-й стадиях выросла с 67,8 до 86,1 %. Удельный вес запущенных случаев (3–4 ст.) уменьшился с 31,2 % в 2011 году до 13,2 % в 2021 году. 1-годичная летальность за эти 10 лет снизилась 13,2 до 8,4 %.
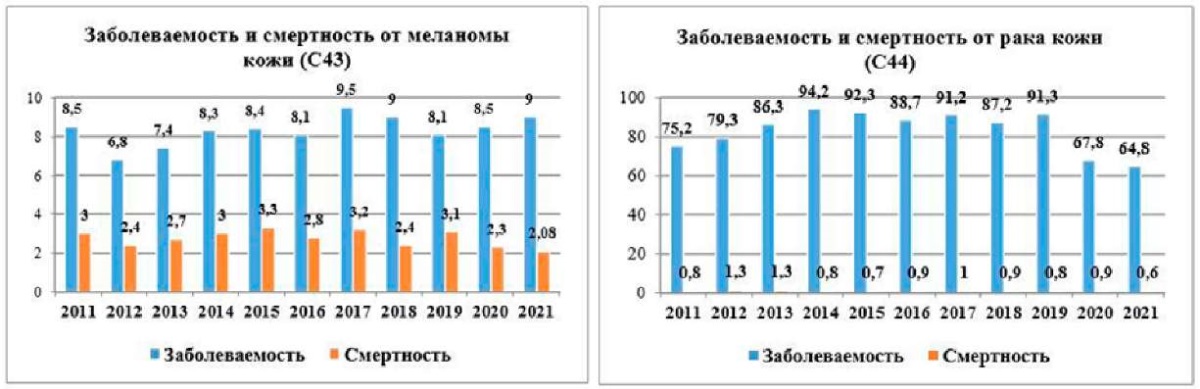
Рисунок 1. Заболеваемость и смертность в Самарской области от ЗНО кожи на 100 тыс. населения
Figure 1. Morbidity and mortality in Samara region from skin cancer per 100 thousand population
Наше исследование мотивировано дальнейшим ростом заболеваемости новообразованиями кожи, особенно меланомой, и направлено на совершенствование ранней неинвазивной диагностики с применением оптических методов анализа биологической ткани.
МАТЕРИАЛЫ И МЕТОДЫ
Меланома кожи — особенная опухоль, важнейшим условием ее успешного лечения является своевременная, ранняя диагностика, которая существенно осложняется отсутствием патогномоничных признаков заболевания на начальных этапах развития. Классические клинические признаки злокачественных меланом достаточно хорошо описаны в литературе и знакомы всем врачам. Однако все эти признаки довольно субъективны, и очень часто злокачественные новообразования могут маскироваться под доброкачественные заболевания кожи. В настоящее время самым популярным способом визуальной дифференциальной клинической диагностики является правило ABСDЕ [5]. Однако использование правила AВСDE связано с субъективным анализом визуальных признаков врачом-диагностом и не имеет достаточной специфичности. Эффективность визуальной диагностики, в том числе с использованием правила АBCDЕ, напрямую зависит от опыта врачей и достаточной практики таких наблюдений.
Существуют методы уточняющей диагностики для преодоления упомянутых недостатков, что подразумевает использование специальных приборов и инструментов для обследования. Наиболее распространенным является метод дерматоскопии, который позволяет достигнуть диагностической точности 92,2 %, чувствительности — 97,9 % и специфичности — 90,3 % [6]. Опытные специалисты, работающие в специализированном медицинском отделении, рутинно применяющие методику дерматоскопии, способны диагностировать злокачественные новообразования кожи с большей специфичностью и чувствительностью, нежели опираясь на данные клинической картины [3].
Также существуют другие методы, которые изучались нами раннее, в том числе и на базе СОКОД. Это флуоресцентная диагностика, когда были получены высокие показатели чувствительности и специфичности [6], ультразвуковое исследование, радиофосфорная индикация опухоли, радиотермометрия и другие. Основным же методом постановки диагноза злокачественного новообразования кожи является морфологический. Однако данные методы являются технически сложными, требующими множества дорогостоящих расходных материалов.
Актуальным остается создание новых методов и подходов в визуальной диагностике новообразований с применением стандартизованных методов оценки, основанных на объективных критериях, с привлечением технологий автоматического, машинного анализа для минимализации участия врачебного персонала и ускорения обследования пациента.
За основу разработки нового диагностического подхода и метода диагностики взяты оптические способы анализа. В последние годы много внимания уделяют спектроскопии комбинационного рассеяния (рамановская спектроскопия), которая обладает высокими разрешающими способностями анализа в биологических исследованиях. В процессе разработки метода была показана возможность ее использования как in vivo, так и in vitro [7] с воспроизводимыми результатами. Спектроскопия КР способна провести детальное исследование химических и структурных особенностей биологического объекта, такого как любая поверхностная ткань, а использование в качестве источника света лазерного излучения в видимом красном диапазоне позволяет проводить исследования в том числе кожи человека. Учитывая длину волны источника света и интенсивность излучения, исследование безопасно и не сопровождается каким-либо повреждением ткани. Более того, вся эта информация может быть извлечена совершенно неинвазивным способом, поскольку спектры КР можно снимать прямо с поверхности кожи.
Предложенные методы практически реализованы на кафедре онкологии СамГМУ и клинической базе ГБУЗ СОКОД, в проведенное исследование было включено более 600 человек [8–10]. В качестве объектов исследований были использованы образцы различных новообразований кожи человека, полученные после лечения в отделениях диспансера. При проведении экспериментальных испытаний получали определенный спектр, характеризующий различные доброкачественные и злокачественные образования кожи человека, в том числе меланому.
РЕЗУЛЬТАТЫ
Результатом серии экспериментальных испытаний стало создание экспериментальной установки, абсолютно безопасной в применении (рис. 2). С помощью рабочей части (оптический модуль) прибора проводят исследование изучаемого участка путем сканирования его лазерным лучом, располагая оптический модуль над исследуемым участком на расстоянии 3–4 мм. Проводят серию регистраций спектров области новообразования и здоровой кожи. Далее на компьютере анализируется полученный сигнал с применением оригинального ПО, результатом является графическое изображение характерного спектра флуоресценции и заключение о природе исследуемого новообразования, которое позволяет принять правильное решение о дальнейшей диагностической и лечебной тактике.
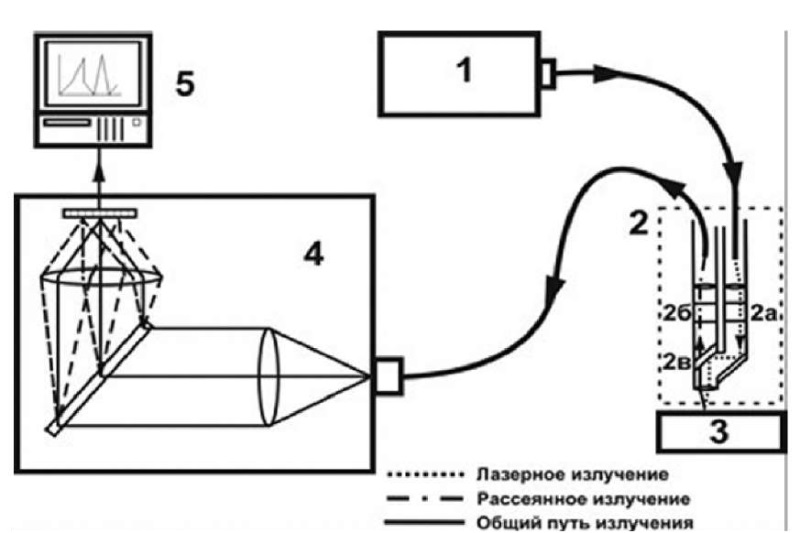
Рисунок 2. Макет прибора для лазерной спектроскопии: 1 — лазер; 2 — оптический модуль, включающий узкополосный фильтр 2 а, широкополосный фильтр 2 б, дихроичное зеркало 2 в; 3 — исследуемый образец; 4 — спектрограф с цифровой камерой; 5 — компьютер
Figure 2. Layout of the device for laser spectroscopy: 1 — laser; 2 — optical module, including narrowband filter 2a, broadband filter 2 б, dichroic mirror 2 в; 3 — test sample; 4 — spectrograph with a digital camera; 5 — computer
Суть предлагаемого метода состоит в анализе специфических концентраций отдельных биологических молекул (белки, липиды) и изменении их структурных соотношений, что влияет на спектр и интенсивность отраженного сигнала комбинационного рассеяния в определенных областях спектра флуоресценции. С учетом того что каждая биологическая молекула обладает уникальными химическими и пространственными характеристиками, она отличается и по своим частотным характеристикам. Установка позволяет анализировать характерные изменения в зоне сканирования, сравнивать участки здоровой биологической ткани и новообразования. Для ткани злокачественного новообразования характерен свой набор максимумов флуоресценции КР, которые обладают определенными частотными сдвигами, формирующими соответствующую сигнатуру [11]. Получаемый спектр КР новообразований кожи определяется наличием большего числа фосфодиэфирных О-Р-О колебаний ДНК (788 см-1), колебаний пролина и основной полосы С–С колебаний белков (850 и 950 см-1), молекулярных колебаний коллагена (1268 и 1312 см-1) и фенилаланина (1003 см-1). Что очень важно, для меланомы кожи характерны специфические повышения сигнала в диапазоне 1650 и 1450 см-1, отвечающие колебаниям метиленовой группы СН2 [12]. Комплексные спектральные данные подвергаются специальной обработке, что позволяет убрать шумы и учесть вклад отдельных компонентов (пигменты, коллаген, керамиды, кератин, триолеин и т. д.) и построить максимально точный классификатор на основе нейросети (рис. 3).
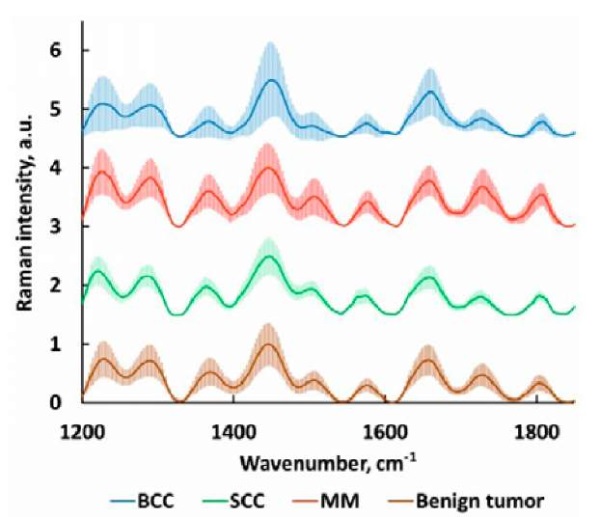
Рисунок 3. Стандартизованные кривые спектроскопии комбинационного рассеяния при анализе различный типов новообразований кожи
Figure 3. Standardized Raman spectroscopy curves in the analysis of various types of skin neoplasms
Определяющим эффективность предложенного способа диагностики является анализ индивидуальных характеристик спектра КР, полученных при исследовании участков нормальной кожи и патологических изменений у каждого пациента, с учетом индивидуальных параметров пигментации и т. д. Таким образом, достигнуты высокие показатели точности 92 % (89 % чувствительность, 93,5 % специфичность), особенно важные для организации массового обследования образований кожи при профилактических осмотрах, учитывая практически полное отсутствие ложных отрицательных ответов.
ОБСУЖДЕНИЕ
Предложенный метод оптической биопсии с оценкой спектров комбинационного рассеяния света в тканях кожи разработан для неинвазивного анализа биологических свойств опухоли и определения природы новообразования.
Предлагаемый метод демонстрирует лучшие или сопоставимые результаты по сравнению с результатами, полученными обученным медицинским персоналом. Предлагаемые системы могут использоваться в клинических условиях для оценки тканей кожи, а результаты такого анализа могут быть добавлены к оценке морфологии новообразования, выполняемой во время дерматоскопического анализа или других анализов изображений опухоли.
Предложенный CNN-анализ спектральных данных Рамановсокого рассеяния даже превосходит подходы, основанные на CNN-анализе оптических изображений опухолей кожи. Проводилось сравнение предлагаемого метода с различными отечественными и зарубежными исследованиями. В исследовании Haenssle и cоавт. [13] алгоритм CNN классифицировал 60 случаев доброкачественных новообразований по сравнению с 40 случаями злокачественных и предзлокачественных новообразований. Кроме того, исследование Haenssle и cоавт. представляет результаты классификации опухолей кожи, полученные от 96 обученных дерматологов с разным опытом (новички, опытные, эксперты). Также сравнивались сводные данные ROC-результатов диагностики 12 экспертов-дерматологов, представленные в Кокрановском обзоре [14], и диагностические показатели эффективности 21 сертифицированного дерматолога, представленные в исследовании А. Esteva и cоавт. [15].
По сравнению с традиционными, клиническими методами исследования, включая биопсию опухоли, спектроскопическая технология, основанная на исследовании химических и структурных особенностей изучаемой ткани, дает возможность значительно сократить время постановки диагноза. На данный момент, чтобы исключить возможное злокачественное новообразование исследуемой ткани, пациент должен обратиться в специализированный онкологический диспансер, если у врача общей практики есть какие-либо сомнения. Эта процедура занимает недели. Доступность портативной оптической биопсийной установки для врачей общей практики поможет немедленно определить тип ткани, и это поможет сократить клинический путь пациентов [16].
ЗАКЛЮЧЕНИЕ
На сегодня мы наблюдаем высокий уровень заболеваемости меланомой кожи; учитывая динамику за последние десятилетия, ожидаемый показатель заболеваемости будет только увеличиваться.
Таким образом, совершенствование ранней диагностики новообразований кожи остается актуальным. Мы обладаем достаточным опытом в реализации предложенной диагностики. В результате было доказано, что возможно создание компактного мобильного устройства для проведения спектроскопии комбинационного рассеяния, с элементами нейросетевого анализа полученного сигнала. Полученные нами результаты говорят о возможности достижения высокой точности аппаратного, машинного анализа, сравнимого и даже превосходящего по точности обследование, проводимое врачом-специалистом [17]. Важной особенностью способа является безопасный и неинвазивный метод анализа, применяемый независимо от локализации и стадии заболевания. Учитывая техническую простоту реализации метода в клинических условия, высокую скорость анализа и пропускную способность, отсутствие потребности в реактивах и расходных материалах, метод может быть рекомендован в том числе для массовых исследований в ЛПУ любого профиля.
Список литературы
1. Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209–49. DOI: 10.3322/caac.21660
2. Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.) Злокачественные новообразования в России в 2021 году (заболеваемость и смертность). М.: МНИОИ им. П. А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2022.
3. Патрушев А.В., Баранов И.А., Полозов Ю.Р., Сухарев А.В., Щедрин В.И. Диагностическая эффективность дерматоскопии при исследовании меланоцитарных образований. В кн.: Самцова А.В., Хайрутдинова В.Р., Патрушева А.В. (ред.) Актуальные вопросы дерматовенерологической помощи в Вооруженных силах Российской Федерации. СПб.; 2022. С. 40–4.
4. Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2021 году. М.; 2022.
5. Алиев М.Д., Буланов А.А., Бутенко А.В., Гафтон Г.И., Гильмутдинова И.Р., Демидов Л.В., и др. (ред.) Меланома кожи и слизистых оболочек: Клинические рекомендации. М.; 2020. 144 с.
6. Козлов С.В., Захаров В.П., Морятов А.А., Братченко И.А., Артемьев Д.Н. Возможности спектроскопии комбинационного рассеяния для дифференциальной диагностики новообразований кожи. Известия Самарского научного центра РАН. 2015;17(2–3):542–7.
7. Lucassen G.W., Caspers P.J., Puppels G.J., Darvin M.E., Lademann J. Infrared and Raman spectroscopy of human skin in vivo. In: Tuchin V.V. (editor) Handbook of Optical Biomedical Diagnostics. Spie press, 2007. Vol. 2. Р. 124–53.
8. Pence I., Mahadevan-Jansen A. Clinical instrumentation and applications of Raman spectroscopy. Chem Soc Rev. 2016;45:1958–79. DOI: 10.1039/C5CS00581G
9. Bratchenko I.A., Khristoforova Y.A., Bratchenko L.A., Moryatov A.A., Kozlov S.V., Borisova E.G., et al. Optical biopsy of amelanotic melanoma with Raman and autofluorescence spectra stimulated by 785 nm laser excitation. J Biomed Photonics Eng. 2021;7(2):020308. DOI: 10.18287/JBPE21.07.020308
10. Ali S.M. In vivo confocal Raman spectroscopic imaging of the human skin extracellular matrix degradation due to accumulated intrinsic and extrinsic aging. Photodermatol Photoimmunol Photomed. 2021;37:140–52. DOI: 10.1111/phpp.12623
11. Козлов С.В., Захаров В.П., Морятов А.А., Братченко И.А., Артемьев Д.Н. Способ неинвазивной дифференциальной диагностики новообразований кожи: патент Российская Федерация 2551978 C1 от 25.10.2013.
12. Gniadecka M., Philipsen P.A., Sigurdsson S., Wessel S., Nielsen O.F., Christensen D.H., et al. Melanoma diagnosis by Raman spectroscopy and neural networks: structure alterations in proteins and lipids in intact cancer tissue. J Invest Dermatol. 2004;122(2):443–9. DOI: 10.1046/j.0022-202X.2004.22208.x
13. Haenssle H.A., Fink C., Toberer F., Winkler J., Stolz W., Deinlein T., et al. Man against machine reloaded: performance of a market-approved convolutional neural network in classifying a broad spectrum of skin lesions in comparison with 96 dermatologists working under less artificial conditions. Ann Oncol. 2020;31(1):137–43. DOI: 10.1016/j.annonc.2019.10.013
14. Dinnes J., Deeks J.J., Grainge M.J., Chuchu N., Ferrante di Ruffano L., Matin R.N., et al. Visual inspection for diagnosing cutaneous melanoma in adults. Cochrane Database Syst Rev. 2018;12(12):CD013194. DOI: 10.1002/14651858.CD013194
15. Esteva A., Kuprel B., Novoa R.A., Ko J., Swetter S.M., Blau H.M., et al. Dermatologist-level classification of skin cancer with deep neural networks. Nature. 2017;542(7639):115–18. DOI: 10.1038/nature21056
16. Bratchenko L.A., Moryatov A.A., Bratchenko I.A. Raman‐based optical biopsy shortens the clinical pathway of the patient: example of pigmented skin neoplasms diagnosis. Photodermatol Photoimmunol Photomed. 2023;39(2):169–71. DOI: 10.1111/phpp.12862
17. Bratchenko I.A., Bratchenko L.A., Khristoforova Y.A., Moryatov A.A., Kozlov S.V., Zakharov V.P. Classification of skin cancer using convolutional neural networks analysis of Raman spectra. Comput Methods Programs Biomed. 2022;219:106755. DOI: 10.1016/j.cmpb.2022.106755
Об авторах
О. И. КагановРоссия
Каганов Олег Игоревич — д.м.н. профессор, кафедра онкологии
Самара
Ю. Г. Логинова
Россия
Логинова Юлия Григорьевна — кафедра онкологии
Самара
А. А. Морятов
Россия
Морятов Александр Александрович — к.м.н., кафедра онкологии
Самара
С. В. Козлов
Россия
Козлов Сергей Васильевич — д.м.н., профессор, кафедра онкологии
Самара
А. Е. Орлов
Россия
Орлов Андрей Евгеньевич — д.м.н., профессор, кафедра общественного здоровья и здравоохранения ИПО
Самара
И. А. Братченко
Россия
Братченко Иван Алексеевич — д.ф.-м.н., кафедра лазерных и биотехнических систем
Самара
Б. Б. Джураев
Россия
Джураев Бахтовар Баходурович — студент 6-го курса, Институт клинической медицины
Самара
Рецензия
Для цитирования:
Каганов О.И., Логинова Ю.Г., Морятов А.А., Козлов С.В., Орлов А.Е., Братченко И.А., Джураев Б.Б. Оптическая неинвазивная диагностика новообразований кожи с использованием рамановской спектроскопии. Креативная хирургия и онкология. 2024;14(2):136-141. https://doi.org/10.24060/2076-3093-2024-14-2-136-141
For citation:
Kaganov O.I., Loginova I.G., Moryatov A.A., Kozlov S.V., Orlov A.E., Bratchenko I.A., Dzhuraev B.B. Raman Spectroscopy in Optical Non-Invasive Diagnostics of Skin Neoplasms. Creative surgery and oncology. 2024;14(2):136-141. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-2-136-141


































