Перейти к:
Лечебно-диагностическая тактика при метастазах в лимфоузлы шеи без выявленного первичного очага
https://doi.org/10.24060/2076-3093-2024-14-3-216-222
Аннотация
Введение. Метастатический плоскоклеточный рак из неизвестного первичного очага составляет менее 5 % злокачественных опухолей в области головы и шеи. Совершенствование методов диагностики позволяет снизить заболеваемость данной патологией. Материалы и методы. Выполнен ретроспективный анализ результатов диагностики и лечения 59 пациентов с метастазами плоскоклеточного рака в лимфоузлы без ВПО. Доля пациентов мужского пола составила 86 % (51/59), женского пола — 14 % (8/59). Средний возраст пациентов — 61 год. Преобладал плоскоклеточный рак — 79 % (47/59). Результаты. Метастатически пораженные лимфоузлы локализовались в 92 % случаев во II, III уровнях. Преобладала доля пациентов со стадиями N2, N3–55 % (абс. 26), 32 % (абс. 15) соответственно. Гиперэкспрессия белка Р16 в метастатически пораженных лимфоузлах была выявлена в 70 %, PDL1 — в 48 %, а также вируса Эпштейна — Барр (ВЭБ) — 6 %. Ипсилатеральная диагностическая небная тонзиллэктомия внешне неизмененной миндалины выполнена в 15 % (9/59), позволившая выявить первичный очаг — в 1 случае. Из специальных методов лечения преобладало комплексное и комбинированное лечение — 55 % (абс. 26). ДЛТ в самостоятельном варианте была проведена 48 % пациентов, при этом полный курс получили 76 % (абс. 16). Комбинированное лечение (курс ДЛТ с последующей ПХТ) — в 7 % (абс. 3). Полихимиотерапию получили 20 % пациентов. Паллиативную иммунотерапию (пембролизумаб 200 мг в/в — 5 курсов) получил 1 пациент. Средняя продолжительность жизни была выше при комплексном лечении — составила 60 мес., (95 % ДИ 43,5–76,4), медиана выживаемости равна 60 мес. Обсуждение. Основными методами лечения пациентов с метастазами плоскоклеточного рака без ВПО была лучевая терапия в самостоятельном варианте, а также комплексное лечение. Ипсилатеральная диагностическая небная тонзиллэктомия внешне неизмененной миндалины была выполнена в 15 % (абс. 9), позволила выявить первичный очаг в 1 случае. Заключение. Метастазирование в лимфоузлы шеи без ВПО попрежнему остается актуальной междисциплинарной проблемой. Для совершенствования и оптимизации алгоритмов диагностики, лечения данных пациентов требуются проспективные многоцентровые исследования.
Ключевые слова
Для цитирования:
Соколова М.И., Павлова В.И. Лечебно-диагностическая тактика при метастазах в лимфоузлы шеи без выявленного первичного очага. Креативная хирургия и онкология. 2024;14(3):216-222. https://doi.org/10.24060/2076-3093-2024-14-3-216-222
For citation:
Sokolova M.I., Pavlova V.I. Therapeutic and Diagnostic Tactics for Metastases to the Lymph Nodes of the Neck without an Identified Primary Focus. Creative surgery and oncology. 2024;14(3):216-222. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-3-216-222
ВВЕДЕНИЕ
Метастазы злокачественных опухолей без выявленного первичного очага (ВПО) — это гетерогенная группа заболеваний, характеризующаяся метастатическим поражением, при котором, проведя полное обследование, невозможно установить первичный очаг.
Самое раннее описание метастазов в шейные лимфатические узлы без первичного очага датируется 1944 годом у Хейс Мартин [1]. С этого времени заболеваемость данной патологией по-прежнему входит в десятку наиболее распространенных причин смертности от рака [2][3]. Частота метастатического плоскоклеточного рака области головы и шеи ежегодно составляет в среднем от 1 до 4 %, при этом средние показатели 5-летней выживаемости широко варьируют и составляют от 24 до 79 % случаев [4–6].
Известно, что основание языка и небные миндалины являются наиболее распространенными очагами первичной опухоли, обнаруживаемыми при метастазах в лимфатические узлы шеи без выявленного первичного очага [6][7]. По данным R. Mistry, первичная опухоль в небных миндалинах обнаруживается 44,7 %, в основании языка — 43,9 % [7][8].
В систематическом обзоре Ali Al-Lami et al. [9] изучалась эффективность трансоральной роботизированной хирургии (TORS), трансоральной лазерной хирургии (TLM) и эндоскопической электрокоагуляции в диагностике первичного очага области головы и шеи у пациентов без ВПО. Первичный очаг был выявлен у 567 (n = 777) пациентов — 64 % (95 % ДИ 54–73). Показатели первичной идентификации составили 45 и 32 % при мукозэктомии основания языка (n = 273) и небной тонзиллэктомии (n = 118) соответственно. Показатели первичной идентификации рака с помощью хирургических методов составляют: TORS — 60 % (95 % ДИ 49–70), TLM — 80 % (95 % ДИ 0,58–1,01), эндоскопическая электрокоагуляция — 41 % (95 % ДИ 0,05–0,76). N = 529 (68 %) опухолей были ассоциированными с ВПЧ.
М. Kubik et аl. проанализировали частоту первичного выявления у 23 пациентов с p16-негативным статусом CUP-синдрома при использовании TORS (Transoral Robotic Surgery) при мукозэктомии основания языка. Первичная опухоль была выявлена лишь в 3 из 23 случаев (13 %) [10].
На сегодняшний день нет единого мнения о том, следует ли выполнять тонзиллэктомию и мукозэктомию в обязательном порядке.
Тем временем рекомендации ASCO (American Society of Clinical Oncology) 2019 г. подчеркивают важность выполнения ипсилатеральной небной тонзиллэктомии данной категории пациентов. В случае с двусторонней лимфаденопатии, если первичный очаг не подтвержден при эндоскопическом исследовании, рекомендуется выполнение односторонней лингвальной тонзиллэктомии на стороне с большим опухолевым поражением.
Таким образом, при анализе проблем диагностики у пациентов с метастазами в лимфатические узлы шеи без ВПО существуют различные точки зрения в отношении объема и алгоритма обследования. Одни авторы считают необходимым проведение полного обследования только тем пациентам, которым впоследствии можно провести специальное лечение, другие являются сторонниками комплексного обследования с целью поиска первичного очага.
Цель исследования — изучить структуру метастатических поражений лимфоузлов шеи без ВПО, оценить результаты диагностики и лечения данных пациентов.
МАТЕРИАЛЫ И МЕТОДЫ
Нами был проведен ретроспективный анализ данных (амбулаторные карты, истории болезни) 59 пациентов с метастазами в лимфоузлы шеи без выявленного первичного очага, получивших лечение в условиях ГАУЗ ТО «Многопрофильный клинический медицинский центр «Медицинский город». Критерии включения в работу: наличие морфологически верифицированных метастазов в лимфатические узлы шеи, отсутствие первичной опухоли после первичного клинического обследования, отсутствие данных за поражение лимфоузлов другой локализации.
Пациентам выполнялся комплекс исследований, включающий в себя: сбор анамнеза и осмотр, общеклинические лабораторные исследования, фиброларингоскопию (ФЛС), фибробронхоскопию (ФБС), фиброэзофагогастродуоденоскопию (ФГДС), фиброколоноскопию (ФКС), рентгенографию органов грудной клетки; ультразвуковые исследования (УЗИ) лимфатических узлов и мягких тканей шеи, органов брюшной полости и малого таза; компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ), ПЭТ-КТ с ФДГ (позитронно-эмиссионную томографию, совмещенную с компьютерной томографией с фтордезоксиглюкозой).
При гистологическом исследовании проводилась стандартная микроскопия парафиновых срезов с окраской гематоксилин-эозином. При микроскопическом описании биоптата определялся гистологический тип метастаза и степень дифференцировки опухоли, операционного материала — дополнительные факторы риска, глубина инвазии, края резекции. Иммуногистохимическое исследование (ИГХ) проводилось с целью определения тканевой принадлежности метастаза.
ИГХ-исследование проводилось в большинстве случаев с антителами к MCK, CK7, TTF1, Heppar1, CD45, Chromogranin A, Synaptophysin, ki-67, p40, CD56, Р16, Р53, Р40, EVB, CD-20, CD-3, CD-15, CD-30, CD-68, CD-21, CD-23.
РЕЗУЛЬТАТЫ
Согласно эпидемиологическим показателям (рис. 1) пик заболеваемости («грубый» показатель на 100 тыс. населения) приходится на 2016 г. — на 100 тыс. населения заболеваемость составила 2,44. Далее с 2019 по 2023 г. отмечается небольшая тенденция к снижению заболеваемости: снижение заболеваемости с 1,1 до 0,5 на 100 тыс. Высокий уровень заболеваемости в 2016 г., более вероятно, связан отсутствием столь широких возможностей в диагностике в сравнении с последующими годами.
Средний возраст пациентов при постановке диагноза составил 61 год с преобладанием лиц мужского пола (86 %). Основным проявлением заболевания была шейная лимфаденопатия, что являлось основным поводом к обращению за медицинской помощью, реже дисфагия, дисфония, осиплость голоса, болевой синдром, нарушение носового дыхания. В 86 % случаев пациенты обращались в сроки от 1 до 3 мес.
Функциональное состояние пациентов с метастазами в лимфатические узлы шеи без ВПО оценивалось с использованием шкалы ECOG-ВОЗ и по Карновскому — 83 % находились в удовлетворительном состоянии (ECOG 1, по Карновскому — 90–80 %), 17 % — в состоянии средней степени тяжести (ECOG 2–3, по Карновскому 70 %).
Для локализации пораженных лимфоузлов шеи использовалась общепринятая классификация по K. Robbins, согласно которой выделяют 6 уровней и 6 подуровней лимфатических узлов.
Как правило, цитологическое исследование является основным и начальным этапом диагностики лимфаденопатии. В данном исследовании оно было выполнено всем пациентам, при этом отмечено преобладание доли тонкоигольной аспирационной биопсии (ТАБ) — 69 % (абс. 41), тонкоигольной аспирационной биопсии под контролем УЗ (FNA) — 31 % (абс. 18).
По результатам цитологического исследования метастатическое поражение лимфоузлов было подтверждено более чем в половине случаев — в 59 % (абс. 35). В 41 % цитологическое заключение было неинформативным ввиду малого диагностического объема, скудности клеточного состава. Этой категории пациентов верификация проводилась путем иницизионной/эксцизионной биопсии лимфоузла — 88 % (абс. 21), 12 % (абс. 3) — трепан-биопсий.
Всем пациентам выполнялась инструментальная диагностика с целью поиска первичного очага, а также для оценки распространенности опухолевого процесса (рис. 2).
Из эндоскопических методов диагностики преобладали ФГС — 95 % и ФКС — 92 %, реже ФБС — 5 %. Из лучевых методов визуализации чаще проводилась КТ орофарингеальной области и органов шеи — 93 %, ПЭТ-КТ — 89 %.
Объем специального лечения определялся мультидисциплинарным консилиумом (МДК) с участием врача-онколога, химиотерапевта, радиотерапевта. Полихимиотерапия (ПХТ) проводилась в основном по схеме PC, РР, PF (при метастазах плоскоклеточного рака) EP, ЕС (при метастазах нейроэндокринной карциномы), темозоломид при метастазах меланомы, иммунотерапия — препаратами дабрафениб, траметиниб. Дистанционная лучевая терапия проводилась на область носо-рото-гортаноглотки с РОД 2 Гр СОД 60 Гр и зону регионарного лимфоттока I–V уровней СОД 50 Гр в традиционном режиме фракционирования (5 раз в неделю) на аппарате ЛУ «Varian Halcyon». Комплексное лечение включало в себя шейную лимфодиссекцию с последующей ХЛТ на фоне радиомодификации с платиносодержащими препаратами. Комбинированное лечение — курс ДЛТ с последующей ПХТ.
Метастатическое поражение лимфоузлов было подтверждено гистологически у всех пациентов, иммуногистохимическое исследование потребовалось в 76 % (абс. 45).
По данным морфологического заключения в структуре метастазов в лимфоузлы шеи превалировала доля плоскоклеточного рака — 79 % (абс. 47), что соответствует имеющимся литературным данным (рис. 3).
С учетом преобладания метастазов плоскоклеточного рака нами были проанализированы данные именно этой группы пациентов.
Степень дифференцировки метастазов плоскоклеточного рака чаще была умеренной и низкой, составила 77 % (абс. 36). Согласно результатам настоящего исследования заболеваемость у мужчин была выше (86 %), диагноз устанавливался в 72 % в возрасте старше 60 лет. Чаще имело место одностороннее поражение шейных лимфоузлов — 92 %, с локализацией в основном во II, III уровнях. Пациенты с N2, N3 преобладали, составили 55 % (абс. 26) и 32 % (абс. 15) соответственно (табл. 1).
Иммуногистохимическое исследование было выполнено в 70 % (абс. 33) с оценкой частоты экспрессии суррогатного маркера белка Р-16, выявленного в 70 %, PD-L1–48 %, а также вируса Эпштейна — Барр (ВЭБ) — 6 % (абс. 1).
По результатам мульдисциплинарной комиссии (МДК) большинство пациентов получили специальное лечение — 94 % (абс. 44) с преобладанием комплексного и комбинированного лечения — 55 % (абс. 26), 6 % (абс. 4) пациентов по распространенности опухолевого процесса было рекомендовано симптоматическое лечение (табл. 2).
Пациентам с наличием гиперэкспрессии суррогатного маркера ВПЧ-инфекции белка Р-16 по данным ИГХ-исследования биоптата лимфоузлов в 15 % (абс. 9) была выполнена ипсилатеральная диагностическая небная тонзиллэктомия внешне неизмененной миндалины. Выявить первичный очаг удалось в 1 случае, плоскоклеточная микрокарцинома небной миндалины.
Дистанционная лучевая терапия (ДЛТ) в самостоятельном варианте была проведена 48 % пациентов, при этом полный курс получили — 76 % (абс. 16), 24 % завершили лечение на неполной дозе ввиду выраженности лучевых реакций (острый лучевой дерматит был выявлен в 5 %, острый лучевой мукозит в 8 %), декомпенсации соматической патологии, развития пневмонии, ассоциированной COVID-инфекцией в период пандемии.
Комбинированное лечение (курс ДЛТ с последующей ПХТ) проводилось в 7 % (абс. 3); как правило, это пациенты, имеющие прогрессирование заболевания на фоне неполного курса ДЛТ. Полихимиотерапию получили 20 % пациентов, в основном (70 %) это был паллиативный курс пациентам с местно-распространенным процессом.
Паллиативную иммунотерапию (пембролизумаб 200 мг в/в — 5 курсов) получил 1 пациент при прогрессировании на фоне ПХТ платиносодержащими препаратами (6 курсов РР), полного курса ДЛТ до СОД 60 Гр на лимфоузлы шеи с двух сторон в формате 3D-конформного облучения, шейной лимфодиссекции.
Комплексное лечение (шейная лимфодиссекция с последующей ХЛТ на фоне радиомодификации с платиносодержащими препаратами — 3D-конформное двустороннее облучение шеи до СОД от 50 до 66 Гр.) было выполнено 25 % пациентов, при этом среди шейных лимфодиссекций преобладала доля селективных — 82 % (абс. 9), классические радикальные — 18 % (абс. 2).
Средняя продолжительность жизни пациентов с метастазами плоскоклеточного рака в лимфоузлы шеи без ВПО после полного курса ДЛТ в самостоятельном варианте составила 43 мес. (95 % ДИ 23–63), медиана выживаемости 24 мес. При комплексном лечении средняя продолжительность жизни составила 60 мес. (95 % ДИ 43,5–76,4), медиана выживаемости равна 60 мес. При проведении паллиативной полихимиотерапии данный показатель оказался самым низким — 34 мес. (95 % ДИ 28,1–41,3). При этом есть значимые различия между группами (р = 0,028 < 0,05). В группе пациентов после комбинированного лечения (ДЛТ, далее курс ПХТ) средняя продолжительность жизни была выше, чем во всех остальных группах, и составила 96 мес. (95 % ДИ 96–96), медиана выживаемости — 96 мес.
Так как особенности «масштабов» лучевой терапии данных пациентов являются предметом споров, нами была проанализирована эффективность одностороннего и двустороннего облучения лимфоузлов шеи.
В группе пациентов, которым была проведена односторонняя лучевая терапия (19 % (абс. 3)), СОД составила 60 Гр, из них 2 пациента живы (период наблюдения составил 36 и 29 мес.), 1 пациент погиб от декомпенсации сопутствующей патологии (период наблюдения 16 мес.). 3D-конформная двусторонняя лучевая терапия до СОД от 50 до 60 Гр проводилась 13 пациентам (81 %). При этом живы 10 пациентов (77 %), средняя продолжительность жизни — 43 мес.
Нами был проведен анализ историй болезни пациентов со стадиями N1–N2a на предмет наличия экстракапсулярного роста как негативного прогностического фактора при данной патологии. Было выявлено его наличие в 7 случаях (15 %), стадии N2a. Данные пациенты получили комплексное лечение (шейная лимфодиссекция, курс ХЛТ) в 57 % (абс. 4), из которых 3 погибли от прогрессирования заболевания, 1 пациент жив — период наблюдения составил 36 мес. Остальным пациентам (абс. 3) с экстракапсулярным ростом по данным биопсии в связи с декомпенсацией соматической патологии была рекомендована симптоматическая терапия.
При ретроспективном анализе историй болезни всех пациентов с метастазами плоскоклеточного рака без ВПО было выявлено, что у 6 % (абс. 3) первичный очаг реализовался после окончания специального лечения.
В первом случае выявлен рак корня языка спустя 6 мес. после операции Крайля при очередном динамическом осмотре при ФЛС с биопсией. Выполнена резекция корня языка, шейная лимфодиссекция. Гистологически — плоскоклеточный рак, G3. Пациенту был проведен курс ХЛТ с карбоплатином до СОД 60 Гр. В данный момент находится в ремиссии 18 мес.
Во втором случае спустя 4 года после комплексного лечения (шейная лимфодиссекция, 6 курсов РР, паллиативный курс ДЛТ на область носо-рото-гортаноглотки до СОД 60 Гр) по данным КТ шеи с контрастным усилением выявлена опухоль грушевидного синуса с инвазией в корень языка. Пациенту выполнена расширенная ларингэктомия с резекцией корня языка, тиреоидэктомия, лимфодиссекция. Гистологически подтвержден плоскоклеточный рак, G2. Пациент погиб от соматической патологии через 24 мес. после окончания курса специального лечения.
В третьем случае — спустя 2 года после операции Крайля при динамическом осмотре по причине дисфагии выполнена контрольная ФГС с верификацией опухоли в пищеводе до 12 мм.
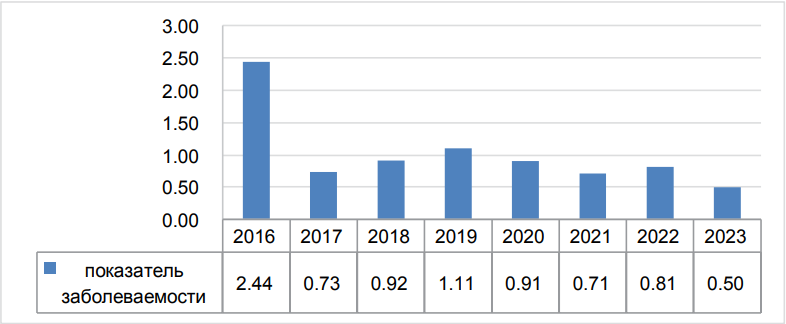
Рисунок 1. Заболеваемость метастазами в лимфоузлы шеи без ВПО (Тюменская область без АО)
Figure 1. Incidence of metastasis to neck lymph nodes without a primary site (Tyumen region excluding autonomous districts)
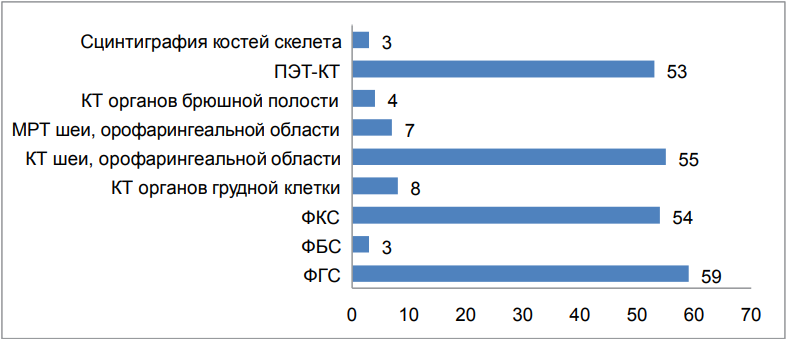
Рисунок 2. Объем инструментальной диагностики пациентов с метастазами в лимфоузлы шеи без ВПО
Figure 2. Scope of instrumental diagnostics in patients with metastasis to neck lymph nodes without a primary site
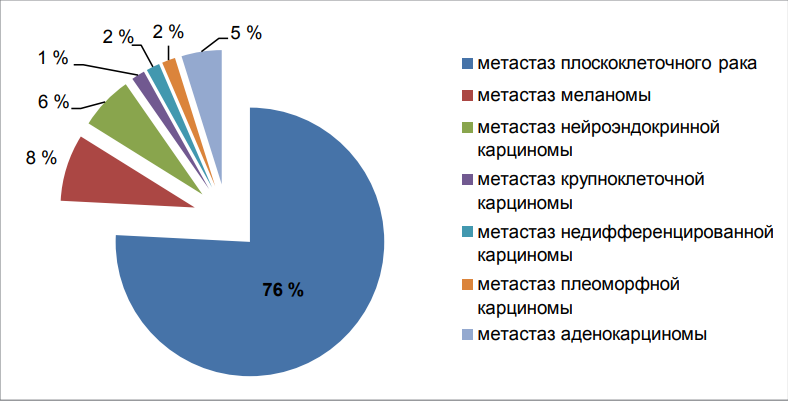
Рисунок 3. Структура метастазов в лимфоузлы шеи без ВПО
Figure 3. Structure of metastases in neck lymph nodes without a primary site
Показатели | Количество (абс.) | % |
50–59 лет | 15 | 32 |
60–69 лет | 32 | 68 |
Женщины | 16 | 34 |
Мужчины | 31 | 66 |
Локализация лимфоузлов | ||
односторонняя | 43 | 92 |
двусторонняя | 4 | 8 |
Уровень поражения: | ||
II | 15 | 32 |
III | 23 | 49 |
IV | 7 | 15 |
V | 2 | 4 |
Стадия N: | ||
N1 | 6 | 13 |
N2 | 26 | 55 |
N3 | 15 | 32 |
Экспрессия р-16: | ||
положительная | 23 | 70 |
отрицательная | 10 | 30 |
не определена | 14 | 30 |
Экспрессия PD-L1: | ||
CPS > 1 | 16 | 48 |
CPS 0 | 17 | 52 |
Таблица 1. Характеристика пациентов
Table 1. Patient characteristics
Метод лечения | Абс. | % |
Лучевая терапия | 21 | 48 |
Паллиативная | 4 | 19 |
Радикальная | 16 | 71 |
Полный курс | 16 | 76 |
Неполный курс | 6 | 24 |
Комплексное лечение (химиолучевая терапия, шейная лимфодиссекция) | 11 | 25 |
Полихимиотерапия | 9 | 20 |
Паллиативная | 7 | 78 |
Иммунотерапия (СРS > 20) | 1 | 2 |
Комбинированное лечение (лучевая терапия, полихимиотерапия) | 3 | 7 |
Симптоматическая терапия | 4 | 6 |
Таблица 2. Методы лечения пациентов с метастазами плоскоклеточного рака в шейные лимфоузлы без ВПО
Table 2. Structure of metastases in neck lymph nodes without a primary site
ОБСУЖДЕНИЕ
Несмотря на совершенствование методов диагностики и визуализации, метастазирование в лимфоузлы шеи без ВПО по-прежнему остается актуальной проблемой современной онкологии. Подход к лечению данной патологии вызывает многочисленные споры, так как большинство имеющихся алгоритмов носят рекомендательный характер, основаны на нерандомизированных исследованиях, зачастую на небольшой выборке пациентов.
Полученные данные показали, что лучевая терапия как часть мультидисциплинарного подхода к лечению является эффективным методом лечения метастазов в лимфоузлы шеи без ВПО, приводит к относительно высоким показателям локорегионарного контроля. Средняя продолжительность жизни пациентов при двусторонней ЛТ до СОД 50–60 Гр составила 43 мес., при односторонней — 32,5 мес.
Пик заболеваемости в возрасте 61 года, преимущественно у пациентов мужского пола, с преобладанием плоскоклеточного рака как наиболее распространенного гистологического типа, что подчеркивает мировые демографические особенности данной патологии.
Большинство метастазов в лимфатические узлы локализовались во II–III уровнях (81 %), что свидетельствует о возможном наличии скрытой первичной опухоли области головы и шеи, в частности ротоглотки. Ипсилатеральная диагностическая небная тонзиллэктомия (внешне неизмененной миндалины) в нашем исследовании была выполнена в 15 % (абс. 9) случаев, что позволило выявить первичную карциному небной миндалины у 1 пациента. Согласно литературным данным, тонзиллэктомия позволяет выявить первичный очаг до 63,8 %.
Не менее важным остается вопрос необходимости одно- или двусторонней лучевой терапии.
В нашем исследовании пациенты получили лучевую терапию в формате 3D-конформного облучения в самостоятельном варианте в 76 %, при этом медиана выживаемости составила 24 мес. Острый лучевой дерматит 3-й степени наблюдался у 5 % пациентов, а у 8 % пациентов был острый мукозит ≥ 3-й степени, что подчеркивает приемлемую переносимость длительной лучевой терапии.
Вопрос о том, можно ли вообще отказаться от лучевой терапии после первичной операции, является еще одним предметом споров. В частности, для стадий pN1 или pN2a без экстракапсулярного распространения отказ от проведения лучевой терапии может быть оправдан при гарантированном тщательном наблюдении на основе визуализации. В случае прогрессирования лучевую терапию можно использовать в качестве терапии «спасения» [11].
Применение и польза химиолучевой терапии также являются предметом дискуссий. Показания к проведению противоопухолевой лекарственной терапии экстраполируются на данные по лечению распространенных гистотипов злокачественных опухолей области головы и шеи с использованием препаратов платины [11][12]. В исследовании, проведенном А. Сhen и коллегами, было обнаружено, что сопутствующая химиотерапия приводит к повышению уровня токсичности, но не к улучшению общей выживаемости и локорегионарного контроля [13]. В нашем исследовании химиолучевая терапия назначалась в 25 % случаев, в основном при экстракапсулярном распространении, медиана выживаемости данных пациентов составила 60 мес.
ЗАКЛЮЧЕНИЕ
Таким образом, широкопольное облучение с одновременной химиотерапией приводит к более низкой вероятности проявления первичного очага, но при этом повышает риск развития побочных эффектов. Определение локализации первичной опухоли является предпочтительным, так как позволяет проводить целенаправленное лечение, что приводит к более благоприятному клиническому исходу [14][15].
Список литературы
1. Frost P. Unknown primary tumors: an example of accelerated (type 2) tumor progression. Basic Life Sci. 1991;57:233–7; discussion 237–40. DOI: 10.1007/978-1-4684-5994-4_20
2. Varadhachary G. New strategies for carcinoma of unknown primary: the role of tissue-of-origin molecular profiling. Clin Cancer Res. 2013;19:4027–33. DOI: 10.1158/1078-0432.CCR-12-3030
3. Куликов Е.П., Захаркина Т.В., Сашина Е.Л., Мануковская О.В., Редькин А.Н., Чевардов Н.И. и др. Поиск первичного очага при метастатическом поражении лимфоузлов шеи. Российский медико-биологический вестник им. академика И.П. Павлова. 2016;24(4):119–25. DOI: 10.23888/PAVLOVJ20164119-125
4. Al Kadah B., Papaspyrou G., Linxweiler M., Schick B, Rübe C., Büchler B.S., et al. Cancer of unknown primary (CUP) of the head and neck: retrospective analysis of 81 patients. Eur Arch Otorhinolaryngol. 2017;274:2557–66. DOI: 10.1007/s00405-017-4525-8
5. Рудык А.Н., Зинченко С.В., Хасанов Р.Ш., Хамидуллин Р.Г., Чернышева В.А. Определение локализации первичной опухоли у пациентов с метастазами в лимфатические узлы шеи без выявленного первичного очага. Онкохирургия. 2013;5(2):57–9.
6. Саприна О.А. Метастазы плоскоклеточного рака в лимфоузлы шеи без выявленного первичного очага. Опухоли головы и шеи. 2012;4:53–8. DOI:10.17650/2222-1468-2012-0-4-53-58
7. Farooq S., Khandavilli S., Dretzke J., Moore D., Nankivell P.C., Sharma N., et al. Transoral tongue base mucosectomy for the identification of the primary site in the work-up of cancers of unknown origin: Systematic review and meta-analysis. Oral Oncol. 2019;91:97–106. DOI: 10.1016/j.oraloncology.2019.02.018
8. Mistry R., Walker A., Kim D., Ofo E. Transoral robotic surgery for the benefit of patients with head and neck cancer of unknown primary: our experience at St George’s University Hospital, London. Ann R Coll Surg Engl. 2020;102(6):442–50. DOI: 10.1308/rc-sann.2020.0071
9. Al-Lami A., Gao C., Saddiq M., Al Zuhir N., Simo R., Arora A., et al. Reducing the unknowns: A systematic review & meta-analysis of the effectiveness of trans-oral surgical techniques in identifying head and neck primary cancer in carcinoma unknown primary. Oral Oncol. 2022;126:105–7. DOI: 10.1016/j.oraloncology
10. Kubik M.W., Channir H.I., Rubek N., Kim S., Ferris R.L., von Buchwald C., et al. TORS Base-of-Tongue mucosectomy in human papilloma virus-negative carcinoma of unknown primary. Laryngoscope. 2021;131(1):78–81. DOI: 10.1002/lary.28617
11. Liu X., Li D., Li N., Zhu X. Optimization of radiotherapy for neck carcinoma metastasis from unknown primary sites: a meta-analysis. Oncotarget. 2016;7(48):78736–46. DOI: 10.18632/oncotarget.12852
12. Maghami E., Ismaila N., Alvarez A., Chernock R., Duvvuri U., Geiger J., et al. Diagnosis and management of squamous cell carcinoma of unknown primary in the head and neck: ASCO Guideline. J Clin Oncol. 2020;38(22):2570–96. DOI: 10.1200/JCO.20.00275
13. Chen A.M., Farwell D.G., Lau D.H., Li B.Q., Luu Q., Donald P.J. Radiation therapy in the management of head-and-neck cancer of unknown primary origin: how does the addition of concurrent chemotherapy affect the therapeutic ratio? Int J Radiat Oncol Biol Phys. 2011;81(2):346–52. DOI: 10.1016/j.ijrobp.2010.06.031
14. Ofo E., Spears H., Kim D., Duvvuri U. Transoral robotic surgery and unknown primary surgery. ORL J Otorhinolaryngol Relat Spec. 2018;80:148–55. DOI: 10.1159/000490596
15. Civantos F.J., Vermorken J.B., Shah J.P., Rinaldo A., Suárez C., Kowalski L.P., et al. Metastatic squamous cell carcinoma to the cervical lymph nodes from an unknown primary cancer: management in the HPV era. Front Oncol. 2020;10:593164. DOI: 10.3389/fonc.2020.593164
Об авторах
М. И. СоколоваРоссия
Соколова Мария Ивановна — отделение опухолей головы и шеи
Тюмень
В. И. Павлова
Россия
Павлова Валерия Игоревна — к.м.н., доцент, кафедра онкологии, радиологии и радиотерапии
Тюмень
Рецензия
Для цитирования:
Соколова М.И., Павлова В.И. Лечебно-диагностическая тактика при метастазах в лимфоузлы шеи без выявленного первичного очага. Креативная хирургия и онкология. 2024;14(3):216-222. https://doi.org/10.24060/2076-3093-2024-14-3-216-222
For citation:
Sokolova M.I., Pavlova V.I. Therapeutic and Diagnostic Tactics for Metastases to the Lymph Nodes of the Neck without an Identified Primary Focus. Creative surgery and oncology. 2024;14(3):216-222. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-3-216-222


































