Перейти к:
Методы борьбы с послеоперационными осложнениями у пациентов, перенесших лимфаденэктомию по поводу рака молочной железы
https://doi.org/10.24060/2076-3093-2024-14-3-229-234
Аннотация
Введение. Снижение агрессивности хирургической тактики в настоящее время — перспективное направление в медицине, которое поддерживает множество последователей из-за лучшего профиля безопасности. Однако большой процент пациентов нуждается в расширении объемов вмешательства. При лечении рака молочной железы основные сложности в послеоперационном ведении связаны с операциями на лимфатической системе. Цель: провести сравнительный анализ методик интраоперационной борьбы с лимфореей у пациентов во время проведения лимфодиссекции по поводу рака молочной железы в условиях Ярославской областной онкологической больницы. Материалы и методы. Проведен анализ историй болезни 660 пациентов после выполнения подмышечной подключичной подлопаточной лимфаденэктомии. В послеоперационном периоде у пациентов отмечалась длительная лимфорея. В группе из 108 пациентов при выполнении вмешательств использовалась увеличительная техника (бинокулярные линзы, микроскоп) для обнаружения и выделения лимфатических сосудов. Для лигирования лимфатических сосудов использовалась методика двойной коагуляционной пломбировки. Достаточная коагуляционная поверхность достигалось путем формирования линий шва угла, превышающего 90°. При выполнении мастэктомии методика дополнялась циркулярным бинтованием грудной клетки. Результаты и обсуждение. Анализ историй болезни показал, что основным значимым фактором, влияющим на лимфорею, является выполнение лимфаденэктомии. Использование щадящих методик позволяло снизить риск возникновения постмастэктомического синдрома. При сравнении исследуемой группы с контрольной отмечалось статистически значимое снижение выраженности лимфореи, без увеличения риска появления других осложнений. Заключение. Совокупность указанных методик показала статистически значимые преимущества в борьбе с послеоперационными осложнениями. Легкость воспроизведения позволяет с минимальными затратами внедрить их в практику. Экономические преимущества связаны не только с отсутствием дополнительных затрат на оперативное вмешательство, но и с уменьшением времени, проведенного пациентами в круглосуточном стационаре. Все это значительно увеличивает удовлетворенность пациентов проведенным лечением.
Ключевые слова
Для цитирования:
Букин Э.М., Васин А.Б., Голощапова Н.С., Рощин И.Н., Акимова А.Е. Методы борьбы с послеоперационными осложнениями у пациентов, перенесших лимфаденэктомию по поводу рака молочной железы. Креативная хирургия и онкология. 2024;14(3):229-234. https://doi.org/10.24060/2076-3093-2024-14-3-229-234
For citation:
Bukin E.M., Vasin A.B., Goloshchapova N.S., Roschin I.N., Akimova A.E. Methods of Controlling Postoperative Complications after Lymphadenectomy in Patients with Breast Cancer. Creative surgery and oncology. 2024;14(3):229-234. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-3-229-234
ВВЕДЕНИЕ
Рак молочной железы — одна из центральных проблем современной онкологии. Распространенность этой патологии занимает первые строчки в заболеваемости (20,9 % от общей онкологической заболеваемости), и увеличивается количество пациентов молодого возраста [1]. Лечение рака молочной железы во всех случаях является комплексным вопросом. Значительный вклад в выздоровление пациентов вносит хирургический этап.
Снижение агрессивности хирургической тактики в настоящее время — перспективное направление в медицине, которое поддерживает множество последователей из-за лучшего профиля безопасности [2]. Однако большой процент пациентов нуждается в расширении объемов вмешательства [3]. При лечении рака молочной железы основные сложности в послеоперационном ведении связаны с операциями на лимфатической системе. Именно это вмешательство сопряжено с большим спектром возможных осложнений как в раннем, так и в позднем послеоперационном периодах [4]. Одним из наиболее распространенных явлений становится лимфорея. По данным разных авторов, ее выраженность находится в прямой зависимости от количества удаленных лимфатических узлов, а также от индивидуальных особенностей больного [5]. Наличие этого осложнения может серьезно сказаться на сроках начала следующих этапов лечения, что, безусловно, влияет на прогноз (исследования показали, что оптимальным временем начала послеоперационной лучевой терапии считается срок, не превышающий 12 недель после операции. Проведение же лекарственной терапии следует начинать, учитывая профиль безопасности, в максимально ранние сроки [6][7]). Другая проблема, а именно инфекционные осложнения, связана с неадекватной длительностью дренирования либо скоплением лимфоцеле [8, 9]. Каскад трудноконтролируемых осложнений, возникающих на этом фоне, ухудшает прогноз течения заболевания в связи с отсрочкой или даже отменой положенной противоопухолевой терапии. Немаловажным становится частое возникновение WEB-cиндрома и лимфедемы верхней конечности у таких пациентов. Применение тех или иных средств в борьбе с послеоперационной лимфореей зачастую становится сложным выбором для хирурга [10][11]. Разработка новых технических решений и их модернизация позволяет подобрать наиболее индивидуализированные и эффективные методики.
Их принято делить на группы:
— системная терапия (ингибиторы фибринолиза, соматостатин и т. д.),
— использование герметиков и сиалентов,
— лигирующие методики, направленные на уменьшение «мертвого пространства» послеоперационной раны,
— применение высокотехнологичных устройств интраоперационно (электрогенераторы с защищенными режимами работы, ограничивающие выходную мощность; аппараты для проведения лазерного воздействия на область послеоперационной раны),
— лигирование лимфатических сосудов.
При выборе того или иного решения специалисты руководствуются накопленным опытом, доступностью и профилем безопасности. При этом данных о комплексных тактиках борьбы с осложнениями зачастую недостаточно [12].
Цель исследования: провести сравнительный анализ методик интраоперационной борьбы с лимфореей у пациентов во время проведения лимфодиссекции по поводу рака молочной железы.
МАТЕРИАЛЫ И МЕТОДЫ
Статистические подсчеты выполнены в программе Statistica 10. Нами проведен ретроспективный анализ историй болезни 660 пациентов, проходивших лечение в условиях онкологического стационара за период с 2020 по 2021 г. Из них 250 пациентов клинически имели первую стадию болезни (39 %), 277 — вторую стадию (42 %). Мы исключили 133 пациента, т. к. они имели местнораспространенные формы и/или были предлечены на этапе проведения неоадъювантной химиотерапии, а также паллиативной химиотерапии. Средний возраст пациентов составил 62,5 года (среднее квадратичное отклонение 8 лет). Всем пациентам была выполнена подмышечная подключичная подлопаточная лимфаденэктомия в сочетании с мастэктомией (201 случай — группа А) либо с радикальной резекцией молочной железы (326 случаев — группа В). Для борьбы с послеоперационной лимфореей в контрольной группе использовались стандартные методики электрохирургической работы.
В группе А нами были рассмотрены возможные дополнительные способы влияния на размер «мертвого пространства» в области передней грудной стенки. У 41 пациента использовалось циркулярное эластичное бинтование. С целью активной борьбы с послеоперационной лимфореей нами сформирована группа из 108 пациентов. В исследуемой группе во время выполнения подмышечной лимфодиссекции в сочетании с мастэктомией (группа А1) либо с резекцией молочной железы (группа В1) при выполнении вмешательств в области подмышечной впадины использовалась увеличительная техника (бинокулярные линзы, хирургический микроскоп) для обнаружения и бережного выделения лимфатических сосудов области. Особое внимание уделялось сохранению венозных, артериальных и нервных структур мелкого калибра. Для лигирования лимфатических сосудов использовалась методика двойной коагуляционной пломбировки. Энергетическая мощность не превосходила 30 Вт. Важным аспектом стало соблюдение достаточной коагуляционной поверхности, что достигалось путем формирования линий шва угла, превышающего 90° (рис. 1).
Контроль наличия лимфореи проводился визуально. Послеоперационная рана дренировалась активной дренажной системой Redon. В группе А1 после окончания операции производилось эластичное бинтование грудной клетки для лучшей адгезии лоскутов.
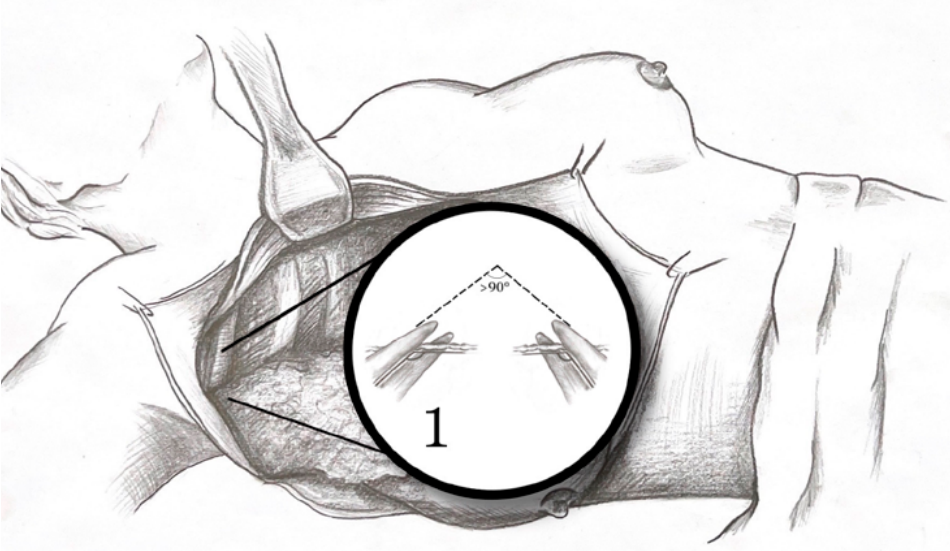
Рисунок 1. Лигирование лимфатического сосуда методикой двойной коагуляционной пломбировки
Figure 1. Lymphatic vessel ligation by double coagulation technique
РЕЗУЛЬТАТЫ
Средний объем послеоперационной лимфореи в случае выполнения мастэктомии по Маддену составил 610 мл (среднее квадратичное отклонение 142), в группе радикальной резекции молочной железы — 560 мл (среднее квадратичное отклонение 170), различия в сроках лимфореи не были статистически значимыми, из чего следует вывод, что основополагающим фактором в развитии лимфореи является объем лимфадентэктомии.
В группе А отмечалось клиническое уменьшение объема послеоперационной лимфореи (570 мл, среднее квадратичное отклонение 150), при сравнении с контрольной группой различия не были статистически значимыми (значимость проверена с использованием Т-критерия, p = 0,64). Однако в группе эластичного бинтования отсутствовали геморрагические осложнения повлекшие повторное хирургическое вмешательство (1,5 % в контрольной группе), а также при отказе от активного дренажа необходимость проведения пункционных, в том числе повторных, эвакуаций лимфоцеле по отношению к количеству пациентов была статистически меньше: 77 % против 60 % (значимость проверена с использованием критерия Манна — Уитни, р = 0,003), что в совокупности увеличивает удовлетворенность пациентов проведенным лечением (для оценки использовалась анкета по анализу удовлетворенности качеством предоставления медицинских услуг в стационарных условиях) [13]. Среднее количество койко-дней, проведенных в стационаре группой А — 21 день (среднее отклонение 3), группой В — 15 дней (среднее отклонение 2). Возникновение постмастэктомического синдрома было отмечено в 60 % случаев (группа А), 50 % случаев (группа В).
Основной вклад в вероятность предотвращения постмастэктомического синдрома принадлежал деликатной работе с сосудисто-нервными структурами, располагающимися в подмышечной впадине. Сохранение межреберно-плечевого нерва, передних ветвей межреберных нервов, латеральных грудных и торакоэпигастральных вен позволяло снизить шанс возникновения указанного синдрома. При этом особо важными являются нервосберегающие методики лимфодиссекции, что, однако, не было сопряжено с уменьшением количества удаляемых лимфатических узлов. Остаются малоизученными случаи сохранения части указанных структур. Однако при наличии технической возможности сохранения умышленное их лигирование признано неэтичным. По данным литературы, отказ от лигирования артерий и вен небольшого калибра снижает риск ранних и поздних послеоперационных осложнений, положительно сказываясь как на заживлении послеоперационной раны, так и на вероятности развития лимфедемы [14].
Объем послеоперационной лимфореи в группе А1 составил 350 мл (среднее квадратичное отклонение 70), в группе В1 — 250 мл (среднее квадратичное отклонение 40). При сопоставлении с контрольной группой указанная методика статистически значимо снижает выраженность послеоперационной лимфореи (значимость проверена с использованием Т-критерия, р = 0.0002).
ОБСУЖДЕНИЕ
Долгое время хирурги совершенствовали приемы электрохирургической работы. В 2008 г А. Manouras et al. описывают методику лимфодиссекции с использованием электрогенератора с биполярной рабочей поверхностью [15]. Основным недостатком метода являлось отсутствие таргетного воздействия на лимфатические сосуды, а также недостаточный анализ энергетических режимов работы, что, по данным литературы, может оказать влияние на выраженность лимфореи в послеоперационном периоде. Описываемый способ также выполняется с применением хирургического электрогенератора. Пломбировка с использованием двойной коагуляции обеспечивает надежный блок, препятствующий истечению лимфы. Использование бинокулярной оптики или операционного микроскопа, во-первых, позволяет обнаружить и произвести деликатное выделение лимфатических сосудов с последующим их лигированием, во-вторых, обеспечивает условия для сохранения трубчатых структур небольшого калибра (a. et v. thoracicus lateralis, v. thoracoepigastrica, rr. ventrales (nn. intercostales), n. intercostobrachialis).
При этом обязательным атрибутом проведения подобных вмешательств являлось умышленное ограничение мощности электрогенератора, что снижает риск непреднамеренного их повреждения. Целесообразно использовать режимы работы, не превышающие пиковую мощность в 30 Вт, либо применять защищенные биполярные генераторы (Force Triad Liga Sure).
В прямой зависимости от увеличения выходной мощности находился объем лимфореи и выраженность болевого синдрома, что подтверждается данными литературы [16]. Уменьшение мощности менее 30 Вт оказывается нецелесообразным в связи с отсутствием влияния как на сроки послеоперационной лимфореи, так и на выраженность проявлений постмастэктомического синдрома, но с наличием негативного влияния на увеличение времени хирургического вмешательства в связи с необходимостью смены мощности при выполнении каждого из этапов гемостаза, что объективно создает дополнительные трудности для медицинского персонала и исполнителей операции.
При анализе литературы близким к описываемому способу является патентное изобретение RU20090135302 [17]. Принципиальное же отличие заключается в отказе от формирования кожно-мышечных тоннелей в пользу формирования двойной коагуляционной пломбы в области пересекаемых лимфатических сосудов. Это положительно влияет на снижение стоимости оперативного вмешательства благодаря уменьшению расхода шовного материала, а также снижает риск случайной травмы сохраняемых анатомических структур. Немаловажным преимуществом является уменьшение среднего времени оперативного вмешательства, что, по мнению специалистов, является фактором, доказанно влияющим на выраженность послеоперационной лимфореи. Уменьшение продолжительности операции увеличивает пропускную способность операционного стола и снижает нагрузку на операционную бригаду.
Циркулярное бинтование грудной клетки в раннем послеоперационном периоде с использованием эластичного материала при удалении молочной железы сокращало объем «мертвого пространства» в зоне вмешательства, исключая при этом травму различных анатомических структур. Применение современного подхода к борьбе с послеоперационной лимфореей улучшает показатели заживления раны, сокращая сроки госпитализации, что неоспоримо влияет на удовлетворенность пациентов лечением.
ЗАКЛЮЧЕНИЕ
Применение современного подхода к борьбе с послеоперационной лимфореей в виде совокупности указанных методик показывает статистически значимые преимущества в борьбе с послеоперационными осложнениями, улучшая показатели заживления раны. Легкость воспроизведения позволяет с минимальными затратами внедрить их в практику. Экономические преимущества связаны не только с отсутствием дополнительных затрат на оперативное вмешательство, но и с уменьшением времени, проведенного пациентами в круглосуточном стационаре. Все это значительно увеличивает удовлетворенность пациентов лечением.
Список литературы
1. Каприн A.Д., Старинский В.В., Шахзадова А.О. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). Москва: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2021.
2. Magnoni F., Galimberti V., Corso G., Intra M., Sacchini V., Veronesi P. Axillary surgery in breast cancer: An updated historical perspective. Semin Oncol. 2020;47(6):341–52. DOI: 10.1053/j.seminon-col.2020.09.001
3. Ганусевич О.Н., Нестерович Т.Н. , Федоркевич И.В. Современные подходы к лечению рака молочной железы (по материалам конференции в Сан-Галлен, 2017). Проблемы здоровья и экологии. 2018;3:11–8. DOI: 10.51523/2708-6011.2018-15-3-3
4. Li H., Li W.B., Sun Z.X., Yu J., Lv P.Y., Li C.X., et al. Analysis of the risk factors of breast cancer-related lymphedema and construction and evaluation of a prediction model. Lymphat Res Biol. 2023;21(6):565– 73. DOI: 10.1089/lrb.2022.0058
5. Ogiya A., Kimura K., Ueno T., Iwase T., Ohno S. Time trend of breast cancer-related lymphedema according to body mass index. Eur J Surg Oncol. 2024;50(6):108350. DOI: 10.1016/j.ejso.2024.108350
6. Chen S.Y., Tang Y., Wang S.L., Song Y.W., Fang H., Wang J.Y., et al. Timing of chemotherapy and radiotherapy following breast-conserving surgery for early-stage breast cancer: a retrospective analysis. Front Oncol. 2020;10:571390. DOI: 10.3389/fonc.2020.571390
7. Рак молочной железы: Клинические рекомендации. М., 2021. URL: https://cr.minzdrav.gov.ru/schema/379_4 (дата обращения: 05.06.2024).
8. Roy S., Gupta S.S., Singh U., Anand R., Bhat G., Sooraj R., et al. Prospective study to evaluate efficacy of single versus double drains in breast cancer patients undergoing surgery. Indian J Oncol. 2024;15(2):437–45. DOI: 10.1007/s13193-024-01923-z
9. Marco E., Trépanier G., Chang E., Mauti E., Jones J.M., Zhong T. Postmastectomy Functional Impairments. Curr Oncol Rep. 2023;25(12):1445–53. DOI: 10.1007/s11912-023-01474-6
10. Фатуев О.Э., Козлов Н.С., Королюк Г.М., Ратке И.А., Ронзин А.В., Степанянц Н.Г. и др. Новые подходы к профилактике и лечению ранней и поздней послеоперационной лимфореи. Исследования и практика в медицине. 2019;6(1):60–74. DOI: 10.17709/2409-2231-2019-6-1-6
11. Богданов А.В., Куракина И.С., Нохрин Д.Ю. Профилактика длительной и обильной лимфореи при раке молочной железы. Онкология. Журнал им. П.А. Герцена. 2020;9(3):34–40. DOI: 10.17116/onkolog2020903134
12. Spiekerman van Weezelenburg M.A., Bakens M.J.A.M., Daemen J.H.T., Aldenhoven L., van Haaren E.R.M., Janssen A., et al. Prevention of seroma formation and its sequelae after axillary lymph node dissection: an up-to-date systematic review and guideline for surgeons. Ann Surg Oncol. 2024;31(3):1643–52. DOI: 10.1245/s10434-023-14631-9
13. Черкасов М.А., Черный А.Ж., Шубняков И.И., Иржанский А.А., Идрисов Х.К., Дзамихов Р.Х. Комплексная оценка качества оказания медицинской помощи с точки зрения пациента. Новости хирургии. 2019;27(1):49–58. DOI: 10.18484/2305-0047.2019.1.49
14. Filipoiu F., Dogaru I.A., Munteanu O., Anca Monica O.M., Tulin A.D., Ursut B.M. Axillary Lymphadenectomy: Safe Dissection Through a Correct Technique. Cureus. 2024;16(1):e52434. DOI: 10.7759/cureus.52434
15. Manouras A., Markogiannakis H., Genetzakis M., Filippakis G.M., Lagoudianakis E.E., Kafiri G., et al. Modified radical mastectomy withaxillary dissection using the electrothermal bipolar vessel sealing system. Arch Surg. 2008;143(6):575–80. DOI: 10.1001/archsurg.143.6.575
16. Melhem J., Amarin M., Odeh G., Al-Bustami N., Al-Lauzy H., Ayoub R. Intercostobrachial Nerve (ICBN) preservation versus sacrifice in axillary dissection: randomized controlled trial. Am J Clin Oncol. 2021;44(5):206–9. DOI: 10.1097/COC.0000000000000809
17. Букин Э.М. Способ интраоперационной профилактики лимфореи при выполнении радикальной мастэктомии или радикальной резекции молочной железы с подмышечно-подлопаточноподключичной лимфодиссекцией: патент Российская Федерация 20090135302 C1 от 02.05.2023.
Об авторах
Э. М. БукинРоссия
Букин Эдуард Максимович — отделение опухолей молочной железы и кожи
Ярославль
А. Б. Васин
Россия
Васин Александр Борисович
Ярославль
Н. С. Голощапова
Россия
Голощапова Наталья Сергеевна — дневной стационар
Ярославль
И. Н. Рощин
Россия
Рощин Игорь Николаевич — к.м.н., отделение торакальной онкологии
Ярославль
А. Е. Акимова
Россия
Акимова Анастасия Евгеньевна — отделение опухолей молочной железы и кожи
Ярославль
Рецензия
Для цитирования:
Букин Э.М., Васин А.Б., Голощапова Н.С., Рощин И.Н., Акимова А.Е. Методы борьбы с послеоперационными осложнениями у пациентов, перенесших лимфаденэктомию по поводу рака молочной железы. Креативная хирургия и онкология. 2024;14(3):229-234. https://doi.org/10.24060/2076-3093-2024-14-3-229-234
For citation:
Bukin E.M., Vasin A.B., Goloshchapova N.S., Roschin I.N., Akimova A.E. Methods of Controlling Postoperative Complications after Lymphadenectomy in Patients with Breast Cancer. Creative surgery and oncology. 2024;14(3):229-234. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-3-229-234


































