Перейти к:
Деэскалация лучевой терапии в плане лечения больных раком молочной железы I–IIВ стадий после подкожных/кожесохранных мастэктомий с одномоментной реконструкцией
https://doi.org/10.24060/2076-3093-2024-14-3-235-242
Аннотация
Введение. Показания к лучевой терапии после мастэктомий с/без реконструкции при Т1–2N0–1 М0 четко не определены, в стандартах лечения есть ссылки на возможное назначение лучевой терапии при факторах, повышающих рецидив рака молочной железы. Материалы и методы. Проведено ретроспективное одноцентровое нерандомизированное исследование 984 пациенток раком молочной железы, которые пролечены в МНИОИ им. П. А. Герцена с 2014 по 2022 г. Пациенты разделены на 2 группы: с лучевой терапией и без лучевой терапии. Результаты и обсуждение. Представлен анализ возраста пациенток, гистологической структуры опухоли, иммуногистохимических характеристик, степени злокачественности опухоли, мультицентричности, наличия лимфоваскулярной инвазии, опухолевых клеток, состояния краев R1 и R0, стадии на риск развития рецидива. Общая выживаемость в группе с рецидивом составила 95,1 %, в группе без рецидива 98,4 %. В группе с ЛТ (I группа) общая выживаемость составила 98,4 %, метастазы диагностированы в 4,9 % случаев. В группе без ЛТ (II группа) общая выживаемость составила 98,2 %, метастазы выявлены в 5,9 % случаев. Заключение. При однофакторном анализе в исследуемых группах проведение лучевой терапии снижает риск развития рецидива на 3,5 %. При положительном крае R1 рекомендуют проведение ЛТ, что подтвердилось в нашем исследовании, разница составила 14,5 %, и, безусловно, при наличии R1 необходима ЛТ в послеоперационном периоде. При анализе стадии РМЖ и риске рецидива статистическая разница выявлена только при IIА стадии сТ1N1 М0, ЛТ снижала риск рецидива РМЖ. Статистическая разница в I и II группах была выявлена при степени злокачественности G2, уровне Кi67 менее 50 %, наличии опухолевой эмболии и возрасте пациенток до 40 лет. Лучевая терапия после подкожной/кожесохранной мастэктомии снижает риск рецидива на 3,2 %, но общая выживаемость в группе с и без лучевой терапии составила 98,4 и 98,2 %, разница статистически не достоверна. В нашем исследовании критерии для назначения лучевой терапии в послеоперационном периоде следующие: молодой возраст пациенток, край резекции R1, люминальный/нелюминальный НЕR2 позитивный тип, сN1, наличие опухолевой эмболии.
Ключевые слова
Для цитирования:
Рассказова Е.А., Зикиряходжаев А.Д. Деэскалация лучевой терапии в плане лечения больных раком молочной железы I–IIВ стадий после подкожных/кожесохранных мастэктомий с одномоментной реконструкцией. Креативная хирургия и онкология. 2024;14(3):235-242. https://doi.org/10.24060/2076-3093-2024-14-3-235-242
For citation:
Rasskazova Е.А., Zikiryakhodzhaev A.D. De-escalation of Radiation Therapy in the Treatment Plan of Patients with Stage I-IIV Breast Cancer after Subcutaneous/Skin-Sparing Mastectomies with Immediate Reconstruction. Creative surgery and oncology. 2024;14(3):235-242. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-3-235-242
ВВЕДЕНИЕ
Лечение рака молочной железы (РМЖ) включает локальное воздействие (хирургическое вмешательство и лучевая терапия) и системный подход (таргетная терапия, гормонотерапия, химиотерапия). При этом часто сочетают локальное и системное лечение в зависимости от стадии РМЖ, объема хирургического вмешательства, иммуногистохимического типа (ИГХ) [1].
За последние десятилетия лекарственная терапия становится важным этапом лечения РМЖ, при этом таргетная терапия, постнеоадъювантная терапия позволяет увеличить общую выживаемость больных [2]. При выполнении органосохраняющих операций на молочной железе выполнение лучевой терапии (ЛТ) долго было неотъемлемым компонентом лечения, в настоящее время при I стадии РМЖ, люминальном типе А и возрасте пациентки старше 70 лет можно отказаться от проведения лучевой терапии [3][4]. Показания к назначению лучевой терапии при выполнении мастэктомий с/без реконструкцией при II стадии РМЖ остаются дискутабельными, особенно после выполненной неоадъювантной полихимиотерапии (НАПХТ) и достижения полной степени патоморфологического ответа (рСR) [5–8].
По рекомендациям РООМ при сТ1–2N0 М0 после мастэктомии с/без реконструкцией ЛТ не показана при R0, но можно рассмотреть проведение ЛТ при R1, а также при наличии нескольких неблагоприятных факторов (центральная/медиальная локализация опухоли или рТ2 и хотя бы один из факторов высокого риска развития рецидива: лимфоваскулярная инвазия, степень злокачественности G3, отрицательный статус по рецепторам эстрогенов, трижды негативный подтип; у больных с <6 удаленными лимфатическими узлами, при низкой ожидаемой эффективности системной терапии или ее отсутствии). Отдельные рекомендации в данной группе пациенток, но с проведенной НАПХТ.
Лучевая терапия у пациенток сТ1–3N1 М0 без НАПХТ при выполнении мастэктомии с/без реконструкцией молочной железы показана. Но можно рассмотреть отказ от ЛТ при наличии благоприятных факторов (статус рТ1, наличие положительного статуса по рецепторам эстрогенов, G1, НЕR2 — отрицательный подтип (при наличии как минимум 3 критериев)) [9].
Побочные эффекты от ЛТ известны: увеличение частоты и степени капсулярной контрактуры при использовании алломатериалов, при использовании лоскутной методики развитие жирового некроза в отдаленном периоде, что приводит к повторным хирургическим вмешательствам [10][11].
Таким образом, рекомендации назначения ЛТ после мастэктомии с/без реконструкцией четко не определены, при неблагоприятных прогностических факторах можно рассмотреть проведение ЛТ, включая и пациенток рТ1N0 М0, а можно и не проводить ЛТ при рТ1–2N1 М0, но при наличии благоприятных прогностических факторов.
Целью исследования является улучшение онкологических результатов лечения пациенток с диагнозом РМЖ I–IIВ стадий с/без лучевой терапией после выполнения подкожных/кожесохранных мастэктомий с реконструкцией.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено ретроспективное одноцентровое нерандомизированное исследование 984 пациенток РМЖ, которые пролечены в МНИОИ им. П. А. Герцена с 2014 по 2022 г. Хирургический этап включал выполнение подкожных/кожесохранных мастэктомий с одномоментной реконструкцией.
Число хирургических вмешательств составило 1020 в исследуемых группах из-за двухстороннего вмешательства у 36 пациенток с диагнозом первично-множественного синхронного РМЖ. Для реконструкции молочной железы использовали аутологичные лоскуты и алломатериалы (экспандеры/имплантаты). При применении экспандеров на 1-м этапе выполняли одномоментную двухэтапную реконструкцию молочной железы, заменяя экспандер на втором этапе на имплантат.
Пациенты разделены на 2 группы:
I группа — пациентки с этапом лучевой терапии на молочную железу ± регионарные зоны (n = 613);
II группа — пациентки без лучевой терапии (n = 407).
Средний возраст пациенток составил 42,0 ± 1,2 года.
На основании клинико-инструментальных методов исследования распределение по стадиям пациенток представлено в таблице 1.
В исследование включены пациентки с размером опухолевого узла до 5 см, так как пациентки с Т3 по стандартам лечения включают обязательный этап лучевой терапии.
Пациентки с 0 стадией, включенные в исследование за счет ПМСР молочных желез, составили 7 человек.
Биопсия сторожевого лимфатического узла выполнена 552 больным (56 %).
Гистологические типы представлены: cancer in situ — 7 (0,7 %), инвазивный рак без признаков специфичности — 818 (80,2 %), инвазивный дольковый рак — 105 (10,3 %), комбинированный рак — 40 (3,9 %), редкие формы рака — 50 (4,9 %) случаев.
Мультицентричность опухолевых узлов в молочной железе диагностирована в 19,2 ± 1,3 % случаев.
Распределение по иммуногистохимическим типам РМЖ: люминальный тип В НЕR2 негативный выявлен в 342 (33,8 %) случаев, люминальный тип А — в 267 (26,5 %), тройной негативный тип — в 197 (19,4 %), люминальный тип В НЕR2 позитивный — в 120 (11,8 %), нелюминальный НЕR2 позитивный — в 86 (8,5 %) случаев.
Неоадъювантная полихимиотерапия (НАПХТ) включала следующие схемы лечения и число курсов: 4 АС+4 Т, 6 ТСН, 6 ТСН+пертузумаб, при тройном негативном типе — 4 АС+4 Т+4 карбоплатин. Число пациенток с НАПХТ — 276 (28 %), в 12 случаях был диагностирован ПМСР молочных желез. Подкожная мастэктомия с реконструкцией выполнена у 617 (60,5 %), кожесохранная мастэктомия — у 403 (39,5 %) пациенток. Адъювантная полихимиотерапия выполнена в 40 %, лучевая терапия — в 62,3 %, таргетная терапия — в 17,2 %, гормональная терапия — в 70,1 %, выключение функции яичников — в 8,3 % случаев.
Клинико-морфологические характеристики I и II групп представлены в таблице 2.
Стадии | Число (абс, %) |
0 | 7 (0,7) |
I | 431 (42,3) |
IIА (Т1N0 М0) | 143 (14) |
IIА (Т2N0 М0) | 252 (24,7) |
IIВ (Т2N1 М0) | 187 (18,3) |
Всего | 1020 (100 %) |
Таблица 1. Распределение пациенток РМЖ по стадиям
Table 1. Distribution of breast cancer patients by stages
Факторы | I группа | II группа |
Возраст больных, лет | ||
До 40 | 241 (65,5 %) | 127 (34,5 %) |
После 40 | 372 (60,4 %) | 244 (39,6 %) |
Стадия РМЖ | ||
0 | - | 7 (100 %) |
I | 176 (40,8 %) | 255 (59,2 %) |
IIА Т2N0 М0 | 175 (69,5 %) | 77 (30,5 %) |
IIА Т1N1 М0 | 97 (67,8 %) | 46 (32,2 %) |
IIВ | 165 (86,8 %) | 22 (13,2 %) |
ИГХ типы | ||
Люминальный А | 107 (40 %) | 160 (60 %) |
Люминальный В | 226 (66,1 %) | 116 (33,9 %) |
Люминальный В НЕR2-позитивный | 76 (63,3 %) | 44 (36,7 %) |
НЕR2-позитивный | 56 (65,1 %) | 30 (34,9 %) |
Тройной негативный | 148 (75,1 %) | 49 (24,9 %) |
Гистологический тип РМЖ | ||
Протоковый | 507 (62 %) | 311 (38 %) |
Дольковый | 64 (61 %) | 41 (39 %) |
Комбинированный | 23 (57,5 %) | 17 (42,5 %) |
Редкие формы | 19 (38 %) | 31 (62 %) |
Степень дифференцировки | ||
G1 | 11 (26,2 %) | 31 (73,8 %) |
G2 | 324 (54,4 %) | 272 (45,6 %) |
G3 | 260 (78 %) | 73 (22 %) |
Состояние регионарных лимфатических узлов | ||
N0 | 351 (50,9 %) | 339 (49,1 %) |
N1 | 262 (79,4 %) | 68 (20,6 %) |
Лимфоваскулярная инвазия | ||
Есть | 70 (70 %) | 30 (30 %) |
Нет | 543 (59 %) | 377 (41 %) |
Уровень Кi-67 | ||
Менее 50 | 407 (54,4 %) | 341 (45,6 %) |
Более 50 | 205 (77,6 %) | 59 (22,4 %) |
Наличие опухолевой эмболии | ||
Есть | 90 (71,4 %) | 36 (28,6 %) |
Нет | 523 (58,5 %) | 371 (41,5 %) |
Мультицентричность | ||
Есть | 142 (72,1 %) | 55 (27,9 %) |
Нет | 471 (49,5 %) | 480 (50,5 %) |
Состояние края R | ||
R1 | 74 (71,8 %) | 29 (28,2 %) |
R0 | 539 (58,8 %) | 378 (41,2 %) |
Таблица 2. Распределение пациенток с/без ЛТ у больных РМЖ в зависимости от клинико-морфологических факторов
Table 2. Distribution of breast cancer patients with/without radiation therapy depending on clinical and morphologic factors
РЕЗУЛЬТАТЫ
Оценим влияние ЛТ и других факторов на риск возникновения рецидива РМЖ.
Рецидивы в I группе диагностированы в 16/613 (2,6 ± 0,6 %) случаев, при этом рецидив одномоментно с отдаленным метастазированием выявлен у 3 пациенток. OR = 0,42 (от 0,22 до 0,81), р < 0,05. Рецидивы во II группе диагностированы в 25/407 (6,1 ± 1,2 %) случаев (р = 0,009221, критерий Т — 2,61), при этом у 5 пациенток рецидивы были диагностированы одномоментно с отдаленными метастазами.
Таким образом, лучевая терапия снижает риск развития рецидива РМЖ.
Проанализируем зависимость рецидива от молекулярно-биологического типа РМЖ. При люминальном типе А риск рецидива в I группе — 4/107 (3,8 %) случаев, во II группе — 10/160 (6,3 %) случаев, при люминальном типе В в I группе — 3/226 (1,3 %) случаев, во II группе — 7/116 (6 %) случаев, при тройном негативном типе в I группе — 6/148 (4 %), во II группе рецидивов не выявлено, при люминальном типе В НER2 позитивном риск развития рецидива в I группе — 3/76 (4 %), во II группе 4/44 (9 %) случаев, при нелюминальном НЕR2 позитивном в I группе — не было рецидивов, во II группе 4/30 (13,3 %) случаев.
Проанализируем влияние ЛТ на риск рецидива в зависимости от гистологической формы РМЖ. При инвазивном протоковом раке риск рецидива в I группе — 14/507 (2,8 %) случаев, во II группе — 20/311 (6,4 %), OR = 0,43 (от 0,21 до 0,86), при инвазивном дольковом раке в I группе риск рецидива 2/64 (3,1 %) случаев, во II группе — 1/41 (2,4 %) случаев. OR = 1,28 (0,11 до 14,59), р > 0,05.
При положительном крае резекции R1 риск рецидива в I группе 2/74 (2,7 %) случаев, во II группе — 5/29 (17,2 %) случаев, OR = 0,16 (от 0,03 до 0,85); при крае резекции R0 риск рецидива в I группе 14/539 (2,6 %) случаев, во II группе — 20/378 (5,3 %) случаев, OR = 0,49 (от 0,24 до 0,98), р < 0,05.
Состояние лимфатических узлов и риск рецидива РМЖ: при сN0 в I группе рецидив выявлен в 11/351 (3,1 %) случаев, во II группе — 20/339 (5,9 %), OR = 0,53 (от 0,25 до 1,13), р > 0,05, при сN1 в I группе риск рецидива 5/262 (1,9 %) случаев, во II группе — 5/68 (7,4 %) случаев, OR = 0,26 (от 0,07 до 0,92), р < 0,05 (рис. 1).
Зависимость рецидива от стадии РМЖ: при I стадии — 8/176 (4,5 %) случаев, во II группе — 18/255 (7 %) случаев, при IIА ст. (Т2N0 М0) рецидив в I группе — 3/175 (1,7 %) случаев, во II группе — 2/77 (2,6 %) случаев, при IIА ст. (Т1N1 М0) рецидив в I группе — 2/97 (2,1 %) случаев, во II группе — 4/46 (8,7 %) случаев, при IIВ стадии в I группе рецидив выявлен в 3/165 (1,8 %) случаев, во II группе — 1/22 (4,5 %) случаев (рис. 2).
Зависимость рецидива от степени злокачественности опухоли при G2 в I группе — 7/324 (2,2 %) случаев, при II группе — 17/272 (6,3 %) случаев, OR = 0,35 (от 0,14 до 0,85), при G3 в I группе риск рецидива 8/260 (3,1 %) случаев, во II группе — 5/73 (6,8 %) случаев, OR = 0,45 (от 0,14 до 1,41), статистической разницы при G3 не выявлено.
Зависимость рецидива при наличии лимфоваскулярной инвазии: в I группе — 3/70 (4,3 %) случаев, во II группе — 1/30 (3,3 %), при отсутствии лимфоваскулярной инвазии риск рецидива в I группе — 13/543 (2,4 %) случаев, во II группе — 24/377 (6,4 %) случаев.
Зависимость рецидива от наличия опухолевой эмболии: в I группе — 5/90 (5,5 %) случаев, во II группе — 4/36 (11,1 %) случаев, при отсутствии опухолевой эмболии в I группе — 11/523 (2,1 %), во II группе — 21/371 (5,7 %) случаев.
Зависимость уровня Кi-67 % и риск рецидива при уровне <50 % в I группе — 10/407 (2,5 %) случаев, во II группе — 24/341 (7 %) случаев, OR = 0,35 (от 0,16 до 0,74), р < 0,05; при уровне >50 % в I группе — 6/205 (2,9 %) случаев, во II группе — 1/59 (1,7 %) случаев, OR = 1,73 (от 0,2 до 14,63), р > 0,05.
Зависимость рецидива от возраста пациенток, в возрасте до 40 лет в I группе частота рецидива 6/241 (2,5 %) случаев, во II группе — 13/127 (10,2 %), OR = 0,24 (от 0,09 до 0,66), р < 0,05; в возрасте более 40 лет в I группе — 10/372 (2,7 %) случаев, во II группе — 12/244 (4,9 %) случаев, OR = 0,55 (от 0,23 до 1,28), р > 0,05.
Мультицентричность и рецидивы РМЖ: выявлен рецидив был только в I группе, и вероятность составила 6/142 (4,2 %), при уницентричной опухоли рецидив в I группе — 3/471 (0,6 %) и во II группе — 32/480 (6,7 %) случаев.
Общая выживаемость в группе с рецидивом составила 95,1 %, в группе без рецидива 98,4 %. В группе с ЛТ (I группа) общая выживаемость составила 98,4 %, метастазы диагностированы в 4,9 % случаев. В группе без ЛТ (II группа) общая выживаемость составила 98,2 %, метастазы выявлены в 5,9 % случаев. Общая выживаемость при I стадии 98,6 %, при IIА стадии — 98,2 %, при IIВ стадии — 97,8 %. Общая выживаемость в зависимости от ИГХ типов следующая: при люминальном типе А — 98,5 %, при люминальном В — 98,5 %, при тройном негативном — 97,9 %, при люминальном типе В HER2-позитивном — 99,1 %, при нелюминальном НЕR2-позитивном — 96,5 %.
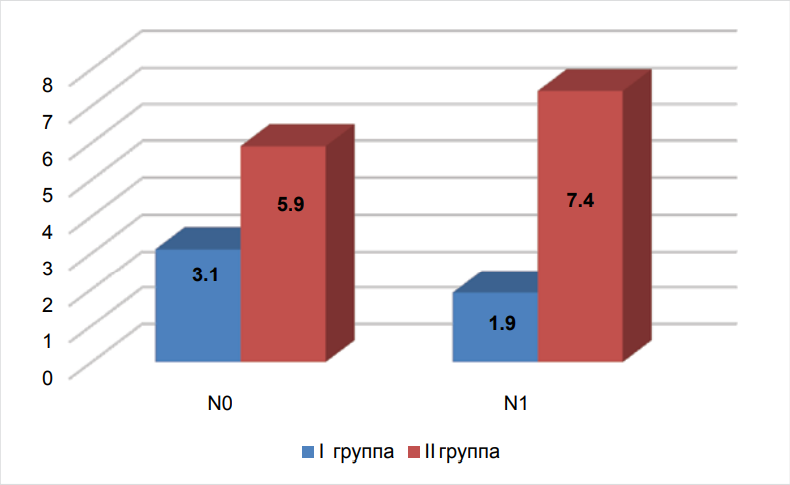
Рисунок 1. Рецидивы в зависимости от статуса лимфатических узлов при РМЖ в I и II группах
Figure 1. Recurrences depending on the status of lymph nodes in breast cancer in groups I and II
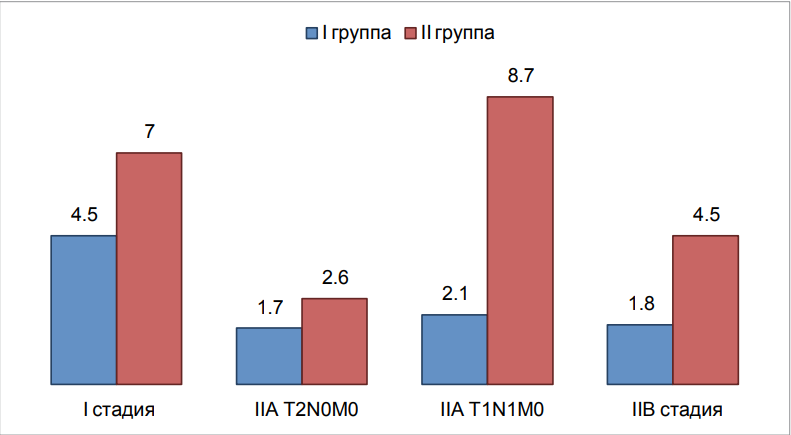
Рисунок 2. Зависимость рецидивов от стадии РМЖ в I и II группах
Figure 2. Dependence of recurrences on the stage of breast cancer in groups I and II
ОБСУЖДЕНИЕ
По данным G. G. Halfteck с соавторами, при анализе 8907 пациенток РМЖ, включенных с положительным рецепторным статусом и отрицательным НЕR2 статусом, данной группе пациенток выполнена радикальная мастэктомия из-за наличия метастазов в лимфатических узлах (N1). Из общего числа 3203 (36 %) пациенток получили адъювантную ЛТ, а 5704 (64 %) — нет. Во всей когорте 5-летняя общая выживаемость составила 97,5 % для пациенток, получавших ЛТ, и 96,8 % для тех, кто не получил (р = 0,063). То есть при отборе пациенток по благоприятным прогностическим факторам (люминальные подтипы по данным иммуногистохимического исследования) пациенткам можно не проводить ЛТ в адъювантном режиме [12].
В нашей работе при двухфакторном анализе (зависимость ЛТ и ИГХ подтипы) выявлен высокий процент рецидивов при нелюминальном/люминальном НЕR2 позитивных подтипах, что аналогично данным G. G. Halfteck et al.
N. Zhang и соавторы проанализировали 20 336 женщин в возрасте от 18 до 80 лет с диагнозом рака молочной железы и наличием от одного до трех положительных лимфатических узлов. Средний срок наблюдения составил 95 месяцев. Пациентки разделены на 2 группы: с ЛТ и без ЛТ.
Первоначально однофакторный анализ выявил клинико-патологические характеристики, сильно коррелирующие с частотой опухолево-специфической выживаемости и общей выживаемости в когортах с ЛТ и без нее, демонстрируя, что возраст, гистологическая структура, степень злокачественности, размер и статус ER и PR (все p < 0,05) связаны с ухудшением опухолево-специфической и общей выживаемости. У пациенток, не получавших ЛТ, количество пораженных узлов было обратно пропорционально связано со снижением опухолево-специфической выживаемости (два по сравнению с одним, ОР = 1,392; 95 % доверительный интервал (ДИ) 1,265–1,531; р < 0,001; три по сравнению с одним, ОР = 1,838; 95 % ДИ 1,650–2,048; р < 0,001) и общей выживаемости (два по сравнению с одним, ОР = 1,175; 95 % ДИ 1,090–1,265; р < 0,001; три против одного, ОР = 1,505; 95 % ДИ 1,380–1,640; р < 0,001). Тем не менее не было обнаружено корреляции между количеством положительных узлов и исходами выживаемости среди пациенток, получавших ЛТ, но инвазивные протоковые (по сравнению с инвазивными дольковыми) опухоли более высокой степени злокачественности, большего размера и отрицательный статус ER и PR оставались значимыми предикторами худших результатов опухолево-специфической и общей выживаемости в группе ЛТ [13].
В нашем исследовании при анализе гистологического типа и риска рецидива не было выявлено статистической разницы при инвазивном дольковом раке и ЛТ, а в группе инвазивного протокового рака разница при проведении ЛТ выявлена.
При двухфакторном анализе (ЛТ и состояние лимфатических узлов) выявлена следующая зависимость: при сN0 разница в группах статистически не достоверна, а при сN1 разница достоверна и риск рецидива РМЖ ниже в группе с ЛТ, что аналогично исследованию N. Zhang.
S. Wang et al. представили результаты влияния ЛТ после мастэктомии в лечении пациентов с раком молочной железы T1–2N1, целью этого исследования была оценка риска рецидива рака молочной железы T1–2N1 и эффективности ЛТ в группах пациентов низкого, среднего и высокого риска. Были проанализированы данные 1986 пациентов (1521 без ЛТ; 465 с ЛТ). Пациенты без PMRT были разделены на группы низкого, промежуточного и высокого риска по возрасту, локализации опухоли, количеству положительных узлов и лимфоваскулярной инвазии. 5-летняя частота локализованных регионарных рецидивов и отдаленных метастазов для трех групп риска была значительной и составила 2,5, 5,4 и 16,2 % (p< 0,001) соответственно и 4,9, 8,4 и 18,6 % (p < 0,001) соответственно. И в группе с низким риском необходимость ЛТ сомнительна.
Риск рецидива у пациенток с раком молочной железы T1–2N1, которые не получали ЛТ, составлял 7–15 % через 10 лет наблюдения [14].
В нашем исследовании не было разделения на группы с высоким, низким, средним риском рецидива. Но проведение лучевой терапии снизило риск развития рецидива на 3,5 % среди наших пациенток.
В открытое международное рандомизированное контролируемое исследование с параллельными группами (SUPREMO) включены женщины в возрасте 18 лет и старше с раком молочной железы среднего риска (определяемым как pT1–2N1, pT3N0 или pT2N0), перенесшие мастэктомию. Они были рандомизированы 1:1 для получения лучевой терапии грудной стенки (50 Гр в 25 фракциях, или радиобиологически эквивалентная доза 45 Гр в 20 фракциях, или 40 Гр в 15 фракциях) или отсутствия лучевой терапии. Рандомизация проводилась с перестановкой блоков различной длины, стратифицированных по центру, без маскирования пациентов или исследователей. Первичной конечной точкой является 10-летняя общая выживаемость. Также представлены 2-летние результаты (предварительно определенной вторичной конечной точки), где оценивают осложнения.
Постмастэктомическая лучевая терапия приводила к большему количеству локальных симптомов (на грудной стенке) в группе с ЛТ [15].
Безусловно, осложнения ЛТ носят локальный характер, в случае реконструктивных операций после ПМЭ частота осложнений составляет до 24 % [16].
Цель ЛТ: снизить частоту рецидивов РМЖ, но не «перелечить» пациенток, что приведет к увеличению числа осложнений и необходимости повторных хирургических вмешательств.
ЗАКЛЮЧЕНИЕ
При однофакторном анализе в исследуемых группах выполнение лучевой терапии снижает риск развития рецидива на 3,5 %. При двухфакторном анализе (зависимость ЛТ и ИГХ подтипы) выявлен высокий процент рецидивов при нелюминальном/люминальном НЕR2 позитивных подтипах. Интересен анализ гистологического типа и риска рецидива. Не было выявлено статистической разницы при инвазивном дольковом раке и ЛТ, а в группе инвазивного протокового рака разница при проведении ЛТ выявлена. Известно, что дольковый рак не чувствителен к ЛТ.
При положительном крае R1 рекомендуют проведение ЛТ, что подтвердилось в нашем исследовании, разница составила 14,5 %, и, безусловно, при наличии R1 необходима ЛТ в послеоперационном периоде.
При двухфакторном анализе (ЛТ и состояние лимфатических узлов) выявлена следующая зависимость: при сN0 разница в группах статистически не достоверна, а при сN1 разница достоверна и риск рецидива РМЖ ниже в группе с ЛТ. При анализе стадии РМЖ и риске рецидива статистическая разница выявлена только при IIА стадии сТ1N1 М0, ЛТ снижала риск рецидива РМЖ.
Статистическая разница в I и II группах была выявлена при степени злокачественности G2, уровне Кi-67 менее 50 %, наличии опухолевой эмболии и возрасте пациенток до 40 лет.
Мультицентричность опухолевых узлов является важным фактором, повышающим риск рецидива при органосохраняющих операциях, и не играет роли при выполнении ПМЭ/КМЭ. Лучевая терапия после ПМЭ/КМЭ снижает риск рецидива на 3,2 %, но общая выживаемость в группе с ЛТ и без ЛТ составила 98,4 и 98,2 %, разница статистически не достоверна. При четких критериях можно отказаться от проведения ЛТ при I–IIВ стадиях РМЖ в случае выполнения ПМЭ/КМЭ с реконструкцией.
В нашем исследовании критерии для назначения лучевой терапии в послеоперационном периоде следующие: молодой возраст пациенток, край резекции R1, люминальный/нелюминальный НЕR2-позитивный тип, сN1, наличие опухолевой эмболии.
Необходим дальнейший поиск предикторов риска рецидива РМЖ для выработки показаний к лучевой терапии после ПМЭ/КМЭ при I–IIВ стадиях.
И, безусловно, качество жизни пациенток выше при реконструкции молочной железы после ПМЭ/КМЭ по сравнению с мастэктомией.
Список литературы
1. Рассказова Е.А., Зикиряходжаев А.Д., Каприн А.Д. Рецидивы и отдаленные метастазы после радикальных подкожных и кожесохранных мастэктомий с реконструкцией при раке молочной железы. Врач. 2023:34(10):58–62. DOI: 10.29296/25877305-2023-10-11
2. Huo X., Li J., Zhao F., Ren D., Ahmad R., Yuan X., et al. The role of capecitabinebased neoadjuvant and adjuvant chemotherapy in early- stage triple-negative breast cancer: a systematic review and meta-analysis. BMC Cancer. 2021;21(1):78. DOI: 10.1186/s12885-021-07791-y
3. Ортабаева Д.Р., Зикиряходжаев А. Д., Рассказова Е. А., Сарибекян Э.К., Каприн А.Д. Отдаленные онкологические результаты органосохраняющего лечения без послеоперационной лучевой терапии у больных ранним раком молочной железы старше 65 лет. Опухоли женской репродуктивной системы. 2022;18(3):24–8. DOI: 10.17650/1994-4098-2022-18-3-24-28
4. Hong M.J., Lum S.S., Dupont E., Howard-McNatt M., Chiba A., Levine E.A., et al. Omission of radiation in conservative treatment for breast cancer: opportunity for de-escalation of care. J Surg Res. 2022;279:393– 7. DOI: 10.1016/j.jss.2022.06.036
5. Verma R., Chandarana M., Barrett J., Anandadas C., Sundara Rajan S. Post-mastectomy radiotherapy for women with early breast cancer and one to three positive lymph nodes. Cochrane Database Syst Rev. 2023;6(6):CD014463. DOI: 10.1002/14651858.CD014463.pub2
6. Jafer F., Malki S., Akram M., Gulwarisdotter T., Karakatsanis A., Valachis A. Postmastectomy radiation therapy in breast cancer patients with micrometastatic disease in sentinel node dissection: A cohort study and meta-analysis. Clin Transl Radiat Oncol. 2024;46:100770. DOI: 10.1016/j.ctro.2024.100770
7. Zeidan Y.H., Habib J.G., Ameye L., Paesmans M., de Azambuja E., Gelber R.D., et al. Postmastectomy radiation therapy in women with T1-T2 tumors and 1 to 3 positive lymph nodes: analysis of the Breast International Group 02-98 Trial. Int J Radiat Oncol Biol Phys. 2018;101(2):316–24. DOI: 10.1016/j.ijrobp.2018.01.105
8. Lai S.F., Huang C.S., Kuo S.H. Whether adjuvant radiotherapy is desired for postmastectomy patients with T1-T2 tumors and 1-3 positive axillary lymph nodes who received modern systemic therapy? Transl Cancer Res. 2019;8(Suppl 2):S110–4. DOI: 10.21037/tcr.2018.11.18
9. Золотой стандарт профилактики, диагностики, лечения и реабилитации больных РМЖ. М.; 2024.
10. Дуадзе И.С., Каприн А.Д., Зикиряходжаев А. Д., Решетов И.В., Усов Ф.Н., Рассказова Е.А. и др. Влияние лучевой терапии на развитие осложнений при одномоментной аутологичной реконструкции молочной железы DIEP-лоскутом у больных раком молочной железы. Современная онкология. 2023:25(1):68– 72. DOI: 10.26442/18151434.2023.1.202080
11. Munder B., Andree C., Witzel C., Fertsch S., Stambera P., Schulz T., et al. The DIEP flap as well-established method of choice for autologous breast reconstruction with a low complication rate — retrospective single-centre 10-year experience. Geburtshilfe Frauenheilkd. 2020;80(6):628–38. DOI: 10.1055/a-1116-2102
12. Halfteck G.G., Polychronopoulou Y.E., Haque W., Weiser R., Hatch S.S., Klimberg V.S. De-escalation of post-mastectomy irradiation in hormone receptor-positive breast cancer with one to three positive nodes. Ann Surg Oncol. 2023;30(13):8335–43. DOI: 10.1245/s10434-023-14155-2
13. Zhang N., Zhang J., Zhang H., Liu Y., Zhao W., Wang L., Individualized Prediction of survival benefit from postmastectomy radiotherapy for patients with breast cancer with one to three positive axillary lymph nodes. Oncologist. 2019;24(12):e1286–93. DOI: 10.1634/theoncologist.2019-0124
14. Wang S., Wen G., Tang Y., Yang Y., Jing H., Wang J., et al. Effectiveness of the AJCC 8th edition staging system for selecting patients with T1- 2N1 breast cancer for post-mastectomy radiotherapy: a joint analysis of 1986 patients from two institutions. BMC Cancer. 2020;20(1):792. DOI: 10.1186/s12885-020-07267-5
15. Velikova G., Williams L.J., Willis S., Dixon J.M., Loncaster J., Hatton M., et al. Quality of life after postmastectomy radiotherapy in patients with intermediate-risk breast cancer (SUPREMO): 2-year follow-up results of a randomised controlled trial. Lancet Oncol. 2018;19(11):1516– 29. DOI: 10.1016/S1470-2045(18)30515-1
16. Ульрих Д.Г., Криворотько П.В., Брянцева Ж.В., Песоцкий Р.С., Бондарчук Я.И., Амиров Н.С. и др. Реконструктивно- пластические операции в комбинированном лечении рака молочной железы: факторы риска осложнений и реконструктивных неудач. Онкология. Журнал им. П.А. Герцена. 2024;13(3):13–9. DOI: 10.17116/onkolog20241303113
Об авторах
Е. А. РассказоваРоссия
Рассказова Елена Александровна — к.м.н., научный сотрудник, отделение онкологии и реконструктивно-пластической хирургии молочной железы и кожи
А. Д. Зикиряходжаев
Россия
Зикиряходжаев Азиз Дильшодович — д.м.н., профессор, отделение онкологии и реконструктивно-пластической хирургии молочной железы и кожи
Москва
Рецензия
Для цитирования:
Рассказова Е.А., Зикиряходжаев А.Д. Деэскалация лучевой терапии в плане лечения больных раком молочной железы I–IIВ стадий после подкожных/кожесохранных мастэктомий с одномоментной реконструкцией. Креативная хирургия и онкология. 2024;14(3):235-242. https://doi.org/10.24060/2076-3093-2024-14-3-235-242
For citation:
Rasskazova Е.А., Zikiryakhodzhaev A.D. De-escalation of Radiation Therapy in the Treatment Plan of Patients with Stage I-IIV Breast Cancer after Subcutaneous/Skin-Sparing Mastectomies with Immediate Reconstruction. Creative surgery and oncology. 2024;14(3):235-242. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-3-235-242


































