Перейти к:
Хирургическое лечение первичных опухолей позвоночника
https://doi.org/10.24060/2076-3093-2024-14-3-243-254
Аннотация
Первичные опухоли позвоночника встречаются значительно реже, чем метастатические поражения, однако их хирургическое лечение представляет собой сложную и многогранную задачу. На выбор показаний и сроков хирургического вмешательства влияют многочисленные факторы, включая неврологический статус пациента, гистологические характеристики опухоли, ее локализацию, стабильность позвоночного столба и наличие сопутствующих заболеваний. При значительной компрессии спинного мозга, быстром прогрессировании неврологического дефицита или выраженной нестабильности позвоночного столба может потребоваться неотложное хирургическое вмешательство. В случаях, когда спинномозговой канал не поражен, первым этапом лечения должна быть биопсия для точного определения гистологии опухоли. Некоторые виды опухолей, такие как гигантоклеточная опухоль, остеобластома, хордома и хондросаркома, требуют полного удаления. Тем не менее выполнение широкой резекции единым блоком часто затруднено изза компрессии сосудистых и нервных структур. Современные подходы к хирургическому лечению первичных опухолей позвоночника включают использование малоинвазивных техник, которые значительно улучшают послеоперационное восстановление и снижают риск осложнений. Эти методы, изначально применявшиеся для лечения дегенеративных заболеваний позвоночника и травм, продемонстрировали свою эффективность и в хирургии опухолей. Адаптация хирургической стратегии в зависимости от гистологии и локализации опухоли, а также интеграция малоинвазивных методов может улучшить выживаемость и качество жизни пациентов. В данной обзорной статье представлены новейшие достижения в области хирургического лечения первичных опухолей позвоночника, обсуждаются текущие методики и стратегии, а также перспективы дальнейших исследований в этой области.
Ключевые слова
Для цитирования:
Бейлерли О.А., Гареев И.Ф., Мусаев Э.Р., Вонг Ч., Симфукве К. Хирургическое лечение первичных опухолей позвоночника. Креативная хирургия и онкология. 2024;14(3):243-254. https://doi.org/10.24060/2076-3093-2024-14-3-243-254
For citation:
Beylerli O.A., Gareev I.F., Musaev E.R., Wang Ch., Simfukwe K. Surgical Treatment of Primary Spinal Tumors. Creative surgery and oncology. 2024;14(3):243-254. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-3-243-254
ВВЕДЕНИЕ
Первичные новообразования позвоночника являются редким явлением. Хотя некоторые из них, такие как гемангиомы тел позвонков, встречаются чаще, лишь немногие требуют хирургического вмешательства [1]. Первичные опухоли позвоночника составляют 5 % всех первичных опухолей костей опорно-двигательного аппарата с частотой от 0,8 до 8,0 случая на 100 000 населения [1]. Эти опухоли включают широкий спектр гистологических типов и могут происходить из различных структур: спинного мозга (внутриаксиальные или интрамедуллярные), мозговых оболочек (внутридуральные экстрамедуллярные) или экстрадуральных мягких тканей и костных структур (экстрадуральные) [1][2]. В хирургической практике чаще всего встречаются доброкачественные опухоли, такие как остеоид-остеома, остеобластома, новообразования оболочек нервов, аневризматическая костная киста и доброкачественные фиброзные опухоли. Злокачественные первичные опухоли позвоночника встречаются еще реже. К таким новообразованиям относятся хордома, хондросаркома, остеогенная саркома, саркома Юинга, злокачественные опухоли оболочек периферических нервов и плазмоцитома (табл. 1) [3–7].
Первичные опухоли позвоночника чаще встречаются в грудном и пояснично-крестцовом отделах, чем в шейном отделе позвоночника. Эти опухоли возникают в соответствии с типичным анатомическим распределением внутри позвонка. В целом, злокачественные опухоли чаще встречаются в передней колонне позвоночного столба, а доброкачественные опухоли — в задней. Соответствующее лечение может быть наблюдательным (латентные поражения по Enneking) или хирургическим (большинство других поражений) в зависимости от болевого синдрома, нестабильности позвоночника, неврологического дефицита и естественного течения поражения [3–5]. Целями хирургического вмешательства являются полная резекция единым блоком (en-bloc) пораженного участка, где это возможно, с сохранением неврологической функции. Если рассматривается хирургическое вмешательство, подход к опухоли определяется ее расположением в позвоночном канале. Например, задний доступ позволяет идентифицировать твердую мозговую оболочку и обнажить нервные корешки. Этот подход обычно используется при опухолях в задней колонне позвоночного столба или для выявления опухолей внутри твердой мозговой оболочки. Возможна декомпрессия на нескольких уровнях и при необходимости может быть выполнена многоуровневая сегментарная фиксация. Передний доступ отлично подходит для опухолей в передней колонне позвоночного столба. Этот подход также позволяет реконструировать дефекты, вызванные удалением тел позвонков, и позволяет размещать устройства фиксации короткого сегмента [8–10]. Опухоли грудного и поясничного отделов позвоночника, которые поражают как передние, так и задние колонны позвоночного столба, могут быть проблемой для резекции единым блоком. Нередко для хирургического лечения этих сложных поражений используется задний доступ, за которым следует отдельно этапный передний доступ [8]. В данной работе будут освещены и представлены самые последние достижения в области хирургического лечения первичных опухолей позвоночника.
Вид | Характерные особенности | Локализация | Возраст, годы | Пол | % поражения позвоночника по сравнению с другими анатомическими структурами | Нейровизуализация |
Остеосаркома | Может быть связано с болезнью Педжета и предшествующей лучевой терапией, высоким уровнем щелочной фосфатазы, частыми легочными метастазами в сопровождении пневмоторакса | В 79 % случаев задние структуры, в 17 % случаев вовлечение соседних позвонков и в 84 % случаев прорастание в позвоночный канал | 30 | Муж/Жен = 1 | 0,6–3,2 | Агрессивная, инвазивная, деструктивные изменения костной ткани с поражением мягких тканей |
Хондросаркома | Возможно злокачественное перерождение остеохондромы в энхондрому | Грудной отдел | 40–50 | Муж/Жен = 2:1 | 3–12 | Деструктивное образование с хондроидным матриксом или без него (кольца и дуги кальцификации), участки лизированной костной ткани |
Саркома Юинга | Локализованная боль. Высокие цифры СОЭ и остеомиелиты | Все отделы позвоночника с преобладанием в крестце. Задние структуры и тела позвонков | 10–30 | Муж/Жен = 2:1 | 3–10 | Агрессивная, инвазивная, деструктивные изменения костной ткани с поражением мягких тканей |
Лангергансоклеточный гистиоцитоз | Локализованная боль и отек, иногда, деформация костей и патологические переломы костей | Подвижные отделы позвоночника с преобладанием грудного отдела | Старше 20 | Муж/Жен = 1 | 6 | Интактые пластины позвонков. |
Остеоид-остеома | Боль усиливается ночью и облегчается салицилатами | В 75 % случаев задние структуры позвоночника с преобладанием в шейных и поясничных отделах; реже в грудном отделе и крестец | 10–20 | Муж/Жен = 2–3/1 | 10 | Рентгенопрозрачные зоны остеолизиса с зонами уплотнения за счет участков остеосклероза и отека |
Остеобластома | Агрессивность, неспецифическая локальная боль | В 85 % случаев задние структуры позвоночника с преобладанием в шейных отделах; в основном затронуты тела позвонков | 10–30
| Муж/Жен = 2–2,5/1 | 30–40 | Многоочаговость, остеолизис (остеолитический характер > 2 см со склеротическим кольцом), экспансивный рост, формирование вторичных аневризматических костных кист |
Аневризматическая костная киста | Боль усиливается ночью, возможны патологические переломы | В 70–90 % случаев задние структуры позвоночника с преобладанием в шейном и грудном отделах; в основном затронуты тела позвонков | Старше 20 | Муж/Жен = 2:1 | 12–30 | Экспансивный рост, полости с серозной жидкостью |
Эностоз (костный островок) | Без болевого синдрома | Любой отдел позвоночника. Прилегает к эндостальной поверхности кортекса | Любой возраст | Муж/Жен = 1:4 | - | Края с шипами, окружающие трабекулярные кости в норме |
Гигантоклеточная опухоль | Агрессивность, рецидив опухоли часто наблюдается после внутриочаговой или неполной резекции | Крестец, в основном затронуты тела позвонков | 20–40 | Муж/Жен = 1:2,5 | 7–15 | Экспансивный рост, формирование вторичных аневризматических костных кист |
Гемангиома | Агрессивное течение у женского пола, патологические переломы со сдавлением спинного мозга и его структур | Любой отдел позвоночника. Задние структуры позвоночника, в основном затронуты тела позвонков | Любой возраст | Муж/Жен = 1:4 | - | Хорошо очерченное поражение с грубыми вертикальными трабекулами: «белые точки в горошек» |
Хондрома | Гистологически: дольки, пласты и тяжи светлых клеток с интрацитоплазматическими вакуолями (физалифорные клетки). Отдаленные метастазы встречаются редко, но могут быть вторичные очаги поражений | Крестец и копчик | 30–60 | Муж/Жен = 2:1 | - | Деструктивное образование по средней линии с множественными перегородками, кальцификация, сдавление мягких тканей |
Остеохондрома | Поражение в виде «цветной капусты». Компрессия спинного мозга встречается редко | Преобладают поражения шейного отдела, в основном затронуты остистый и поперечный отростки и тело позвонка | 20–40 | Муж/Жен = 3:1 | Менее 5 | На ножке, экзофитный рост, наличие «хрящевой крышки» |
Таблица 1. Виды и особенности первичных опухолей позвоночника
Table 1. Types and features of primary spinal tumors
Принципы хирургического вмешательства при первичных опухолях подвижных сегментов позвоночника и крестца
Принципы хирургического лечения первичных опухолей позвоночника в значительной степени основываются на критериях, разработанных Enneking. Эта система классификации учитывает биологическую агрессивность опухоли, ее местное распространение, а также наличие или отсутствие метастазов. Подход Enneking сочетает гистологические, рентгенологические и клинические признаки для определения стратегии резекции первичных опухолей позвоночника. Согласно критериям Enneking, важно учитывать несколько ключевых факторов при планировании хирургического вмешательства. Биологическая агрессивность опухоли указывает на скорость ее роста и потенциал для инвазии в окружающие ткани. Локальное распространение опухоли оценивается на основании данных визуализационных методов, таких как МРТ и КТ, что позволяет хирургу понять степень вовлечения костных и мягкотканевых структур. Наличие метастазов также играет решающую роль в выборе тактики лечения, так как оно указывает на системное распространение опухолевого процесса. Комбинируя эти гистологические, рентгенологические и клинические данные, критерии Enneking помогают определить оптимальный подход к резекции опухоли, будь то радикальная резекция с широкими границами или более консервативное вмешательство. Эта систематизация способствует улучшению прогнозов и уменьшению риска рецидива, что делает ее незаменимой в современной онкологической хирургии позвоночника (табл. 2) [11][12].
Эта классификация предоставляет хирургам рекомендации относительно объема хирургического вмешательства, необходимого для достижения эффективного контроля над заболеванием. Ее применение при опухолевых поражениях аппендикулярного скелета хорошо документировано и широко признано. В частности, для первичных опухолей позвоночника часто используются методы кюретажа или частичного иссечения, известного как внутриочаговая резекция [13]. Тем не менее данные подходы имеют явные недостатки, такие как высокий риск контаминации опухолевыми клетками окружающих анатомических структур и возможность оставления остаточной опухолевой ткани. Это обусловлено сложностью четкого различения опухолевых и здоровых тканей во время операции. Такие факторы могут привести к неполному удалению опухоли и, как следствие, к высокой частоте рецидивов, что особенно критично при злокачественных опухолях позвоночника [14][15]. Резекция единым блоком представляет собой метод удаления всей опухоли вместе с капсулой, не нарушая ее целостности. Этот подход требует резекции пораженного участка в пределах здоровой ткани, обеспечивая минимизацию риска оставления опухолевых клеток [10].
Систематический обзор, проведенный Yamazaki и коллегами, показал, что использование внутриочаговых методов резекции было связано с повышенным риском локальных рецидивов, которые, в свою очередь, ассоциировались с повышенной смертностью [16]. В одном из исследований, включавшем 147 пациентов, Fisher и коллеги продемонстрировали улучшение показателей выживаемости и снижение частоты локальных рецидивов при удалении злокачественных новообразований позвоночника согласно принципам классификации Enneking [17]. Многочисленные исследования подтверждают целесообразность использования резекции единым блоком при лечении таких опухолей, как хордома, хондросаркома, саркома Юинга и остеосаркома [18–20]. Эти данные подчеркивают важность подхода Enneking в хирургии позвоночника, так как он позволяет достичь более благоприятных клинических исходов, уменьшая вероятность рецидива и улучшая общую выживаемость пациентов. Важно отметить, что успешность применения данного метода зависит от тщательной предоперационной оценки и планирования, а также от высокой квалификации хирурга, выполняющего операцию.
Используя номенклатуру, разработанную Французской федерацией онкологических центров саркомной группы (FNCLCC), и следуя рекомендациям Американского объединенного комитета по раку (UICC), резекционные края при первичных опухолях позвоночника подразделяют на три категории: R0 (полностью чистые края), R1 (макроскопически полное удаление, но с микроскопическими остатками опухоли) и R2 (наличие макроскопических остатков опухолевой ткани) [21]. Основной целью всех операций по удалению опухоли является достижение состояния R0, то есть резекция с чистыми краями. Для оценки возможности полного удаления опухоли применяется поэтапный подход, который помогает определить, насколько обширной должна быть резекция для достижения этой цели и насколько оправданным является ее объем с точки зрения последствий для пациента. Существуют определенные противопоказания для полного удаления опухоли. Например, чрезмерное распространение опухоли на другие анатомические структуры рядом с позвоночником, такие как крупные кровеносные сосуды, пищевод или органы забрюшинного пространства, а также значительное распространение опухоли в позвоночный канал, что может привести к резекции типа R1 или даже R2 [22]. В таких случаях необходимо тщательно взвесить преимущества и недостатки различных вариантов резекции. Решение может состоять в том, чтобы выполнить краевую резекцию типа R1 (с субмиллиметровыми краями) в позвоночном канале, частично полагаясь на различные методы неоадъювантного лечения. Резекция твердой мозговой оболочки вместе с опухолью проводится редко, так как это существенно увеличивает риск неврологического дефицита и практически всегда осложняет послеоперационный период [14]. Таким образом, успешное удаление первичных опухолей позвоночника требует не только точного планирования и выполнения операции, но и комплексного подхода, включающего предоперационную оценку и возможное использование дополнительных методов лечения для минимизации риска рецидива и улучшения прогнозов для пациента.
Существуют также другие классификации распространения первичных опухолей в позвоночнике. Самый известный из них — Weinstein и Boriani [23]. Позвонок разделен на 12 полумесяцев на осевом срезе, обозначенных цифрами от 1 до 12 по часовой стрелке, с зонами 1 и 12, расположенными слева и справа от остистого отростка соответственно. Далее позвонок делится на 5 концентрических колец с дуральным мешком посередине. Если двигаться от периферии к центру, А — внекостные мягкие ткани, В — периферический внутрикостный слой, С — глубокий внутрикостный слой, D — экстрадуральный внекостный слой, Е — интрадуральный внекостный слой. Б Biagini же предложили алгоритм хирургической резекции первичной опухоли, основанный на количестве пораженных сегментов (рис. 1) [24].
В итоге предоперационное стадирование используется для определения хирургической стратегии и навыков, которые потребуются для удаления опухоли. Эта оценка также помогает оценить риски осложнений и риск летального исхода, определить течение послеоперационного периода и предоставить при этом пациенту и его семье полную информацию о патологии. Эта информация должна быть честной и подробной, без «рисования мрачной картины» ситуации, которая может привести к отказу пациента от операции и последующему риску того, что опухоль станет нерезектабельной. Исследования, приведенные выше, подтверждают, что соблюдение принципов, основанных на доказательствах, достижимо, если правильно определять стадирование опухоли, что это возможно и приводит к значительному снижению частоты рецидивов и смертности.
Доброкачественные первичные опухоли позвоночника | ||
Стадирование | Описание | Лечение |
S1 (латентный): нет роста | Хорошо выраженная капсула | Неоперативное (если не требуется декомпрессия/стабилизация) |
S2 (активный): медленный рост | Тонкая капсула; реактивная псевдокапсула | Внутриочаговый кюретаж |
S3 (агрессивный): быстрый рост | Капсула развита плохо; широкая реактивная псевдокапсула | Краевая резекция единым блоком |
Злокачественные первичные опухоли позвоночника | ||
Стадирование | Описание | Лечение |
Низкая степень (I): IA (ограничено позвонком); IB (паравертебральное распространение) | Широкая псевдокапсула | Широкая резекция единым блоком |
Высокий класс (II): IIA (ограничена позвонком); IIB (паравертебральное расширение) | Псевдокапсула инфильтрирована опухолью | Широкая резекция единым блоком с адъювантной терапией |
Высокая степень с метастазами (III) | Отдаленные метастазы | Паллиативная хирургия и адъювантная терапия |
Таблица 2. Соображения относительно хирургического стадирования первичных опухолей позвоночника, основанные на модифицированной классификации Enneking
Table 2. Surgical staging of primary spinal tumors based on modified Enneking classification
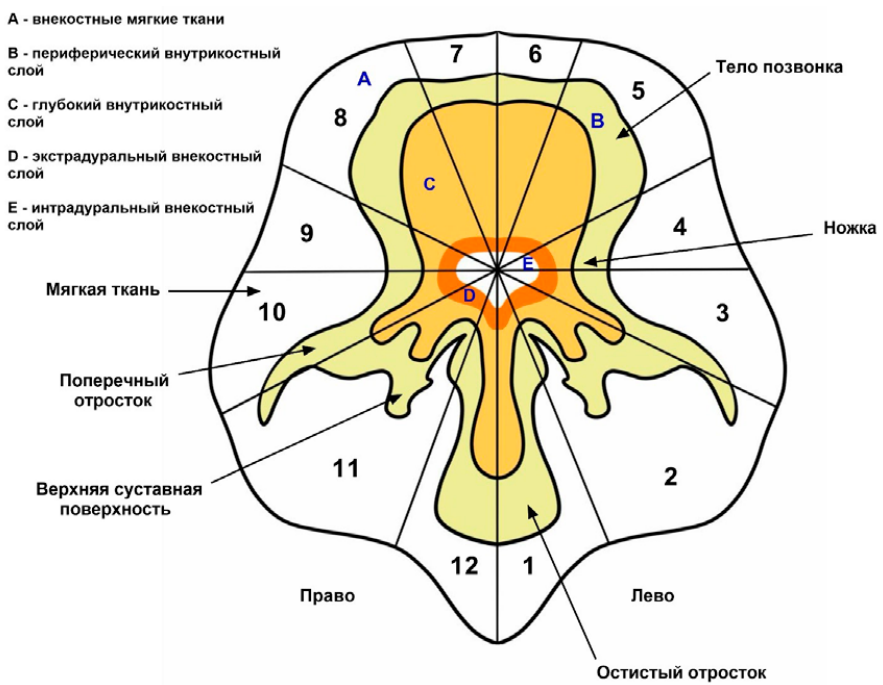
Рисунок 1. Классификация Weinstein = Boriani = Biagini
Fig. 1. Weinstein — Boriani — Biagini (WBB) classification
Какую стратегию хирургического лечения следует использовать?
Как уже было сказано, основной стратегией хирургического лечения первичных опухолей позвоночника является возможность R0 резекции костной ткани с сохранением спинного мозга и его структур в сочетании с реконструкцией для обеспечения лучшего заживления дефектов в позвоночнике. В зависимости от распространения опухоли костную ткань необходимо резецировать в области здоровой ткани, а распространение на мягкие ткани резецировать с достаточными краями. На определенных уровнях позвоночника это потребует также резекции париетальной, сосудистой, легочной ткани или других элементов забрюшинного пространства [25].
Резекция единым блоком означает полное удаление опухоли как единого фрагмента. Вертебрэктомия — резекция одной или нескольких частей одного или нескольких позвонков позвоночного столба. В свою очередь, вертебрэктомия имеет определенные подтипы. В таблице 3 представлены основные типы резекций, используемых при хирургическом лечении первичных опухолей позвоночника [26][27].
Типы | Описание |
Гемивертебрэктомия | Состоит из сагиттальной остеотомии позвонка с захватом суставной поверхности, ножки и части тела позвонка с одной стороны. Можно удалить одну треть, половину или две трети тела позвонка. Этот тип резекции сохраняет непрерывность кости на контралатеральной стороне |
Тотальная вертебрэктомия | Удаляется весь позвонок. Очень часто оправданно выполнение резекции тела позвонка единым блоком с прилежащими ножками и удалением задней дуги. Это приводит к нарушению целостности позвоночника (нестабильность позвоночника) |
Тотальная вертебрэктомия единым блоком | Считается неправильным определением, за исключением случаев, когда приходиться «жертвовать» спинным мозгом и/или нервными корешками. В редких опубликованных отчетах об этой процедуре, за исключением случаев параплегии, имеется низкая выживаемость в постоперационном периоде |
Резекция задних структур позвонка | Удаление единым блоком остистого отростка, пластинки, фасеточных суставов и части ножек позвонка |
Костотрансверзэктомия | Данный тип представляет собой удаление единым блоком всего или части ребра с внесуставным рассечением реберно-позвоночного и реберно-поперечного суставов. Чаще всего это выполняется сзади наперед, но также может выполняться спереди назад. Это частичная вертебрэктомия, которая оправданна при опухолях грудной стенки или легких, имеющих высокий риск распространения на позвоночник. Однако существуют серьезные последствия после применения данной техники: высокий риск кровоизлияний и ликвореи или даже повреждения нервного корешка в ходе операции |
Таблица 3. Типы резекций позвонков при хирургическом лечении первичных опухолей позвоночника
Table 3. Types of vertebral resections in the surgical treatment of primary spinal tumors
Хирургические техники и анатомические особенности
Доступно множество хирургических техник хирургического лечения первичных опухолей позвоночника и/или связанных с ними симптомов. В целом есть две категории: 1) малоинвазивная хирургия, которая включает в себя относительно небольшие разрезы и более короткое время восстановления; и 2) открытая хирургия, требующая больших разрезов и обширного повреждения тканей, и c более длительным периодом восстановления. Первичные опухоли позвоночника могут вызывать компрессию спинного мозга и патологические переломы, а также привести к изнурительным хроническим болям и в целом ухудшению неврологического статуса [28][29]. Хирургическая декомпрессия и стабилизация позвоночника являются неотъемлемыми компонентами лечения первичных опухолей позвоночника [30][31]. Целью стабилизация позвоночника является стабилизация позвоночника путем сращивания соседних позвонков и уменьшения деформации, которая могла возникнуть. Хирурги обычно выбирают наилучший метод стабилизации в зависимости от типа опухоли, степени разрушения кости, общего состояния пациента и предполагаемого лечения опухоли (например, химиотерапия). Существуют различные методы стабилизации позвоночника. Хотя целью является слияние соседних позвонков, нехирургическое лечение опухоли, например химиотерапия, может помешать заживлению кости, необходимому для сращения. Стабильность позвоночника в этих случаях может зависеть от прочной механической фиксации с помощью имплантатов, таких как титановые винты, пластины, стержни и межпозвонковые кейджи [30][32].
Декомпрессионная хирургия позвоночника включает различные оперативные методы, предназначенные для уменьшения давления на спинной мозг и его структуры. Эти методы классифицируются следующим образом: 1) корпэктомия — процедура, при которой удаляется тело позвонка вместе с межпозвоночными дисками; 2) ламинэктомия, также известная как задняя декомпрессия, — удаление небольшой части костных дуг, образующих позвоночный канал, которая называется пластинкой; и 3) костотрансверзэктомия — удаление части ребра вместе с поперечным отростком позвонка. Помимо этих методов, существуют и другие способы декомпрессии позвоночника, и нередко несколько методик комбинируются в рамках одной операции. Выбор наиболее подходящего метода декомпрессии зависит от ряда факторов, включая анатомическое расположение опухоли и общее состояние здоровья пациента. Корпэктомия эффективна при значительном сдавлении спинного мозга, когда необходимо устранить целый сегмент позвоночника. Ламинэктомия применяется для облегчения доступа к спинному мозгу и нервным корешкам путем удаления задней части позвонка. Костотрансверзэктомия, в свою очередь, позволяет удалить костные структуры, создающие компрессию, с бокового подхода. В некоторых случаях может потребоваться сочетание нескольких методов декомпрессии для достижения наилучшего результата. Это особенно актуально, когда опухоль имеет сложное расположение или когда необходимо минимизировать хирургическое вмешательство, чтобы снизить риски для пациента. Таким образом, выбор метода декомпрессии позвоночника является комплексным процессом, требующим индивидуального подхода и тщательного планирования, учитывающего все аспекты состояния пациента и характеристики опухоли [31].
Как уже упоминалось, при предоперационном планировании необходимо учитывать местоположение, морфологию и биологические характеристики опухоли. Более 65 % опухолей поражают тело позвонка и переднюю колонну позвоночного столба, в то время как менее 33 % локализуются в задней дуге позвонка [33]. Основываясь на этом распределении, передний доступ к опухолям, расположенным в передней колонне позвоночного столба, стал «золотым стандартом» [34]. Использование заднего доступа для передних опухолей требует значительной резекции задних элементов позвонка и многоуровневой стабилизации, что делает эту процедуру более сложной. Однако благодаря знакомству большинства хирургов с этим доступом и его удобству задний доступ остается популярной техникой [35]. В общем, анатомические особенности каждой области позвоночника определяют наиболее подходящий хирургический подход. Например, задние доступы чаще всего применяются в верхнем шейном отделе позвоночника, тогда как передние доступы предпочтительны в субаксиальном шейном отделе. В некоторых случаях могут использоваться комбинированные передние и задние доступы, особенно если это необходимо для обеспечения стабильности позвоночника после резекции опухоли и зависит от качества костной ткани пациента. В верхнегрудном отделе позвоночника до уровня Th5 передние доступы могут быть осложнены риском повреждения магистральных сосудов. Тем не менее при необходимости адекватного доступа может быть выполнена стандартная стернотомия [36–38]. Таким образом, выбор подхода к резекции опухоли требует тщательного анализа анатомических и клинических факторов для обеспечения наилучших исходов для пациента.
Малоинвазивные методы хирургического лечения
Первоначально малоинвазивные методы были популярны в хирургии дегенеративных заболеваний позвоночника и травм, но после стали широко применяться в хирургии опухолей и деформаций позвоночника. Среди пациентов со злокачественными опухолями позвоночника сведение к минимуму прерывания или задержки системной и лучевой терапии играет решающую роль в улучшении выживаемости. Использование малоинвазивных методик, облегчающих послеоперационное восстановление и снижающих риск осложнений, может улучшить выживаемость пациентов и сыграть роль в их скором возвращении к нормальной жизни с продолжением консервативной терапии. Хирургическое вмешательство при первичных опухолях может быть предпринято с лечебной целью, в то время как хирургическое вмешательство при метастатических опухолях проводится для облегчения симптомов (паллиативная помощь). Ключевыми компонентами малоинвазивной хирургии при опухолях позвоночника являются разработка чрескожных (перкутанных) инструментальных систем, использование трубчатых и расширяемых ретракторов, облегчающие трансмускулярные доступы, и нейронавигация. Малоинвазивная хирургия имеет явные преимущества для пациентов с опухолями позвоночника [39, 40]. У пациентов с первичными опухолями минимальное нарушение мышечных и костных структур позволяет избежать ятрогенной нестабильности позвоночника и необходимости спондилодеза, а также снизить риск хронической боли. Поэтому в нашем распоряжении есть широкий спектр хирургических техник, где основные осложнения после их применения и возможности которых кратко изложены в таблице 4.
Техника | Возможности | Осложнения |
Вертебро- и кифопластика | Коррекция деформации (кифопластика) и обезболивание | Внутриканальная утечка цемента (9,2–78,5 % случаев), радикулиты и тромбоэмболия легочной артерии (ТЭЛА) |
Фиксация чрескожными транспедикулярными винтами | Стабилизация позвоночника | Неправильная установка инструментария (<10 % случаев) и нестабильность винтов |
Цементная аугментация позвонка | Доминирующий метод | Утечка цемента (9–39 % случаев) и тромбоэмболия легочной артерии (ТЭЛА) |
Задний открытый путь | Декомпрессия, транспедикулярная вертебрэктомия | Инфекция, кровотечение и болевой синдром: меньше, чем при традиционной открытой хирургии |
Передний открытый путь | Корпэктомия, вентральная (передняя) стабилизация позвоночного столба | Кровотечение, пневмоторакс и илеус |
Таблица 4. Осложнения и возможности в зависимости от основных техник по хирургическогому лечению первичных опухолей позвоночника
Table 4. Complications and potential of the main techniques for surgical treatment of primary spinal tumors
Стабилизация позвоночника
Стабилизация позвоночника служит отдельным хирургическим показанием, независимо от целей. Чтобы упростить оценку механической стабильности и унифицировать процесс принятия решений и отчетности в разных учреждениях, исследовательская группа по онкологии позвоночника разработала систему оценки: шкалу неопластической нестабильности позвоночника (SINS) [41]. SINS получила широкое распространение и используется для определения стабильных, нестабильных и промежуточных показателей, что в конечном итоге ускоряет направление пациентов для оценки и лечения нестабильности позвоночника. Пациентам с механической нестабильностью, но без выраженного эпидурального распространения радиорезистентных опухолей и без механической радикулопатии не требуется хирургическая декомпрессия, и их можно лечить только стабилизацией [42]. Цементная и инструментальная стабилизация являются доминирующими методами стабилизации позвоночника. Морфология патологического перелома определяет, будет ли достаточна только аугментация позвонка цементом или же будет показана дополнительная инструментальная стабилизация.
Чрескожная стабилизация является малоинвазивным и эффективным методом. Применение транспедикулярных винтов для чрескожной фиксации позволяет с минимальной травматизацией стабилизировать патологические переломы, которые не поддаются самостоятельной чрескожной аугментации цементом [43]. Этот метод требует минимальной травматизации мягких тканей, связанной с доступом, по сравнению с открытой задней установкой инструментов, что позволяет избежать некроза мышц, деваскуляризации и денервации, а также свести к минимуму кровопотерю.
Описаны различные методы радиографического или навигационного контроля при размещении чрескожных транспедикулярных винтов [44]. Чрескожная аугментация позвонка цементом обеспечивает надежное обезболивание у пациентов с простыми компрессионными переломами без обширной кортикальной деструкции или распространения на заднюю колонну позвоночного столба. Кифопластика и вертебропластика могут быть выполнены в амбулаторных условиях и представляют собой наиболее стойкий и наименее инвазивный метод стабилизации позвоночника [45]. Цемент вводится в тело позвонка с помощью чрескожно введенной иглы и может быть введен непосредственно в губчатую кость при вертебропластике или в полость, созданную с помощью надувного баллона при кифопластике. Использование чрескожной цементной аугментации может быть использовано для обеспечения дополнительной стабильности позвоночника у пациентов, нуждающихся в использовании транспедикулярных винтов для чрескожной фиксации.
Пациенты с онкологией часто страдают нарушением плотности костной ткани (преобладание резорбции), что подвергает пациентов высокому риску нестабильности фиксированных винтов [46]. Доказано, что аугментация костных винтов с помощью цемента является эффективным методом решения этой проблемы. Фенестрированные винты позволяют вводить цемент через винт непосредственно в окружающую кость в теле позвонка [47]. Традиционно при открытом доступе транспедикулярные винты размещают как минимум на 2 уровня выше и ниже опухолевого поражения, чтобы уменьшить риск нестабильности винта, использование же фенестрированных винтов позволяет использовать короткие конструкции с винтами, расположенными на 1 уровень выше и ниже опухолевого очага [48]. В случаях значительного остеолизиса тела позвонка чрескожная цементная аугментация на уровне опухоли может обеспечить дополнительную стабильность передней колонны позвоночного столба [49].
Иссечение опухоли и декомпрессия
У пациентов с первичными опухолями хирургическое иссечение (эксцизия) может быть предпринято с лечебной целью. Тем не менее пациенты с метастатическими опухолями подвергаются хирургическому вмешательству с целью паллиативного лечения. В обоих случаях цель эксцизии включает значимый локальный контроль и декомпрессию спинного мозга и нервных корешков.
Мини-открытый доступ сочетает использование чрескожных транспедикулярных винтов с традиционными срединными или передними доступами для иссечения опухоли и декомпрессии спинного мозга [40]. Этот доступ, как правило, требует 1- или 2-уровневого срединного подхода для обнажения опухоли и декомпрессии, сохраняя при этом целость части срединной мускулатуры, которая была бы рассечена и отведена для размещения хирургического инструментария сзади у пациента. Также были описаны передние мини-открытые доступы, в основном с использованием торакотомии или ретроперитонеальных доступов с ограничением рассечения кожи и мышц [50]. Объем иссечения опухоли и декомпрессии варьируется от ламинэктомии до корпорэктомии единым блоком. Сравнительный анализ различных мини-открытых доступов с традиционной открытой хирургией продемонстрировал снижение интраоперационной кровопотери, послеоперационной боли и продолжительности госпитализации после применения мини-открытого доступа [40][51].
Трубчатые и расширяемые ретракторы обеспечивают трансмускулярную экспозицию за счет серийной дилатации мышц, позволяя выполнять более щадящий разрез мышц по сравнению со срединным мини-открытым доступом [52]. Такие ретракторы обычно используются для удаления интрадуральных и экстрадуральных опухолей. Трубчатые ретракторы бывают различной длины и диаметра, что позволяет выбирать ретракторы в соответствии с особенностями анатомии пациента. Расширяемые ретракторы обеспечивают более широкое операционное поле и имеют подвижные лезвия, которые можно регулировать по ходу операции [53]. Эти ретракторы можно вводить через разрезы, используемые при установке чрескожных транспедикулярных винтов, по траектории, обеспечивающей целенаправленную декомпрессию, или через отдельный разрез. Траектория ретрактора имеет решающее значение для обеспечения адекватной экспозиции и безопасных условий для удаления опухоли [52][53]. У пациентов с опухолями, вызывающими литическую деструкцию пластинки, серийную дилатацию следует проводить с большой осторожностью, чтобы избежать непреднамеренного проникновения в спинномозговой канал. Использование таких ретракторов описано при широком спектре операций на первичных опухолях позвоночника, от ограниченной ламинэктомии до внутриочаговой корпэктомии при экстрадуральных опухолях, а также при удалении интрадуральных опухолей.
Роботизированная хирургия, эндоскопия и абляция
Применение эндоскопов представляет собой следующий шаг в снижении инвазивности при операциях на позвоночнике. Современные эндоскопические системы обеспечивают субсантиметровый канал для визуализации и однопортовой диссекции [54]. Популярность применения эндоскопов для лечения дегенеративных заболеваний позвоночника резко возросла, а результаты многих клинических исследований подтверждают их безопасность и эффективность. Использование торакоскопии для корпорэктомии с передним доступом при первичных опухолях позвоночника было описано в нескольких сериях клинических случаев и технических примечаниях [55][56]. С другой стороны, использование эндоскопии для работы с первичными опухолями позвоночника с задним доступом было ограничено и описано лишь в ряде отчетов [57]. Тем не менее эндоскопическая техника заднего доступа обещает целенаправленное иссечение опухоли и удаление кости для декомпрессии спинного мозга и нервных корешков, и эти применения будут приобретать все большее значение по мере совершенствования технологии и накопления опыта хирургов в области эндоскопии позвоночника. Имеющиеся в настоящее время эндоскопические инструменты имеют очень ограниченную способность контролировать кровотечение из ложа опухоли, что значительно ограничивает роль эндоскопии в работе с опухолями. Однако ожидается, что в скором времени на рынке появятся улучшенные устройства для коагуляции.
Роботизированная хирургия получила широкое распространение в широком спектре хирургических специальностей, включая торакальную и колоректальную хирургию, урологию, а также хирургию головы и шеи [58]. В большинстве операций с помощью роботов используются транскавитальные доступы, которые обеспечивают рабочее пространство для нескольких роботизированных манипуляторов и камеры, обеспечивая превосходную визуализацию анатомии определенных органов и систем, а также контролируемые и точные движения хирургических инструментов в небольших пространствах [59]. Роботизированная хирургия позвоночника не выполнялась при операциях на позвоночнике с задним доступом; однако в нескольких сообщениях описывается ее использование при удалении параспинальных торакальных и пресакральных опухолей [60].
Различные методы абляции также использовались для достижения локального контроля над опухолью. Описано использование радиочастотной, лазерной, микроволновой абляции и криоабляции для лечения доброкачественных первичных опухолей позвоночника [61]. Абляция часто выполняется в сочетании с чрескожной аугментацией позвонка цементом и лучевой терапией. Близость опухолей к нервным корешкам и сосудистым структурам ограничивает использование чрескожной абляции; однако различные методы смещения органов и улучшенный нейромониторинг могут позволить более широкое применение. Результаты многочисленных клинических случаев позволяют предположить, что радиочастотная абляция обеспечивает облегчение боли при лечении злокачественных первичных и метастатических опухолей позвоночника [62][63]. Однако убедительных данных о роли радиочастотной абляции в обеспечении местного контроля над опухолью недостаточно. Лазерная абляция позволяет контролировать зону абляции в режиме реального времени, повышая безопасность процедуры. Лазерная интерстициальная термоабляция в сочетании со стереотаксической лучевой терапией тела позвонка успешно применялась для лечения злокачественных первичных и метастатических опухолей позвоночника, о чем сообщалось в исследованиях с большой когортой пациентов [64].
Использование навигации в спинальной хирургии набирает популярность у пациентов с дегенеративными, деформационными и травматическими заболеваниями, и было показано, что ее применение сокращает время установки винтов, повышает точность установки металлоконструкций и снижает риск повторной операции [65]. При малоинвазивных операциях интраоперационная навигация особенно важна для размещения оборудования. Учитывая повышенный риск хирургической заболеваемости и осложнений, современное хирургическое лечение опухолей позвоночника направлено на минимизацию операционного воздействия, времени операции и осложнений. Однако роль навигации при опухолях позвоночника в настоящее время еще изучается. Известно, что в хирургии опухолей позвоночника используются различные 2- или 3-мерные интраоперационные навигационные системы. Эти системы регистрируются на интраоперационном сканировании либо с помощью рентгеноскопических систем, либо, в последнее время, с устройств интраоперационной компьютерной томографии [65]. На сегодняшний день ключевая роль навигации в хирургии опухолей позвоночника заключается в помощи в инструментальной стабилизации при минимальном облучении персонала и пациентов. В отличие от первичных опухолей, где навигация может использоваться для планирования остеотомии, роль декомпрессии с навигацией при метастатических поражениях позвоночника ограничена, поскольку циторедуктивные вмешательства или тотальная резекция не всегда возможны, за исключением учреждений, в которых фракционная стереотаксическая лучевая терапия доступна. Тем не менее навигационные дрели, зонды и кюретки в сочетании с интраоперационным ультразвуковым исследованием могут быть полезны для облегчения вентральной декомпрессии.
ЗАКЛЮЧЕНИЕ
Опухоли позвоночника включают разнообразные гистологические новообразования, каждое из которых требует индивидуального подхода. В случаях множественных поражений позвоночника чаще всего диагностируются метастатические опухоли, тогда как единичные поражения могут указывать на наличие первичных опухолей позвоночника. Эти опухоли могут происходить из различных структур, включая спинной мозг, окружающие его мозговые оболочки, экстрадуральные мягкие ткани и костные элементы позвоночника. Среди диагностируемых доброкачественных новообразований встречаются такие, как эностоз, остеоид-остеома, остеобластома, аневризматическая костная киста, гигантоклеточная опухоль и остеохондрома. В то время как злокачественные опухоли, включая хордому, хондросаркому, саркому Юинга и остеосаркому, встречаются реже, но требуют более агрессивного подхода к лечению.
Основными показаниями к хирургическому вмешательству у пациентов с опухолями позвоночника являются стремление к максимально возможно полному удалению опухоли, декомпрессия спинного мозга и нервных корешков, а также восстановление механической стабильности позвоночного столба. При первичных опухолях хирургическое вмешательство часто направлено на излечение, в то время как при метастатических опухолях основная цель операции заключается в облегчении симптомов и улучшении качества жизни пациента. Малоинвазивные хирургические методы показывают значительные преимущества по сравнению с открытыми хирургическими доступами у пациентов с первичными опухолями позвоночника. Минимизация повреждений мягких тканей в результате применения малоинвазивных методик способствует более быстрому заживлению и позволяет пациентам быстрее перейти к послеоперационной консервативной терапии. Применение малоинвазивных методов в хирургии первичных опухолей позвоночника продолжает расширяться, причем такие передовые технологии, как эндоскопия и роботизированная хирургия, способствуют улучшению результатов хирургического лечения.
Эти достижения подчеркивают важность комплексного подхода к лечению опухолей позвоночника, включающего тщательное предоперационное планирование, использование современных технологий и индивидуализированные стратегии лечения. Такой подход направлен на улучшение прогноза и качества жизни пациентов, обеспечивая им наилучшие возможные исходы. В конечном счете, интеграция новых технологий и методов в клиническую практику продолжает развивать и совершенствовать возможности хирургического лечения первичных опухолей позвоночника.
Список литературы
1. Dea N., Gokaslan Z., Choi D., Fisher C. Spine oncology = primary spine tumors. Neurosurgery. 2017;80(3S):S124–30. DOI: 10.1093/neuros/nyw064
2. Ciftdemir M., Kaya M., Selcuk E., Yalniz E. Tumors of the spine. World J Orthop. 2016;7(2):109–16. DOI: 10.5312/wjo.v7.i2.109
3. Missenard G., Bouthors C., Fadel E., Court C. Surgical strategies for primary malignant tumors of the thoracic and lumbar spine. Orthop Traumatol Surg Res. 2020;106(1S):S53–62. DOI: 10.1016/j.otsr.2019.05.028
4. Dang L., Liu Z., Liu X., Jiang L., Yu M., Wu F., et al. Sagittal en bloc resection of primary tumors in the thoracic and lumbar spine: feasibility, safety and outcome. Sci Rep. 2020;10(1):9108. DOI: 10.1038/s41598-020-65326-0
5. Dandurand C., Fisher C.G., Rhines L.D., Boriani S., Charest-Morin R., Gasbarrini A., et al. Feasibility of achieving planned surgical margins in primary spine tumor: a PTRON study. Neurosurg Focus. 2021;50(5):E16. DOI: 10.3171/2021.2.FOCUS201091
6. Schilling A.T., Ehresman J., Huq S., Ahmed A.K., Lubelski D., Cottrill E., et al. Risk Factors for wound-related complications after surgery for primary and metastatic spine tumors: a systematic review and meta-analysis. World Neurosurg. 2020;141:467–78.e3. DOI: 10.1016/j.wneu.2020.03.210
7. Alan N., Cohen J., Ozpinar A., Agarwal N., Kanter A.S., Okonkwo D.O., et al. Top 50 most cited articles on primary tumors of the spine. J Clin Neurosci. 2017;42:19–27. DOI: 10.1016/j.jocn.2017.02.019
8. Mesfin A., El Dafrawy M.H., Jain A., Hassanzadeh H., Kebaish K.M. Total en bloc spondylectomy for primary and metastatic spine tumors. Orthopedics. 2015;38(11):e995–1000. DOI: 10.3928/01477447-20151020-08
9. Sciubba D.M., De la Garza Ramos R., Goodwin C.R., Xu R., Bydon A., Witham T.F., et al. Total en bloc spondylectomy for locally aggressive and primary malignant tumors of the lumbar spine. Eur Spine J. 2016;25(12):4080–7. DOI: 10.1007/s00586-016-4641-y
10. Shah A.A., Paulino Pereira N.R., Pedlow F.X., Wain J.C., Yoon S.S., Hornicek F.J., et al. Modified en bloc spondylectomy for tumors of the thoracic and lumbar spine: surgical technique and outcomes. J Bone Joint Surg Am. 2017;99(17):1476–84. DOI: 10.2106/JBJS.17.00141
11. Quintana L.M. Primary vertebral tumors-and enneking was right. World Neurosurg. 2017;99:775–6. DOI: 10.1016/j.wneu.2016.12.092
12. Darwish A.E., Hasan B.Z., Elgebery A.O., Badr I.T. The clinical and radiological outcome of stages 1 and 2 enneking benign bone lesions with pathological fracture. Injury. 2021;52(10):2920–5. DOI: 10.1016/j.injury.2021.01.026
13. Sciubba D.M., De la Garza Ramos R., Goodwin C.R., Abu-Bonsrah N., Bydon A., Witham T.F., et al. Clinical, surgical, and molecular prognostic factors for survival after spinal sarcoma resection. Neurosurg Focus. 2016;41(2):E9. DOI: 10.3171/2016.5.FOCUS16118
14. Jones M., Alshameeri Z., Uhiara O., Rehousek P., Grainger M., Hughes S., et al. En bloc resection of tumors of the lumbar spine: a systematic review of outcomes and complications. Int J Spine Surg. 2021;15(6):1211–21. DOI: 10.14444/8155
15. Gazzeri R., Telera S., Galarza M., Callovini G.M., Isabella S., Alfieri A. Surgical treatment of intramedullary spinal cord metastases: functional outcome and complications-a multicenter study. Neurosurg Rev. 2021;44(6):3267–75. DOI: 10.1007/s10143-021-01491-8
16. Yamazaki T., McLoughlin G.S., Patel S., Rhines L.D., Fourney D.R. Feasibility and safety of en bloc resection for primary spine tumors: a systematic review by the Spine Oncology Study Group. Spine (Phila Pa 1976). 2009;34(22 Suppl):S31–8. DOI: 10.1097/BRS.0b013e3181b8b796
17. Fisher C.G., DiPaola C.P., Ryken T.C., Bilsky M.H., Shaffrey C.I., Berven S.H., et al. A novel classification system for spinal instability in neoplastic disease: an evidence-based approach and expert consensus from the Spine Oncology Study Group. Spine (Phila Pa 1976). 2010;35(22):E1221–9. DOI: 10.1097/BRS.0b013e3181e16ae2
18. Kim B., Moon S.H., Kim S.Y., Kim H.J., Lee H.M. Delayed spinal epidural hematoma after en block spondylectomy for vertebral ewing’s sarcoma. Asian Spine J. 2010;4(2):118–22. DOI: 10.4184/asj.2010.4.2.118
19. Tu C.H., Chiu Y.P., Ji H.R., Chiu C.D. Primary osseous chondrosarcoma in the lumbar spine: case report and literature review with analysis. J Int Med Res. 2021;49(11):3000605211058890. DOI: 10.1177/03000605211058890
20. Howell E.P., Williamson T., Karikari I., Abd-El-Barr M., Erickson M., Goodwin M.L., et al. Total en bloc resection of primary and metastatic spine tumors. Ann Transl Med. 2019;7(10):226. DOI: 10.21037/atm.2019.01.25
21. Ashraf N., Hoffe S., Kim R. French FNCLCC/FFCD 9703 study. Oncologist. 2014;19(4):431. DOI: 10.1634/theoncologist.2013-0456
22. Singh H.P., Grover S., Garg B., Sood N. Histopathological spectrum of soft-tissue tumors with immunohistochemistry correlation and FNCLCC grading: a North Indian experience. Niger Med J. 2017;58(5):149–55. DOI: 10.4103/nmj.NMJ_226_16
23. Versteeg A.L, Dea N., Boriani S., Varga P.P., Luzzati A., Fehlings M.G., et al. Surgical management of spinal osteoblastomas. J Neurosurg Spine. 2017;27(3):321–7. DOI: 10.3171/2017.1.SPINE16788
24. Amendola L., Cappuccio M., De Iure F., Bandiera S., Gasbarrini A., Boriani S. En bloc resections for primary spinal tumors in 20 years of experience: effectiveness and safety. Spine J. 2014;14(11):2608–17. DOI: 10.1016/j.spinee.2014.02.030
25. Kaloostian P.E., Yurter A., Etame A.B., Vrionis F.D., Sciubba D.M., Gokaslan Z.L. Palliative strategies for the management of primary and metastatic spinal tumors. Cancer Control. 2014;21(2):140–3. DOI: 10.1177/107327481402100206
26. Desai B., Hobbs J., Hartung G., Xu G., Gokaslan Z.L., Linninger A., et al. Image-guidance technology and the surgical resection of spinal column tumors. J Neurooncol. 2017;131(3):425–35. DOI: 10.1007/s11060-016-2325-4
27. Barber S.M., Konakondla S., Nakhla J., Fridley J.S., Xia J., Oyelese A.A., et al. Spinal dural resection for oncological purposes: a systematic analysis of risks and outcomes in patients with malignant spinal tumors. J Neurosurg Spine. 2019:32(1):69–78. DOI: 10.3171/2019.7.SPINE19477
28. Varga P.P., Szövérfi Z., Lazary A. Surgical treatment of primary malignant tumors of the sacrum. Neurol Res. 2014;36(6):577–87. DOI: 10.1179/1743132814Y.0000000366
29. Shimizu T., Murakami H., Demura S., Kato S., Yoshioka K., Yokogawa N., et al. Total en bloc spondylectomy for primary tumors of the lumbar spine. Medicine (Baltimore). 2018;97(37):e12366. DOI: 10.1097/MD.0000000000012366
30. Ng S., Boetto J., Poulen G., Berthet J.P., Marty-Ane C., Lonjon N. Partial vertebrectomies without instrumented stabilization during en bloc resection of primary bronchogenic carcinomas invading the spine: feasibility study and results on spine balance. World Neurosurg. 2019;122:e1542–50. DOI: 10.1016/j.wneu.2018.11.098
31. Bakar D., Tanenbaum J.E., Phan K., Alentado V.J., Steinmetz M.P., Benzel E.C., et al. Decompression surgery for spinal metastases: a systematic review. Neurosurg Focus. 2016;41(2):E2. DOI: 10.3171/2016.6.FOCUS16166
32. Avila M.J., Skoch J., Fennell V.S., Palejwala S.K., Walter C.M., Kim S., et al. Combined posterior hemiosteotomies and stabilization with lateral thoracotomy for en bloc resection of thoracic paraspinal primary bone tumors: technical note. J Neurosurg Spine. 2016;24(2):223–7. DOI: 10.3171/2015.4.SPINE15107
33. Cappelletto B., Giorgiutti F., Balsano M. Evaluation of the effectiveness of expandable cages for reconstruction of the anterior column of thespine. J Orthop Surg (Hong Kong). 2020;28(1):2309499019900472. DOI: 10.1177/2309499019900472
34. Fourney D.R., Abi-Said D., Rhines L.D., Walsh G.L., Lang F.F., Mc- Cutcheon I.E., et al. Simultaneous anterior-posterior approach to the thoracic and lumbar spine for the radical resection of tumors followed by reconstruction and stabilization. J Neurosurg. 2001;94(2 Suppl):232–44. DOI: 10.3171/spi.2001.94.2.0232
35. Wei F., Liu Z., Liu X., Jiang L., Dang G., Passias P.G., et al. An approach to primary tumors of the upper cervical spine with spondylectomy using a combined approach: our experience with 19 cases. Spine (Phila Pa 1976). 2018;43(2):81–8. DOI: 10.1097/BRS.0000000000001007
36. Zhong N., Yang M., Ma X., Gao X., Ye C., Yang J., et al. Early major complications after radical resection of primary C2-involved upper cervical chordoma through the combined anterior retropharyngealposterior approach: incidence and risk factors. World Neurosurg. 2021;154:e790–6. DOI: 10.1016/j.wneu.2021.08.001
37. Dubory A., Missenard G., Lambert B., Court C. Interest of laparoscopy for “en bloc” resection of primary malignant sacral tumors by combined approach: comparative study with open median laparotomy. Spine (Phila Pa 1976). 2015;40(19):1542–52. DOI: 10.1097/BRS.0000000000001069
38. Rao P.J., Thayaparan G.K., Fairhall J.M., Mobbs R.J. Minimally invasive percutaneous fixation techniques for metastatic spinal disease. Orthop Surg. 2014;6(3):187–95. DOI: 10.1111/os.12114
39. Payer M., Sottas C. Mini-open anterior approach for corpectomy in the thoracolumbar spine. Surg Neurol. 2008;69(1):25–31; discussion 31–2. DOI: 10.1016/j.surneu.2007.01.075
40. Gibbs W.N., Nael K., Doshi A.H., Tanenbaum L.N. Spine oncology: imaging and intervention. Radiol Clin North Am. 2019;57(2):377–95. DOI: 10.1016/j.rcl.2018.10.002
41. Uei H., Tokuhashi Y., Maseda M., Nakahashi M., Sawada H., Nakayama E., et al. Clinical results of multidisciplinary therapy including palliative posterior spinal stabilization surgery and postoperative adjuvant therapy for metastatic spinal tumor. J Orthop Surg Res. 2018;13(1):30. DOI: 10.1186/s13018-018-0735-z
42. Moussazadeh N., Rubin D.G., McLaughlin L., Lis E., Bilsky M.H., Laufer I. Short-segment percutaneous pedicle screw fixation with cement augmentation for tumor-induced spinal instability. Spine J. 2015;15(7):1609–17. DOI: 10.1016/j.spinee.2015.03.037
43. Kumar N., Malhotra R., Maharajan K., Zaw A.S., Wu P.H., Makandura M.C., et al. Metastatic spine tumor surgery: a comparative study of minimally invasive approach using percutaneous pedicle screws fixation versus open approach. Clin Spine Surg. 2017;30(8):E1015–21. DOI: 10.1097/BSD.0000000000000400
44. Yimin Y., Zhiwei R., Wei M., Jha R. Current status of percutaneous vertebroplasty and percutaneous kyphoplasty--a review. Med Sci Monit. 2013;19:826–36. DOI: 10.12659/MSM.889479
45. Redini F., Heymann D. Bone tumor environment as a potential therapeutic target in ewing sarcoma. Front Oncol. 2015;5:279. DOI: 10.3389/fonc.2015.00279
46. Barzilai O., McLaughlin L., Lis E., Reiner A.S., Bilsky M.H., Laufer I. Utility of cement augmentation via percutaneous fenestrated pedicle screws for stabilization of cancer-related spinal instability. Oper Neurosurg (Hagerstown). 2019;16(5):593–9. DOI: 10.1093/ons/opy186
47. Wagner A., Haag E., Joerger A.K., Gempt J., Krieg S.M., Wostrack M., et al. Cement-augmented carbon fiber-reinforced pedicle screw instrumentation for spinal metastases: safety and efficacy. World Neurosurg. 2021;154:e536–46. DOI: 10.1016/j.wneu.2021.07.092
48. Sanli I., van Kuijk S.M.J., de Bie R.A., van Rhijn L.W., Willems P.C. Percutaneous cement augmentation in the treatment of osteoporotic vertebral fractures (OVFs) in the elderly: a systematic review. Eur Spine J. 2020;29(7):1553–72. DOI: 10.1007/s00586-020-06391-x
49. Cheng J.S., Upadhyaya C., Wu J.C., Tu T.H., Mummaneni P.V. Mini-open removal of intradural spinal tumor. Neurosurg Focus. 2012;33(Suppl.1):1. DOI: 10.3171/2012.V2.FOCUS12152
50. Uribe J.S., Dakwar E., Le T.V., Christian G., Serrano S., Smith W.D. Minimally invasive surgery treatment for thoracic spine tumor removal: a mini-open, lateral approach. Spine (Phila Pa 1976). 2010;35(26 Suppl):S347–54. DOI: 10.1097/BRS.0b013e3182022d0f
51. Tan L.A., O’Toole J.E. Tubular retractor selection in minimally invasive spinal tumor resection. J Neurosurg Spine. 2014;20(5):596–7. DOI: 10.3171/2013.10.SPINE13944
52. Dorman J.K. Tumor resection utilizing a minimally invasive spinal retractor with a novel cranial adaptor. Minim Invasive Neurosurg. 2008;51(6):358–60. DOI: 10.1055/s-0028-1085447
53. Álvarez Delgado A. Endoscopic closure systems for perforations, fistulas, and leaks. In expert hands or in all endoscopy units? Rev Esp Enferm Dig. 2020;112(5):335–7. DOI: 10.17235/reed.2020.7112/2020
54. Soldozy S., Syed H.R., Jha R.T., O’Connell K., Ozdemirli M., Voyadzis J.M. Giant granular cell tumor of the cervical spinal cord resected via anterior corpectomy with reconstruction: technical note and review of literature. World Neurosurg. 2020;139:136–41. DOI: 10.1016/j.wneu.2020.03.157
55. Park M.S., Deukmedjian A.R., Uribe J.S. Minimally invasive anterolateral corpectomy for spinal tumors. Neurosurg Clin N Am. 2014;25(2):317–25. DOI: 10.1016/j.nec.2013.12.009
56. Lau D., Chou D. Posterior thoracic corpectomy with cage reconstruction for metastatic spinal tumors: comparing the mini-open approach to the open approach. J Neurosurg Spine. 2015;23(2):217–27. DOI: 10.3171/2014.12.SPINE14543
57. D’Souza M., Gendreau J., Feng A., Kim L.H., Ho A.L., Veeravagu A. Robotic-assisted spine surgery: history, efficacy, cost, and future trends. Robot Surg. 2019;6:9–23. DOI: 10.2147/RSRR.S190720
58. Campbell D.H., McDonald D., Araghi K., Araghi T., Chutkan N., Araghi A. The clinical impact of image guidance and robotics in spinal surgery: a review of safety, accuracy, efficiency, and complication reduction. Int J Spine Surg. 2021;15(s2):S10–20. DOI: 10.14444/8136
59. Lieberman I.H., Kisinde S., Hesselbacher S. Robotic-assisted pedicle screw placement during spine surgery. JBJS Essent Surg Tech. 2020;10(2):e0020. DOI: 10.2106/JBJS.ST.19.00020
60. Cazzato R.L., Auloge P., De Marini P., Boatta E., Koch G., Dalili D., et al. Spinal tumor ablation: indications, techniques, and clinical management. Tech Vasc Interv Radiol. 2020;23(2):100677. DOI: 10.1016/j.tvir.2020.100677
61. Gazis A., Beuing O., Jöllenbeck B., Franke J., Skalej M. Bipolar radio frequency ablation of spinal neoplasms in late stage cancer disease: a report of three cases. Spine (Phila Pa 1976). 2012;37(1):E64–8. DOI: 10.1097/BRS.0b013e31821cc57e
62. Lv N., Geng R., Ling F., Zhou Z., Liu M. Clinical efficacy and safety of bone cement combined with radiofrequency ablation in the treatment of spinal metastases. BMC Neurol. 2020;20(1):418. DOI: 10.1186/s12883-020-01998-5
63. Jimenez-Ruiz F., Arnold B., Tatsui C.E., Cata J.P. Perioperative and anesthetic considerations for neurosurgical laser interstitial thermal therapy ablations. J Neurosurg Anesthesiol. 2018;30(1):10–7. DOI: 10.1097/ANA.0000000000000376
64. Massaad E., Shankar G.M., Shin J.H. Novel applications of spinal navigation in deformity and oncology surgery-beyond screw placement. Oper Neurosurg (Hagerstown). 2021;21(Supp 1):S23–38. DOI: 10.1093/ons/opaa322
65. Overley S.C., Cho S.K., Mehta A.I., Arnold P.M. Navigation and robotics in spinal surgery: Where are we now? Neurosurgery. 2017;80(3S):S86–99. DOI: 10.1093/neuros/nyw077
Об авторах
О. А. БейлерлиРоссия
Бейлерли Озал Арзуман оглы — к.м.н., старший научный сотрудник
Уфа
И. Ф. Гареев
Россия
Гареев Ильгиз Фанилевич — к.м.н., старший научный сотрудник
Уфа
Э. Р. Мусаев
Россия
Мусаев Эльмар Расим оглы — д.м.н., профессор, член-корр. РАН, кафедра онкологии
Москва
Ч. Вонг
Китай
Вонг Чунлеи — профессор, отделение нейрохирургии
Харбин
К. Симфукве
Замбия
Кит Симфукве — к.м.н., отделение нейрохирургии
Лусака
Рецензия
Для цитирования:
Бейлерли О.А., Гареев И.Ф., Мусаев Э.Р., Вонг Ч., Симфукве К. Хирургическое лечение первичных опухолей позвоночника. Креативная хирургия и онкология. 2024;14(3):243-254. https://doi.org/10.24060/2076-3093-2024-14-3-243-254
For citation:
Beylerli O.A., Gareev I.F., Musaev E.R., Wang Ch., Simfukwe K. Surgical Treatment of Primary Spinal Tumors. Creative surgery and oncology. 2024;14(3):243-254. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-3-243-254
JATS XML


































