Перейти к:
Безопасность применения противоопухолевых лекарственных препаратов вне зарегистрированных показаний у пациентов в реальной клинической практике: опыт онкологов субъекта Российской Федерации
https://doi.org/10.24060/2076-3093-2024-14-4-323-335
Аннотация
Введение. Одной из ключевых проблем использования противоопухолевых лекарственных препаратов «вне инструкции» является безопасность. Как правило, преимущества подобных назначений в онкологии ассоциированы с превышением потенциальной клинической пользы над рисками возникновения осложнений.
Цель. Изучить в сравнительном аспекте безопасность применения противоопухолевой лекарственной терапии вне зарегистрированных показаний и в рамках зарегистрированных показаний в реальной клинической практике онкологов Тульской области.
Материалы и методы. Исследование проводилось на базе ГУЗ «Тульский областной клинический онкологический диспансер». За 6 месяцев 2019 года проанализирована клиническая информация о 919 законченных случаях лечения 201 пациента старше 18 лет, получивших противоопухолевую лекарственную терапию по поводу солидных ЗНО, с помощью региональной информационной системы. Выделены пациенты, имевшие хотя бы одну госпитализацию для проведения противоопухолевой лекарственной терапии вне зарегистрированных показаний, а также пациенты, получавшие лечение в рамках зарегистрированных показаний. Проведено изучение безопасности применения противоопухолевой лекарственной терапии вне зарегистрированных показаний и в соответствии с зарегистрированными показаниями у пациентов, включенных в исследование: частота встречаемости нежелательных явлений (НЯ); спектр НЯ; степень тяжести НЯ; летальные исходы; приостановка и отмена лечения; госпитализация. По вышеперечисленным показателям произведено сравнение результатов применения противоопухолевых агентов вне зарегистрированных показаний и в соответствии с зарегистрированными показаниями.
Результаты и обсуждение. В данной работе не было зафиксировано непредвиденных нежелательных реакций. Спектр НЯ включал в себя 40 клинических и лабораторных отклонений с различной распространенностью в исследуемых группах. НЯ обнаружены у большинства пациентов в обеих исследуемых группах (82,9 и 86,1 %). Отмечено преобладание I и II степеней токсичности. В ряде случаев зафиксирована отмена терапии, приостановка лечения и госпитализации, однако частота их встречаемости была существенно ниже по сравнению с представленными литературными данными. Зафиксирован один летальный исход от осложнений проводимой терапии. Все НЯ встречались в исследуемых группах со схожей частотой. Наиболее распространенные НЯ в обеих группах представлены гепатотоксичностью, анемией, тромбоцитопенией, нефропатией, цефалгией, лейкоцитозом, дислипидемией, артериальной гипертензией, костным болевым синдромом, головокружением, нейтропенией. Остальные НЯ встречались в единичных случаях со схожей частотой. Наиболее тяжелое течение отмечено при следующих НЯ: тромбоцитопения, диарея, лейкоцитоз, гипергликемия, иммуноопосредованный сахарный диабет с кетоацидотической комой.
Заключение. В реальной клинической практике безопасность применения противоопухолевых лекарственных препаратов вне зарегистрированных показаний не имеет значимых отличий от безопасности использования данных агентов в рамках зарегистрированных показаний.
Ключевые слова
Для цитирования:
Карабина Е.В., Сакаева Д.Д., Липатов О.Н. Безопасность применения противоопухолевых лекарственных препаратов вне зарегистрированных показаний у пациентов в реальной клинической практике: опыт онкологов субъекта Российской Федерации. Креативная хирургия и онкология. 2024;14(4):323-335. https://doi.org/10.24060/2076-3093-2024-14-4-323-335
For citation:
Каrabina E.V., Sakaeva D.D., Lipatov O.N. Safety of the Off-Label Use of Antitumor Drugs in Real Clinical Practice: Experience of Oncologists of the Russian Federation. Creative surgery and oncology. 2024;14(4):323-335. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-4-323-335
ВВЕДЕНИЕ
Преобладание ожидаемой пользы над рисками возникновения осложнений при применении противоопухолевых лекарственных препаратов вне зарегистрированных показаний является основополагающим в отношении целесообразности и обоснованности подобных назначений. Однако в тех ситуациях, когда соотношение риска и пользы препарата недостаточно изучено, использование противоопухолевых агентов не в соответствии с инструкцией может иметь негативные последствия. При анализе зарубежных и отечественных публикаций прослеживается фокусировка авторов на негативные медицинские и юридические последствия применения препаратов вне зарегистрированных показаний, а также на важность мониторинга НЯ [1–3]. Кроме того, при изучении литературных данных, посвященных исследованиям безопасности противоопухолевой лекарственной терапии «вне инструкции», отмечено отсутствие сведений о прямых сравнениях безопасности при использовании лечения вне зарегистрированных показаний и в соответствии с зарегистрированными показаниями. Вышеперечисленные аспекты определяют актуальность изучения безопасности противоопухолевой лекарственной терапии вне зарегистрированных показаний в реальной клинической практике.
Цель: изучить в сравнительном аспекте безопасность применения противоопухолевой лекарственной терапии вне зарегистрированных показаний и в рамках зарегистрированных показаний в реальной клинической практике онкологов Тульской области.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось с 01.10.2021 по 30.06.2024 на базе ГУЗ «Тульский областной клинический онкологический диспансер». За 6 месяцев 2019 года (с 01.01.2019 по 30.06.2019) проанализирована клиническая информация о 919 законченных случаях лечения 201 пациента старше 18 лет, получивших противоопухолевую лекарственную терапию по поводу солидных злокачественных новообразований (ЗНО) в круглосуточном и дневном стационарах ГУЗ ТОКОД, с помощью региональной информационной системы здравоохранения Тульской области «ИНФОКЛИНИКА». Произведена выкопировка законченных случаев лечения противоопухолевыми лекарственными препаратами вне зарегистрированных показаний и в рамках зарегистрированных показаний. Выделены пациенты, имевшие хотя бы одну госпитализацию для проведения противоопухолевой лекарственной терапии вне зарегистрированных показаний. В каждом законченном случае лечения проверялось соответствие показаний для назначения и использования противоопухолевых лекарственных препаратов с перечнем показаний, перечисленных в действующих на момент начала терапии инструкциях по медицинскому применению этих агентов. Произведена выкопировка законченных случаев лечения противоопухолевыми лекарственными препаратами вне зарегистрированных показаний и в соответствии с зарегистрированными показаниями. Осуществлен расчет доли законченных случаев, связанных с применением противоопухолевых препаратов вне зарегистрированных показаний и в рамках зарегистрированных показаний среди всех случаев проведения противоопухолевой лекарственной терапии с 01.01.2019 по 30.06.2019. Законченный случай относился к категории применения противоопухолевой лекарственной терапии вне зарегистрированных показаний в тех ситуациях, при которых показания для назначения того или иного противоопухолевого лекарственного препарата не соответствовали перечню показаний, указанных в инструкции по медицинскому применению на момент начала лечения.
Использован список всех противоопухолевых лекарственных препаратов, зарегистрированных в Российской Федерации, и перечень показаний к ним на период проведения исследования с 01.01.2019 по 30.06.2019, а также российские клинические и практические рекомендации, действовавшие в указанный промежуток времени. Произведено сопоставление инструкций с клиническими и практическими рекомендациями. Наблюдение за пациентами осуществлялось до 30.06.2024. Проведено изучение безопасности применения противоопухолевой лекарственной терапии вне зарегистрированных показаний и в соответствии с зарегистрированными показаниями у всех пациентов, включенных в исследование: частота встречаемости нежелательных явлений (НЯ); спектр НЯ; степень тяжести НЯ; летальные исходы; приостановка лечения; отмена госпитализации. Нежелательным явлением считали любой неблагоприятный симптом, заболевание, а также увеличение интенсивности ранее имевшихся симптомов, возникших после начала лечения. Степень токсичности определялась согласно критериям токсичности Common terminology criteria for adverse events (CTCAE) v. 5.0 [4]. По вышеперечисленным показателям произведено сравнение результатов применения противоопухолевых агентов вне зарегистрированных показаний и в соответствии с зарегистрированными показаниями. Осуществлена оценка результатов лабораторных исследований и анализ протоколов осмотра специалистов в процессе лечения и после каждого цикла терапии.
Статистический анализ проводился с использованием языка программирования R и программы IBMR SPSSR Statistics 26,0. Категориальные переменные представлены в абсолютных и относительных числах, сравнение проведено с помощью критерия χ2-Пирсона с применением поправки Йейтса при количестве наблюдений от пяти до десяти, а также точного критерия Фишера в случае количества наблюдений менее пяти. Для категориальных переменных рассчитано значение отношения шансов с 95 % доверительным интервалом (OШ (95 % ДИ)). Количественные переменные представлены в виде медианы и интерквартильного размаха (Me (Q1; Q3)). Данные проанализированы на соответствие нормальному распределению (критерий Колмогорова — Смирнова). В связи с несоответствием данных нормальному распределению, анализ проводился с использованием непараметрического теста Манна — Уитни. Статистически значимыми считались различия при p < 0,05. Корреляционные взаимосвязи были исследованы с использованием критерия Спирмана с поправкой Холма на множественные сравнения. В приведенных результатах указано значение Спирмана, а также уровень значимости связи. Оценка силы связи проведена в соответствии со шкалой Чеддока. В ходе работы были сформированы 2 группы исследования в зависимости от назначенной терапии. Нами были определены группы пациентов с терапией, назначенной в соответствии с зарегистрированными показаниями (группа 1), а также пациентов, получавших терапию вне зарегистрированных показаний (группа 2).
РЕЗУЛЬТАТЫ
При анализе 919 законченных случаев лечения 201 пациента старше 18 лет, получивших противоопухолевую лекарственную терапию по поводу солидных ЗНО в круглосуточном и дневном стационарах ГУЗ ТОКОД, зафиксировано 318 случаев использования противоопухолевых препаратов вне зарегистрированных показаний (34,6 %) у 72 (35,8 %) пациентов, тогда как в рамках зарегистрированных показаний — 601 случай (65,4 %) у 129 (64,2 %) пациентов.
Обе исследуемые группы были представлены женщинами в 74 % случаев и мужчинами — в 26 %. Возраст больных среди получавших терапию по показаниям и вне показаний различался и составлял 59 и 55 лет соответственно.
Всего использовано 46 препаратов в составе 73 схем противоопухолевой лекарственной терапии. Отмечено применение нескольких препаратов в составе комбинаций вне зарегистрированных показаний, не являющихся самостоятельными схемами: кальция фолинат, иринотекан, оксалиплатин: иринотекан, оксалиплатин; доцетаксел, оксалиплатин, кальция фолинат; оксалиплатин + кальция фолинат. Схемы противоопухолевой лекарственной терапии и противоопухолевые препараты представлены в таблице 1.
|
N |
Схемы лечения |
Лекарственные препараты |
|
1 |
Акситиниб |
Акситиниб |
|
2 |
Анастрозол |
Анастрозол |
|
3 |
Атезолизумаб |
Атезолизумаб |
|
4 |
Бевацизумаб |
Бевацизумаб |
|
5 |
Винорельбин |
Винорельбин |
|
6 |
Гемцитабин |
Гемцитабин |
|
7 |
Деносумаб |
Деносумаб |
|
8 |
Доксорубицин |
Доксорубицин |
|
9 |
Доцетаксел |
Доцетаксел |
|
10 |
Золедроновая кислота |
Золедроновая кислота |
|
11 |
Иматиниб |
Иматиниб |
|
12 |
Иринотекан + Бевацизумаб |
Иринотекан |
|
13 |
Капецитабин |
Капецитабин |
|
14 |
Ниволумаб |
Ниволумаб |
|
15 |
Олапариб |
Олапариб |
|
16 |
Пазопаниб |
Пазопаниб |
|
17 |
Паклитаксел 1 раз в 3 недели |
Паклитаксел |
|
18 |
Паклитаксел еженедельно |
Палбоциклиб |
|
19 |
Панитумумаб |
Панитумумаб |
|
20 |
Пеметрексед |
Пеметрексед |
|
21 |
Пембролизумаб |
Пембролизумаб |
|
22 |
Регорафениб |
Регорафениб |
|
23 |
Сунитиниб |
Сунитиниб |
|
24 |
Трастузумаб |
Трастузумаб |
|
25 |
Трастузумаб-эмтанзин |
Трастузумаб-эмтанзин |
|
26 |
Фулвестрант |
Фулвестрант |
|
27 |
Цетуксимаб |
Цетуксимаб |
|
28 |
Эверолимус |
Эверолимус |
|
29 |
Экземестан |
Экземестан |
|
30 |
Эрибулин |
Эрибулин |
|
31 |
Наб-паклитаксел |
Наб-паклитаксел |
|
32 |
Дабрафениб + Траметиниб |
Дабрафениб |
|
33 |
Интерферон альфа + Бевацизумаб |
Интерферон альфа |
|
34 |
Летрозол + Рибоциклиб |
Летрозол |
|
35 |
Ниволумаб + Деносумаб |
Рибоциклиб |
|
36 |
Палбоциклиб + Фулвестрант |
Циклофосфамид |
|
37 |
Анастрозол + Бусерелин +Трастузумаб |
Бусерелин |
|
38 |
Анастрозол + Трастузумаб |
Ломустин |
|
39 |
Бевацизумаб + Гемцитабин + Карбоплатин |
Траметиниб |
|
40 |
Бевацизумаб + Ломустин |
Эпирубицин |
|
41 |
Гемцитабин + Карбоплатин |
Этопозид |
|
42 |
Гемцитабин + Цисплатин |
Карбоплатин |
|
43 |
Доксорубицин + Бевацизумаб |
Оксалиплатин |
|
44 |
Доксорубицин + Цисплатин |
Цисплатин |
|
45 |
Доцетаксел + Трастузумаб |
Фторурацил |
|
46 |
Доцетаксел + Карбоплатин + Трастузумаб |
Кальция фолинат |
|
47 |
Капецитабин + Бевацизумаб |
- |
|
48 |
Капецитабин + Трастузумаб |
- |
|
49 |
Паклитаксел + Трастузумаб |
- |
|
50 |
Паклитаксел 1 раз в 3 недели + Карбоплатин 1 раз в 3 недели |
- |
|
51 |
Паклитаксел еженедельно + Трастузумаб еженедельно |
- |
|
52 |
Паклитаксел еженедельно + Карбоплатин еженедельно |
- |
|
53 |
Паклитаксел еженедельно + Карбоплатин 1 р\3 недели |
|
|
54 |
Паклитаксел + Цисплатин |
- |
|
55 |
Пеметрексед + Карбоплатин |
- |
|
56 |
Трастузумаб + Винорельбин |
- |
|
57 |
Цисплатин + Фторурацил |
- |
|
58 |
Эпирубицин + Циклофосфамид |
- |
|
59 |
Этопозид + Карбоплатин |
- |
|
60 |
Этопозид + Цисплатин |
- |
|
61 |
АС (Доксорубицин + Циклофосфамид) |
- |
|
62 |
DeGramon + Панитумумаб (Фторурацил, Кальция фолинат, Панитумумаб) |
- |
|
63 |
FLOT (Доцетаксел, Оксалиплатин, Кальция фолинат, Фторурацил) |
- |
|
64 |
FOLFOX (Оксалиплатин + Кальция фолинат + Фторурацил) |
- |
|
65 |
FOLFOX + Панитумумаб (Оксалиплатин, Кальция фолинат, Панитумумаб) |
- |
|
66 |
FOLFIRI (Иринотекан, Кальция фолинат, Фторурацил) |
- |
|
67 |
FOLFIRI + Панитумумаб (Иринотекан, Кальция фолинат, Фторурацил, Панитумумаб) |
- |
|
68 |
FOLFIRI + Бевацизумаб (Иринотекан, Кальция фолинат, Фторцрацил, Бевацизумаб) |
- |
|
69 |
FOLFIRINOX (Оксалиплатин, Иринотекан, Кальция фолинат, Фторурацил) |
- |
|
70 |
FOLFOXIRI + Бевацизумаб (Оксалиплатин, Иринотекан, Кальция фолинат, Фторурацил, Бевацизумаб) |
- |
|
71 |
XELIRI + Бевацизумаб (Капецитабин, Иринотекан, Бевацизумаб) |
- |
|
72 |
XELOX (Капецитабин, Оксалиплатин) |
- |
|
73 |
XELOX + Бевацизумаб (Капецитабин, Оксалиплатин, Бевацизумаб) |
- |
Таблица 1. Схемы противоопухолевой лекарственной терапии и препараты
Table 1. Regimens of antitumor drug therapy and antineoplastic agents
Все применявшиеся препараты как в рамках зарегистрированных показаний, так и вне рамок зарегистрированных показаний были разделены на следующие группы: иммунотерапия ингибиторами контрольных точек иммунного ответа (ИКТИО), гормонотаргетная терапия, гормонотерапия, иммуно-таргетная терапия, монохимиотерапия, полихимиотерапия, остеомодифицирующие агенты, таргетная терапия, химио-таргетная терапия.
В данном исследовании не было зафиксировано непредвиденных нежелательных реакций. Согласно Решению Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза» «непредвиденная нежелательная реакция» — нежелательная реакция, характер, степень тяжести или исход которой не соответствует информации, содержащейся в действующей общей характеристике лекарственного препарата [5]. К числу непредвиденных нежелательных реакций относятся свойственные для фармакологического класса эффекты, указанные в общей характеристике лекарственного препарата, которые не были описаны как связанные с непосредственным применением лекарственного препарата [5].
В ходе исследования были выявлены НЯ. Для подробного изучения различий в частоте встречаемости НЯ в зависимости от проводимой терапии проведен частотный анализ (табл. 2).
|
Показатель |
Терапия по показаниям |
Терапия вне зарегистрированных показаний |
χ 2 |
OШ (95 % ДИ) |
p-value |
|
Нежелательные явления |
|||||
|
Нет |
17,1% (22) |
13,9% (10) |
0,22 |
1,22 (0,54;2,75) |
0,70 |
|
Есть |
82,9% (107) |
86,1% (62) |
|||
|
Редукция |
0% (0) |
2,8% (2) |
0,45 |
- |
0,13 |
|
Приостановка |
7,8% (10) |
18,1% (13) |
4,51 |
0,38 (0,16; 0,94) |
0,03 |
|
Отмена лечения |
1,6% (2) |
1,4% (1) |
0,012 |
0,88 (0,08;9,82) |
1,00 |
|
Госпитализация |
2,3% (3) |
5,6% (4) |
0,22 |
0,41 (0,08;2,01) |
0,42 |
|
Случаи смерти |
0,8% (1) |
0% (0) |
0,58 |
- |
1,00 |
Таблица 2. Частота встречаемости нежелательных явлений и их последствия в исследуемых группах
Table 2. Incidence of adverse events and their consequences in the studied groups
Согласно полученным результатам НЯ были обнаружены у большинства пациентов в обеих исследуемых группах (82,9 % при применении терапии в рамках зарегистрированных показаний и 86,1 % при использовании лечения вне зарегистрированных показаний). Частота встречаемости НЯ при использовании терапии вне зарегистрированных показаний и в рамках зарегистрированных показаний не имела существенных отличий. При этом НЯ в некоторых случаях являлись причиной отмены терапии, приостановки лечения, а также фиксировались случаи госпитализации по причине НЯ. Зафиксирован один летальный исход от острого инфаркта миокарда. Стоит отметить, что все НЯ встречались в исследуемых группах со схожей частотой. При терапии вне зарегистрированных показаний госпитализация по причине НЯ потребовалась в 5,6 % случаев в отличие от 2,3 % при использовании лечения в рамках зарегистрированных показаний, однако статистически значимых различий выявлено не было.
Спектр НЯ включал в себя 40 клинических и лабораторных отклонений с различной распространенностью в исследуемых группах (табл. 3).
|
Тип нежелательного явления |
Терапия по показаниям |
Терапия вне зарегистрированных показаний |
|
Гепатотоксичность |
35,7% (46) |
45,8% (33) |
|
Анемия |
41,9% (54) |
52,8% (38) |
|
Тромбоцитопения |
20,2% (26) |
26,4% (19) |
|
Нефропатия |
14% (18) |
16,7% (12) |
|
Рожистое воспаление |
0,8% (1) |
0% (0) |
|
Тревожное расстройство |
1,6% (2) |
0% (0) |
|
Диарея |
9,3% (12) |
12% (9) |
|
Цефалгия |
17,8% (23) |
15,3% (11) |
|
Тошнота и рвота |
2,3% (3) |
6,9% (5) |
|
Тромбоцитоз |
6,2% (8) |
6,9% (5) |
|
Медикаментозная кардиомиопатия |
0% (0) |
1,4% (1) |
|
Лейкоцитоз |
17,8% (23) |
15,3% (11) |
|
Гриппоподобный синдром |
3,9% (5) |
0% (0) |
|
Снижение массы тела |
0,8% (1) |
0% (0) |
|
Нейтропения |
19,4% (25) |
26,4% (19) |
|
Кожная токсичность |
3,1% (4) |
2,8% (2) |
|
Гиперхолестеринемия |
17,8% (23) |
27,8% (20) |
|
Дислипидемия |
3,1% (4) |
4,2% (3) |
|
Гипергликемия |
20,2% (26) |
23,6% (17) |
|
Артериальная гипертензия |
14% (18) |
12,5% (9) |
|
Полинейропатия |
1,6% (2) |
11,1% (8) |
|
Острый инфаркт миокарда |
0,8% (1) |
0% (0) |
|
Гиперкальциемия |
0% (0) |
1,4% (1) |
|
Костный болевой синдром |
19,4% (25) |
13,9% (10) |
|
Гипербилирубинемия |
6,2% (8) |
11,1% (8) |
|
Головокружение |
14,7% (19) |
19,4% (14) |
|
Шаткость походки |
6,3% (8) |
5,6% (4) |
|
Нарушение памяти |
1,6% (2) |
1,4% (1) |
|
Нарушения сна |
2,3% (3) |
5,6% (4) |
|
Цистит |
2,3% (3) |
0% (0) |
|
Носовое кровотечение |
0,8% (1) |
0% (0) |
|
Гипотензия |
0,8% (1) |
0% (0) |
|
Гипертермия |
2,3% (3) |
0% (0) |
|
Отеки |
0,8% (1) |
1,4% (1) |
|
Иммуноопосредованный пульмонит |
0% (0) |
1,4% (1) |
|
Иммуноопосредованный энцефаломиелит с психоорганическим синдромом |
1,6% (2) |
0% (1) |
|
Снижение зрения |
1,6% (2) |
0% (0) |
|
Сахарный диабет |
0,8% (1) |
2,8% (2) |
|
Иммуноопосредованный сахарный диабет с кетоацидотической комой |
0,8% (1) |
0% (0) |
|
Иммуноопосредованная нефропатия |
0,8% (1) |
0% (0) |
Таблица 3. Спектр нежелательных явлений в исследуемых группах пациентов
Table 3. Spectrum of adverse events in the studied groups
Наиболее распространенные НЯ в обеих группах исследования представлены гепатотоксичностью, анемией, тромбоцитопенией, нефропатией, цефалгией, лейкоцитозом, дислипидемией, артериальной гипертензией, костным болевым синдромом, головокружением, нейтропенией. Перечисленные НЯ встречались в 11–52 % случаев среди пациентов обеих групп. Остальные НЯ встречались в единичных случаях со схожей частотой. Качественный анализ НЯ выявил, что доля случаев полинейропатии была кратно выше среди пациентов, получавших препарат вне зарегистрированных показаний (11,1%), относительно пациентов, лечившихся по показаниям (1,6%).
Проведено изучение степени выраженности НЯ. Тяжелые осложнения соответствовали четвертой степени тяжести (табл. 4). Согласно полученным результатам наиболее тяжелое течение отмечено среди таких НЯ, как тромбоцитопения, диарея, лейкоцитоз, гипергликемия, а также иммуноопосредованный сахарный диабет с кетоацидотической комой, большая часть из которых проявлялась у пациентов, получавших терапию по показаниям.
|
Нежелательное явление |
Степень проявления |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
||||||
|
Группа 1 |
Группа 2 |
Группа 1 |
Группа 2 |
Группа 1 |
Группа 2 |
Группа 1 |
Группа 2 |
Группа 1 |
Группа 2 |
|
|
Гепатотоксичность |
28,7% (37) |
34,7% (25) |
6,2% (8) |
11,1% (8) |
0,8% (1) |
0% (0) |
- |
- |
- |
- |
|
Анемия |
29,5% (38) |
38,9% (28) |
9,3% (12) |
11,1% (8) |
3,1% (4) |
2,8% (2) |
- |
- |
- |
- |
|
Тромбоцитопения |
14,7% (19) |
19,4% (14) |
2,3% (3) |
5,6% (4) |
0,8% (1) |
1,4% (1) |
2,3% (3) |
0% (0) |
- |
- |
|
Нефропатия |
11,6% (15) |
16,7% (12) |
1,6% (2) |
0% (0) |
0,8% (1) |
0% (0) |
- |
- |
- |
- |
|
Рожистое воспаление |
0,8% (1) |
0% (0) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Тревожное расстройство |
1,6% (2) |
0% (0) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Диарея |
8,5% (11) |
9,7% (7) |
0% (0) |
1,4% (1) |
0% (0) |
1,4% (1) |
0,8% (1) |
0% (0) |
- |
- |
|
Цефалгия |
17,8% (23) |
15,3% (11) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Тошнота |
2,3% (3) |
5,6% (4) |
0% (0) |
1,4% (1) |
- |
- |
- |
- |
- |
- |
|
Тромбоцитоз |
6,2% (8) |
6,9% (5) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Медикаментозная кардиомиопатия |
0% (0) |
1,4% (1) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Лейкоцитоз |
10,1% (13) |
11,1% (8) |
4,7% (6) |
1,4% (1) |
2,3% (3) |
1,4% (1) |
0,8% (1) |
1,4% (1) |
- |
- |
|
Гриппоподобный синдром |
1,6% (2) |
0% (0) |
2,3% (3) |
0% (0) |
- |
- |
- |
- |
- |
- |
|
Снижение массы тела |
0,8% (1) |
0% (0) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Нейтропения |
12,4% (16) |
19,4% (14) |
4,7% (6) |
5,6% (4) |
2,3% (3) |
1,4% (1) |
- |
- |
- |
- |
|
Кожная токсичность |
2,3% (3) |
1,4% (1) |
- |
- |
0,8% (1) |
1,4% (1) |
- |
- |
- |
- |
|
Гиперхолестеринемия |
14,7% (19) |
22,2% (16) |
1,6% (2) |
2,8% (2) |
1,6% (2) |
2,8% (2) |
- |
- |
- |
- |
|
Дислипидемия |
3,1% (4) |
2,8% (2) |
0% (0) |
1,4% (1) |
0% (0) |
1,4% (1) |
- |
- |
- |
- |
|
Гипергликемия |
14,7% (19) |
15,3% (11) |
2,3% (3) |
5,5% (4) |
2,3% (3) |
2,8% (2) |
0,8% (1) |
0% (0) |
- |
- |
|
Артериальная гипертензия |
7,8% (10) |
11,1% (8) |
3,9% (5) |
1,4% (1) |
2,3% (3) |
0% (0) |
- |
- |
- |
- |
|
Полинейропатия |
0,8% (1) |
8,3% (6) |
0,8% (1) |
2,8% (2) |
- |
- |
- |
- |
- |
- |
|
Острый инфаркт миокарда |
- |
- |
- |
- |
- |
- |
- |
- |
0,8% (1) |
- |
|
Гиперкальциемия |
0% (0) |
1,4% (1) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Костный болевой синдром |
14,0% (18) |
11,1% (8) |
2,3% (3) |
0% (0) |
3,1% (4) |
2,8% (2) |
- |
- |
- |
- |
|
Гипербилирубинемия |
5,4% (7) |
11,1% (8) |
0,8% (1) |
0% (0) |
- |
- |
- |
- |
- |
- |
|
Головокружение |
14,7% (19) |
19,4% (14) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Шаткость походки |
6,2% (8) |
5,6% (4) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Нарушение памяти |
1,6% (2) |
1,4% (1) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Нарушения сна |
2,3% (3) |
5,6% (4) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Цистит |
2,3% (3) |
0% (0) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Носовое кровотечение |
0,8% (1) |
0% (0) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Гипотензия |
0,8% (1) |
0% (0) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Гипертермия |
1,6% (2) |
0% (0) |
0,8% (1) |
0% (0) |
- |
- |
- |
- |
- |
- |
|
Отеки |
0,8% (1) |
1,4% (1) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Иммуноопосредованный пульмонит |
- |
- |
- |
- |
0% (0) |
1,4% (1) |
- |
- |
- |
- |
|
Иммуноопосредованный энцефаломиелит с психоорганическим синдромом |
- |
- |
- |
- |
1,6% (2) |
0% (0) |
- |
- |
- |
- |
|
Снижение зрения |
1,6 % (2) |
0 % (0) |
- |
- |
- |
- |
- |
- |
- |
- |
|
Сахарный диабет |
- |
- |
- |
- |
0,8% (1) |
2,8% (2) |
- |
- |
- |
- |
|
Иммуноопосредованный сахарный диабет с кетоацидотической комой |
- |
- |
- |
- |
- |
- |
0,8 % (1) |
0 % (0) |
- |
- |
|
Иммуноопосредованная нефропатия |
0,8 % (1) |
0 % (0) |
- |
- |
- |
- |
- |
- |
- |
- |
Таблица 4. Степень тяжести нежелательных явлений в исследуемых группах пациентов
Table 4. Severity of adverse events in the studied groups
Для проверки корреляционных связей был проведен анализ ассоциаций НЯ с типом ЗНО и с типом терапии. Результаты анализа ассоциации НЯ с ЗНО представлены на корреляционной матрице (рис. 1).
По итогам анализа статистически значимых ассоциаций нежелательных явлений с типом ЗНО выявлено не было.

Рисунок 1. Корреляционная матрица нежелательных явлений с типом ЗНО
Figure 1. Correlation matrix of adverse events for malignant neoplasms
С целью анализа ассоциативной связи нежелательных явлений с типом назначенной терапии были созданы корреляционные матрицы, представленные на рисунках 2 и 3.
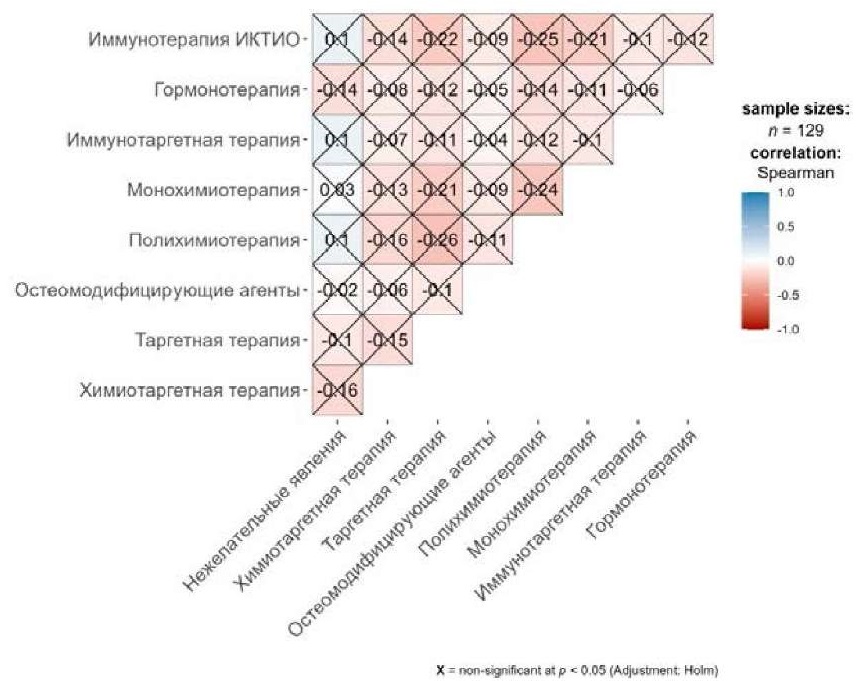
Рисунок 2. Корреляционная матрица нежелательных явлений с типом терапии в группе больных, получавших лечение по показаниям
Figure 2. Correlation matrix of adverse events in the group of patients receiving on-label therapy
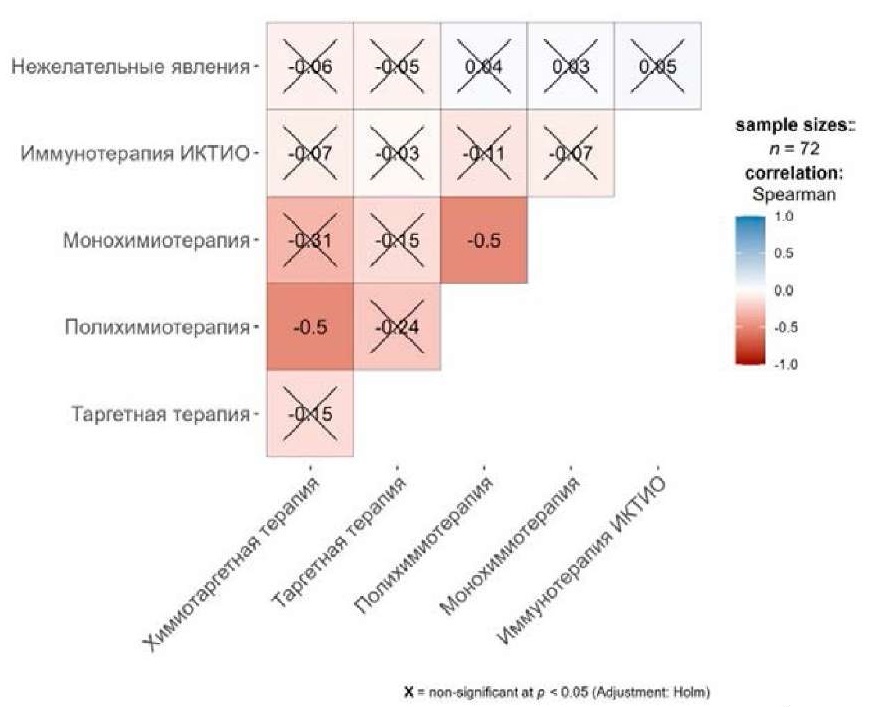
Рисунок 3. Корреляционная матрица нежелательных явлений с типом терапии в группе больных, получавших лечение вне зарегистрированных показаний
Figure 3. Correlation matrix of adverse events in the group of patients receiving off -label therapy
Проанализированы соответствующие показатели отдельно в группе пациентов, получавших терапию по показаниям и вне зарегистрированных показаний (таблица 5, таблица 6, рисунок 2, рисунок 3). По итогам анализа выявлено, что в группе больных, получавших терапию по показаниям, чаще наблюдались НЯ при проведении таргетной терапии, полихимиотерапии, монохимиотерапии, а также иммунотерапии ИКТИО. Стоит отметить, что статистически значимая ассоциативная связь между типом назначаемой терапии и НЯ отсутствует. При этом корреляции не обнаружено ни в группе пациентов, лечившихся по показаниям, ни среди больных, получавших терапию вне зарегистрированных показаний.
|
Группа препаратов |
НЯ нет |
НЯ есть |
χ 2 |
OШ (95 % ДИ) |
p-value |
|
Химиотаргетная терапия |
18,2% (4) |
6,5% (7) |
3,17 |
3,30(0,08;1,18) |
0,08 |
|
Таргетная терапия |
27,3% (6) |
16,8% (18) |
1,32 |
0,54(0,19;1,57) |
0,20 |
|
Остеомодифицирующие агенты |
4,5% (1) |
3,7% (4) |
0,03 |
0,82(0,09;7,67) |
0,86 |
|
Полихимиотерапия |
13,6% (3) |
24,3% (26) |
1,19 |
2,03(0,56;7,43) |
0,28 |
|
Монохимиотерапия |
13,6% (3) |
16,8% (18) |
0,14 |
1,28(0,34;4,79) |
0,72 |
|
Иммунотаргетная терапия |
0% (0) |
5,6% (6) |
0,30 |
- |
0,59 |
|
Гормонотерапия |
13,6% (3) |
4,7% (5) |
2,52 |
0,31(0,06;1,41) |
0,11 |
|
Гормонотаргетная терапия |
0% (0) |
0,9% (1) |
1,00 |
- |
1,00 |
|
Иммунотерапия ИКТИО |
9,1% (2) |
20,6% (22) |
1,59 |
2,58(0,5;11,00) |
0,21 |
Таблица 5. Проявление нежелательных явлений в группе терапии по показаниям при лечении разными группами препаратов
Table 5. Adverse events in the on-label therapy group of patients treated with different classes of medications
|
Группа препаратов |
НЯ нет |
НЯ есть N = 62 1 |
χ 2 |
OШ (95 % ДИ) |
p-value |
|
Химиотаргетная терапия |
30% (3) |
22,6% (14) |
0,26 |
0,68(0,16;2,98) |
0,72 |
|
Таргетная терапия |
10% (1) |
6,5% (4) |
0,17 |
0,62(0,06;6,20) |
0,5 |
|
Полихимиотерапия |
40% (4) |
45,2% (28) |
0,09 |
1,24(0,32;4,82) |
0,91 |
|
Монохимиотерапия |
20% (2) |
24,2% (15) |
0,08 |
1,28(0,24;6,68) |
0,97 |
|
Иммунотерапия ИКТИО |
0% (0) |
1,6% (1) |
1,00 |
- |
1,00 |
Таблица 6. Проявление нежелательных явлений в группе терапии вне зарегистрированных показаний при лечении разными группами препаратов
Table 6. Adverse events in the off-label therapy group of patients treated with different classes of medications
ОБСУЖДЕНИЕ
В 2020 году М. Lim и соавторы опубликовали результаты ретроспективного когортного исследования по изучению эффективности и безопасности противоопухолевой таргетной терапии «вне инструкции» у детей и взрослых моложе 30 лет [6]. 38 % случаев использования противоопухолевых агентов не в соответствии с инструкцией сопровождались токсическими реакциями. Половина этих случаев отмечена у пациентов, получавших таргетную терапию «вне инструкции» в комбинации с химиотерапией или другими таргетными агентами. Лечение таргетными препаратами группы «малых молекул» в 40 % случаев было ассоциировано с развитием НЯ, при этом 16 % пациентов завершили терапию по причине развития токсических реакций. Применение моноклональных антител в 35 % случаев сопровождалось возникновением нежелательных явлений, что привело к отмене терапии у 10 % пациентов. По мнению авторов, несмотря на то что у 38 % пациентов, получавших лечение таргетными препаратами «вне инструкции», отмечены токсические реакции, только в 13 % случаев потребовалось прекращение указанной терапии. Исследователи отметили несколько противоопухолевых агентов, которые применялись на протяжении длительного времени: бевацизумаб, сорафениб, талидомид. Средняя продолжительность использования бевацизумаба составила 169 дней [6]. В ряде публикаций продемонстрирована эффективность и безопасность указанного агента при рецидивирующей медуллобластоме и глиоме у детей [7–10].
А. Gikandi и соавторы опубликовали результаты одноцентрового ретроспективного исследования, в котором изучали применение ингибиторов контрольных точек иммунного ответа (ИКТИО) вне инструкции у детей и молодых взрослых. Исследователи показали, что у 44 % больных (n = 22) наблюдалось хотя бы одно иммуноопосредованное НЯ (иоНЯ) [11]. Отмечено, что у 12 из 22 пациентов реализовывалось несколько иНЯ, в результате чего общее количество данных осложнений составило 62. Лечение ИКТИО прервано у 14 пациентов (28 %), при этом у 7 из них отмечены иоНЯ 3-й степени и выше. Ни один случай смерти не был непосредственно связан с иоНЯ [11].
В 2016 году А. А. Eaton и соавторы опубликовали результаты исследования, в котором была изучена безопасность применения лекарственных препаратов «вне инструкции» у пожилых пациенток с раком молочной железы [12]. Исследователи оценили частоту госпитализаций и случаи оказания неотложной помощи, сопоставляя их с химиотерапевтическими препаратами, которые использовались в соответствии с инструкцией или «вне инструкции», но в соответствии с Руководством NCCN по клинической практике в области онкологии (NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®)), либо «вне инструкции» и не в соответствии с рекомендациями NCCN. Госпитализация или обращение в отделение неотложной помощи зафиксированы в 32 % (95 % ДИ: 29–34) случаев использования цитостатиков «вне инструкции» и не в соответствии с рекомендациями NCCN, по сравнению с 27 % (95 % ДИ: 25–29) в когорте применения химиотерапевтических агентов «вне инструкции», но в соответствии с рекомендациями NCCN и 25 % (95 % ДИ: 22–27) в группе пациентов, получавших лечение препаратами в соответствии с инструкцией (p < 0,0001). Использование цитостатиков в рамках зарегистрированных показаний было связано с самым низким уровнем событий, при этом наличие IV стадии рака молочной железы у пациенток данной группы продемонстрировало наибольший показатель госпитализаций или госпитализаций в отделение неотложной помощи (p = 0,241). Авторы исследования полагают, что применение препаратов «вне инструкции» в отсутствие доказательной базы ассоциировано с увеличением токсичности [12].
Анализу безопасности применения противоопухолевых препаратов, в особенности таргетной терапии, у детей и подростков посвящено большее количество публикаций [13][14].
А. Spini и соавторы, проведя систематический обзор и метаанализ ряда клинических испытаний и обсервационных исследований, сообщили о том, что у каждого второго педиатрического пациента (≤18 лет) с солидной опухолью, для лечения которых применялись антиангиогенные препараты в качестве монотерапии, наблюдались серьезные нежелательные явления [7]. В исследованиях оценивали НЯ антиангиогенных препаратов у пациентов с опухолями ЦНС [15–18], с саркомами [19–22] и с солидными опухолями [23][24]. Доля серьезных и несерьезных НЯ при использовании вышеуказанных агентов в качестве монотерапии составила 0,46 и 0,89 соответственно. Частота развития серьезных НЯ варьировала в зависимости от препаратов: сунитиниб — 79 %; ленватиниб — 64 %; сорафениб — 48 %; рамуцирумаб — 41 %; пазопаниб — 30 % и вандетаниб — 27 %. Доля серьезных и несерьезных НЯ, реализовавшихся при использовании антиангиогенных препаратов в сочетании с химиотерапией, составила 0,51 [ 95 % ДИ: 0,32–0,69] и 0,90 [ 95 % ДИ: 0,80–0,96] соответственно.
Между исследованиями, результаты которых сообщали о серьезных и несерьезных НЯ при использовании бевацизумаба в комбинации с химиотерапией, обнаружена высокая гетерогенность. Исследователи показали, что желудочно-кишечные и гематологические события представляли собой наиболее распространенные НЯ у пациентов, получавших антиангиогенные препараты в монорежиме. При этом частота и тяжесть миелосупрессии варьировали в зависимости от антиангиогенных препаратов и их антикиназной селективности [7]. Среди сердечно-сосудистых событий на фоне приема противоопухолевых антиангиогенных препаратов наиболее часто встречалась артериальная гипертензия [22][25].
Меньшая частота встречаемости НЯ по данным мировой литературы в сравнении с представляемыми нами данными, вероятно, обусловлена оценкой токсичности большинством исследователей таргетных препаратов и их комбинаций с цитостатиками. Мы не исключаем влияние проблемы занижения отчетности НЯ. А. Mascolo и соавторы, изучив отчеты о безопасности отдельных случаев при использовании противоопухолевых агентов «вне инструкции» у детей и подростков на основе данных системы спонтанных сообщений фармаконадзора в Италии, сделали выводы о присутствии феномена занижения отчетности, который является основным ограничением в фармаконадзоре [14]. В нашем исследовании проведен тщательный сбор информации о любых НЯ в процессе лечения, а также после его завершения и в течение всего периода наблюдения до начала следующего курса терапии, что, вероятно, повлияло на более высокую частоту встречаемости осложнений и отсутствие зависимости НЯ от препарата и его групповой принадлежности. Полученные данные свидетельствуют о преобладании I и II степеней токсичности. Кроме того, в нашем исследовании отмечена более низкая частота госпитализаций, приостановки и отмены лечения по сравнению с представленными литературными данными [6][11][12][26], что, вероятнее всего, указывает на контролируемый и обратимый характер НЯ. Также отмечен низкий процент отмены лечения (1,4 %), в отличие от данных S. Fontanals и соавторов, которые в ретроспективном когортном исследовании по изучению применения препаратов «вне инструкции» и в рамках сострадательного использования у взрослых онкологических пациентов (старше 16 лет) сообщили о том, что причиной прекращения лечения была токсичность у 13,7 % пациентов [26].
В ходе исследования отмечено, что частота развития полинейропатии была выше в группе применения терапии вне зарегистрированных показаний (11,1% случаев) по сравнению с группой, получавшей лечение в рамках зарегистрированных показаний (1,6%). Вероятно, это обусловлено более частым использованием паклитаксела и оксалиплатина в когорте больных, получавших терапию вне зарегистрированных показаний.
Приостановка лечения потребовалась большему количеству пациентов, получавших терапию вне зарегистрированных показаний (18,1 и 7,8 % соответственно), при этом различия были статистически значимы. Указанная частота приостановки лечения в группе больных с применением терапии вне зарегистрированных показаний, вероятно, связана с более частым использованием химиотерапевтических агентов, в частности, еженедельным применением паклитаксела, лечение которыми ассоциировано с большими рисками нарушения интервальности лечения. Не исключено влияние практики предпочтения прерывания терапии снижению дозы. Однако указанный аспект требует проведение отдельного анализа.
Исследование имеет несколько ограничений. Во-первых, работа проводилось в одном учреждении. Во-вторых, из реестра счетов извлекались данные о пациентах и госпитальных случаях, связанных с лечением в круглосуточном и дневном стационарах. В-третьих, исследование имело ретроспективно-проспективный характер. В-четвертых, в данной работе не были предусмотрены оценка качества жизни пациентов и анализ их общего состояния.
ЗАКЛЮЧЕНИЕ
В реальной клинической практике безопасность применения противоопухолевых лекарственных препаратов вне зарегистрированных показаний не имеет значимых отличий от безопасности использования данных агентов в рамках зарегистрированных показаний.
Список литературы
1. Барышникова И.Н., Кетова Г.Г., Зарипова Г.Р., Шамурова Ю.Ю., Кузин А.И., Шамина О.М. Нормативно-правовые аспекты назначения лекарственных препаратов не по инструкции (off-label) в Российской Федерации. Клиническая фармакология и терапия. 2023;32(2):73–9. DOI: 10.32756/0869-5490-2023-2-73-79
2. Rusz C.M., Ősz B.E., Jîtcă G., Miklos A., Bătrînu M.G., Imre S. Off-label medication: from a simple concept to complex practical aspects. Int J Environ Res Public Health. 2021;18(19):10447. DOI: 10.3390/ijerph181910447
3. Van Norman G.A. Off-label use vs off-label marketing of drugs: Part 1: Off-label use-patient harms and prescriber responsibilities. JACC: Basic to Translational Science. 2023;8(2):224–33. DOI: 10.1016/j.jacbts.2022.12.011
4. National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE). Version 5.0. 2017. [cited 2023 Dec 15]. Available at: https://ctep.cancer.gov/protocolde-velopment/electronic_applications/docs/ctcae_v5_quick_reference_5x7.pdf
5. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза». Евразийский экономический союз. Режим доступа: https://docs.cntd.ru/document/456026106 (дата обращения: 12.07.2024).
6. Lim M., Shulman D.S., Roberts H., Li A., Clymer J., Bona K., et al. Off-label prescribing of targeted anticancer therapy at a large pediatric cancer center. Cancer Med. 2020;9(18):6658–66. DOI: 10.1002/cam4.3349
7. Spini A., Ciccone V., Rosellini P., Ziche M., Lucenteforte E., Salvo F., et al. Safety of anti-angiogenic drugs in pediatric patients with solid tumors: a systematic review and meta-analysis. Cancers (Basel). 2022;14(21):5315. DOI: 10.3390/cancers14215315
8. Calò P., Pianton N., Basle A., Vasiljevic A., Barritault M., Beuriat P.A., et al. Bevacizumab as Single Agent in Children and Teenagers with Optic Pathway Glioma. Cancers (Basel). 2023;15(4):1036. DOI: 10.3390/cancers15041036
9. Green K., Panagopoulou P., D’Arco F., O’Hare P., Bowman R., Walters B., et al. A nationwide evaluation of bevacizumab-based treatments in pediatric low-grade glioma in the UK: Safety, efficacy, visual morbidity, and outcomes. Neuro Oncol. 2023;25(4):774–85. DOI: 10.1093/neuonc/noac223.
10. Bennebroek C.A.M., van Zwol J., Porro G.L., Oostenbrink R., Dittrich A.T.M., Groot A.L.W., et al. Impact of bevacizumab on visual function, tumor size, and toxicity in pediatric progressive optic pathway glioma: a retrospective nationwide multicentre study. Cancers (Basel). 2022;14(24):6087. DOI: 10.3390/cancers14246087
11. Gikandi A., Chi S.N., Yeo K.K., O’Neill A.F., Shulman D.S., DuBois S.G., et al. Off-label prescribing of immune checkpoint inhibitor therapy at a single pediatric cancer center. Cancer Med. 2024;13(8):e7154. DOI: 10.1002/cam4.7154
12. Eaton A.A., Sima C.S., Panageas K.S. Prevalence and safety of off-label use of chemotherapeutic agents in older patients with breast cancer: estimates from SEER-Medicare data. J Natl Compr Canc Netw. 2016;14(1):57–65. DOI: 10.6004/jnccn.2016.0007
13. Cenna R., Basiricò M., Berchialla P., Bertorello N., Cagnazzo C., Ceolin V., et al. Off-label and compassionate use of targeted anticancer therapies: The experience of an Italian pediatric cancer center. Pediatr Blood Cancer. 2023;70(3):e30148. DOI: 10.1002/pbc.30148
14. Mascolo A., Scavone C., Bertini M., Brusco S., Punzo F., Pota E., et al. Safety of anticancer agents used in children: a focus on their off-label use through data from the spontaneous reporting system. Front Pharmacol. 2020;11:621. DOI: 10.3389/fphar.2020.00621
15. de Marcellus C., Tauziède-Espariat A., Cuinet A., Pasqualini C., Robert M.P., Beccaria K., et al. The role of irinotecan-bevacizumab as rescue regimen in children with low-grade gliomas: a retrospective nationwide study in 72 patients. J Neurooncol. 2022;157(2):355–64. DOI: 10.1007/s11060-022-03970-4
16. El-Khouly F.E., Veldhuijzen van Zanten S.E.M., Jansen M.H.A., Bakker D.P., Sanchez Aliaga E., Hendrikse N.H., et al. A phase I/II study of bevacizumab, irinotecan and erlotinib in children with progressive diffuse intrinsic pontine glioma. J Neurooncol. 2021;153(2):263–71. DOI: 10.1007/s11060-021-03763-1
17. Metts J., Harrington B., Salman E., Bradfield S.M., Flanary J., Mosha M., et al. A phase I study of irinotecan and temozolomide with bevacizumab in children with recurrent/refractory central nervous system tumors. Childs Nerv Syst. 2022;38(5):919–28. DOI: 10.1007/s00381-022-05479-7
18. Levy A.S., Krailo M., Chi S., Villaluna D., Springer L., Williams-Hughes C., et al. Temozolomide with irinotecan versus temozolomide, irinotecan plus bevacizumab for recurrent medulloblastoma of childhood: Report of a COG randomized Phase II screening trial. Pediatr Blood Cancer. 2021;68(8):e29031. DOI: 10.1002/pbc.29031
19. Gaspar N., Campbell-Hewson Q., Gallego Melcon S., Locatelli F., Venkatramani R., Hecker-Nolting S., et al. Phase I/II study of single-agent lenvatinib in children and adolescents with refractory or relapsed solid malignancies and young adults with osteosarcoma (ITCC-050)*. ESMO Open. 2021;6(5):100250. DOI: 10.1016/j.esmoop.2021.100250
20. Gaspar N., Venkatramani R., Hecker-Nolting S., Melcon S.G., Locatelli F., Bautista F., et a. Lenvatinib with etoposide plus ifosfamide in patients with refractory or relapsed osteosarcoma (ITCC-050): a multicentre, open-label, multicohort, phase 1/2 study. Lancet Oncol. 2021;22(9):1312–21. DOI: 10.1016/S1470-2045(21)00387-9
21. Russo I., Di Paolo V., Crocoli A., Mastronuzzi A., Serra A., Di Paolo P.L., et al. A chart review on the feasibility and safety of the vincristine irinotecan pazopanib (VIPaz) association in children and adolescents with resistant or relapsed sarcomas. Front Oncol. 2020;10:1228. DOI: 10.3389/fonc.2020.01228
22. Weiss A.R., Chen Y.L., Scharschmidt T.J., Chi Y.Y., Tian J., Black J.O., et al. Pathological response in children and adults with large unresected intermediate-grade or high-grade soft tissue sarcoma receiving preoperative chemoradiotherapy with or without pazopanib (ARST1321): a multicentre, randomised, open-label, phase 2 trial. Lancet Oncol. 2020;21(8):1110–22. DOI: 10.1016/S1470-2045(20)30325-9
23. Geoerger B., Morland B., Jiménez I., Frappaz D., Pearson A.D.J., Vassal G., et al. Phase 1 dose-escalation and pharmacokinetic study of regorafenib in paediatric patients with recurrent or refractory solid malignancies. Eur J Cancer. 2021;153:142–52. DOI: 10.1016/j.ejca.2021.05.023
24. Meany H.J., Widemann B.C., Hinds P.S., Bagatell R., Shusterman S., Stern E., et al. Phase 1 study of sorafenib and irinotecan in pediatric patients with relapsed or refractory solid tumors. Pediatr Blood Cancer. 2021;68(11):e29282. DOI: 10.1002/pbc.29282
25. Wetmore C., Daryani V.M., Billups C.A., Boyett J.M., Leary S., Tanos R., et al. Phase II evaluation of sunitinib in the treatment of recurrent or refractory high-grade glioma or ependymoma in children: a children’s Oncology Group Study ACNS1021. Cancer Med. 2016;5(7):1416–24. DOI: 10.1002/cam4.713
26. Fontanals S., Esteve A., González A., Ibáñez C., Martínez J., Mesía R., et al. Real-world treatment outcomes of medicines used in special situations (off-label and compassionate use) in oncology and hematology: A retrospective study from a comprehensive cancer institution. Cancer Med. 2023;12(16):17112–25. DOI: 10.1002/cam4.6360
Об авторах
Е. В. КарабинаРоссия
Карабина Елена Владимировна — отделение противоопухолевой лекарственной терапии, аспирант, кафедра онкологии и клинической морфологии
Республика Башкортостан, Уфа
Д. Д. Сакаева
Россия
Сакаева Дина Дамировна — д.м.н., профессор, кафедра фармакологии
Республика Башкортостан, Уфа
О. Н. Липатов
Россия
Липатов Олег Николаевич — д.м.н., профессор, кафедра онкологии и клинической морфологии
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Карабина Е.В., Сакаева Д.Д., Липатов О.Н. Безопасность применения противоопухолевых лекарственных препаратов вне зарегистрированных показаний у пациентов в реальной клинической практике: опыт онкологов субъекта Российской Федерации. Креативная хирургия и онкология. 2024;14(4):323-335. https://doi.org/10.24060/2076-3093-2024-14-4-323-335
For citation:
Каrabina E.V., Sakaeva D.D., Lipatov O.N. Safety of the Off-Label Use of Antitumor Drugs in Real Clinical Practice: Experience of Oncologists of the Russian Federation. Creative surgery and oncology. 2024;14(4):323-335. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-4-323-335


































