Перейти к:
Клинические характеристики и особенности неинвазивного рака молочной железы
https://doi.org/10.24060/2076-3093-2025-15-3-244-250
Аннотация
Введение. В статье представлен опыт МНИОИ им. П.А. Герцена, проанализированы 110 пациенток с диагнозом РМЖ 0 стадии за период с 2023 по 2024 г. Материалы и методы. По гистологической структуре преобладал внутрипротоковый рак — Тis (DCIS) 100/110 (90,9%), на втором месте рак Педжета — Тis (Paget) 7/110 (6,4%), на третьем месте внутридольковый рак — Тis (LCIS) 3/110 (2,7%). Мастэктомия выполнена у 17 (15,5%) больных, подкожная/кожесохранная мастэктомия с реконструкцией — у 44 (40%) пациенток и резекция молочной железы — в 49 (44,5%) случаях. Результаты. По данным планового гистологического исследования конверсия 0 стадии выявлена в 42/110 (38,2%) случаях. При этом I стадии РМЖ диагностирована в 33,6%, II стадия РМЖ — в 4,5%. Положительные края резекции (R1) при плановом морфологическом исследовании диагностированы у 15 (13,6%) пациенток. Обсуждение. МРТ молочных желез при неинвазивном РМЖ — необходимый компонент для определения распространенности процесса, определения мультифокальности или мультицентричности поражения, и, как следствие, решения о возможности сохранения молочной железы или ее удаления. Важным также является вопрос о необходимости исследования сторожевого лимфатического узла при неинвазивном раке молочной железы. Заключение. Локальные рецидивы РМЖ среди анализируемой группы диагностированы у 2 (1,8 ± 1,6%) пациенток. Конверсия 0 стадии РМЖ в другие стадии, т. е. cTis→pT+, диагностирована у 42/110 (38,2%) пациенток. Несмотря на распространенность процесса (средний размер сancer in situ 42 мм), в 93% выполнены органосохранные операции или подкожные мастэктомии с реконструкцией. Таким образом, сancer in situ может в 40% трансформироваться в другие стадии. Безусловно, роль диагностических методов для оценки распространенности стадии РМЖ крайне важна для выбора оптимального объема хирургического лечения.
Ключевые слова
Для цитирования:
Рассказова Е.А., Онофрийчук И.М., Гехт Г.А. Клинические характеристики и особенности неинвазивного рака молочной железы. Креативная хирургия и онкология. 2025;15(3):244-250. https://doi.org/10.24060/2076-3093-2025-15-3-244-250
For citation:
Rasskazova Е.A., Onofriychuk I.M., Gekht G.A. Clinical Characteristics and Features of Noninvasive Breast Cancer. Creative surgery and oncology. 2025;15(3):244-250. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-3-244-250
ВВЕДЕНИЕ
Протоковая карцинома in situ (DCIS) — это неинвазивная карцинома, определяемая как злокачественная пролиферация клеток протокового эпителия молочной железы [1]. Заболевание ограничивается протоково-дольковой системой с сохранением целостности базальной мембраны и слоя миоэпителиальных клеток, что предотвращает метастазирование опухолевых клеток. Размеры протоковой карциномы могут быть от минимальных до занимающих весь объем молочной железы [2].
В последние десятилетия, в результате широкого внедрения программ скрининга рака молочной железы (РМЖ) и цифровой визуализации, частота выявления DCIS увеличилась [3]. В настоящее время DCIS представляет собой до 20–25 % впервые диагностированного РМЖ [4].
DCIS является гетерогенным заболеванием. И, несмотря на ограниченный метастатический потенциал, некоторые DCIS прогрессируют до инвазивной карциномы молочной железы [5][6]. Это подтверждается результатами проспективных исследований, оценивающих частоту рецидивов DCIS после комплексного лечения, в которых приблизительно 50 % ипсилатеральных рецидивов были инвазивными [7][8]. Механизм предполагает, что злокачественные клетки развиваются внутри протоков до тех пор, пока мутация или другое эпигеномное событие не приведет к появлению новой субпопуляции клеток, способных разрушать базальную мембрану [9][10].
У больных РМЖ состояние подмышечных лимфатических узлов считается важным прогностическим фактором [11]. При этом биопсия «сторожевого» лимфатического узла (БСЛУ) является основным методом оценки состояния регионарных лимфатических узлов, исследование которого помогает решить вопрос о целесообразности выполнения лимфаденэктомии при инвазивном РМЖ в случае отсутствия данных об их поражении по данным диагностических методов (ультразвуковое исследование, компьютерная томография) [12–16]. Тем не менее отсутствует достаточное количество рандомизированных проспективных исследований, изучающих преимущества проведения БСЛУ у пациенток с DCIS [1].
По данным Американского общества онкологии и Итальянской ассоциации онкологии, в случае DCIS БСЛУ следует выполнять в ситуациях, требующих мастэктомии (МЭ), при обширной зоне поражения паренхимы молочной железы (более 20–50 мм), при подозрении на поражение лимфатических узлов по данным физикального осмотра и рентгенологически [17–20].
Потенциальные прогностические факторы прогрессирования DCIS могут помочь практикующим врачам определить показания к БСЛУ и таким образом избежать повторного хирургического вмешательства или ненужной операции на лимфатических узлах [1].
Цель работы — проанализировать больных с предоперационным диагнозом DCIS, частоту выявления конверсии DCIS до инвазивной карциномы, потенциальные прогностические факторы перехода DCIS в инвазивный рак с целью максимального сокращения количества ненужных биопсий СЛУ.
МАТЕРИАЛЫ И МЕТОДЫ
В МНИОИ им. П. А. Герцена проанализированы результаты обследования и лечения 110 пациенток с диагнозом РМЖ 0 стадии за период с 2023 по 2024 г.
Диагностика РМЖ 0 стадии включала клиническое обследование, ультразвуковое исследование молочных желез и регионарных зон, маммографию (рис. 1), томосинтез. Для исключения мультицентричности процесса МРТ (магнитно-резонансная томография) молочных желез с контрастом, для верификации процесса применяют трепанобиопсию для гистологического исследования и определение чувствительности к рецепторам эстрогена и прогестерона.
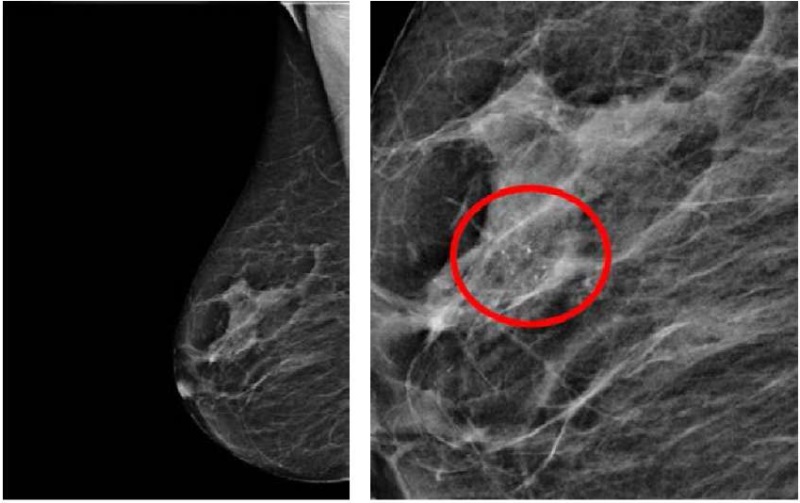
Рисунок 1. Маммография (справа — зона кальцинатов)
Figure 1. Mammography (on the right — area of calcifications)
Так как 0 стадия РМЖ не метастазирует, показаний к назначению сцинтиграфии костей скелета нет.
Средний возраст пациенток в исследовании от 22 до 79 (55,0 ± 2,1) лет.
Пациентки с сохраненной менструальной функцией — 48 (43,7 %), в менопаузе — 62 (56,3 %).
По гистологической структуре биопсийного материала преобладает внутрипротоковый рак — Тis (DCIS) 100/110 (90,9 %), на втором месте рак Педжета — Тis (Paget) 7/110 (6,4 %), на третьем месте внутридольковый рак — Тis (LCIS) 3/110 (2,7 %).
Размер поражения в молочной железе DCIS и LCIS составил от 2 до 60 мм по данным маммографии и МРТ молочных желез. Данные размеры обусловлены в основном зоной микрокальцинатов в молочной железе.
Наличие мутаций BRCA1,2 диагностировано у 11 (10 %) пациенток, во всех случаях в данной группе выполнена подкожная мастэктомия с одномоментной реконструкцией имплантатом и профилактическая подкожная мастэктомия (ПМЭ) контралатеральной молочной железы для снижения риска возникновения рака.
Объем хирургического вмешательства был различным как на молочной железе, так и в подмышечной области. Объем операции на молочной железе определяют локализацией изменений по квадрантам, соотношением изменений и объемом молочной железы, наличием мультицентричности, желанием пациентки, наличием мутации в генах.
Мастэктомия выполнена у 17 (15,5 %) больных, подкожная/кожесохранная мастэктомия (КМЭ) с одномоментной реконструкцией имплантатами — у 44 (40 %) пациенток и резекция молочной железы — в 49 (44,5 %) случаях (рис. 2).
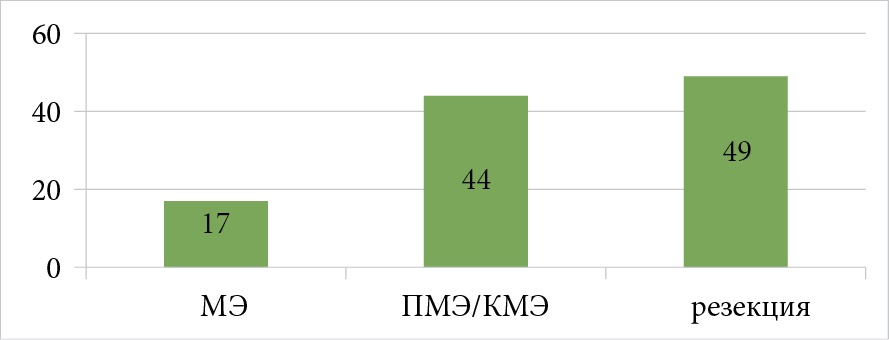
Рисунок 2. Объем хирургического вмешательства пациенток РМЖ 0 стадии (n = 110)
Figure 2. Volume of surgical intervention in patients with breast cancer stage 0 (n = 110)
Подавляющему числу пациенток выполнены органосохраняющие операции или подкожные/кожесохранные мастэктомии с одномоментной реконструкцией имплантатом, что улучшает качество жизни пациенток и позволяет реабилитировать онкологических больных.
При выполнении органосохраняющих операций интраоперационно маркировали края разными красителями или лигатурами разной длины и цвета удаленного сектора молочной железы для анализа чистоты краев резекции при плановом гистологическом исследовании, а также для топического описания опухолевого узла по отношению к 6 краям резекции молочной железы.
Биопсия сторожевого лимфатического узла выполнена у 103 пациенток, подмышечная лимфаденэктомия у 5, в 2 случаях на лимфатических путях операции не было в рамках клинического протокола.
Клинический протокол подразумевает обязательное ультразвуковое исследование группы лимфатических узлов с обязательной пункцией и последующим цитологическим исследованием лимфатического узла в подмышечной области, который является ближайшим к исследуемой зоне поражения или отличается по ультразвуковым критериям от других лимфатических узлов.
Среднее число удаленных лимфатических узлов при биопсии сторожевого лимфатического узла — 2,1. Методики БСЛУ стандартны и включают радиоактивное или контрастное исследование с применением индоцианина зеленого сторожевого лимфатического узла. Срочная интраоперационная верификация выполнена с помощью цитологического исследования.
Лучевая терапия на 2 этапе выполнена у 74 (67,3 %) пациенток. Лучевую терапию выполняли при органосохраняющих операциях на молочной железе, в случае R1, при мультицентричности процесса, при низкодифференцированной форме.
Гормонотерапию назначили 62 (56,4 %) пациенткам с учетом иммуногистохимических показателей внутрипротокового или внутридолькового рака молочной железы.
РЕЗУЛЬТАТЫ
По данным планового гистологического исследования удаленной части или всего объема молочной железы конверсия 0 стадии выявлена в 42/110 (38,2 %) случаях. При этом I стадии РМЖ диагностирована в 33,6 %, II стадия РМЖ — в 4,5 % (табл. 1). Все случаи конверсии по гистологической структуре отнесены к инвазивному раку без признаков специфичности.
ТNМ | Число пациенток (абс., %) |
Т1mic | 6 (5,5 %) |
Т1 а | 14 (12,7 %) |
Т1 б | 8 (7,3 %) |
Т1 с | 9 (8,2 %) |
Т2 | 4 (3,6 %) |
Т3 | 1 (0,9 %) |
Всего | 42/110 (38,2 %) |
Таблица 1. Конверсия 0 стадии рака молочной железы (n = 110)
Table 1. Conversion of stage 0 breast cancer (n = 110)
Конверсия сN0 в рN1 выявлена у 7/110 (6,4 %) пациенток при плановом гистологическом исследовании сторожевых лимфатических узлов. Безусловно, метастазирование в лимфатические узлы возможно только при инвазивном компоненте опухолевого узла. Надо отметить, что при срочном цитологическом исследовании БСЛУ метастазов не выявлено у данных 7 пациенток.
Чем больше размер опухолевого узла, тем выше вероятность метастатического поражения лимфатических узлов. Только при размере опухолевого узла рТ1 а у 14 пациенток не выявлено метастатическое поражение лимфатических узлов. В таблице 2 представлена взаимосвязь между размером опухолевого узла и наличием метастазов в лимфатических узлах.
ТNМ | Число пациенток с метастазами в лимфатических узлах (абс., %) |
Т1mic | 1/6 (16,7 %) |
Т1 б | 1/8 (12,5 %) |
Т1 с | 2/9 (22,2 %) |
Т2 | 2/4 (50 %) |
Т3 | 1/1 (100 %) |
Всего | 7/28 (25 %) |
Таблица 2. Частота метастатического поражения лимфатических узлов при РМЖ от размера опухолевого узла (n = 28)
Table 2. Frequency of metastatic lymph node involvement in breast cancer depending on tumor node size (n = 28)
Положительные края резекции (R1) при плановом морфологическом исследовании диагностированы у 15 (13,6 %) пациенток. К R1 относят наличие «чернил на опухоли» в случае инвазивного рака молочной железы или расстоянии менее 2 мм от края резекции при cancer in situ. В случае положительных краев резекции существуют две тактики: повторное хирургическое лечение до чистоты краев резекции (R0) или лучевая терапия с дополнительным бустом на R1 до суммарной очаговой дозы (СОД) 10 Гр.
Мы проанализировали диагностические возможности совпадения размеров поражения 0 стадии РМЖ по данным МРТ/маммографии (рис. 3) и планового морфологического исследования.
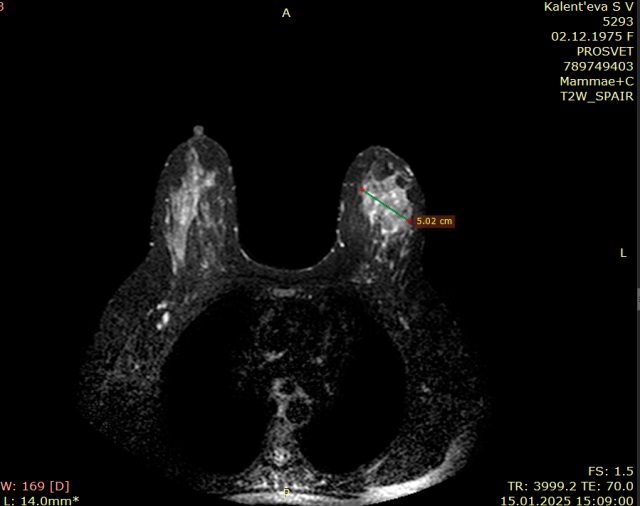
Рисунок 3. МРТ молочных желез (в левой молочной железе зона контрастирования внутрипротокового рака)
Figure 3. MRI of the mammary glands (in the left mammary gland there is a contrast zone of intraductal cancer)
МРТ молочных желез выполнена у 49,1 % пациенток, при этом размеры поражения по данным маммографии и МРТ совпали в 53,7 % случаев, а при сравнении размеров поражения по МРТ и морфологического исследования и аналогичного сопоставления маммографии и морфологического исследования данные не различались (табл. 3). При этом средние размеры сancer in situ 42 мм по результатам планового гистологического исследования.
МРТ молочных желез, n, % | Совпадение размеров по данным МРТ и ММГ n, % | Совпадение размеров МРТ и данных морфологического исследования n, % | Совпадение размеров маммографии и данных морфологического исследования n, % |
54/110 (49,1 %) | 29/54 (53,7 %) | 29/54 (53,7 %) | 12/23 (52,2 %) |
Таблица 3. Совпадение размеров МРТ, маммографии и данных морфологического исследования
Table 3. Matching the sizes of MRI, mammography and morphological examination data
Мультицентричность диагностирована у 9/110 (8,2 %) пациенток 0 стадии РМЖ, при этом мультицентричность среди внутрипротокового рака рТis (DCIS)m выявлена у 8/100 (8 %) пациенток, а мультицентричность среди внутридолькового рака диагностирована — рТis (LCIS)m у 1/3 (33,3 %) пациенток, разница статистически недостоверна из-за недостаточного числа пациенток с внутридольковым раком молочной железы.
ОБСУЖДЕНИЕ
МРТ молочных желез при неинвазивном РМЖ — необходимый компонент для определения распространенности процесса, определения мультифокальности или мультицентричности поражения, и, как следствие, решения вопроса о возможности сохранения молочной железы или ее удаления.
При этом кроме обычного МРТ молочных желез с контрастом, по данным литературы, применяют многопараметрическую МРТ, и дополнительные методы позволяют исключить инвазивный компонент РМЖ [21].
Если сравнить цифровой томосинтез молочной железы с контрастным усилением с маммографией с контрастным усилением и МРТ молочных желез, то самая высокая чувствительность и точность на первом месте у МРТ молочных желез, на 2-м месте — томосинтез с контрастным усилением и на 3-м месте маммография с контрастом [22–25].
При неинвазивном РМЖ необходимость исследования сторожевых лимфатических узлов отсутствует, что снижает радиационные риски при радиоизотопных методиках сторожевых лимфатических узлов. Это выгоднее в экономическом плане (снижение за счет уменьшения объема операции, профилактика лимфостаза верхней конечности и необходимости последующих реабилитационных мероприятий) [26].
Так, исследование SOUND продемонстрировало, что безопасно можно отказаться от выполнения биопсии сторожевого лимфоузла у больных с сT1N0, т. е. деэскалация БСЛУ продолжена и при инвазивных формах РМЖ. Более сложным остается вопрос, может ли этот вывод распространяться на все молекулярно-биологические типы рака молочной железы и возрастные группы пациенток. В исследовании SOUND подавляющее большинство больных имело люминальный фенотип; HER2-позитивный и тройной негативный фенотипы определялись у 6 и 5 % больных соответственно. Как правило, этим пациентам назначалась химиотерапия, в том числе и только по результатам иммуногистохимического анализа опухолевого узла. Хотя не получено свидетельств об ухудшении локального контроля этих больных, число таких наблюдений явно недостаточно, чтобы безопасно рекомендовать отказ от выполнения биопсии сторожевых лимфоузлов при агрессивных фенотипах [27].
Поэтому точная диагностика неинвазивных форм РМЖ является важной и актуальной проблемой в онкологии.
В случае выявления инвазивного компонента при плановом гистологическом исследовании высока необходимость повторных хирургических вмешательств на лимфатическом коллекторе.
Локальные рецидивы РМЖ среди анализируемой группы диагностированы у 2 (1,8 ± 1,6 %) пациенток. При этом у одной пациентки были позитивные края R1, что повышает риск рецидива РМЖ [28–30].
Время до возникновения рецидива составило 14 и 20 месяцев, рецидивы представлены внутрипротоковым раком, и лечение было хирургическим: в одном случае выполнена мастэктомия, во втором случае повторная органосохраняющая операция.
Отдаленных метастазов среди анализируемой группы пациенток не выявлено.
В голландском популяционном исследовании риск рецидива внутрипротокового рака составил 7,1 % (95 % ДИ 5,5–9,1), при этом рецидивы произошли в течение 10 лет и были представлены инвазивным РМЖ. Многочисленные рандомизированные исследования показали, что лучевая терапия снижает риск местного рецидива, как инвазивного, так и неинвазивного, примерно на 50 %, но не влияет на общую выживаемость [17].
Конверсия 0 стадии РМЖ в другие стадии, т. е. cTis→pT+ диагностирована у 42/110 (38,2 %) пациенток. В группе с конверсией в инвазивный рак метастазы в подмышечных лимфатических узлах выявлены у 7 (6,4 %) пациенток.
Совпадение размеров сancer in situ по данным МРТ молочных желез с размерами по данным маммографии выявлено в 53,7 % случаев. Аналогичные данные получены и в отношении сравнения МРТ молочных желез и размеров планового гистологического исследования.
Мультицентричность сancer in situ диагностирована в 8,2 % случаев, при этом при мультицентричном процессе выполняли мастэктомию или подкожную/кожесохранную мастэктомию с одномоментной реконструкцией имплантатами.
Несмотря на распространенность процесса (средний размер сancer in situ 42 мм), в 93 % выполнены органосохранные операции или подкожные мастэктомии с реконструкцией.
ЗАКЛЮЧЕНИЕ
Таким образом, сancer in situ может в 40 % трансформироваться в другие стадии. Безусловно, роль диагностических методов для оценки распространенности стадии РМЖ крайне важна для выбора оптимального объема хирургического лечения.
В случае диагностики по данным биопсии сancer in situ необходимой опцией для выбора объема хирургического вмешательства на молочной железе необходимо кроме рутинных методов диагностики обязательно выполнять МРТ молочных желез с контрастом.
Выполнение БСЛУ при сancer in situ не является необходимой опцией, снижается нагрузка на диагностические службы, на патолого-анатомическую службу, что экономически выгодно при лечения данных больных РМЖ.
Список литературы
1. Davey M.G., O’Flaherty C., Cleere E.F., Nohilly A., Phelan J., Ronane E., et al. Sentinel lymph node biopsy in patients with ductal carcinoma in situ: systematic review and meta-analysis. BJS Open. 2022;6(2):zrac022. DOI: 10.1093/bjsopen/zrac022
2. Salvatorelli L., Puzzo L., Vecchio G.M., Caltabiano R., Virzì V., Magro G. Ductal carcinoma in situ of the breast: an update with emphasis on radiological and morphological features as predictive prognostic factors. Cancers (Basel). 2020;12(3):609. DOI: 10.3390/cancers12030609
3. Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7–30. DOI: 10.3322/caac.21442
4. Giaquinto A.N., Sung H., Miller K.D., Kramer J.L., Newman L.A., Minihan A., et al. Breast cancer statistics, 2022. CA Cancer J Clin. 2022;72(6):524–41. DOI: 10.3322/caac.21754
5. Ward W.H., DeMora L., Handorf E., Sigurdson E.R., Ross E.A., Daly J.M., et al. Preoperative delays in the treatment of DCIS and the associated incidence of invasive breast cancer. Ann Surg Oncol. 2020;27(2):386–96. DOI: 10.1245/s10434-019-07844-4
6. Колядина И.В., Бутримова А.С., Поддубная И.В, Кометова В.В., Родионов В.В. Биологические особенности протоковой карциномы in situ: клиническая роль и основа для индивидуализации лечения. Современная онкология. 2021;23(2):263–8. DOI 10.26442/18151434.2021.2.200964
7. Cuzick J., Sestak I., Pinder S.E., Ellis I.O., Forsyth S., Bundred N.J., et al. Effect of tamoxifen and radiotherapy in women with locally excised ductal carcinoma in situ: long-term results from the UK/ ANZ DCIS trial. Lancet Oncol. 2011;12(1):21–9. DOI: 10.1016/S1470-2045(10)70266-7
8. Donker M., Litière S., Werutsky G., Julien J.P., Fentiman I.S., Agresti R., et al. Breast-conserving treatment with or without radiotherapy in ductal carcinoma In Situ: 15-year recurrence rates and outcome after a recurrence, from the EORTC 10853 randomized phase III trial. J Clin Oncol. 2013;31(32):4054–9. DOI: 10.1200/JCO.2013.49.5077
9. Grimm L.J., Destounis S.V., Rahbar H., Soo M.S., Poplack S.P. Ductal carcinoma in situ biology, language, and active surveillance: a survey of breast radiologists’ knowledge and opinions. J Am Coll Radiol 2020;17(10):1252–8. DOI: 10.1016/j.jacr.2020.03.004
10. Павлова Т.В., Шивилов Е.В., Аничкина К.А., Юрканова Д.Д., Карнаухов Н.С. Протоковый рак in situ в сочетании с синдромом воспаления молочной железы: редкое клиническое наблюдение. Радиология — практика. 2023;3(99):60–74. DOI 10.52560/2713-0118-2023-3-60-74
11. Shin Y.D., Lee H.M., Choi Y.J. Necessity of sentinel lymph node biopsy in ductal carcinoma in situ patients: a retrospective analysis. BMC Surg. 2021;21(1):159. DOI: 10.1186/s12893-021-01170-x
12. Magnoni F., Galimberti V., Corso G., Intra M., Sacchini V., Veronesi P. Axillary surgery in breast cancer: An updated historical perspective. Semin. Oncol. 2020;47:341–52. DOI: 10.1053/j.seminoncol.2020.09.001
13. Зубарева Е.Ю., Сеньчукова М.А. Способ прогнозирования высокого риска регионарного метастазирования при раке молочной железы: патент Российская Федерация 2816441 C1 от 18.10.2023.
14. Москвичев Е.В., Меркулова Л.М., А. И. Кузнецова, Кострова О.Ю., Драндрова Е.Г., Стручко Г.Ю. и др. Иммуногистохимическая характеристика сторожевых лимфатических узлов при разных молекулярно-биологических подтипах рака молочной железы. Клиническая и экспериментальная морфология. 2022;11(1):25–32. DOI: 10.31088/CEM2022.11.1.25-32
15. Криворотько П.В., Новиков С.Н., Табагуа Т.Т., Крживицкий П.И., Емельянов А.С., Амиров Н.С. и др, Метод определения сигнальных лимфатических узлов при раке молочной железы с помощью радиоизотопной и/или флуоресцентной методик. СПб.: НМИЦ онкологии им. Н.Н. Петрова; 2024.
16. Семиглазов В.Ф., Криворотько П.В., Жильцова Е.К., Канаев С.В., Труфанова Е.С., Крживицкий П.И. и др. Двадцатилетний опыт использования биопсии сигнальных лимфатических узлов при раке молочной железы. Опухоли женской репродуктивной системы. 2020;16(1):12–20.
17. Neoplasia della mamiella: Linee guida. Roma; 2023.
18. Delaloge S., Khan S.A., Wesseling J., Whelan T. Ductal carcinoma in situ of the breast: finding the balance between overtreatment and undertreatment. Lancet. 2024;403(10445):2734–46. DOI: 10.1016/S0140-6736(24)00425-2
19. Kanbayashi C., Iwata H. Update on the management of ductal carcinoma in situ of the breast: current approach and future perspectives. Jpn J Clin Oncol. 2025;55(1):4–11. DOI: 10.1093/jjco/hyae122
20. Wright J.L., Gray R., Rahbar H., Comstock C.E., Tjoe J.A., Badve S., et al. Lumpectomy without radiation for ductal carcinoma in situ of the breast: 20-year results from the ECOG-ACRIN E5194 study. NPJ Breast Cancer. 2024;10(1):16. DOI: 10.1038/s41523-024-00622-w
21. Prinz D., Bartsch S.J., Ehret V., Friske J., Pinker K., Helbich T.H. Multiparametric magnetic resonance imaging of the breast: What can we expect from the future? Radiologie (Heidelb). 2025;65(3):162–9. German. DOI: 10.1007/s00117-024-01390-1
22. Clauser P., Pötsch N., Santonocito A., Ferrara F., Zeitouni L., Hörnig M., et al. Contrast-enhanced digital breast tomosynthesis compared with contrast-enhanced mammography and magnetic resonance imaging in the assessment of breast lesions: a pilot study. Invest Radiol. 2025;60(6):369–75. DOI: 10.1097/RLI.0000000000001138
23. Santonocito A., Zarcaro C., Zeitouni L., Ferrara F., Kapetas P., Helbich T.H., et al. A head-to-head comparison of breast lesion’s conspicuity at contrast-enhanced mammography and contrast-enhanced MRI. Eur Radiol. 2025;35(6):3070–9. DOI: 10.1007/s00330-024-11195-4
24. Pötsch N., Vatteroni G., Clauser P., Helbich T.H., Baltzer P.A.T. Contrast-enhanced mammography versus contrast-enhanced breast MRI: a systematic review and meta-analysis. Radiology. 2022;305(1):94–103. DOI: 10.1148/radiol.212530
25. Серебрякова С.В., Шумакова Т.А., Сафронова О.Б., Юхно Е.А., Серебряков А.Л. Магнитно-резонансная маммография в диагностике внутрипротокового рака in situ (DCIS). Радиология — практика. 2021;3(87):41–61. DOI: 10.52560/2713-0118-2021-3-41-61
26. Khan S.A. Sentinel node biopsy for early breast cancer — a SOUND for de-escalation. JAMA Oncol. 2023;9(11):1501–3. DOI: 10.1001/jamaoncol.2023.3667
27. Gentilini O.D., Botteri E., Sangalli C., Galimberti V., Porpiglia M., Agresti R., et al. Sentinel lymph node biopsy vs no axillary surgery in patients with small breast cancer and negative results on ultrasonography of axillary lymph nodes: The SOUND randomized clinical trial. JAMA Oncol. 2023;9(11):1557–64. DOI: 10.1001/jamaoncol.2023.3759
28. Рассказова Е.А., Зикиряходжаев А.Д., Каприн А.Д. Рецидивы и края резекции R1 в зависимости от гистологических характеристик и молекулярнобиологических типов рака молочной железы. Вопросы онкологии. 2022;68(3):267–72. DOI: 10.37469/0507-3758-2022-68-3-267-272
29. Криворотько П.В., Бондарчук Я.И., Комяхов А.В., Багненко С.С., Жильцова Е.К., Черная А.В. и др. Контроль краев резекции при органосохраняющих и онкопластических операциях. Вопросы онкологии. 2024;70(1):96–104. DOI: 10.37469/0507-3758-2024-70-1-96-104
30. Lin C., Wang K.Y., Chen H.L., Xu Y.H., Pan T., Chen Y.D. Specimen mammography for intraoperative margin assessment in breast conserving surgery: a meta-analysis. Sci Rep. 2022;12(1):18440. DOI: 10.1038/s41598-022-23234-5
Об авторах
Е. А. РассказоваРоссия
Рассказова Елена Александровна — к.м.н., отделение онкологии и реконструктивно-пластической хирургии молочной железы и кожи
Москва
И. М. Онофрийчук
Россия
Онофрийчук Ирина Михайловна — к.м.н., 1 онкологическое отделение (кожи, мягких тканей, молочной железы)
Москва
Г. А. Гехт
Россия
Гехт Галина Андреевна — отделение онкологии и реконструктивно-пластической хирургии молочной железы и кожи
Москва
Рецензия
Для цитирования:
Рассказова Е.А., Онофрийчук И.М., Гехт Г.А. Клинические характеристики и особенности неинвазивного рака молочной железы. Креативная хирургия и онкология. 2025;15(3):244-250. https://doi.org/10.24060/2076-3093-2025-15-3-244-250
For citation:
Rasskazova Е.A., Onofriychuk I.M., Gekht G.A. Clinical Characteristics and Features of Noninvasive Breast Cancer. Creative surgery and oncology. 2025;15(3):244-250. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-3-244-250
JATS XML


































