Перейти к:
Карбамазепин в лечении эпилепсии у больных глиобластомой (обзор литературы с описанием клинического случая)
https://doi.org/10.24060/2076-3093-2025-15-3-287-298
Аннотация
Глиобластома — злокачественная опухоль головного мозга, характеризующаяся агрессивным течением, устойчивостью к химиолучевой и иммунотерапии, рецидивированием и высокой летальностью. Заболеваемость глиобластомой составляет от 3,2 до 5 на 100 000 человек. В последние годы отмечен рост заболеваемости среди пациентов в возрасте до 45 лет. У 25–60% больных глиобластомой развивается эпилепсия, снижая качество жизни и ухудшая прогноз заболевания. У 35–40% пациентов эпиприступы являются первым проявлением глиобластомы, но могут появляться и в процессе лечения/рецидива глиобластомы. На риск развития и тяжесть течения эпилепсии оказывают влияние объем опухоли, характер роста, локализация, наличие предоперационных судорог, мутации IDH1–2, объем остаточной опухоли. Этиопатогенез эпилепсии, ассоциированной с глиобластомой, является многофакторным и малоизученным. Ведущая роль в эпилептогенезе отводится дисфункции ионных каналов с увеличением уровня внеклеточного K+, гиперэкспрессией SCN1A и SCN2A альфа-субъединиц Na+-каналов, а также дисрегуляторных Ca 2+-каналов. В результате в перитуморальной зоне нарушаются гомеостаз тормозных и возбуждающих нейротрансмиттеров, процессы реполяризации/деполяризации, электро‑химическое взаимодействие между нейронами и клетками опухоли. Для лечения эпилепсии, ассоциированной с глиобластомой, наиболее часто применяется карбамазепин ввиду его высокой клинической эффективности. Противоэпилептическая активность карбамазепина обусловлена инактивацией Na+-каналов, потенцированием потенциал-зависимых K+-, Cl–-каналов, ГАМК-ергической системы, торможением выброса глутамата, влиянием на гомеостаз других нейромедиаторных систем головного мозга. Немаловажное значение имеет способность карбамазепина подавлять пролиферацию клеток в ряде клеточных линий злокачественной глиомы. Несмотря на то что карбамазепин является индуктором микросомальных ферментов печени, он не снижает эффективность темозоламида, который не метаболизируется в печени. Возможные при применении карбамазепина нежелательные реакции не требуют отмены препарата. Учитывая высокую клиническую эффективность карбамазепина, необходимы дальнейшие исследования его плейотропных эффектов у больных эпилепсией, ассоциированной с глиобластомой и другими злокачественными опухолями головного мозга.
Ключевые слова
Для цитирования:
Муфазалова Л.Ф., Муфазалова Н.А., Имаев А.Б., Фархутдинова Е.Ф., Безрукова С.С., Душанбаев Б.Ю. Карбамазепин в лечении эпилепсии у больных глиобластомой (обзор литературы с описанием клинического случая). Креативная хирургия и онкология. 2025;15(3):287-298. https://doi.org/10.24060/2076-3093-2025-15-3-287-298
For citation:
Mufazalova L.F., Mufazalova N.A., Imaev A.B., Farkhutdinova E.F., Bezrukova S.S., Dushanbaev B.Yu. Carbamazepine for Epilepsy Treatment in Glioblastoma Patients: A Review and a Clinical Case. Creative surgery and oncology. 2025;15(3):287-298. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-3-287-298
ВВЕДЕНИЕ
Глиобластома (glioblastoma, GBM) — первичная злокачественная опухоль головного мозга (ЗОГМ) астроцитарного происхождения, характеризующаяся проградиентным течением, высокой скоростью инвазивного роста, метастазированием, рецидивированием, устойчивостью к химиолучевой терапии, неблагоприятным прогнозом [1–4].
Большинство авторов связывают это с молекулярной неоднородностью, обильной васкуляризацией, склонностью к инфильтрации жизненно важных структур мозга, способностью к регенерации, устойчивостью к различным методам лечения [5–7].
У больных GBM часто развивается эпилепсия — эпилепсия, ассоциированная с глиобластомой (Glioblastoma-Related Epilepsy, GRE) [8–10].
Перитуморальная зона GBM является источником патологической электрической активности, способствующей гипервозбудимости нейронов, формированию эпилептиформных разрядов, разрастанию опухоли и уклонению от иммунного ответа [11].
Этому способствуют неосинаптогенез, избыток глутамата и измененные внутренние мембранные токи в перитуморальной области, что ведет к нарушению процессов возбуждения/торможения в центральной нервной системе (ЦНС), результатом чего является развитие GRE [11].
Проведен анализ научной литературы в электронных базах данных PubMed/MEDLINE, EMBASE, Cochrane Library с 2005 по апрель 2025 г. Анализ и выбор исследований были проведены в соответствии с рекомендациями PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses) [12]. Поиск проводился с использованием ключевых слов «глиобластома», «эпилепсия, ассоциированная с глиобластомой», «карбамазепин», «эффективность», «нежелательные реакции», «лекарственное взаимодействие», «темозоламид».
При анализе литературы было использовано описание клинического случая больного GBM с классическим течением заболевания, лечением согласно рекомендациям МЗ РФ и стандартной противоэпилептической терапии.
Описание клинического случая
Больной С., 1995 г. р., поступил в отделение радиотерапии № 2 ГАУЗ РКОД МЗ РБ 26.10.2022 с диагнозом: Злокачественное новообразование правого полушария головного мозга с вовлечением мозолистого тела, клиническая группа 2. По данным гистологического исследования: диффузная полушарная глиома (глиобластома) Н3 G34 — мутантная, WHO Grade 4. Осложнение: Структурная фокальная эпилепсия с билатеральными тонико-клоническими эпилептическими приступами. Левосторонний умеренный гемипарез.
Из анамнеза: болен с 16.07.2022, когда впервые в жизни возник судорожный синдром с потерей сознания. По результатам компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ) головного мозга (ГМ) выявлено объемное образование в правой теменной области. После осмотра невролога был назначен леветирацетам (LEV) (в дозе 500 мг² р/д). 20.08.2022 — повторный эпиприступ с потерей сознания, госпитализирован в ГКБ № 21 г. Уфы. У пациента констатирована структурная фокальная эпилепсия с эволюцией в билатеральные тонико-клонические приступы, приступный период.
Для постановки диагноза были использованы клинические и лабораторные критерии, предлагаемые клиническими рекомендациями МЗ РФ (2020 г.), учитывались международные критерии национальной сети по борьбе с раком (National Comprehensive Cancer Network, NCCN), Американского общества радиационной онкологии (American Society for Therapeutic Radiology and Oncology, ASTRO), Европейской организации по изучению и лечению рака (European Organisation for Research and Treatmentof Cancer, EORTC).
В процессе стационарного лечения (с 20.08.2022 по 24.08.2022) проводилась симптоматическая терапия, продолжен прием леветирацетама (500 мг 2 р/д). Пациент ожидал госпитализацию по квоте в нейрохирургический центр г. Тюмени. В связи с повторяющимися эпиприступами 16.10.2022 пациенту был отменен леветирацетам и назначен карбамазепин (CBZ) (400 мг/сутки).
В Федеральном центре нейрохирургии г. Тюмени 07.09.2022 проведена стереотаксическая биопсия объемного образования головного мозга. Гистологическое заключение от 15.09.2022: Астроцитома, grade 3. При выписке рекомендовано повторное морфологическое исследование на базе референсной лаборатории. Микропрепараты консультированы в НИМЦ НХ им. акад. Н. Н. Бурденко (Москва): морфологическая картина соответствует High Grade глиоме. Выявлена мутация H3F3A вариант G34R, не выявлено мутаций IDH1, IDH2, H3F3A вариант К27 М. С учетом данных молекулярно-генетических исследований диагноз (согласно классификации опухолей ЦНС ВОЗ, 5-е издание, 2021 г.): диффузная полушарная глиома (глиобластома) Н3 G34 — мутантная, WHO Grade 4.
Первичный осмотр нейрохирурга ГАУЗ РКОД МЗ РБ (Уфа) 23.09.22. По данным МРТГМ с применением контрастирования 10.10.2022: МР-картина многофокусной опухоли ГМ с вовлечением мозолистого тела, состояние после стереотаксической биопсии. Умеренная дислокация срединных структур.
Пациент осмотрен радиотерапевтом, нейрохирургом ГАУЗ РКОД МЗ РБ, рекомендовано проведение химиолучевой терапии по радикальной программе. В период планирования лучевой терапии пациент продолжал прием карбамазепина (400 мг/сут), эпиприступы не наблюдались.
При госпитализации в отделение радиотерапии № 2 пациент был осмотрен неврологом, в качестве противоэпилептической терапии продолжен прием карбамазепина (400 мг/сут). При приеме препарата в указанной дозе самочувствие пациента оставалось удовлетворительным, эпиприступы не рецидивировали.
С 26.10.2022 по 09.12.2022 проведен радикальный курс химиолучевого лечения: ротационная лучевая терапия (ЛТ) с модуляцией объема излучения (VMAT) на линейном ускорителе электронов «ElektaInfinity» с использованием индивидуальной термопластической маски, классическим фракционированием, суммарная очаговая доза 60 Гр/30 фракций на опухолевые очаги ГМ, прием темозоломида (TMZ) (из расчета 75 мг/м² 1 раз в сутки) в дни проведения лучевой терапии. После проведения химиолучевого лечения согласно клиническим рекомендациям было проведено 2 курса химиотерапии (ХТ) в режиме темозоломид 150 мг/м². По данным МРТ ГМ от 01.2023 выявлена прогрессия заболевания, также отмечалось ухудшение самочувствия пациента ECOG 2–3. 26.01.2023 осмотрен заведующим отделением нейроонкологии ГАУЗ РКОД МЗ РБ, рекомендовано проведение оперативного вмешательства. 15.02.2023 проведена трепанация черепа с частичным удалением новообразования ГМ. Пациент консультирован химиотерапевтом, рекомендовано проведение ХТ в режиме бевацизумаб 5–10 мг/кг дни 1, 15, 29 + ломустин 90 мг/м² — день 1, каждые 6 недель. Проведено 5 курсов с 17.04.2023 по 02.11.2023. Вся терапия проводилась на фоне приема препарата карбамазепин с небольшой вариацией доз (от 400 до 600 мг/сут). 01.12.23 — госпитализирован в ГБУЗ РБ «Благовещенская ЦРБ» в связи с повторными приступами судорог с потерей сознания. В ходе контрольного обследования установлен рецидив опухоли с диссеминацией. У пациента наблюдалась симптоматическая генерализованная эпилепсия с развитием эпилептического статуса, отеком ГМ, деструктивная кома 2-й степени.
Проводилась симптоматическая терапия, пациент был переведен в отделение реанимации, где при нарастании тяжести состояния и неэффективности проводимой терапии 02.02.24 была констатирована смерть пациента.
Глиобластома: современный взгляд на проблему
Глиобластома (GBM) по классификации Всемирной организации здравоохранения относится к высокозлокачественным опухолям ГМ (WHO Grade 4) [2]. Важное место в современной онкологии занимает проблема лечения GRE [8–10].
GBM — это одна из наиболее агрессивных форм первичных ЗОГМ, на долю которой приходится до 60–70 % [3][5][13]. Заболеваемость GBM составляет от 3,2 до 5 на 100 000 человек [1][14][15] и увеличивается с возрастом: у пациентов в возрасте 40–64 лет — 57 %, старше 65 лет — 62,7 % [16]. Однако в последние годы отмечен рост заболеваемости среди пациентов в возрасте до 45 лет, что во многом связано с внедрением новых методов диагностики [6][7][17].
Диагностика GBM основывается на результатах современных методов нейровизуализации: МРТ в трех проекциях в стандартных режимах (Т1, Т2, Т1 с контрастированием, FLAIR, DWI); при локализации опухоли в области речевых и двигательных зон выполняется функциональная МРТ (фМРТ) и МР-трактография. При подозрении на диссеминацию опухоли по оболочкам спинного мозга выполняется МРТ с контрастированием всего спинного мозга. При необходимости выполняется МР-ангиография, МР-перфузия, МР-спектроскопия; при невозможности выполнения МРТ (наличие кардиостимулятора или ферромагнитных имплантов, др.) проводится КТ с контрастированием (КТ-перфузия, КТ-ангиография) [18–21]. При необходимости (дифференциальная диагностика с инфекционными, демиелинизирующими, сосудистыми и прочими заболеваниями) выполняется позитронно-эмиссионная томография (ПЭТ): ПЭТ-КТ с метионином, тирозином, ¹⁸F-DOPA [19].
Стандартом постановки диагноза является гистомолекулярное исследование биоптатов тканей, при невозможности его выполнения клинический диагноз может быть установлен на основании нейровизуализационных методик (МРТ, ПЭТ-КТ с аминокислотами) [19].
Большое значение имеет определение молекулярных биомаркеров, в том числе мутации IDH, TP53, NF1, PTEN, ATRX, TERT и амплификация EGFR, влияющих на опухолевую прогрессию, результативность проводимой терапии, риск рецидивирования, общую выживаемость, выживаемость без прогрессирования, качество жизни пациента [22].
Согласно классификации ВОЗ GBM также подразделяются на подтипы с геном изоцитратдегидрогеназы 1 или 2 (IDH) дикого типа и подтипы с мутацией IDH [18].
Несмотря на достижения в понимании патофизиологии GBM, выявление новых прогностических биомаркеров, своевременную диагностику, разработку новых методов лечения, прогноз больных GBM остается неблагоприятным [6][7][13].
GBM характеризуется низкими показателями общей и безрецидивной выживаемости, и даже при максимально возможной резекции опухоли и стандартной радиохимиотерапии медиана выживаемости, по данным разных авторов, составляет менее 2 лет [5][18]: от 8 месяцев до 12–14–18 месяцев [1][7][22][23]. Пятилетняя выживаемость больных GBM за последние три десятилетия практически не изменилась и составляет 4–5 % [7][24].
Независимым фактором риска прогноза у больных GBM является высокий уровень системного иммунного воспаления в предоперационный период [15][25]. По мнению G. Yanovich-Arad и соавторов (2021), протеомная неоднородность GBM является ключом к пониманию низкой выживаемости больных [5]. Наиболее низкая выживаемость наблюдается у пациентов с рецидивирующей и химиорезистентной GBM [26].
Современная терапия GBM включает хирургическое удаление опухоли с последующей химиолучевой терапией (ЛТ 60 Гр/30 фракций и ХТ TMZ) [7][19][26–28].
Тотальная резекция опухоли, своевременная химиолучевая терапия, метилирование промотора MGMT (O6-methylguanine-DNA methyltransferase, MGMT), отсутствие рецидива оказывают положительное влияние на выживаемость больных GBM [3, 29].
TMZ — это пероральный алкилирующий химиотерапевтический препарат, противоопухолевый эффект которого опосредован метилированием ДНК и остановкой клеточного цикла. Эффективность TMZ у пациентов с глиобластомой коррелирует с повышенным метилированием промотора MGMT [30].
Второй линией терапии является препарат Бевацизумаб, который представляет собой рекомбинантные гиперхимерные моноклональные IgG1 антитела, которые подавляют биологическую активность VEGF, препятствуя ангиогенезу в опухолевых тканях [26].
Вместе с тем за последние несколько десятилетий не отмечено значительного успеха в лечении GBM, что обусловлено опухолевой неоднородностью, гипермутацией, измененной метаболической активностью, иммунотолерантностью, высоким риском рецидива, отсутствием реакции на таргетную терапию, патофизиологическими особенностями GBM [24]. Кроме того, выявлены сложные структурные и функциональные взаимосвязи между GBM и клеточной архитектурой мозга, включающей нейроны, глию и сосуды, что оказывает значимое влияние на распространение и рецидив GBM, а также на общую выживаемость пациентов, демонстрируя сложное взаимодействие между опухолью и ЦНС [4][7][13][31].
На выживаемость больных GBM влияют мутации изоцитратдегидрогеназы (isocitratedehydrogenase, IDH). У пациентов с мутацией IDH общая выживаемость выше, чем у больных с глиомой IDH дикого типа [32][33].
К тому же GBM с IDH дикого типа возникает у пациентов в более молодом возрасте [32][33], как и в представленном клиническом случае.
Общая выживаемость (Overallsurvival, OS) и выживаемость без прогрессирования (Progression-freesurvival, PFS) выше у больных с метилированием промотора MGMT, что связано со снижением экспреcсии MGMT [32]. Однако метилирование промотора MGMT встречается, как правило, у больных с вторичными GBM. Помимо этого, у больных GBM с мутациями IDH1 и метилированием MGMT наблюдается не только увеличение OS и PFS, но и более высокая чувствительность к ЛТ и темозоламиду [32]. Это согласуется с представленными клиническими данными: у пациента С. заболевание дебютировало в возрасте 27 лет, при иммуногистохимическом исследовании не было выявлено мутаций IDH1 и IDH2, время до прогрессирования после окончания радикального курса химиолучевого лечения составило менее двух месяцев.
Эпилепсия, ассоциированная с опухолью, развивается у больных ЗОГМ в 40–75 % случаев, что значимо снижает качество жизни и ухудшает прогноз заболевания [16v34].
При этом у больных с глиомой I–II степени злокачественности эпилепсия развивается в 45–95 % случаев, а с глиомой III–IV степени злокачественности — в 30–70 % случаев [9][10][16]. У больных GBM эпилепсия развивается в 25–60 % случаев, что можно объяснить меньшей продолжительностью жизни [19]. На риск развития и тяжесть течения GRE оказывают влияние первичный объем опухоли, характер роста, локализация, наличие предоперационных судорог, мутации IDH1–2, объем остаточной опухоли [22][35]. Чаще GRE развивается при расположении GBM в корковой, височной, лобной, теменной, субвентрикулярной, островковой зонах ГМ [11]. Так, по данным МРТ ГМ описанного клинического случая у больного С. первичная опухоль ГМ определялась в правой лобно-теменной области с вовлечением серого и белого вещества с вовлечением мозолистого тела, частичным распространением на базальные ядра и правый таламус. При GBM наблюдаются фокальные, тонико-клонические припадки с/без нарушения сознания, с/без вторичной генерализацией, а также сложные парциальные и соматосенсорные припадки [9][17].
В рассматриваемом случае заболевание манифестировало развитием эпиприступа с потерей сознания. У пациента была диагностирована структурная фокальная эпилепсия с трансформацией в билатеральные тонико-клонические приступы.
GRE сопровождается развитием когнитивной дисфункции, неврологического дефицита, депрессии, нарушением социального функционирования [9][36].
У 20–45 % пациентов эпиприпадки являются первым проявлением GBM, что способствует ее своевременной диагностике и терапии [1][36][37]. Нередко эпиприступы появляются в процессе лечения/рецидива GBM и сопровождаются нарастанием неврологического дефицита [16]. Это является негативным прогностическим признаком и коррелирует со снижением OS [22][37][38].
Прогрессия заболевания в представленном клиническом случае сопровождалась нарастанием тяжести общего состояния пациента: увеличением частоты и тяжести эпиприступов, неспособностью к самообслуживанию, значительным ограничением физической активности, головными болями, снижением когнитивного потенциала, сложностью в коммуникации (дислексия, дизартрия, дислалия) и др.
Несмотря на многочисленные исследования, механизмы эпилептогенеза у больных GBM во многом остаются неизвестными [37][39].
Этиопатогенез GRE является сложным, многофакторным и отражает взаимозависимость процессов онко- и эпилептогенеза, что определяет нарушения функционирования нейромедиаторных, ферментных систем ГМ, ионных каналов, транспортеров, электролитные нарушения и др. [11][40].
Развитию эпиприступов способствуют гипоксия, отек ГМ, оксидативный стресс, ацидоз, метаболические, иммунологические и воспалительные изменения [11][15][24][41].
При этом гиперпродукция активных форм кислорода (АФК) с нарушением окислительной функции митохондрий способствует активации эффекта Варбурга в клетках опухоли (преобладание гликолиза в процессах энергообеспечения даже в условиях нормоксии), что является неотъемлемой частью опухолевой прогрессии [11][42].
Большая роль в развитии GRE принадлежит гиперэкспрессии и дисрегуляции ряда генов (PTEN, TERT, VEGF, NF1 и TP53) [11][22]. Это частично может объяснить ограниченную эффективность ряда противоэпилептических препаратов (ПЭП), а также сохранение эпиприступов после удаления опухоли у больных GBM [11].
Так, установлена гиперэкспрессия гена рецептора эпидермального фактора роста (epidermalgrowthfactorreceptor, EGFR), уровень которого коррелирует с риском развития судорог у больных GBM как до, так и после операции [33].
Неблагоприятным прогностическим признаком является мутация промотора обратной транскриптазы теломеразы (Telomerase reversetranscriptase, TERT), гиперэкспрессия фактора роста эндотелия сосудов VEGF (VEGF-A) — медиатора ангиогенеза и прогрессии GBM [22].
При этом неоангиогенез у больных GBM является причиной дисфункции гематоэнцефалического барьера (ГЭБ), что способствует проникновению сывороточных белков в паренхиму ГМ, развитию вазогенного отека и повышению внутричерепного давления (ВЧД) [10][22].
Это сопровождается потерей нейронов, глии, усилением воспалительной реакции в перитуморальной зоне с повышением концентрации цитокинов (интерлейкины IL-1β, IL-6, IL-8, фактор некроза опухоли — TNF-α), хемокинов, металлопротеиназ (ММП-2 и ММП-9), ферментов ремоделирования внеклеточного матрикса, что способствует эпилептогенезу и опухолевой прогрессии [10][22][37][43].
Важная роль в формировании гипервозбудимой среды и дисфункции нейронных сетей с развитием судорог у больных GBM принадлежит дисфункции ионных каналов [11].
Так, в перитуморальной зоне выявлена экспрессия генов K⁺-каналов (KCNA1,2; KCNAB2; KCNC1; KCNH1,5; KCNS1; KCNT1) c изменением их функции, накоплением внеклеточного K⁺, нарушением обратного захвата глутамата, что обуславливает снижение порога возбудимости нейронов, а также нарушение процессов деполяризации/реполяризации [22].
Гиперэкспрессия субъединиц K⁺-каналов, в том числе активируемого Ca2⁺, KCNN4, коррелирует с клеточной пролиферацией при GBM [11].
В перитуморальной зоне обнаружено скопление субпопуляций олигодендроцитов-предшественников (СОП), которые экспрессируют ген, кодирующий калиевый потенциалзависимый ионотропный канал, подсемейство D, тип 2 (potassiumvoltage-gatedchannelsubfamily D, KCND2), который кодирует потенциалзависимый калиевый канал K⁺ KV4.2, повышающий возбудимость нейронов в результате накопления внеклеточного K⁺ [40].
Выявлено, что KCND2 играет решающую роль во взаимосвязи электрической активности между нервными и опухолевыми клетками. Это открытие указывает на то, что СОП могут быть вовлечены в патогенез судорог у больных GBM [40].
В перитуморальной зоне выявлены генетически обусловленные изменения экспрессии и функции Na⁺-каналов: гиперэкспрессия SCN1A и SCN2A, участвующих в формировании эпилепсии, при снижении экспрессии SCN5A, 8A и SCN1B [11].
Также установлена гиперэкспрессия дисрегуляторных Ca²⁺-каналов, изменение активности которых связано с возникновением эпиприступов [11]. Более того, показано, что концентрация ионов Ca2+ коррелирует с пролиферацией опухолевых клеток, их миграцией и апоптозом [31].
В результате в перитуморальной зоне нарушается экспрессия ионных каналов, гомеостаз тормозных и возбуждающих нейротрансмиттеров, электрохимическое взаимодействие между нейронами и клетками опухоли, что вносит значимый вклад в эпилептогенез при GBM [37].
Большая роль в этиопатогенезе GRE принадлежит процессам нейровоспаления с дисфункцией иммунной системы [10][28][35].
В перитуморальной зоне формируется воспалительное микроокружение опухоли (tumormicroenvironment, TME), которое включает клетки GBM, иммунной, нервной системы, кровеносные сосуды ГМ, слои внеклеточного матрикса и др. [31]. В результате формируется сложная многоклеточная система, высоко адаптируемая и устойчивая к химиолучевой терапии, что в значительной мере определяет опухолевую прогрессию и прогноз заболевания [31][44].
У больных GBM выявлена количественная и функциональная несостоятельность NK-клеток [31]. Этому способствует TME путем секреции TGFβ, который подавляет экспрессию NKG2D-активирующего рецептора на NK-клетках, выделенных у пациентов с GBM [10][31][35].
В последние годы показано, что медиаторная система ГМ (глутамат, ГАМК, норадреналин, дофамин, серотонин, аденозин) и нейромодуляторы в микроокружении GBM играют значимую роль в процессах патологической возбудимости, а также пролиферации, дифференцировке нейронов, клеток глии [1][45].
При GBM выявлено нарушение гомеостаза глутамата с повышением его внеклеточного уровня в 100 раз по сравнению с интактным ГМ [40][46]. Основным механизмом повышения внеклеточного глутамата является его секреция через цистин/глутаматный антипортер (SLC7A11 или xCT), экспрессия которого связана с возникновением судорог, а при GBM выявлена гиперэкспрессия данного антипортера, которая рассматривается как независимый биомаркер GRE [10][16][33][43].
Этому способствует формирующийся дефицит глутаматсинтетазы, участвующей в превращении глутамата в глютамин [10]. Опосредованная глутаматом передача сигналов может формировать «петли обратной связи», приводящие к повышенной возбудимости глиомно-нейронной сети [31][35].
В GBM выявлена гиперэкспрессия ионо- и метаботропных рецепторов глутамата, причем самая высокая экспрессия — mGluR3, которым принадлежит большое значение в процессах возбудимости нейронов и нейротрансмиссии [11].
Установлено, что взаимодействие глутамата с AMPA-рецепторами (α-amino-3-hydroxy-5-methyl-4-isoxazolepropionicacid) обуславливает не только повышение судорожной активности, но и прогрессию опухолевого роста [14][35][46][47]. Показано, что TME потенцирует активирующее действие глутамата на AMPA-рецепторы [31].
Также в развитии GRE большое значение имеет активация глутаматных NMDA-рецепторов [16]. Это сопровождается повышением выброса нейротрофического фактора головного мозга (brain-derived neurotrophic factor, BDNF), увеличением синаптических связей между перитуморальными нейронами и клетками глиомы, активацией нейроглии [31][43]. Модуляция синаптической пластичности, осуществляемая BDNF, протекает с участием трансмембранного рецептора тирозинкиназы B (Tropomyosinreceptorkinase B, TrkB) [31]. Показано, что повышение экспрессии BDNF и TrkB, наблюдаемое при GBM, коррелирует с опухолевой прогрессией и подавлением апоптоза [31].
В развитии GRE значимая роль принадлежит нарушению ГАМК-ергической нейротрансмиссии, прежде всего в перитуморальной зоне: выявлена гиперэкспрессия ГАМК-рецепторов, подавление тормозных влияний, появление парадоксальных возбуждающих эффектов, опосредованных изменениями гомеостаза Cl⁻ в нейронах и опухолевых клетках [11][33].
Этому способствует повышение концентрации K⁺ во внеклеточной среде, нарушение сбалансированного функционирования котранспортеров K⁺, Cl⁻ (KCC2) (выводящего Cl⁻ из клетки), и Na⁺, K⁺, 2Cl⁻ (NKCC1) (транспортирующего Cl⁻ в клетку), результатом чего является появление парадоксальной деполяризации и функциональной активации нейронов, и не только подавление ГАМКергического торможения, но и возможное появление возбуждения, опосредованного ГАМК [11][22][33][43]. Более того, повышение уровня NKCC1 при значительном снижении KCC2 в перитуморальных нейронах способствует повышению концентрации глутамата [43].
Лечение эпилепсии, ассоциированной с глиобластомой
Для лечения эпиприступов у больных ЗОГМ нередко используют LEV и вальпроевую кислоту (VPA) [9][16][17][48]. Однако применение VPA ограничено тяжелой гепато-, гемато-, нейротоксичностью, риском кровотечений, эндокринными нарушениями, риском ЛВЗ (лекарственное взаимодействие) ввиду ингибирующего влияния VPA на активность моноксигеназной системы (МОС) печени [41][42][49]. При применении LEV, который обладает значительно меньшей токсичностью и низким риском ЛВЗ, возможны гематотоксичность, значимые нарушения со стороны ЦНС (агрессия, психоз, суицидальные намерения, галлюцинации, двигательные нарушения и др.), что может существенно ухудшить состояние больных GBM [49].
В последние годы появляются сведения о возможности применения перампанела (PER) для лечения эпилепсии у больных ЗОГМ [50]. Однако сведения о клинической эффективности PER у больных ЗОГМ крайне малочисленны и требуют дальнейших наблюдений [50].
В лечении GRE показана высокая эффективность ПЭП, блокирующих Na⁺-каналы — CBZ и ламотриджина (LTG) [51][52]. При этом применение CBZ у больных эпилепсией (без GBM) обеспечивает более раннее достижение и длительность ремиссии по сравнению с LTG при равных по частоте и тяжести нежелательных лекарственных реакциях (НЛР) [52]. Более частое назначение CBZ у больных GRE обусловлено высокой клинической эффективностью, хорошей переносимостью и многолетним опытом применения [36][51–53].
Карбамазепин в лечении эпилепсии, ассоциированной с глиобластомой
CBZ был создан Вальтером Шиндлером в 1953 г. (лаборатория J. R. Geigy A. G., Швейцария). В качестве ПЭП CBZ стал применяться в Великобритании с 1965 г., а с 1970-х гг. — во всем мире [53].
При эпилепсии CBZ высокоэффективен в лечении фокальных и тонико-клонических припадков с/без вторичной генерализацией [36].
Эффективность CBZ в монотерапии эпилепсии составляет 75–85 %, при этом почти у половины пациентов при лечении криптогенных и симптоматических форм эпилепсии возможно полное прекращение припадков [53].
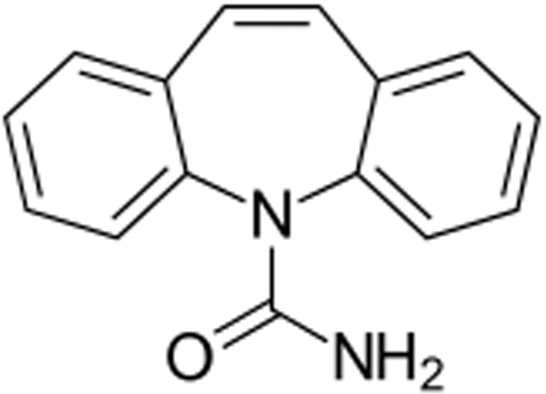
Карбамазепин (C15H12N2O)
CBZ оказывает не только противосудорожное, но и антидепрессивное, седативное действие, эффективен в коррекции нарушений поведения, настроения, в лечении биполярного аффективного расстройства (БАР), нейропатической боли [36][54]. Это очень важно для больных GBM, поскольку появление судорог часто сопровождается развитием тревоги и депрессивных нарушений, что снижает качество жизни и выживаемость [42]. CBZ обладает также миорелаксирующим действием [36][53].
В механизме противосудорожного действия CBZ важную роль играет блокада потенциал-зависимых Na⁺-каналов (около 50 %) и пролонгирование их инактивированного состояния [53]. Влияя на α1-, β2-, γ2-субъединицы ГАМКа-рецепторов, CBZ увеличивает проводимость Cl⁻-каналов, потенцируя тормозные эффекты ГАМК [53]. CBZ уменьшает высвобождение глутамата, подавляет активность Ca²⁺-каналов, а также повышает проводимость тормозных потенциал-зависимых K⁺-каналов, нормализуя гомеостаз K⁺ в ЦНС [53]. CBZ снижает метаболизм норадреналина и дофамина в ЦНС [53]. Большое значение имеет способность CBZ повышать уровень BDNF-фактора в ЦНС [53].
В фармакокинетике CBZ заслуживает внимания его метаболизм. CBZ метаболизируется в печени при участии микросомальных ферментов (CYP3 А4, CYP1A2, CYP2A6, CYP2C8, CYP3A5) с образованием токсичного метаболита 10,11-эпоксида [55].
В то же время в процессе метаболизма CBZ на разных этапах участвуют другие изоформы МОС печени: CBZ-10,11-Trans-diol (CYP2C8, CYP2C19, EPHX1), 3-hydroxyCBZ (CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2D6, CYP3A4), 2,3-hydroxyCBZ (CYP3A4, CYP3A5) [53].
Изменение активности указанных изоформ при применении других лекарственных препаратов (ЛП) может влиять на концентрацию CBZ в сыворотке крови и, следовательно, на его противосудорожную активность [49]. В свою очередь, GBZ, как и фенитоин, являясь индуктором МОС печени, способен изменять метаболизм/эффективность совместно применяемых ЛП [55][56]. Период полувыведения CBZ составляет от 25 до 65 часов, что связано с генетическим полиморфизмом CYP3 А4, CYP3 А5, SCN1Ars3812718 и может уменьшаться более чем в 2 раза при длительном применении CBZ в связи с ускорением его метаболизма [55][57]. Результатом этого является развитие фармакокинетической толерантности, что требует своевременного повышения дозы CBZ для сохранения его противосудорожной активности [39].
При применении CBZ возможно развитие ряда НЛР [9][49].
CBZ, особенно в высоких дозах, может оказывать гепатотоксическое действие вплоть до развития гранулематозного гепатита, гепатита с гепатоцеллюлярным некрозом [39][58]. У пациентов с избыточной массой тела возможно развитие неалкогольной жировой болезни печени [59]. Учитывая индукцию CBZ микросомальных ферментов печени, что сопровождается изменением образования веществ, влияющих на фосфорно-кальциевый обмен (витамин D и его метаболиты), возможно развитие остеопении, остеопороза, что влечет за собой риск возникновения переломов [39][42][49].
Особого внимания заслуживает влияние CBZ на мочевыводящие пути (МВП): возможно возникновение острого интерстициального нефрита, гранулематозного некротизирующего ангиита с развитием острой почечной недостаточности (ОПН), а также олиго- и анурии [9][17][49]. Особый риск представляет развитие гипонатриемии, которая наиболее часто наблюдается у пациентов, имеющих в анамнезе заболевания сердечно-сосудистой системы (ССС) или МВП и получающих такие ЛП, как диуретики, ингибиторы ангиотензинпревращающего фермента и др. [36][39].
Как и другие ПЭП, блокирующие Na⁺-, K⁺-, Ca²⁺-каналы, CBZ может вызвать нарушения ритма и проводимости сердца, развитие фатальных аритмий, изменение интервала QT и др. [17][60]. У больных с сопутствующей патологией ССС возможно прогрессирование сердечной недостаточности. Также CBZ повышает уровень липидов в сыворотке крови [60]. В связи с этим CBZ не применяется у пациентов с блокадными аритмиями, тяжелой почечной/печеночной недостаточностью [17].
Также возможно развитие гипогонадизма, особенно у мужчин, с нарушением сексуальной функции [36][39]. Применение CBZ нередко сопровождается развитием гипотиреоза [49].
CBZ может вызвать нарушение нервно-мышечной проводимости, повреждение мышц иммунного генеза [36].
При применении CBZ возможно развитие ряда двигательных нарушений (тики, тремор, дистония, нарушения координации), невритов, редко — галлюцинаций, дезориентации [9][49][61]. После отмены CBZ указанные двигательные нарушения устраняются в течение 8–9 дней [61].
Использование CBZ может вызвать нарушения зрения, слуха, гематологические изменения (снижение тромбоцитов, лейкоцитов, развитие анемии) [9][49].
При лечении больных GRE особое значение имеет ЛВЗ совместно применяемых препаратов — ПЭП и противоопухолевых, поскольку возможно как изменение/снижение эффективности, так и повышение риска развития НЛР, обусловленных каждым из препаратов [30][48].
CBZ индуцирует МОС печени (CYP3A4, CYP2C9, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP3A4/5, CYP24), что обуславливает ускорение метаболизма других ЛП, в том числе противоопухолевых ЛП и высокий риск ЛВЗ [36][41].
Однако TMZ, основной препарат для лечения GBM, не метаболизируется в печени, и CBZ не влияет на его метаболизм, а следовательно, и на его противоопухолевую активность [17].
Учитывая, что CBZ и TMZ могут вызвать лейкопению, агранулоцитоз, тромбоцитопению, при совместном их применении возможно усугубление гематотоксичности [9][49]. Индуцируя МОС печени, CBZ может ускорять метаболизм преднизолона и дексаметазона, снижая их концентрацию в сыворотке крови, что требует коррекции дозы [62]. В то же время антидепрессанты (флуоксетин и флуоксамин), снижая активность ряда изоформ МОС (CYP3A4, CYP3A5, CYP1A2, CYP2D6), способны влиять на эффективность CBZ [42][53]. Кроме того, флуоксетин, вызывая гипонатриемию, может усугубить НЛР CBZ [53].
Безусловно, особого внимания заслуживает влияние CBZ на опухолевую прогрессию у больных GBM [34][61]. В исследовании В. Cacho-Diaz и соавторов (2018) при изучении влияния ряда ПЭП на выживаемость больных с ЗОГМ было показано, что OS была выше у пациентов, получавших CBZ (p = 0,02), LTG (p = 0,015), LEV (p = 0,03) и VPA (p = 0,009) [63]. Экспериментальное изучение противоопухолевой активности ряда ПЭП на шести клеточных линиях злокачественной глиомы (A 172, AM 38, T98G, U-138MG, U-251MG и YH 13) выявило, что CBZ подавлял клеточную пролиферацию в трех клеточных линиях [34]. Вероятно, в механизме противоопухолевого действия CBZ имеет значение блокада потенциал-зависимых Na⁺-каналов, гиперэкспрессия которых наблюдается во многих злокачественных клетках, а их блокада может способствовать подавлению опухолевой прогрессии [53]. Известно, что нейровоспалению принадлежит огромная роль как в опухолевой прогрессии, так и в эпилептогенезе [64][65]. Показано, что CBZ способен уменьшать нейровоспаление, снижая уровень провоспалительных цитокинов (IL-1β, TNF-α), образование NO, экспрессию iNOS и др. [66]. Большое значение имеет устранение гиперэкспрессии дисрегулярных Ca²⁺-каналов, восстановление гомеостаза K+, тормозных (ГАМК-ергических) и возбуждающих (глутаматергических) нейромедиаторных систем ЦНС и др.
Имеющиеся данные не могут в полной мере объяснить высокую эффективность CBZ в лечении GRE, что требует дальнейших углубленных исследований механизмов его противоэпилептической и, вероятно, противоопухолевой активности.
ЗАКЛЮЧЕНИЕ
GBM — это высокоагрессивная, быстропрогрессирующая, плохо поддающаяся терапии первичная ЗОГМ. Течение GBM часто осложняется развитием GBM-ассоциированной эпилепсии, которая может быть как первым проявлением заболевания, так и появляться в процессе лечения. GRE существенно утяжеляет состояние пациентов, ухудшает прогноз заболевания и требует применения ПЭП.
Несмотря на огромный арсенал ПЭП, в том числе препаратов 3-го поколения, важное место в лечении GRE по-прежнему занимает CBZ. Это обусловлено его высокой клинической эффективностью, хорошей переносимостью и значительным опытом применения.
Отличительной особенностью CBZ является отсутствие его влияния на фармакокинетику и противоопухолевую эффективность TMZ. Более того, CBZ обладает определенным собственным противоопухолевым эффектом, в механизме которого имеет значение снижение пролиферации клеток GBM, уменьшение нейровоспаления, устранение дисфункции Na⁺, Ca2⁺, K⁺, Cl⁻-каналов, восстановление гомеостаза глутамата со снижением его внеклеточного уровня, уменьшение/устранение дисфункции нейромедиаторных систем ЦНС.
Учитывая вышесказанное, а также сведения о положительном влиянии CBZ на продолжительность жизни у больных GBM, незначительные НЛР, отсутствие ЛВЗ между CBZ и TMZ, накопленный значительный опыт применения, CBZ остается одним из основных ПЭП для лечения эпилепсии у больных GBM.
Список литературы
1. Hu S., Kao H.Y., Yang T., Wang Y. Early and Bi-hemispheric seizure onset in a rat glioblastoma Multiforme model. Neurosci Lett. 2022;766:136351. DOI: 10.1016/j.neulet.2021.136351
2. Wang G.M., Cioffi G., Patil N., Waite K.A., Lanese R., Ostrom Q.T., et al. Importance of the intersection of age and sex to understand variation in incidence and survival for primary malignant gliomas. Neuro Oncol. 2022;24(2):302–10. DOI: 10.1093/neuonc/noab199
3. Chehade G., Lawson T.M., Lelotte J., Daoud L., Di Perri D., Whenham N., et al. Long-term survival in patients with IDH-wildtype glioblastoma: clinical and molecular characteristics. ActaNeurochir (Wien). 2023;165(4):1075–85. DOI: 10.1007/s00701-023-05544-3
4. Salvalaggio A., Pini L., Bertoldo A., Corbetta M. Glioblastoma and brain connectivity: the need for a paradigm shift. Lancet Neurol. 2024;23(7):740–8. DOI: 10.1016/S1474-4422(24)00160-1
5. Yanovich-Arad G., Ofek P., Yeini E., Mardamshina M., Danilevsky A., Shomron N., et al. Proteogenomics of glioblastoma associates molecular patterns with survival. Cell Rep. 2021;34(9):108787. DOI: 10.1016/j.celrep.2021.108787
6. Hamad A., Yusubalieva G.M., Baklaushev V.P., Chumakov P.M., Lipatova A.V. Recent developments in glioblastoma therapy: oncolytic viruses and emerging future strategies. Viruses. 2023;15(2):547. DOI: 10.3390/v15020547
7. Roda D., Veiga P., Melo J.B., Carreira I.M., Ribeiro I.P. Principles in the management of glioblastoma. Genes. 2024;15(4):501. DOI: 10.3390/genes15040501
8. Coppola A., Hernandez-Hernandez L., Balestrini S., Krithika S., Moran N., Hale B., et al. Cortical myoclonus and epilepsy in a family with a new SLC20A2 mutation. J Neurol. 2020;267(8):2221–7. DOI: 10.1007/s00415-020-09821-4
9. de Bruin M.E., van der Meer P.B., Dirven L., Taphoorn M.J.B., Koekkoek J.A.F. Efficacy of antiepileptic drugs in glioma patients with epilepsy: a systematic review. NeurooncolPract. 2021;8(5):501–17. DOI: 10.1093/nop/npab030
10. Rossi J., Cavallieri F., Bassi M.C., Biagini G., Rizzi R., Russo M., et al. Efficacy and tolerability of perampanel in brain tumor-related epilepsy: a systematic review. Biomedicines. 2023;11(3):651. DOI: 10.3390/biomedicines11030651
11. Soeung V., Puchalski R.B., Noebels J.L. The complex molecular epileptogenesis landscape of glioblastoma. Cell Rep Med. 2024;5(8):101691. DOI: 10.1016/j.xcrm.2024.101691
12. Moher D., Liberati A., Tetzlaff J., Altman D.G. PRISMA Group. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. BMJ. 2009;3(3):e123–30. DOI: 10.1136/bmj.b2535
13. Xu K., Zhang C., WeiGao, Shi Y., Pu S., Huang N., et al. The involvement of circRNAs in molecular processes and their potential use in therapy and diagnostics for glioblastoma. Gene. 2025;940:149214. DOI: 10.1016/j.gene.2025.149214
14. Cruz N., Herculano-Carvalho M., Roque D., Faria C.C., Cascao R., Ferreira H.A., et al. Highlighted advances in therapies for difficultto-treat brain tumours such as glioblastoma. Pharmaceutics. 2023 15(3):928. DOI: 10.3390/pharmaceutics 15030928
15. An J., Freeman E., Stewart I.J., Dore M. Association of traumatic brain injury and glioblastoma multiforme: a case series. Mil Med. 2024;189(1–2):e391–5. DOI: 10.1093/milmed/usad162
16. Lange F., Hornschemeyer J., Kirschstein T. Glutamatergic mechanisms in glioblastoma and tumor-associated epilepsy. Cells. 2021;10(5):1226. DOI: 10.3390/cells10051226
17. Stella M., Baiardi G., Pasquariello S., Sacco F., Dellacasagrande I., Corsaro A., et al. Antitumor potential of antiepileptic drugs in human glioblastoma: pharmacological targets and clinical benefits. Biomedicines. 2023;11(2):582. DOI: 10.3390/biomedicines11020582
18. Molinaro A.M., Hervey-Jumper S., Morshed R.A., Young J., Han S.J., Chunduru P., et al. Association of maximal extent of resection of contrast-enhanced and non-contrast-enhanced tumor with survival within molecular subgroups of patients with newly diagnosed glioblastoma. JAMA Oncol. 2020;6(4):495–503. DOI: 10.1001/jamaoncol.2019.6143
19. Schaff L.R., Mellinghoff I.K. Glioblastoma and other primary brain malignancies in adults: a review. JAMA. 2023;329(7):574–87. DOI: 10.1001/jama.2023.0023
20. Рахматуллина И.Р., Золотухин К.Н., Самородов А.В. Реализация технологий «Point-of-care testing» в условиях интенсивной терапии. Наука и инновации в медицине. 2017;4(8):23–7.
21. Золотухин К.Н., Поляков И.В., Самородов А.В. Сравнительный анализ мониторинга центральной гемодинамики монитором МПР 6-03 «Тритон» и «Picco plus». Тольяттинский медицинский консилиум. 2012;3–4:19–23.
22. Hills K.E., Kostarelos K., Wykes R.C. Converging mechanisms of epileptogenesis and their insight in glioblastoma. Front. Mol. Neurosci. 2022;15:903115. DOI: 10.3389/fnmol.2022.903115
23. Verma S., Malviya R., Uniyal P. Survival of patients with primary brain tumor: a data analysis of 10 years. Curr Pharm Des. 2024;30(15):1129– 32. DOI: 10.2174/0113816128306113240328050608
24. Grabowski M.M., Sankey E.W., Ryan K.J., Chongsathidkiet P., Lorrey S.J., Wilkinson D.S., et al. Immune suppression in gliomas. J Neurooncol. 2021;151(1):3–12. DOI: 10.1007/s11060-020-03483-y
25. Duan X., Yang B., Zhao C., Tie B., Cao L., Gao Y. Prognostic value of preoperative hematological markers in patients with glioblastoma multiforme and construction of random survival forest model. BMC Cancer. 2023;23(1):432. DOI: 10.1186/s12885-023-10889-0
26. Tong E., Horsley P., Wheeler H., Wong M., Venkatesha V., Chan J., et al. Hypofractionated re-irradiation with bevacizumab for relapsed chemorefractory glioblastoma after prior high dose radiotherapy: a feasible option for patients with large-volume relapse. J Neurooncol. 2024;168(1):69–76. DOI: 10.1007/s11060-024-04643-0
27. Ванг Юи, Муфазалова Н.А., Муфазалова Л.Ф., Ильясова Н.В., Мурадова Р.Р., Киёмов И.Э. и др. Перспективы применения перампанела в лечении эпилепсии у пациентов со злокачественными глиомами головного мозга. Обзоры по клинической фармакологии и лекарственной терапии. 2024;22(3):223–36. DOI: 10.17816/RCF629243
28. Ураков А.Л., Никитина И.Л., Клен Е.Э., Ванг Ю., Самородов А.В. Перспективы фармакологической валидации использования тромбоцитов в качестве «периферической модели» нейронов. Обзоры по клинической фармакологии и лекарственной терапии. 2023;21(4):307–17. DOI: 10.17816/RCF568907
29. Hertler C., Felsberg J., Gramatzki D., Le Rhun E., Clarke J., Soffietti R., et al. Long-term survival with IDH wildtype glioblastoma: first results from the ETERNITY Brain Tumor Funders’ Collaborative Consortium (EORTC 1419). Eur J Cancer. 2023;189:112913. DOI: 10.1016/j.ejca.2023.05.002
30. Climans S.A., Brandes A.A., Cairncross J.G., Ding K., Fay M., Laperriere N., et al. Temozolomide and seizure outcomes in a randomized clinical trial of elderly glioblastoma patients. J. Neurooncol. 2020;149(1):65–71. DOI: 10.1007/s11060-020-03573-x
31. Sharma P., Aaroe A., Liang J., Puduvalli V.K. Tumor microenvironment in glioblastoma: Current and emerging concepts. Neurooncol Adv. 2023;5(1):vdad009. DOI: 10.1093/noajnl/vdad009
32. Senhaji N., SqualliHoussaini A., Lamrabet S., Louati S., Bennis S. Molecular and circulating biomarkers in patients with glioblastoma. Int J Mol Sci. 2022;23(13):7474. DOI: 10.3390/ijms23137474
33. Du Y., Li R., Fu D., Zhang B., Cui A., Shao Y., et al. Multi-omics technologies and molecular biomarkers in brain tumor-related epilepsy. CNS NeurosciTher. 2024;30(4):e14717. DOI: 10.1111/cns.14717
34. Yagi C., Tatsuoka J., Sano E., Hanashima Y., Ozawa Y., Yoshimura S., et al. Anti-tumor effects of anti-epileptic drugs in malignant glioma cells. Oncol Rep. 2022;48(6):216. DOI: 10.3892/or.2022.8431
35. Lopez-Anguita S., Gutierrez-Ruano B., Munoz-Gonzalez A., Valenzuela-Rojas F.J., Olmedilla-Gonzаlez M.N. Epilepsy in cancer patients: primary prevention and the importance of high-risk patient screening. Rev Neurol. 2022;75(11):349–56. DOI: 10.33588/rn.7511.2022200
36. Sanchez-Villalobos J.M., Aledo-Serrano A., Villegas-Martinez I., Shaikh M.F., Alcaraz M. Epilepsy treatment in neuro-oncology: A rationale for drug choice in common clinical scenarios. Front Pharmacol. 2022;13:991244. DOI: 10.3389/fphar.2022.991244
37. Tabaee Damavandi P., Pasini F., Fanella G., Cereda G.S., Mainini G., DiFrancesco J.C., et al. Perampanel in brain tumor-related epilepsy: a systematic review. Brain Sci. 2023;13(2):326. DOI: 10.3390/brainsci13020326
38. Demetz M., Hecker C., Salim H.A., Krigers A., Steinbacher J., Machegger L., et al. Epilepsy as primary tumor manifestation correlates with patient status, age, and tumor volume but not with survival in elderly glioblastoma patients: a retrospective bicentric analysis. Neurosurg Rev. 2025;48(1):264. DOI: 10.1007/s10143-025-03397-1
39. Loscher W., Klein P. The pharmacology and clinical efficacy of antiseizure medications: from bromide salts to cenobamate and beyond. CNS Drugs. 2021;35(9):1033–4. DOI: 10.1007/s40263-021-00827-8
40. Zhang Y., Duan W., Chen L., Chen J., Xu W., Fan Q., et al. Potassium ion channel modulation at cancer-neural interface enhances neuronal excitability in epileptogenic glioblastoma multiforme. Neuron. 2025;113(2):225–43. DOI: 10.1016/j.neuron.2024.10.016
41. Ruda R., Mo F., Pellerino A. Epilepsy in brain metastasis: an emerging entity. Curr Treat Options Neurol. 2020;22(2):6. DOI: 10.1007/s11940- 020-0613-y
42. Armstrong T.S., Grant R., Gilbert M.R., Lee J.W., Norden A.D. Epilepsy in glioma patients: Mechanisms, management, and impact of anticonvulsant therapy. Neuro-Oncology. 2016;18(6):779–89. DOI: 10.1093/neuonc/nov269
43. Radin D.P., Tsirka S.E. Interactions between tumor cells, neurons, and microglia in the glioma microenvironment. Int. J. Mol. Sci. 2020;21(22):8476. DOI: 10.3390/ijms21228476
44. Prager B.C., Bhargava S., Mahadev V., Hubert C.G., Rich J.N. Glioblastoma stem cells: driving resilience through chaos. Trends Cancer. 2020;6(3):223–35. DOI: 10.1016/j.trecan.2020.01.009
45. Joghataei M.T., Bakhtiarzadeh F., Dehghan S., Ketabforoush A.H.M.E., Golab F., Zarbakhsh S., et al. The role of neurotransmitters in glioblastoma multiforme-associated seizures. Int J Dev Neurosci. 2023;83(8):677–90. DOI: 10.1002/jdn.10294
46. Wang Yu., Bulatova N.R., Klen E.E., Rozit G.A., Nikitina I.L., Startseva L.V., et al. Efficacy of 4-(2-(4-nttrophenyl)-2-oxoethyl)-1- (thietane-3-yl)-1h-1,2,4-triazol-4 bromide in the rat model of inferior vena cava thrombosis. Translational medicine. 2024;11(1):19–27. DOI: 10.18705/2311-4495-2024-11-1-19-27
47. Kamilov F.K., Timirkhanova G.A., Samorodov A.V., Khaliullin F.A. Choosing potential dissolution medium to study the influence of water-insoluble substances on aggregation of platelets within preclinical studies under conditions in vitro. Biology and Medicine. 2013; 5(1):15–9.
48. Maschio M., Aguglia U., Avanzini G., Banfi P., Buttinelli C., Capovilla G, et al. Management of epilepsy in brain tumors. Neurol Sci. 2019;40(10):2217–34. DOI: 10.1007/s10072-019-04025-9
49. Муфазалова Н.А., Валеева Л.А., Муфазалова Л.Ф., Батракова К.В. Нежелательные лекарственные реакции. Взаимодействие лекарственных средств. Противоэпилептические препараты. Уфа; 2021.
50. Wang Y., Yang H., Li N., Wang L., Guo C., Ma W., et al. A novel ubiquitin ligase adaptor PTPRN suppresses seizure susceptibility through endocytosis of NaV1.2 sodium channels. Adv Sci. 2024;11(29):e2400560. DOI: 10.1002/advs.202400560
51. Василенко А.В., Улитин А.Ю., Лебедев И.А., Аблаев Н.Р., Диконенко М.В., Мансуров А.С. и др. Эпилепсия у больных с глиобластомой: механизмы возникновения и проблемы лечения (часть 2). Медицинский алфавит. 2023;(33):13–9. DOI: 10.33667/2078-5631-2023-33-13-19
52. Beydoun A., DuPont S., Zhou D., Matta M., Nagire V., Lagae L. Current role of carbamazepine and oxcarbazepine in the management of epilepsy. Seizure. 2020;83:251–63. DOI: 10.1016/j.seizure.2020.10.018
53. Шнайдер Н.А., Бочанова Е.Н., Дмитренко Д.В. и др. Фармакогенетика карбамазепина. Эпилепсия и пароксизмальные состояния. 2019;11(4):364–78. DOI: 10.17749/2077-8333.2019.11.4.364-378
54. Vaiman E., Gayduk A., Strelnik A., Smirnova D., Davydkin I., Fedyashov I., et al. Possible clinical and pharmacogenetic predictors of the efficacy and safety of carbamazepine in post-COVID-19 depression. Psychiatr Danub. 2022;34(8):31–7. PMID: 36170698
55. Zhao G.X., Zhang Z., Cai W.K., Shen M.L., Wang P., He G.H. Associations between CYP3A4, CYP3A5 and SCN1A polymorphisms and carbamazepine metabolism in epilepsy: A meta-analysis. Epilepsy Res. 2021;173:106615. DOI: 10.1016/j.eplepsyres.2021.106615
56. Ortega-Vazquez A., Dorado P., Fricke-Galindo I., Jung-Cook H., Monroy-Jaramillo N., Martinez-Juаrez I.E., et al. CYP2C9, CYP2C19, ABCB1 genetic polymorphisms and phenytoin plasma concentrations in Mexican-Mestizo patients with epilepsy. Pharmacogenomics J. 2016;16(3):286–92. DOI: 10.1038/tpj.2015.45
57. Riffi R., Boughrara W., Chentouf A., Ilias W., Brahim N.M.T., Berrebbah A.A., et al. Pharmacogenetics of carbamazepine: a systematic review on CYP3A4 and CYP3A5 polymorphisms. CNS Neurol Disord Drug Targets. 2024;23(12):1463–73. DOI: 10.2174/0118715273298953240529100325
58. Amos K., Garcia-Bournissen F., Zhao L., Taheri S. Carbamazepineinduced liver injury in an 11-year-old female: Case report and review of the literature. J Paediatr Child Health. 2023;59(1):165–8. DOI: 10.1111/jpc.16200
59. Drokov A.P., Lipatova L.V., Shnayder N.A. Pharmacogenetic markers for metabolic impairments in treatment with valproic acid. Neuroscience and behavioral physiology. 2020;50(1):13–9. DOI: 10.1007/s11055-019-00861-6
60. Manni R., Toscano G., Terzaghi M. Epilepsy and cardiovascular function: seizures and antiepileptic drugs effects. In: Govoni S., Politi P., Vanoli (eds) Brain and Heart Dynamics. Springer; 2020. Р. 507–15. DOI: 10.1007/978-3-030-28008-6_30
61. Rissardo J.P., Caprara A.L.F.. Carbamazepine-, Oxcarbazepine-, Eslicarbazepine-associated movement disorder: a literature review. Clin Neuropharmacol. 2020;43(3):66–80. DOI: 10.1097/WNF.0000000000000387
62. Benit C.P., Vecht C.J. Seizures and cancer: drug interactions of anticonvulsants with chemotherapeutic agents, tyrosine kinase inhibitors and glucocorticoids. Neurooncol. Pract. 2016;3(4):245–60. DOI: 10.1093/nop/npv038
63. Cacho-Diaz B., San-Juan D., Salmeron K., Boyzo C., Lorenzana-Mendoza N. Choice of antiepileptic drugs affects the outcome in cancer patients with seizures. Clin Transl Oncol. 2018;20(12):1571–6. DOI: 10.1007/s12094-018-1892-6
64. Kobylarek D., Iwanowski P., Lewandowska Z., Limphaibool N., Szafranek S., Labrzycka A., et al. Advances in the potential biomarkers of epilepsy. Front Neurol. 2019;10:685. DOI: 10.3389/fneur.2019.00685
65. Cai M., Tang X. Human archaea and associated metabolites in health and disease. Biochemistry. 2022;61(24):2835–40. DOI: 10.1021/acs.biochem.2c00232
66. Zhou T., Wang N., Xu L., Huang H., Yu C., Zhou H. Effects of carbamazepine combined with vitamin B12 on levels of plasma homocysteine, hs-CRP and TNF-α in patients with epilepsy. Exp Ther Med. 2018;15(3):2327–32. DOI: 10.3892/etm.2018.5698
Об авторах
Л. Ф. МуфазаловаРоссия
Муфазалова Ляйсан Фагимовна — к.м.н., кафедра фармакологии
Республика Башкортостан, Уфа
Н. А. Муфазалова
Россия
Муфазалова Наталья Альбертовна — д.м.н., профессор, кафедра фармакологии
Республика Башкортостан, Уфа
А. Б. Имаев
Россия
Имаев Айрат Богданович — к.м.н., отделение противоопухолевой лекарственной терапии № 2
Республика Башкортостан, Уфа
Е. Ф. Фархутдинова
Россия
Фархутдинова Елена Фаузировна — поликлиническое отделение
Республика Башкортостан, Уфа
С. С. Безрукова
Россия
Безрукова Софья Сергеевна — студентка
Республика Башкортостан, Уфа
Б. Ю. Душанбаев
Россия
Душанбаев Булат Юнирович — студент
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Муфазалова Л.Ф., Муфазалова Н.А., Имаев А.Б., Фархутдинова Е.Ф., Безрукова С.С., Душанбаев Б.Ю. Карбамазепин в лечении эпилепсии у больных глиобластомой (обзор литературы с описанием клинического случая). Креативная хирургия и онкология. 2025;15(3):287-298. https://doi.org/10.24060/2076-3093-2025-15-3-287-298
For citation:
Mufazalova L.F., Mufazalova N.A., Imaev A.B., Farkhutdinova E.F., Bezrukova S.S., Dushanbaev B.Yu. Carbamazepine for Epilepsy Treatment in Glioblastoma Patients: A Review and a Clinical Case. Creative surgery and oncology. 2025;15(3):287-298. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-3-287-298


































