Перейти к:
Рефидинг-синдром у пациентов хирургического профиля. Анализ клинических случаев
https://doi.org/10.24060/2076-3093-2019-9-2-118-124
Аннотация
Введение. Рефидинг-синдром — это состояние, в основе которого лежат метаболические нарушения, возникающие в результате возобновления питания у пациентов после длительного голодания. Истинная частота потенциально опасного для жизни синдрома повторного кормления неизвестна. В этой связи целью настоящей работы является демонстрация на примере клинического случая клинической картины и методов разрешения рефидинг-синдрома.
Материалы и методы. На примере пациентки с острым панкреатитом средней тяжести продемонстрирована клиническая картина рефидинг-синдрома с выраженной неврологической и кардиологической симптоматикой при возобновлении энтерального питания. Представлен обзор доступной литературы на данную тему.
Результаты и обсуждение. Диагностический поиск проводился в широком диапазоне —исключались острая коронарная и неврологическая патологии. По данным дополнительных лабораторных методов исследования было сформировано предположение о развитии рефидинг-синдрома, проведена коррекция лечения. Применялось парентеральное введение фосфатсодержащих препаратов, а также энтеральное питание, в составе которого имеются фосфаты. Пациентка переведена на долечивание в неврологическое отделение. Выписана на 53-е сутки с полным регрессом неврологической симптоматики.
Заключение. Ключевым клиническим маркером рефидинг-синдрома является гипофосфатемия — очень низкий уровень фосфора в крови. Однако пониженное содержание калия, кальция, магния и витамина В1 в крови также может сыграть свою роль. Высокий риск развития рефидинг-синдрома отмечается у пациентов с хронической алиментарной недостаточностью и/или не принимающих пищу более 10 дней. Повторное кормление следует начинать при низком уровне замещения энергии. Прием витаминов следует начинать с повторного кормления и продолжать в течение не менее 10 дней. Исправление дисбаланса электролитов и жидкости перед кормлением не требуется; это следует делать вместе с кормлением.Ключевые слова
Для цитирования:
Нартайлаков М.А., Салимгареев И.З., Пантелеев В.С., Нагаев Ф.Р., Погадаев В.В., Резяпов В.В., Иванов И.И. Рефидинг-синдром у пациентов хирургического профиля. Анализ клинических случаев. Креативная хирургия и онкология. 2019;9(2):118-124. https://doi.org/10.24060/2076-3093-2019-9-2-118-124
For citation:
Nartailakov M.A., Salimgareev I.Z., Panteleev V.S., Nagaev F.R., Pogаdaev V.V., Rezyapov V.V., Ivanov I.I. Refeeding Syndrome in Surgical Patients. A Clinical Case Analysis. Creative surgery and oncology. 2019;9(2):118-124. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-2-118-124
Введение
Рефидинг-синдром — это состояние, в основе которого лежат метаболические нарушения, возникающие в результате возобновления питания у пациентов после длительного голодания [1-3]. Следует отметить, что данное состояние является потенциально смертельно опасным, однако среди хирургов общего профиля существует ограниченное понимание синдрома, отчасти из-за отсутствия общепринятых принципов диагностики и лечения. В этой связи целью настоящей работы является демонстрация на примере клинического случая клинической картины и методов разрешения рефидинг-синдрома.
Клинический случай
Пациентка Г., 52 года, поступила в хирургическое отделение с диагнозом: острый панкреатит средней тяжести. Осложнения: сдавление двенадцатиперстной кишки воспалительным инфильтратом с формированием дуоденальной непроходимости, парапанкреатический инфильтрат.
Из данных анамнеза: в течение последних 2 месяцев беспокоят незначительные боли в животе, тошнота, рвота, потеря массы тела до 20 кг.
При поступлении: ИМТ 32 кг/м2. Потеря веса >15 % за 2 месяца.
Проводилась дифференциальная диагностика с опухолью головки поджелудочной железы. Онкомаркеры: СА 19-9 30,9 Ед/мл. РЭА 2,02 нг/мл.
По данным компьютерной томографии с в/в контрастированием данных за злокачественное новообразование нет. Больше данных за псевдотуморозный панкреатит, последствия панкреонекроза, формирующаяся псевдокиста поджелудочной железы.
Пациентке был установлен питательный зонд и начата нутритивная поддержка.
На 10-е сутки выполнено оперативное вмешательство: лапаротомия, секвестрнекрэктомия, позадиободочная задняя горизонтальная гастроеюностомия с брауновским соустьем на длинной петле.
На рисунке 1 приведена динамика изменения уровня сывороточного калия, глюкозы в крови.
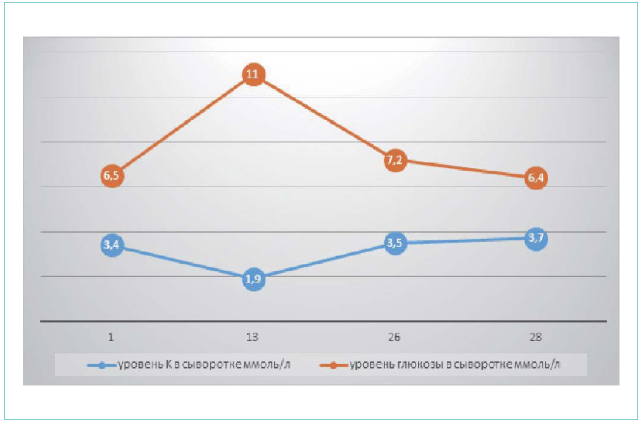
Рисунок 1. Динамика изменения уровня сывороточного калия, глюкозы в крови
Figure 1. Dynamics of the plasma potassium and blood glucose change
В 1-е послеоперационные сутки у пациентки по данным ЭКГ отмечено: формирующийся зубец q- в V2, повышение сегмента S-T в V2-V3, отрицательные зубцы Т V4-V5.
Расценен как острый коронарный синдром с подъемом сегмента S-T.
Проведена ЭхоКГ: полости сердца не расширены, левый желудочек шарообразной формы. Гипертрофия миокарда межжелудочковой перегородки (МЖП) в базальном отделе, ее толщина 14 мм. Толщина МЖП в медиальном отделе 7 мм. Акинез переднеперегородочной стенки медиального и апикального сегментов (миокард истончен — формирующаяся аневризма верхушки левого желудочка). Гипокинез боковой, передней, нижней стенок левого желудочка медиального и апикального сегментов. Систолическая функция левого желудочка снижена, ФВ 31 %. Уплотнение восходящего отдела аорты. Сепарация листков перикарда за задней стенкой 3 мм. Д-ЭхоКГ: МР1+, ТР1+. Диастолическая функция левого желудочка нарушена по 1-му типу.
Проведена в экстренном порядке коронарография. Замедление продвижения контраста по левой коронарной артерии до 5-6 кардиоциклов. Замедление продвижения контраста по правой коронарной артерии до 6 кардиоциклов.
Ферменты КФК МВ, КФК в пределах нормы, тропонин отрицательный весь период пребывания в стационаре. На 2-е послеоперационные сутки проводится ЭхоКГ в динамике. Полости сердца не расширены, левый желудочек шарообразной формы. Гипертрофия миокарда МЖП в базальном отделе, ее толщина 14 мм. Толщина МЖП в медиальном и апикальном отделе 7 мм — истончена. Гипокинез переднеперегородочной и нижней стенок медиального и апикального сегментов. Систолическая функция левого желудочка снижена, ФВ 41 %. Уплотнение восходящего отдела аорты. Сепарация листков перикарда за задней стенкой 2,2 мм. Д-ЭхоКГ: МР1+, ТР1+. Диастолическая функция левого желудочка нарушена по 1-му типу. Слабоположительная динамика, улучшение систолической функции левого желудочка.
На 7-е послеоперационные сутки у пациентки развивается клиническая картина проксимального парапареза, атаксический синдром.
Проводится компьютерная томография (КТ) L-S отделов позвоночника. Правосторонняя обызвествленая грыжа диска L5-S1. КТ признаки остеохондроза, деформирующего спондилоатроза L-S отделов позвоночника.
Электронейромиография (ЭНМГ): на момент исследования убедительных данных за полинейропатию не выявлено. Признаки умеренного аксонального поражения малоберцовых нервов, с большой вероятностью вертеброгенного генеза (дисфункция проведения на уровне L4-L5-S1).
На 10-е послеоперационные сутки у пациентки появляется бульбарный синдром и тетрапарез.
По данным КТ головного мозга (г/м): картина атрофических изменений больших полушарий и мозжечка на фоне хронической цереброваскулярной недостаточности. Патологические изменения орбит не выявлены. Патологические изменения придаточных пазух носа не выявлены. Патологические изменения височных костей не выявлены.
МРТ г/м. На момент исследования убедительных данных за очаговую патологию г/м не выявлено. На DWI и ADC картах патологический МР-сигнал не выявлен. Диагностический поиск проводился в широком диапазоне. Консультация гематолога, невролога, терапевта, психотерапевта. Определялся уровень в моче порфобилиногена и уробилиногена. Показатели в пределах нормы.
На 17-е сутки взят анализ на фосфат в сыворотке крови. Гипофосфатемия: 1.03 мг/дл. Самый низкий показатель фосфата в сыворотке крови приходился на 13-й день. Расценено как проявление рефидинг-синдрома.
На 25-е сутки данные ЭхоКГ. Заключение: уплотнение восходящего отдела аорты, фиброзных колец аортального и митрального клапанов. Незначительная гипертрофия миокарда левого желудочка. Асинергия МЖП и нижней стенки ЛЖ, ФВ 60 % (по Тейхольцу). Диастолическая дисфункция левого желудочка 1-го типа. Полости сердца не расширены.
Клинически нарастание неврологического дефицита. Проведена коррекция лечения. Парентеральное введение фосфатсодержащих препаратов, а также энтеральное питание, в составе которого имеются фосфаты. Пациентка переведена на долечивание в неврологическое отделение. Выписана на 53-е сутки с положительной неврологической динамикой в виде появления активных движений в конечностях.
Результаты и обсуждение
Синдром повторного кормления был сначала описан у заключенных, освобожденных из концентрационных лагерей во время Второй мировой войны, которые начали получать кормление после длительного голодания, что привело к сердечной недостаточности, неврологическим осложнениям, включающим кому, судороги, и в конечном счете к летальному исходу [3]. Патофизиология синдрома повторного кормления на сегодняшний день известна. В период голодания организм переходит от использования углеводов к использованию жиров, секреция инсулина уменьшается в ответ на снижение поступления углеводов. Метаболические превращения направлены на сведение к минимуму расщепления белка и аминокислот. При этом в печени из ацетил-КоА активируется синтез кетоновых тел (Р-оксибутирата и ацетона), которые служат источником энергии для многих тканей, в том числе и для мозга. Это приводит к уменьшению скорости распада белков и снижению потребности в глюкозе [4-6].
В период длительного голодания содержание некоторых внутриклеточных минералов значительно снижается, особенно фосфата. Однако концентрации этих минералов в сыворотке могут оставаться нормальными. Это происходит потому, что минералы в основном находятся во внутриклеточном депо. Кроме того, наблюдается снижение почечной экскреции [7].
Обычно биохимические нарушения возникают в первые 3-4 суток после начала кормления. При возвращении к нормальному питанию резкое насыщение углеводами приводит к внезапной перестройке организма с жирового на углеводный обмен. Увеличивается секреция инсулина. Глюкоза становится основным источником энергии. Инсулин стимулирует возвращение магния и калия в клетку, способствует гликогенезу и синтезу жира и белка. Эти анаболические процессы требуют фосфорилирования промежуточных веществ и, следовательно, высоких затрат внутриклеточных фосфатов. Внутриклеточное депо этих электролитов пополняется за счет быстрого уменьшения их концентрации в плазме крови [8, 9].
Истощение запасов фосфата является чрезвычайно опасным состоянием, при котором нарушаются почти все клеточные физиологические процессы. Фосфат играет важную роль в процессах клеточного дыхания, поскольку его первый этап, гликолиз, включает фосфорилирование глюкозы. Фосфат принимает участие в поддержании функции внутриклеточных ферментов, включая синтез 2,3-дифосфоглицерата, который регулирует диссоциацию кислорода и гемоглобина, участвует в буферной системе кислото- основания.
Общий уровень фосфатов в сыворотке крови составляет 3,0-5,0 мг/дл [8, 10].
Легкая гипофосфатемия: 2,5-3,0 мг/дл.
Умеренная гипофосфатемия: 1,0-2,5 мг/дл.
Тяжелая гипофосфатемия: <1,0 мг/дл.
При рефидинг-синдроме в 96 % наблюдается гипофосфатемия. Но не каждая гипофосфатемия является рефидинг-синдромом.
Этиология гипофосфатемии:
- рефидинг-синдром;
- нарушение всасывания через кишечник; фосфатсвя- зывающие антациды; дефицит витамина D, рвота (синдром Фанкони);
- нарушение почечной экскреции: диуретики; осмотический диурез при диабетическом кетоацидозе; гипер- паратиреоз (первичный и вторичный); проксимальная дисфункция почечных канальцев; хроническая диарея, мальабсорбции;
- экстремальные катаболические состояния: ожоги; травмы; сепсис.
Клинические проявления гипофосфатемии:
- сердечно-сосудистые: острая дисфункция левого желудочка; обратимая дилатационная кардиомиопатия;
- гематологические: острая гемолитическая анемия; дисфункция лейкоцитов;
- нервно-мышечные: диффузная слабость скелетных мышц; судороги; нарушение походки; парестезия, энцефалопатия, рабдомиолиз; деминерализация костей;
- острая и хроническая дыхательная недостаточность, вторичная по отношению к диафрагмальной слабости (нарушение дыхания).
Последствия гипофосфатемии:
- увеличение длительности ИВЛ;
- увеличение продолжительности лечения;
- высокая летальность.
Встречаемость гипофосфатемии <3,0 мг/дл.
При тяжелой травме до 75 %.
При сепсисе — 65-80 %.
При хроническом алкоголизме — 2,5-30,4 %.
Калий, основной внутриклеточный катион, также истощается при недостаточном питании. При этом сывороточная концентрация может оставаться нормальной. При повторном кормлении калий попадает в клетки, что приводит к тяжелой гипокалиемии. Это вызывает нарушения в потенциале электрохимической мембраны, что приводит, например, к аритмиям и остановке сердца [8, 11-13].
Магний, другой преимущественно внутриклеточный катион, является важным коферментом в большинстве ферментных систем, включая окислительное фосфори- лирование и продукцию АТФ. Магний влияет на мембранный потенциал, а его дефицит может привести к сердечной дисфункции и нервно-мышечным осложнениям.
Потребление глюкозы после периода голодания подавляет глюконеогенез за счет выделения инсулина. Поэтому чрезмерное введение может привести к гипергликемии и ее последствиям: дегидратации, метаболическому ацидозу и кетоацидозу. Избыток глюкозы также приводит к липогенезу (опять же в результате стимуляции инсулином), который может вызвать жировой гепатоз печени, увеличение выработки углекислого газа, гиперкапнию и дыхательную недостаточность [12, 14].
Изменения в углеводном обмене оказывают глубокое влияние на баланс натрия и воды. Введение углеводов в рацион приводит к быстрому снижению почечной экскреции натрия и воды. Если затем для поддержания нормального выделения мочи проводится инфузия, у пациентов может быстро развиться перегрузка жидкостью. Это может привести к застойной сердечной недостаточности, отеку легких и аритмии [15-18]. Несмотря на то что при недостаточном потреблении дефицит витаминов может возникать с различной скоростью, тиамин является наиболее важным при осложнениях повторного кормления. Его недостаток приводит к энцефалопатии Вернике (глазные аномалии, атаксия, спутанность сознания, гипотермия, кома) или синдрому Корсакова (ретроградная и антероградная амнезия, конфабуляция) [19, 20].
Критерии риска развития рефидинг-синдрома (NICE)
Риск возникает при наличии одного или нескольких из следующих условий:
- индекс массы тела <16 кг/м2;
- непреднамеренная потеря веса >15 % за последние три-шесть месяцев;
- отсутствие или минимальное потребление пищи в течение >10 дней;
- низкие уровни калия, фосфата или магния перед кормлением.
Либо при наличии двух или более из следующих условий:
- индекс массы тела <18,5 кг/м2;
- непреднамеренная потеря веса >10 % за последние три-шесть месяцев;
- отсутствие или минимальное потребление пищи в течение >5 дней;
- злоупотребления алкоголем или препаратами, включая инсулин, химиотерапию, антациды или диуретики.
Профилактика
Чтобы обеспечить адекватную профилактику, NICE рекомендует провести тщательную оценку питания перед началом повторного кормления. Следует установить недавнее изменение веса, рацион питания, потребление алкоголя, а также социальные и психологические проблемы. Плазменные электролиты (особенно фосфат, натрий, калий и магний) и глюкоза должны быть измерены на базовом уровне перед кормлением, а любые недостатки должны быть исправлены во время кормления с тщательным мониторингом [20].
Для пациентов с высоким риском развития рефидинг- синдрома пополнение энергии должно начинаться медленно (максимум 0,042 МДж/кг/24 часа) и должно быть адаптировано к каждому пациенту. Затем энергетическая доставка может быть увеличена для удовлетворения или превышения полных потребностей в течение четырех-семи дней. У пациентов с недостаточным питанием (индекс массы тела <14 или незначительное потребление в течение двух или более недель) NICE рекомендует начинать повторное кормление из расчета не более 0,021 МДж/кг/24 часа и проводить мониторинг сердечной деятельности из-за риска нарушений ритма сердца. В рекомендациях NICE также говорится, что исправлять дисбаланс электролитов и жидкости перед кормлением не нужно и что это следует делать вместе с кормлением.
Прием витаминов рекомендовано начать немедленно до и в течение первых 10 дней повторного кормления. Следует принимать пероральные, энтеральные или внутривенные добавки калия, фосфата, кальция и магния, если уровень электролитов крови невысок перед повторным кормлением. Однако отсутствуют качественные исследования точных уровней добавок, и поэтому NICE не указывает требуемые уровни этих добавок.
В России отдельное лекарство, содержащее фосфат, не зарегистрировано. Фосфат входит только в состав парентерального, энтерального питания последнего поколения.
Встречаемость гипофосфатемии — при парентеральном питании с добавлением фосфатов в 30-38 %, при отсутствии фосфатов в парентеральном питании — 100 %.
Мы рекомендуем больным сыр и молоко, которые являются источником фосфата.
Уровни электролита следует измерять один раз в день в течение одной недели и не менее трех раз в течение следующей недели [12, 17].
Профилактика рефидинг-синдрома:
- малоинвазивная хирургия (FastTrack);
- не допускать гипотермии в операционном и периопе- рационном периоде;
- инфузия глюкозы 10 % в ночь перед операцией или 200-400 мл 12,5 % углеводного напитка.
- адекватная аналгезия.
Заключение
Синдром повторного кормления определен как потенциально фатальный сдвиг в жидкостях и электролитах, который может возникнуть у истощенных пациентов. Ключевым клиническим маркером этого является гипофосфатемия — очень низкий уровень фосфора в крови. Однако пониженное содержание калия, кальция, магния и витамина B1 в крови также может сыграть свою роль. Высокий риск развития рефидинг-синдрома отмечается у пациентов с хронической алиментарной недостаточностью и/или не принимающих пищу более 10 дней. Повторное кормление следует начинать при низком уровне замещения энергии. Прием витаминов следует начинать с повторного кормления и продолжать не менее 10 дней. Исправление дисбаланса электролитов и жидкости перед кормлением не требуется; это следует делать вместе с кормлением. В исследованиях сообщается о 100%-ной частоте гипофосфатемии у пациентов, получающих для общего парентерального питания растворы, которые не содержат фосфора. При использовании растворов, содержащих фосфаты, заболеваемость может снизиться до 18 %.
Список литературы
1. Миронов Л.Л., Крастелёва И.М., Каско И.Б., Панов А.П., Курдюкова Д.Ю. Рефидинг-синдром. Здравоохранение (Минск). 2018;(9):17–23.
2. Dewar H., Horvath R. Refeeding syndrome. In: Todorovic V.E., Micklewright A., editors. A pocket guide to clinical nutrition. 2nd ed. British Dietetic Association; 2001.
3. Rio A., Whelan K., Goff L., Reidlinger D.P., Smeeton N. Occurrence of refeeding syndrome in adults started on artificial nutrition support: prospective cohort study. BMJ Open. 2013;3(1):e002173. DOI: 10.1136/ bmjopen-2012-002173
4. Knochel J.P. The pathophysiology and clinical charactertistics of severe hypophosphatemia. Arch Intern Med. 1977;137:203–20. PMID: 836118
5. Crook M.A., Hally V., Pantelli J.V. The importance of the refeeding syndrome. Nutrition. 2001;17(7-8):632–7. PMID: 11448586
6. Friedli N., Stanga Z., Sobotka L., Culkin A., Kondrup J., Laviano A., et al. Revisiting the refeeding syndrome: Results of a systematic review. Nutrition. 2017;35:151–60. DOI: 10.1016/j.nut.2016.05.016
7. Nasir M., Zaman B.S., Kaleem A. What a trainee surgeon should know about refeeding syndrome: a literature review. Cureus. 2018;10(3):e2388. DOI: 10.7759/cureus.2388
8. Hayek M.E., Eisenberg P.G. Severe hypophosphatemia following the institution of enteral feedings. Arch Surg. 1989;124(11):1325–8. DOI: 10.1001/archsurg.1989.01410110087016
9. Koletzko B. Nutrition rehabilitation in eating disorders. World Rev Nutr Diet. 2015;113:259–65. DOI: 10.1159/000375192
10. Klein C.J., Stanek G.S., Wiles C.E. Overfeeding macronutrients to critically ill adults: metabolic complications. J Am Diet Assoc. 1998;98(7):795–806. DOI: 10.1016/S0002-8223(98)00179-5
11. Malczyk Ż., Oświęcimska J.M. Gastrointestinal complications and refeeding guidelines in patients with anorexia nervosa. Psychiatr Pol. 2017;51(2):219–29. DOI: 10.12740/PP/65274
12. Lee Z.Y., Heyland D.K. Determination of nutrition risk and status in critically ill patients: what are our considerations? Nutr Clin Pract. 2019;34(1):96–111. DOI: 10.1002/ncp.10214
13. Marik P.E., Bedigan M.K. Refeeding hypophosphataemia in an intensive care unit: a prospective study. Arch Surg. 1996;131(10):1043–7. DOI: 10.1001/archsurg.1996.01430220037007
14. Martinez M.J., Matrinez M.A., Montero M., Campelo E., Castro I., Inaraja M.T. Hypophosphatemia in postoperative patients on total parenteral nutrition:influence of nutritional support teams. Nutr Hosp. 2006;21(6):657–60. PMID: 17147062
15. Perrault M.M., Ostrop N.J., Tierney M.G. Efficacy and safety of intravenous phosphate replacement in critically ill patients. Ann Pharmacother. 1997;31(6):683–8. DOI: 10.1177/106002809703100603
16. Solomon S.M., Kirby D.F. The refeeding syndrome: a review. J Parenter Enteral Nutr. 1990;14(1):90–7. DOI: 10.1177/014860719001400190
17. Tan M.C.Y., Chien J.M.F., Khor L.Y., Chea Y.W., Wong T.H. Acute presentation of post-operative kwashiorkor and refeeding syndrome complicated by chronic Strongyloides infection in an elderly patient. ANZ J Surg. 2018;88(9):E692. DOI: 10.1111/ans.14769
18. Reuler J.B., Girard D.E., Cooney T.G. Wernicke’s encephalopathy. N Engl J Med. 1985;312(16):1035–9. DOI: 10.1056/ NEJM198504183121606
19. Weinsier R.L., Krumdieck C.L. Death resulting from overzealous total parenteral nutrition: the refeeding syndrome revisited. Am J Clin Nutr. 1980;34(3):393–9. DOI: 10.1093/ajcn/34.3.393
20. Rizzo S.M., Douglas J.W., Lawrence J.C. Enteral nutrition via nasogastric tube for refeeding patients with anorexia nervosa: a systematic review. Nutr Clin Pract. 2019;34(3):359–70. DOI: 10.1002/ ncp.10187
Об авторах
М. А. НартайлаковРоссия
Нартайлаков Мажит Ахметович — д.м.н., член-корреспондент РАЕН, профессор, зав. кафедрой общей хирургии с курсом лучевой диагностики ИДПО, директор НИИ новых медицинских технологий
И. З. Салимгареев
Россия
Салимгареев Ильдар Зуфарович — к.м.н., зав. отделением гастрохирургии
В. С. Пантелеев
Россия
Пантелеев Владимир Сергеевич — д.м.н., зав. отделением лазерной хирургии
Ф. Р. Нагаев
Россия
Нагаев Фарит Робертович — врач-хирург отделения гастрохирургии
В. В. Погадаев
Россия
Погадаев Вадим Валерьевич — врач-хирург отделения гастрохирургии
В. В. Резяпов
Россия
Резяпов Вадим Вакилевич — врач-хирург отделения гастрохирургии
И. И. Иванов
Россия
Иванов Иван Иванович — врач-хирург отделения гастрохирургии
8 937 316 17 18
Рецензия
Для цитирования:
Нартайлаков М.А., Салимгареев И.З., Пантелеев В.С., Нагаев Ф.Р., Погадаев В.В., Резяпов В.В., Иванов И.И. Рефидинг-синдром у пациентов хирургического профиля. Анализ клинических случаев. Креативная хирургия и онкология. 2019;9(2):118-124. https://doi.org/10.24060/2076-3093-2019-9-2-118-124
For citation:
Nartailakov M.A., Salimgareev I.Z., Panteleev V.S., Nagaev F.R., Pogаdaev V.V., Rezyapov V.V., Ivanov I.I. Refeeding Syndrome in Surgical Patients. A Clinical Case Analysis. Creative surgery and oncology. 2019;9(2):118-124. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-2-118-124

































