Перейти к:
Лимфомы клеток мантийной зоны. Новые возможности диагностики и лечения (эпидемиологическое исследование)
https://doi.org/10.24060/2076-3093-2019-9-4-261-265
Аннотация
Введение. Лимфома клеток мантийной зоны — редко встречающийся вариант В-клеточной неходжкинской лимфомы. По статистике из 100 000 человек заболевает 2–3, что составляет примерно 6 % от общего количества больных неходжкинскими лимфомами. Известно, что различные молекулярно-генетические характеристики пациентов с лимфомой мантийной зоны могут обеспечить персонифицированный подход при определении прогноза болезни и тактики лечения.
Материалы и методы. Проведен ретроспективный анализ 45 пациентов с лимфомой зоны мантии, наблюдавшихся в ГАУЗ РКОД Минздрава в период с 2015 г. по настоящее время. При анализе учитывались данные клинико-лабораторного обследования, позитронно-эмиссионная томография, цитологическое, гистологическое и иммуногистохимическое исследования биоптата опухоли и костного мозга. Проанализированы эпидемиологические данные, клинические характеристики пациентов, терапевтические подходы, непосредственные и отдаленные результаты лечения.
Результаты и обсуждение. Установлено, что наиболее часто в патологический процесс вовлекается костный мозг (44 %) и селезенка (41 %). Распределение MIPI: высокий у 14 (30 %), средний у 20 (45 %), низкий у 11 (25 %). Ki67 в 4 случаях менее 30 %, в остальных более 30 %. Пациентам c 2015 по 2017 г. в первой линии проводилась химиотерапия в режиме R-CHOP с последующей поддержкой ритуксимабом. Средняя БПВ составила 20 месяцев, 8 (17 %) пациентов в статусе длительной ремиссии (с 2015 г.). С 2017 г. в первой линии терапии начали применяться режимы R-BAC (схема с высокодозным цитарабином для кандидатов на ТСК) и R-B (для пожилых и коморбидных). С 2018 г. 8 пациентам проведена аутоТСК (в 1-м позднем рецидиве) как этап консолидации лечения. На данный момент обследование на del17p и мутацию TP53 проведено 13 пациентам в федеральных центрах.
Заключение. Продемонстрирована необходимость и варианты терапии в зависимости от результатов молекулярно-генетического анализа лимфомы клеток мантийной зоны.
Ключевые слова
Для цитирования:
Канкумашева Э.И., Валиахметова Ч.Х. Лимфомы клеток мантийной зоны. Новые возможности диагностики и лечения (эпидемиологическое исследование). Креативная хирургия и онкология. 2019;9(4):261-265. https://doi.org/10.24060/2076-3093-2019-9-4-261-265
For citation:
Kankumasheva E.I., Valiakhmetova Ch.Kh. Mantle Zone Cell Lymphomas. New Opportunities for Diagnosis and Treatment (Epidemiological Research). Creative surgery and oncology. 2019;9(4):261-265. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-4-261-265
Введение
Лимфома клеток мантийной зоны (ЛКМЗ) — это редко встречающийся вариант В-клеточной неходжкинской лимфомы. По статистике из 100 000 человек заболевает 2-3, что составляет примерно 6 % от общего количества больных неходжкинскими лимфомами. Среди впервые выявленных случаев соотношение между мужчинами и женщинами составляет 4:1, а медиана возраста — 65 лет. В Западной Европе, Скандинавии и США частота ЛКМЗ варьирует от 0,5 до 0,7 на 100 000 населения, у людей старше 65 лет заболеваемость возрастает до 3,9 на 100 000 [1,2]. Таким образом, различные молекулярно-генетические характеристики у пациентов с лимфомой мантийной зоны могут обеспечить персонифицированный подход при определении прогноза болезни и тактики лечения. В этой связи основной целью данного исследования является анализ эпидемиологической ситуации в Республике Башкортостан, диагностических и терапевтических подходов у пациентов с лимфомой зоны мантии в период от 2015 г. по настоящее время с оценкой возможностей внедрения новых методов диагностики и лечения ЛКЗМ.
Материалы и методы
В ретроспективный анализ были включены 45 пациентов с лимфомой зоны мантии, наблюдавшихся в ГАУЗ РКОД Минздрава в период с 2015 г. по настоящее время. При анализе учитывались данные клинико-лабораторного обследования (100 % обследованных), позитрон- но-эмиссионная томография (100 % обследованных), цитологическое, гистологическое и иммуногистохимическое исследования биоптата опухоли и костного мозга (100 %). Проанализированы эпидемиологические данные: распределение по полу, возрасту и местности проживания. Проанализированы клинические характеристики пациентов: зоны поражения, распространенность, лабораторные показатели, имму- ногистохимические особенности. Проанализированы терапевтические подходы (режимы химиотерапии, использованные в дебюте заболевания и в рецидивах), непосредственные и отдаленные результаты лечения.
Результаты и обсуждение
В основном ЛКМЗ является агрессивно протекающей лимфомой, при которой поражаются лимфатические узлы, кольцо Вальдейера, селезенка, костный мозг, печень, желудочно-кишечный тракт, орбита и другие экс- транодальные органы. Лишь в 10 % случаев ЛКМЗ обладает индолентным течением.
Предикторами агрессивного течения являются продвинутая стадия, В-симптомы, поражение костного мозга, наличие мутаций в генах, кодирующих синтез тяжелых цепей Ig, спленомегалия, умеренный лейкоцитоз, высокая активность лактатдегидрогеназы (ЛДГ), повышение р2-микроглобулина, высокий индекс пролиферации Ki67, ядерная экспрессия SOX11 и мутации TP53, NOTCH У, перестройки гена c-MYC [3, 4].
Из года в год лимфома клеток мантийной зоны привлекает к себе пристальное внимание, что связано с особенностью патогенеза и, как следствие, диагностики и лечения.
С целью диагностики и адекватного стадирования ЛКМЗ используются практически все методы инструментального исследования. Наряду с ПЭТ/КТ крайне важны методы эндоскопического исследования: фиброларингоскопия, фибробронхоскопия, фиброгастродуоденоскопия, фиброколоносокпия, т.к. при ЛКМЗ поражаются любые органы и системы. Морфологическая верификация возможна благодаря иммуногистохимическому и молекулярно-генетическому методам. Современные исследования показали, что ЛКМЗ характеризуется гиперэкспрессией ядерного белка циклин D1 и хромосомной транслокацией t(11;14)(q13;q32). Имеет 6 морфологических вариантов: моноцитоидоподобный, с плазмоцитарной дифференцировкой, пролимфоцитоидный, классический, мелкоклеточный, бластоидный (плеоморфный).
Таким образом, основным моментом в патогенезе ЛКМЗ считается транслокация t(11; 14)(q13; q32). Оптимальным способом определения t( 11; 14)(q13; q32) является флуоресцентная гибридизация in situ (FISH): частота выявления транслокации этим методом при ЛКМЗ достигает 99 %. В результате мутаций гена CCND1, находящегося в 13-м локусе длинного плеча 11-й хромосомы, происходит гиперэкспрессия белка-регулятора клеточного цикла циклина D1. Установление факта избыточной экспрессии циклина D1 является одним из основных молекулярных и иммунологических маркеров ЛКМЗ [3, 5-7].
Нейрональный фактор транскрипции SOX11 напрямую регулирует несколько онкогенных путей, включая пролиферацию, контроль клеточного цикла и апоптоз, дифференцировку В-клеток, ангиогенез, и микроокружение опухоли. В зависимости от экспрессии SOX11 выделяют 2 варианта ЛКМЗ: SOX11 позитивный, характеризующийся агрессивным течением и неблагоприятным прогнозом, и SOX11 негативный, для которого характерна стабильность генома, индолентное течение и более благоприятный исход [4, 8-10]. Пролиферативный индекс Ki-67 может быть сопряжен со степенью клинической агрессивности ЛКМЗ, т. е. низкий пролиферативный индекс обычно соответствует более благоприятному клиническому течению, в то время как высокий пролиферативный индекс сопряжен с меньшей продолжительностью выживания после установления диагноза [1].
ЛКМЗ характеризуется нестабильностью кариотипа и значительным количеством вторичных хромосомных аберраций. В последнее время описано большое количество случаев ЛКМЗ, сопровождающихся наличием однородительских дисомий, способствующих инактивации генов-супрессоров опухоли. Например, одна из наиболее часто обнаруживаемых однородительских дисомий включает участок короткого плеча 17-й хромосомы и способствует инактивации гена TP53, кодирующий белок 53, транскрипционного фактора, регулятора клеточного цикла. Р53 выполняет функцию супрессора, соответственно ген TP53 является антионкогеном. Известно, что пациенты с данной мутацией относятся к группе с крайне неблагоприятным прогнозом с медианой общая выживаемость (ОВ) не более 1,5 года даже после проведения высокодозной химиотерапии [3, 5, 7, 11-13].
В связи с такими молекулярно-генетическими особенностями современные подходы к лечению ЛКМЗ меняются. И описанные выше факторы необходимо учитывать при выборе терапии. Так, если в предыдущие десятилетия стандартом лечения считался режим R-СНОР, то основными тенденциями в терапии ЛКМЗ за последнее десятилетие являются: интенсификация индукционной терапии высокими дозами цитарабина для пациентов моложе 60 лет; проведение аутоТГСК в качестве консолидации первой ремиссии у пациентов моложе 60-65 лет; применение комбинаций средних доз цитарабина с бендамустином, платиносодержащими препаратами, бортезомибом; а также добавление бортезомиба к CHOP-подобным режимам для пациентов старше 60-65 лет; а пациентам, у которых выявлена делеция короткого плеча хромосомы 17 или мутации TP53, применение ингибиторов тирозинкиназы Брутона — ибрутиниба [6, 12-16].
По результатам нашего анализа установлено, что пациенты с лимфомой зоны мантии в Республике Башкортостан составляют около 7 % от общего числа пациентов с неходжкинскими лимфомами, что практически сопоставимо с данными по России и с мировыми данными, где на долю лимфомы зоны мантии приходится 6-7 % от общего числа всех неходжкинских лимфом [1]. Увеличения заболеваемости в зависимости от пола не выявлено, т. е. количество женщин и мужчин в исследуемой группе было одинаково, что, в свою очередь, отличается от данных мировой статистики, где описывают, что болеют преимущественно мужчины и отношение М:Ж — (2-4):1. Медиана возраста пациентов с ЛКМЗ в исследуемой группе составила 64 года, что сопоставимо с данными литературы (рис. 1) [1]. Около 40 % пациентов на момент постановки диагноза имели распространенные стадии, что объясняется агрессивным течением ЛКМЗ.
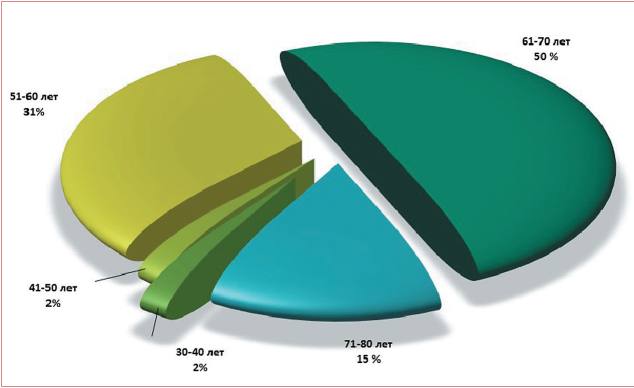
Рисунок 1. Распределение ЛКМЗ по возрасту в Республике Башкортостан
Figure 1. MCL patients by age, Republic of Bashkortostan
Среди проанализированных случаев жители городской местности составили большую часть (65 % против 35 %). При изучении частоты вовлечения в патологический процесс органов и систем установлено: поражение костного мозга — у 20 (44 %), селезенки — у 18 (41 %), костей — у 4 (9 %), легких — у 3 пациентов (6 %) (рис. 2). Распределение MIPI: высокий у 14 (30 %), средний у 20 (45 %), низкий у 11 (25 %). Ki67 в 4 случаях менее 30 %, в остальных более 30 %.
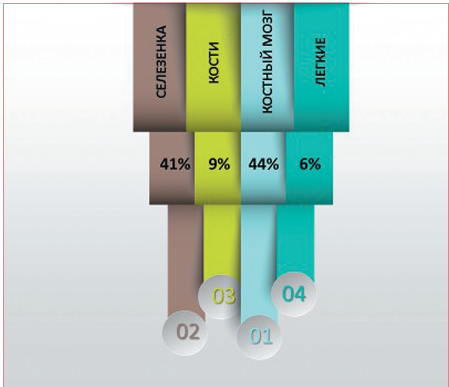
Рисунок 2. Частота поражения органов и систем при ЛКМЗ в РБ
Figure 2. Incidence of lesions in organs and systems in patients with MCL in RB
Ретроспективный анализ показал, что пациентам с 2015 по 2017 г. в большинстве случаев в первой линии проводилась химиотерапия в режиме R-CHOP с последующей поддержкой ритуксимабом до 2 лет. Средняя беспрогрессивная выживаемость (БПВ) составила 20 месяцев, 8 (17 %) пациентов в статусе длительной ремиссии (с 2015 г.). С 2017 г. в первой линии терапии ЛКЗМ начали применяться режимы R-BAC (схема с высокодозным цитарабином для кандидатов на ТСК) и R-B (для пожилых и коморбидных). С 2018 г. 8 пациентам проведена аутоТСК (в 1-м позднем рецидиве) как этап консолидации лечения. На данный момент обследование на del17p и мутацию TP53 проведено 13 пациентам с ЛКМЗ в федеральных центрах. С ноября 2019 года, впервые в Республике Башкортостан, 2 пациентам с ЛКМЗ начали терапию ингибиторами тирозинкиназы Брутона — ибрутинибом.
Заключение
За последние годы во всем мире значительно поменялись подходы к терапии пациентов с лимфомой зоны мантии. Наряду с гистологическим и иммуногистохи- мическим исследованиями опухолевых тканей в практику все больше внедряется метод молекулярно-генетического исследования, что дает больше возможностей в выборе тактики лечения пациентов.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Информация о спонсорстве. Данная работа не финансировалась.
Список литературы
1. Поддубная И.В., Савченко В.Г. (ред.) Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. М.; 2018.
2. Поддубная И.В., Савченко В.Г. (ред.) Алгоритмы диагностики и протоколы лечения заболеваний системы крови. Т. 1. М.; 2018.
3. Лимфомы из клеток мантии у взрослых: Клинические рекомендации. М.; 2018.
4. Bernstein S.H., Epner E., Unger J.M., Leblanc M., Cebula E., Burack R., et al. A phase II multicenter trial of HyperCVAD MTX/Ara-C and rituximab in patients with previously untreated mantle cell lymphoma; SWOG 0213. Ann Oncol. 2013;24(6):1587–93. DOI: 10.1093/annonc/mdt070
5. Hilal T., Wang Z., Almader-Douglas D., Rosenthal A., Reeder C.B., Jain T. Rituximab maintenance therapy for mantle cell lymphoma: A systematic review and meta-analysis. Am J Hematol. 2018;93(10):1220–6. DOI: 10.1002/ajh.25226
6. Lokvenc M., Kalinova M., Forsterova K., Klener P., Trneny M., Fronkova E., et al. Cyclin D1 mRNA as a molecular marker for minimal residual disease monitoring in patients with mantle cell lymphoma. Ann Hematol. 2018;97(3):467–74. DOI: 10.1007/s00277-017-3210-8
7. Dreyling M., Campo E., Hermine O., Jerkeman M., Le Gouill S., Rule S., et al. Newly diagnosed and relapsed mantle cell lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(Suppl. 4):62–71. DOI: 10.1093/annonc/mdx223
8. Rule S., Dreyling M., Goy A., Hess G., Auer R., Kahl B., et al. Outcomes in 370 patients with mantle cell lymphoma treated with ibrutinib: a pooled analysis from three open-label studies. Br J Haematol. 2017;179(3):430–8. DOI: 10.1111/bjh.14870
9. Воробьев В.И., Гемджян Э.Г., Дубровин Е.И., Нестерова Е.С., Капланов К.Д., Володичева Е.М., и др. Риск-адаптированная интенсивная индукционная терапия, аутологичная трансплантация стволовых кроветворных клеток и поддерживающая терапия ритуксимабом позволяют достигнуть высоких показателей 7-летней выживаемости у больных лимфомой из клеток мантийной зоны. Терапевтический архив. 2019;91(7):41–51. DOI: 10.26442/00403660.2019.07.000322
10. Swerdlow S.H., Campo E., Harris N.L., Jaffe E.S., Pileri S.A., Stein H., et al. (eds) WHO classification of tumours of haematopoietic and lymphoid tissues. Lyon: IARC; 2017.
11. Romaguera J.E., McLaughlin P.W. Mantle cell lymphoma. In: Lichtman M.A., Kipps T.J., Seligsohn U., et al. (eds) Williams hematology. New York: McGraw-Hill; 2014.
12. Dabaja B.S., Zelenetz A.D., Ng A.K., Tsang R.W., Qi S., Allen P.K., et al. Early-stage mantle cell lymphoma: a retrospective analysis from the International Lymphoma Radiation Oncology Group (ILROG). Ann Oncol. 2017;28(9):2185–90. DOI: 10.1093/annonc/mdx334
13. Wang Y., Ma S. Risk factors for etiology and prognosis of mantle cell lymphoma. Expert Rev Hematol. 2014;7(2):23343. DOI: 10.1586/17474086.2014.889561
14. Ruan J., Martin P., Christos P., Cerchietti L., Tam W., Shah B., et al. Five-year follow-up of lenalidomide plus rituximab as initial treatment of mantle cell lymphoma. Blood. 2018;132(19):2016–25. DOI: 10.1182/blood-2018-07-859769
15. Malcikova J., Pavlova S., Kozubik K.S., Pospisilova S. TP53 mutation analysis in clinical practice: lessons from chronic lymphocytic leukemia. Hum Mutat. 2014;35(6):663–71. DOI: 10.1002/humu.22508
16. Воробьев В.И., Лорие Ю.Ю., Мангасарова Я.К., Кравченко С.К., Кременецкая А.М. Возможности терапии рецидивов и резистентного течения лимфомы из клеток мантийной зоны. Гематология и трансфузиология. 2011;(1):34–7.
Об авторах
Э. И. КанкумашеваРоссия
Канкумашева Эльза Ильдаровна — врач-онколог
450054, Уфа, пр-т Октября, 73/1
Ч. Х. Валиахметова
Россия
Валиахметова Чулпан Хусаеновна — к.м.н., врачонколог, зав. онкологическим отделением противоопухолевой лекарственной терапии
450054, Уфа, пр-т Октября, 73/1
Рецензия
Для цитирования:
Канкумашева Э.И., Валиахметова Ч.Х. Лимфомы клеток мантийной зоны. Новые возможности диагностики и лечения (эпидемиологическое исследование). Креативная хирургия и онкология. 2019;9(4):261-265. https://doi.org/10.24060/2076-3093-2019-9-4-261-265
For citation:
Kankumasheva E.I., Valiakhmetova Ch.Kh. Mantle Zone Cell Lymphomas. New Opportunities for Diagnosis and Treatment (Epidemiological Research). Creative surgery and oncology. 2019;9(4):261-265. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-4-261-265


































