Перейти к:
Влияние неоадъювантной химиолучевой терапии на функцию анального держания у пациентов с низкими раками прямой кишки
https://doi.org/10.24060/2076-3093-2020-10-3-190-197
Аннотация
Введение. Целью исследования явилась сравнительная оценка функциональных результатов до и после проведения неоадъювантной химиолучевой терапии.
Материалы и методы. Проведен анализ функциональных результатов проспективного клинического исследования, в которое включены 90 пациентов, перенесших низкую переднюю резекцию прямой кишки по поводу рака нижне- или среднеампулярного отдела прямой кишки сТ1–4aN0–2M0 с различными методами реконструкции.
Результаты и обсуждение. В группу А включены 22 пациента с J‑образными резервуарами (J‑ОР), в группу Б с анастомозами «бок-вконец» (БВК) — 30 и группу В с анастомозами «конец-в‑конец» (КВК) — 38. Из общей группы исследования (n = 90) в 43 случаях была проведена неоадъювантная химиолучевая терапия против 47 пациентов, которые не подвергались предоперационному лечению. По частоте применяемых реконструктивных методик в группах с нХЛТ и без нХЛТ статистически значимой разницы не выявлено (р = 0,725). Также не было различий по частоте послеоперационных осложнений (р = 0,103). Исходные показатели баллов шкалы Wexner и результаты аноректальной манометрии в группах сравнения были сопоставимы (p > 0,05), однако по завершении курса нХЛТ и на протяжении периода с момента операции до 12 месяцев после закрытия превентивных кишечных стом функциональные результаты были менее удовлетворительны в группе пациентов, перенесших нХЛТ (n = 43), по сравнению с группой без нХЛТ (n = 47). Однако статистически значимая разница в результатах была прослежена с момента завершения нХЛТ до 3 месяцев после закрытия стомы (p < 0,05).
Заключение. Проведение неоадъювантной химиолучевой терапии имеет негативное последствие на функцию анального держания, что требует проведения параллельной сопроводительной терапии и физиореабилитации как на этапах нХЛТ, так и на отдаленных интервалах времени после основного хирургического этапа лечения.
Ключевые слова
Для цитирования:
Байчоров А.Б., Расулов А.О. Влияние неоадъювантной химиолучевой терапии на функцию анального держания у пациентов с низкими раками прямой кишки. Креативная хирургия и онкология. 2020;10(3):190-197. https://doi.org/10.24060/2076-3093-2020-10-3-190-197
For citation:
Baichorov A.B., Rasulov A.O. Effects of Neoadjuvant Chemio-Radiation Therapy on the Anal Sphincter Function in Patients with Low Rectal Cancers. Creative surgery and oncology. 2020;10(3):190-197. (In Russ.) https://doi.org/10.24060/2076-3093-2020-10-3-190-197
Введение
Неоадъювантная химиолучевая терапия (нХЛТ) является стандартом в комбинированном лечении местно-распространенных форм рака прямой кишки с доказанной эффективностью как в плане локального контроля болезни и достижения резектабельности [1][2][3][4], так и увеличения доли сфинктеросохранных хирургических вмешательств за счет уменьшения размеров опухоли (down sizing) и снижения стадии (down staging) [5][6][7]. Однако наряду с достижением резектабельности и локального контроля болезни в последующем возникает проблема с качеством жизни пациентов, перенесших химиолучевую терапию [8]. С целью изучения негативного влияния химиолучевой терапии на функцию анального держания было проведено немалое количество исследований, при этом целесообразность применения метода неоадъювантной химиолучевой терапии до конца не выяснена [9][10][11][12], что требует определения более узких показаний для назначения нХЛТ, а в случае обязательности ее выполнения параллельного назначения сопроводительной противовоспалительной терапии и комплекса реабилитационных мер для мышц тазовой диафрагмы, что может нивелировать последствия лучевого воздействия [13].
Материалы и методы
В наше исследование, проведенное с октября 2015 по ноябрь 2017 г., были включены 90 пациентов с установленным диагнозом рака средне- и нижнеампулярного отделов прямой кишки mrТ1–4aN0–2M0. Все пациенты оперированы в объеме низкой передней резекции прямой кишки с формированием превентивной кишечной стомы из традиционного лапаротомного доступа, с применением лапароскопического доступа и трансанального доступа с лапароскопической ассистенцией.
Целью исследования являлось улучшение функциональных результатов и качества жизни посредством выбора оптимального метода хирургической реконструкции.
Все пациенты на амбулаторном этапе были обследованы. В комплекс обследования входило: пальцевое исследование, RRS + колоноскопия с биопсией, ирригоскопия при стенозирующих опухолях с целью исключения синхронных опухолей толстой кишки, КТ грудной клетки и брюшной полости с контрастированием, МРТ органов малого таза. Выбор тактики лечения определялся после обсуждения мультидисциплинарной командой, в состав которой входили химиотерапевт, лучевой терапевт, специалист МРТ-диагностики и патоморфолог. Всем пациентам с вовлечением потенциального латерального края резекции проводилась нХЛТ. При наличии факторов негативного прогноза, таких как экстрамуральная лимфоваскулярная и периневральная инвазия, статус cmrN+, проводилась неоадъювантная или индукционная ПХТ по схеме CAPOX.
Были сформированы три группы пациентов: с анастомозами «конец-в-конец» в контрольной группе, с анастомозами «бок-в-конец» в основной группе Б и пациенты, которым формировались J-образные резервуары в основной группе А. Выбор метода реконструкции после низкой передней резекции прямой кишки осуществлялся слепым методом в предоперационном периоде с информированным согласием пациентов. Все анастомозы формировались с помощью циркулярного сшивающего аппарата. При формировании J-образного резервуара использовался линейно-сшивающий аппарат, длина дистального колена составляла не более 5 см. Уровень лигирования нижних брыжеечных сосудов и мобилизации селезеночного изгиба ободочной кишки производился в зависимости от длины низводимой в полость малого таза сигмовидной кишки. Выбор в формировании превентивных илео- или трансверзостом зависел от личных предпочтений хирурга, а также от нутритивного статуса пациента, где у ослабленных пациентов было более предпочтительным формирование трансверзостомы. Сроки восстановительных операций по закрытию превентивных стом зависели от необходимости проведения адъювантной химиотерапии.
Специфическим методом обследования и мониторинга функциональных результатов являлась аноректальная манометрия, проводившаяся перед и после неоадъювантной химиолучевой терапии на сроках 3–6–12 месяцев после восстановительной операции. С целью оценки степени анальной инконтиненции использовалась шкала Wexner. Статистический анализ производился с помощью программы SPSS (IBM SPSS statistics for Macintosh, version 22.0, IBM Corp, Armonk, NY).
Результаты
Общее количество набранных в исследование пациентов составило 90 человек. Из них 43 человека перенесли химиолучевую терапию по поводу местно-распространенных форм рака с вовлечением циркулярной границы резекции как первичной опухолью, так и метастатически пораженными лимфоузлами мезоректума. При сравнении общей группы исследования не было получено достоверных различий по количеству пациентов, которые перенесли нХЛТ (n = 43), и группой пациентов, которым не была показана нХЛТ (n = 47). Также не было статистически значимой разницы при внутригрупповом сравнении, где в трех исследуемых группах не было разницы по количеству перенесших нХЛТ и без нХЛТ (р = 0,725) (табл. 1). Исходя из этого мы решили дать сравнительную оценку непосредственных и функциональных результатов у пациентов, перенесших нХЛТ и без применения нХЛТ.
Группы сравнения с нХЛТ и без нХЛТ были сопоставимы по возрасту и индексу массы тела (р > 0,05), по половой принадлежности в группе с нХЛТ было достоверно большее количество пациентов мужского пола, где p = 0,001 (табл. 1).
Таблица 1. Характеристики групп сравнения
Table 1. Characteristics of the comparison groups
Параметры | Группа пациентов с нХЛТ (n = 43) | Группа пациентов без нХЛТ (n = 47) | Р |
Вариант реконструкции: конец-в-конец бок-в-конец J-pouch | 20 13 10 | 18 17 12 | 0,725 |
Возраст (медиана) | 56 (min 34, max 71) | 58 (min 28, max 75) | 0,505 |
Мужчины Женщины | 29 14 | 16 31 | 0,001 |
ИМТ (медиана) | 26,7 (19,3–32,2) | 25,4 (19,1–36,4) | 0,408 |
По частоте сопутствующей патологии также не получено статистически значимых различий в группах с нХЛТ и без нХЛТ соответственно (р = 0,273) (табл. 2).
Таблица 2. Сопутствующие заболевания
Table 2. Comorbidities
Сопутствующая патология | Группа пациентов с нХЛТ (n = 43) | Группа пациентов без нХЛТ (n = 47) | P |
Дыхательная | 3 (6,9%) | 5 (10,6%) | 0,273 |
Сердечно-сосудистая | 19 (44,2%) | 16 (34%) | |
Пищеварительная | 5 (11,6%) | 10 (21,3%) | |
Мочевыделительная | 4 (9,3%) | 1 (2,1%) | |
Эндокринная | 0 | 1 (2,1%) | |
Ожирение | 5 (11,6%) | 10 (21,2%) | |
Не выявлено | 7 (16,2%) | 4 (8,5%) |
При сравнительной оценке стадии по классификации TNM при клиническом МРТ стадировании: по статусу Т — пациенты с опухолями Т4 были представлены в группе с нХЛТ, составив 28 человек, а опухолей T3 оказалось значительно больше в группе пациентов, не подвергнутых нХЛТ, составив 38 случаев, следовательно, р < 0,05 (табл. 3); по статусу N — количество пациентов с метастатически пораженными лимфоузлами мезоректума в группах с и без нХЛТ статистически значимых не различалось (р = 0,271).
Таблица 3. Локализация, уровень резекции и клиническое стадирование
Table 3. Localization, level of resection and clinical staging
Параметры | Группа пациентов с нХЛТ (n = 43) | Группа пациентов без нХЛТ (n = 47) | Р |
Расстояние опухоли от ануса, см (медиана) | 7,0 (5–10) | 7,0 (5–10) | 0,738 |
Линия степлерного шва | 4 (3–7) | 4 (3–6) | 0,674 |
Стадия по ТNM cmr-T: 1 2 3 4 сmr-N + | 0 2 (4,6%) 13 (30,2%) 28 (65,2%) 16 (37,2%) | 2 (4,2%) 8 (17%) 38 (80,9%) 0 13 (27,6%) | 0,004 0,271 |
Также были оценены послеоперационные осложнения по классификации Clavien — Dindo, где наиболее значимым осложнением в сравниваемых группах являлась несостоятельность колоректального анастомоза. Так, несостоятельностей в группе с нХЛТ было 2, они были разрешены консервативно и не потребовали повторной операции, и 3 случая несостоятельности в группе пациентов, не подвергнутых нХЛТ, в двух из которых потребовалось повторное хирургическое вмешательство без разобщения анастомоза. В целом по частоте послеоперационных осложнений статистически значимых различий не получено (р = 0,103) (табл. 4).
Таблица 4. Послеоперационные осложнения
Table 4. Postoperative complications
Степень по Clavien — Dindo | Виды осложнений | Группа пациентов с нХЛТ (n = 43) | Группа пациентов без нХЛТ (n = 47) | Р |
I | Атония мочевого пузыря Парез ЖКТ Гипертермия Тромбоз глубоких вен нижних конечностей | 3 2 3 0 | 0 1 4 2 | >0,05 |
II | Несостоятельность анастомоза | 2 | 1 | >0,05 |
IIIb | Несостоятельность анастомоза Кровотечение из вен малого таза Серозоцеле малого таза | 0 1 3 | 2 0 0 | >0,05 |
Всего | 13 (30%) | 10 (21%) | 0,103 |
Наиболее важна сравнительная оценка функциональных результатов между группами пациентов, перенесших нХЛТ и без нХЛТ. Функциональное состояние анального сфинктерного комплекса оценивалось по шкале анальной инконтиненции Wexner и с помощью аноректальной манометрии.
При сравнении исходных показателей анальной континенции по шкале Wexner (табл. 5, где р = 0,8) и результатов аноректальной манометрии (рис. 1–5, где р > 0,05) в группе пациентов, перенесших нХЛТ, и пациентов без нХЛТ статистически значимых различий не было.
При оценке функции держания по шкале Wexner у пациентов (n = 43) после завершения неоадъювантной химиолучевой терапии имелась тенденция увеличения медианы баллов с 0 до 2, чего не наблюдалось у пациентов, которые не подвергались нХЛТ (n = 47), однако достоверной разницы не выявлено (р = 0,53). Также при наблюдении от 3 до 12 месяцев после восстановительных операций медиана баллов была наибольшей в группе пациентов с нХЛТ, но статистически значимых различий не было (р > 0,05) (табл. 5).
Таблица 5. Оценка функции анального держания по шкале Wexner
Table 5. Assessment of the anal sphincter function on the Wexner scale
Параметры: | Результаты у 43 пациентов, которые получали неоадъювантную химиолучевую терапию | p | |
группа пациентов с нХЛТ (n = 43) | группа пациентов без нХЛТ (n = 47) | ||
До ХЛТ/Исходные значения | 0 (0–1) | 0 (0–2) | 0,8 |
После ХЛТ/Перед операцией | 2 (0–4) | 0 (0–2) | 0,053 |
3 мес. после закрытия стомы | 7 (4–12) | 5 (4–10) | 0,41 |
6 мес. после закрытия стомы | 5 (0–9) | 4 (0–8) | 0,692 |
12 мес. после закрытия стомы | 1 (0–3) | 0 (0–4) | 0,429 |
При сравнительной оценке данных аноректальной манометрии при одинаковых исходных значениях имелась достоверная тенденция снижения всех показателей тонуса анального сфинктера у пациентов, перенесших нХЛТ, по сравнению с пациентами в группе без нХЛТ (р < 0,05) (рис. 1–5).
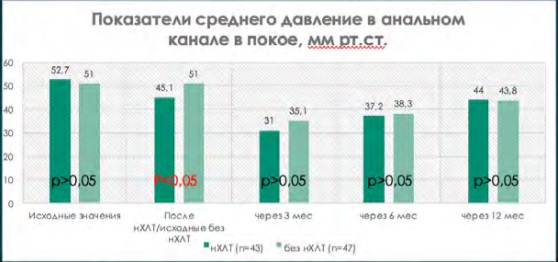
Рисунок 1. Показатели среднего давления покоя в анальном канале на этапах наблюдения
Figure 1. Indicators of the average resting pressure in the anal canal at the stages of observation
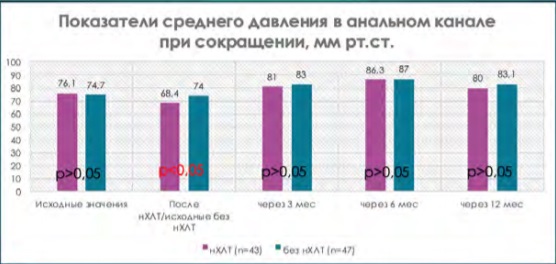
Рисунок 2. Показатели среднего давления сокращения в анальном канале на этапах наблюдения
Figure 2. Indicators of the average contraction pressure in the anal canal at the stages of observation
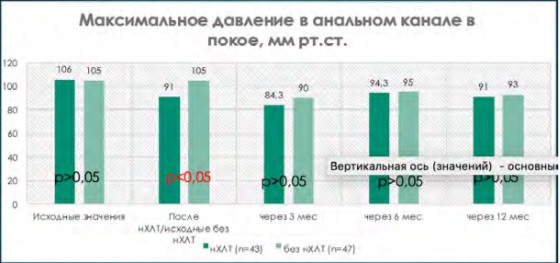
Рисунок 3. Показатели максимального давления покоя в анальном канале на этапах наблюдения
Figure 3. Indicators of the maximum resting pressure in the anal canal at the stages of observation
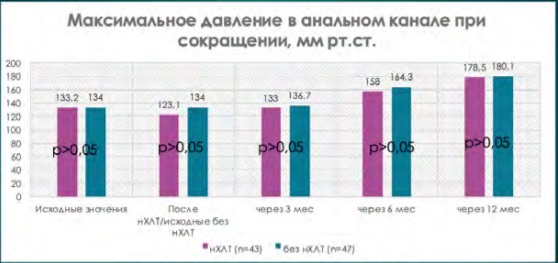
Рисунок 4. Показатели максимального давления в анальном канале при сокращении на этапах наблюдения
Figure 4. Indicators of the maximum contraction pressure in the anal canal at the stages of observation
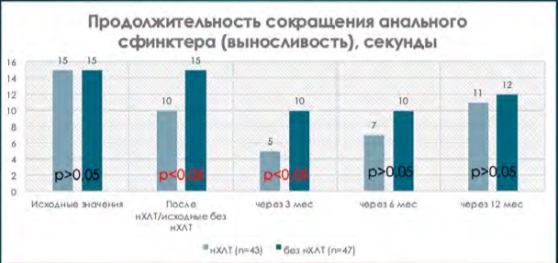
Рисунок 5. Показатели продолжительности сокращения анального сфинктера на этапах наблюдения
Figure 5. Indicators of the duration of contraction of the anal sphincter at the stages of observation
В период от 3 до 12 месяцев показатели аноректальной манометрии были выше у пациентов, которые не подвергались нХЛТ, по сравнению с данными пациентов, перенесших нХЛТ, но также не прослежено достоверной разницы (р > 0,05) (рис. 1–4).
Наиболее показательным результатом негативного воздействия нХЛТ на анальный сфинктерный комплекс было снижение мышечной выносливости, или, другими словами, продолжительности сокращения сфинктера. В группе пациентов с нХЛТ было снижение медианы продолжительности сокращения сфинктера с 15 секунд от исходного состояния до 10 секунд по завершении нХЛТ, а уже к 3 месяцам после восстановительной операции медиана продолжительности сокращения снизилась до 5 секунд против 10 секунд у пациентов, не подвергавшихся нХЛТ (р < 0,05) (рис. 5). С 6 до 12 месяцев наблюдения медиана баллов была ниже в группе с нХЛТ, но без статистической достоверности (р > 0,05).
Резюмируя данные аноректальной манометрии и шкалы Wexner, важно отметить, что, несмотря на снижение функции держания, у пациентов, перенесших нХЛТ, имелась положительная тенденция к улучшению функциональных результатов с 3 до 12 месяцев после восстановительной операции, причем показатели функциональных результатов пациентов сравниваемых групп с отметки 6 месяцев не имели статистически значимых различий и были равными. Но при сравнении баллов шкалы Wexner и числовых значений результатов аноректальной манометрии группа пациентов, перенесших нХЛТ, демонстрировала менее удовлетворительные результаты по сравнению с группой без нХЛТ на протяжении всего срока наблюдения, со времени завершения нХЛТ до 12 месяцев после восстановительной операции.
Обсуждение
По результатам нашего исследования факт негативного влияния ХЛТ на функцию анального держания очевиден. В группах сравнения между пациентами, которые получали нХЛТ, и теми, которые не получали аналогичного неоадъювантного лечения, имеется отчетливая тенденция к снижению показателей аноректальной манометрии и увеличению баллов по шкале Wexner, характеризующих анальную инконтиненцию. Аналогичные данные были опубликованы рядом авторов в западных изданиях. Так, в работах F. Arias et al. [14] представлены данные 92 пациентов, которые получали нХЛТ при местно-распространенных формах рака прямой кишки, и было показано, что доза облучения коррелирует с функцией анального держания. Таким образом, при пролонгированной программе нХЛТ вероятны более негативные функциональные исходы и качество жизни, ввиду чего авторы рекомендуют рациональный подход в проведении нХЛТ с возможным снижением радиационной дозы, насколько это возможно.
Можно предположить, что чем выше доза облучения, тем более выражено негативное влияние лучевой терапии на функцию анального держания. Но есть ряд исследований, свидетельствующих о снижении функции анального держания вне зависимости от дозы лучевой терапии. В исследовании S. Bregendahl [15] продемонстрированы результаты лечения 938 пациентов, перенесших нХЛТ с последующим хирургическим лечением в объеме низкой передней резекции прямой кишки. Авторы связывают явления синдрома низкой передней резекции (СНПР) с тотальной мезоректумэктомией, а также с фактом нХЛТ как одним из ключевых факторов для возникновения анальной инконтиненции, вне зависимости от дозы облучения.
Также свидетельством негативного воздействия нХЛТ на анальный сфинктерный комплекс является работа L. Lundby et al. [16], в которой исследователи описывают группу пациентов, получавших адъювантную терапию после хирургического этапа лечения рака прямой кишки. Авторы заявляют, что данное обстоятельство еще более усугубляло и так имеющиеся неудовлетворительные функциональные результаты, снижая сократительную способность анального сфинктерного комплекса.
В ретроспективном анализе, проведенном L. M. Wiltink et al., была дана сравнительная оценка функциональных результатов пациентов, получавших нХЛТ по пролонгированной программе (СОД 50,4 Гр) и короткий курс нХЛТ (СОД 25 Гр) по поводу рака прямой кишки. Исследование не показало клинически значимых различий между двумя группами сравнения, за исключением меньшей удовлетворенности функцией мочеиспускания, о которой сообщают пациенты в группе пролонгированного курса нХЛТ. Доказано, что оба подхода оказывают сопоставимое влияние на функцию анального недержания в долгосрочном периоде наблюдения [17].
В метаанализ, проведенный M. Loos et al. [18] в 2013 году, включены данные 25 исследований (6548 пациентов), где на большом клиническом материале продемонстрировано отрицательное влияние нХЛТ на сократительную способность анального сфинктера и снижение мочеполовой функции, которые еще больше усугубляются при комбинации нХЛТ и тотальной мезоректумэктомии.
В другом систематическом обзоре [19], посвященном проблеме аноректальной дисфункции при лучевой терапии рака предстательной железы, также отводится отдельная глава функциональным проблемам, связанным с анальным и мочевым недержанием. Авторы предполагают, что механизм, по-видимому, связан с прямым поражением тазовых нервных сплетений и фиброзом таза, индуцированным лучевой терапией.
Негативное влияние неоадъювантной лучевой терапии на функцию анального сфинктера является причиной возникновения анальной инконтиненции в предоперационном периоде и развития в дальнейшем более выраженных проявлений СНПР по сравнению с пациентами, которые не подвергались химиолучевой терапии до операции. Это наводит на мысль актуальности функциональной реабилитации пациентов на этапах проведения нХЛТ и после ее завершения.
Рандомизированное контролируемое исследование у пациентов, перенесших лучевую терапию по поводу рака простаты, показало, что физические упражнения во время лучевой терапии [20] привели к многочисленным положительным физиологическим и психологическим эффектам. Современные рекомендации по функциональной реабилитации пациентов, получающих комбинированное лечение по поводу рака, включают в себя упражнения для улучшения функции как кардиореспираторной системы, так и скелетно-мышечной функции [21][22]. Однако потенциальная роль физических упражнений в улучшении функциональных результатов и качества жизни во время нХЛТ при раке прямой кишки недостаточно исследована и требует дальнейшего изучения. Но есть сообщения [23], что в результате тренировочной программы мышечная сила нижней части тела значительно увеличилась, так же как и мышечная выносливость. Эти результаты показывают, что физические упражнения могут нивелировать неблагоприятное воздействие нХЛТ на мышечную деятельность тазовой диафрагмы и помогают не только сохранять, но и улучшать мышечную функцию анального сфинктерного комплекса пациента до этапа хирургического лечения.
Заключение
Негативное воздействие лучевой терапии в той или иной степени вызывает явления анальной инконтиненции, которая, в свою очередь, вызывает неудовлетворительное качество жизни пациентов. Однако важность применения химиолучевой терапии при комбинированном лечении местно-распространенного рака прямой кишки остается актуальной. Следовательно, выбор метода нХЛТ должен иметь более узкие показания, но необходим контроль качества при проведении лучевой топометрии. Это требует четкого оконтуривания опухоли, предотвращения или минимизации попадания в поля облучения анального сфинктерного комплекса (мышц тазового дна) и тазовых вегетативных нервных сплетений. Исходя из этого пациенты, перенесшие нХЛТ, нуждаются в проведении БОС-терапии и физиореабилитации мышц тазового дна под надзором врачей-реабилитологов, вне зависимости от выбора дальнейшей тактики лечения, что может позитивно сказаться на функции анального держания.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Информация о спонсорстве. Данная работа не спонсировалась.
Список литературы
1. Ерыгин Д.В., Бердов Б.А., Невольских А.А., Титова Л.Н., Смирнова С.Г. Неоадъювантная химиолучевая терапия местно-распространенного рака прямой кишки. Онкология. Журнал им. П.А. Герцена. 2015;4(1):13–20. DOI: 10.17116/onkolog20154113-20
2. Правосудов И.В., Алиев И.И., Шулепов П.В. Мультидисциплинарный подход к лечению больных раком прямой кишки: оценка клинического и патологического ответа у больных, получавших предоперационную химиолучевую терапию. Онкологическая колопроктология. 2012;1:7–11. DOI: 10.17650/2220-3478-2012-0-1-7-10
3. Wawok P., Polkowski W., Richter P., Szczepkowski M., Olędzki J., Wierzbicki R., et al. Preoperative radiotherapy and local excision of rectal cancer: Long-term results of a randomised study. Radiother Oncol. 2018;127(3):396–403. DOI: 10.1016/j.radonc.2018.04.004
4. Ansari N., Solomon M.J., Fisher R.J., Mackay J., Burmeister B., Ackland S., et al. Acute adverse events and postoperative complications in a randomized trial of preoperative short-course radiotherapy versus long-course chemoradiotherapy for T3 adenocarcinoma of the rectum: Trans-Tasman Radiation Oncology Group Trial (TROG 01.04). Ann Surg. 2017;265(5):882–8. DOI: 10.1097/SLA.0000000000001987
5. Magri K.D., Bin F.C., Formiga F.B., Manzione Tda S., Gomes C.M., Candelári Pde A., et al. Impact of neoadjuvant therapy in downstaging of lower rectal adenocarcinoma and the role of pelvic magnetic resonance in staging. Rev Col Bras Cir. 2016;43(2):102–9. DOI: 10.1590/0100-69912016002006
6. Seo N., Kim H., Cho M.S., Lim J.S. Response assessment with MRI after chemoradiotherapy in rectal cancer: current evidences. Korean J Radiol. 2019;20(7):1003–18. DOI: 10.3348/kjr.2018.0611
7. Wang X.J., Chi P., Lin H.M., Lu X.R., Huang Y., Xu Z.B., et al. Effects of neoadjuvant chemoradiotherapy on the rates of sphincter preserving surgery in lower rectal cancer and analysis of their prognostic factors. Zhonghua Wai Ke Za Zhi. 2016;54(6):419–23. DOI: 10.3760/cma.j.issn.0529-5815.2016.06.005
8. Ozgen Z., Ozden S., Atasoy B.M., Ozyurt H., Gencosmanoglu R., Imeryuz N. Long-term effects of neoadjuvant chemoradiotherapy followed by sphincter-preserving resection on anal sphincter function in relation to quality of life among locally advanced rectal cancer patients: a cross-sectional analysis. Radiat Oncol. 2015;10:168. DOI: 10.1186/s13014-015-0479-4
9. Sunesen K.G., Nørgaard M., Lundby L., Havsteen H., Buntzen S., Thorlacius-Ussing O., et al. Long-term anorectal, urinary and sexual dysfunction causing distress after radiotherapy for anal cancer: a Danish multicentre cross-sectional questionnaire study. Colorectal Dis. 2015;17(11):O230–9. DOI: 10.1111/codi.13076
10. Couwenberg A.M., Burbach J.P.M., van Grevenstein W.M.U., Smits A.B., Consten E.C.J., Schiphorst A.H.W., et al. Effect of neoadjuvant therapy and rectal surgery on health-related quality of life in patients with rectal cancer during the first 2 years after diagnosis. Clin Colorectal Cancer. 2018;17(3):e499–e512. DOI: 10.1016/j.clcc.2018.03.009
11. van der Sande M.E., Hupkens B.J.P., Berbée M., van Kuijk S.M.J., Maas M., Melenhorst J., et al. Impact of radiotherapy on anorectal function in patients with rectal cancer following a watch and wait programme. Radiother Oncol. 2019;132:79–84. DOI: 10.1016/j.radonc.2018.11.017
12. Rosa C., Di Tommaso M., Caravatta L., Vinciguerra A., Augurio A., Perrotti F., et al. Assessment of bowel and anal sphincter function after neoadjuvant chemoradiotherapy in locally advanced rectal cancer. Tumori. 2018;104(2):121–7. DOI: 10.1177/0300891618765580.
13. Alejo L.B., Pagola-Aldazabal I., Fiuza-Luces C., Huerga D., de Torres M.V., Verdugo A.S., et al. Exercise prehabilitation program for patients under neoadjuvant treatment for rectal cancer: A pilot study. J Cancer Res Ther. 2019;15(1):20–5. DOI: 10.4103/jcrt. JCRT_30_17
14. Arias F., Eito C., Asín G., Mora I., Cambra K., Mañeru F., et al. Fecal incontinence and radiation dose on anal sphincter in patients with locally advanced rectal cancer (LARC) treated with preoperative chemoradiotherapy: a retrospective, single-institutional study. Clin Transl Oncol. 2017;19(8):969–75. DOI: 10.1007/s12094-017-1627-0
15. Bregendahl S., Emmertsen K.J., Lous J., Laurberg S. Bowel dysfunction after low anterior resection with and without neoadjuvant therapy for rectal cancer: a population-based cross-sectional study. Colorectal Dis. 2013;15(9):1130–9. DOI: 10.1111/codi.12244
16. Lundby L., Krogh K., Jensen V.J., Gandrup P., Qvist N., Overgaard J., et al. Long-term anorectal dysfunction after postoperative radiotherapy for rectal cancer. Dis Colon Rectum. 2005;48(7):1343–9. DOI: 10.1007/s10350-005-0049-1
17. Wiltink L.M., Nout R.A., van der Voort van Zyp J.R.N., Ceha H.M., Fiocco M., Meershoek-Klein Kranenbarg E., et al. Long-term healthrelated quality of life in patients with rectal cancer after preoperative short-course and long-course (chemo) radiotherapy. Clin Colorect Cancer. 2016;15(3):93–9. DOI: 10.1016/j.clcc.2016.02.012
18. Loos M., Quentmeier P., Schuster T., Nitsche U., Gertler R., Keerl A., et al. Effect of preoperative radio(chemo)therapy on long-term functional outcome in rectal cancer patients: a systematic review and meta-analysis. Ann Surg Oncol. 2013;20(6):1816–28. DOI: 10.1245/s10434-012-2827-z
19. Krol R., Smeenk R.J., van Lin E.N., Yeoh E.E., Hopman W.P. Systematic review: anal and rectal changes after radiotherapy for prostate cancer. Int J Colorectal Dis. 2014;29(3):273–83. DOI: 10.1007/s00384-013-1784-8
20. Alibhai S.M.H., Santa Mina D., Ritvo P., Tomlinson G., Sabiston C., Krahn M., et al. A phase II randomized controlled trial of three exercise delivery methods in men with prostate cancer on androgen deprivation therapy. BMC Cancer. 2019;19(1):2. DOI: 10.1186/s12885-018-5189-5
21. Rock C.L., Doyle C., Demark-Wahnefried W., Meyerhardt J., Courneya K.S., Schwartz A.L., et al. Nutrition and physical activity guidelines for cancer survivors. Cancer J Clin. 2012;62(4):243–74. DOI: 10.3322/caac.21142
22. Schmitz K.H., Courneya K.S., Matthews C., Demark-Wahnefried W., Galvão D.A., Pinto B.M., et al. American College of Sports Medicine roundtable on exercise guidelines for cancer survivors. Med Sci Sports Exerc. 2010; 42(7):1409–26. DOI: 10.1249/MSS.0b013e3181e0c112
23. Singh F., Galvão D.A., Newton R.U., Spry N.A., Baker M.K., Taaffe D.R. Feasibility and preliminary efficacy of a 10-week resistance and aerobic exercise intervention during neoadjuvant chemoradiation treatment in rectal cancer patients. Integr Cancer Ther. 2018;17(3):952–9. DOI: 10.1177/1534735418781736
Об авторах
А. Б. БайчоровРоссия
к.м.н., отделение колопроктологии,
Москва
А. О. Расулов
Россия
д.м.н., профессор, отдел малоинвазивной тазовой хирургии,
Москва
Рецензия
Для цитирования:
Байчоров А.Б., Расулов А.О. Влияние неоадъювантной химиолучевой терапии на функцию анального держания у пациентов с низкими раками прямой кишки. Креативная хирургия и онкология. 2020;10(3):190-197. https://doi.org/10.24060/2076-3093-2020-10-3-190-197
For citation:
Baichorov A.B., Rasulov A.O. Effects of Neoadjuvant Chemio-Radiation Therapy on the Anal Sphincter Function in Patients with Low Rectal Cancers. Creative surgery and oncology. 2020;10(3):190-197. (In Russ.) https://doi.org/10.24060/2076-3093-2020-10-3-190-197


































