Перейти к:
Субпопуляции интратуморальных эффекторных клеток при раке молочной железы (обзор литературы и представление собственных данных)
https://doi.org/10.24060/2076-3093-2021-11-4-328-336
Аннотация
Рак молочной железы (РМЖ) является самым распространенным злокачественным новообразованием у женщин в мире. Несмотря на достигнутые успехи в диагностике РМЖ и новейшие лекарственные режимы лечения, остается еще целый ряд нерешенных задач, связанных с развитием опухолевой резистентности и, как следствие, прогрессированием заболевания. Одним из факторов, определяющих устойчивость опухоли к современным методам лечения, является ее способность уклоняться от иммунного ответа. Поэтому на сегодняшний день учеными всего мира достаточно много внимания уделяется изучению механизмов взаимодействия опухоли с иммунной системой организма.
Известно, что микроокружение опухоли вносит значительный вклад в формирование характера данного взаимодействия. Частью микроокружения опухоли являются иммунные клетки, которые могут быть опухольассоциированными макрофагами, супрессорными клетками миелоидного происхождения, опухоль-инфильтрирующими лимфоцитами. Лимфоциты, инфильтрирующие опухоль, представлены В-, Т-, NK-клетками, локализация которых и их субпопуляционный состав в опухоли могут иметь разное прогностическое и клиническое значение. Плотность инфильтрации отдельными видами эффекторных клеток до химиотерапии служит важным предиктором выживаемости больных. Иными словами, присутствие субпопуляций эффекторных лимфоцитов в опухоли характеризует степень напряженности противоопухолевого иммунного ответа и может определять успешность лекарственного лечения.
В данном исследовании проанализированы уровни инфильтрации CD3, CD4, CD20, СD38 лимфоцитами при нескольких молекулярных подтипах РМЖ. Иммунофенотипирование опухоли проведено на криостатных срезах методом иммунофлуоресценции (микроскоп Zeiss (Axioskop, Германия)). Проанализированы 96 образцов люминального РМЖ (37 (38,5 %) — подтип А; 52 (54,2 %) — В-Her2-негативный подтип; 7 (7,3 %) — В-Her2-позитивный подтип) и нелюминального РМЖ (3 (14,3 %) — HER2+ подтип; 18 (85,7 %) — трижды негативный подтип). Оценивались характер инфильтрации и выраженность экспрессии антигенов. Анализ уровня инфильтрации субпопуляциями лимфоцитов установил, что при люминальном РМЖ выраженность инфильтрации меньше, чем при других подтипах, однако достоверной связи не обнаружено.
Ключевые слова
Для цитирования:
Рябчиков Д.А., Чулкова С.В., Шамилов Ф.А., Чантурия Н.В., Желтиков С.Д., Тупицын Н.Н. Субпопуляции интратуморальных эффекторных клеток при раке молочной железы (обзор литературы и представление собственных данных). Креативная хирургия и онкология. 2021;11(4):328-336. https://doi.org/10.24060/2076-3093-2021-11-4-328-336
For citation:
Ryabchikov D.A., Chulkova S.V., Shamilov F.A., Chanturiya N.V., Zheltikov S.D., Tupitsyn N.N. Intratumoural Effector Cell Subpopulations in Breast Cancer: a Literature Review and Own Data Report. Creative surgery and oncology. 2021;11(4):328-336. (In Russ.) https://doi.org/10.24060/2076-3093-2021-11-4-328-336
Введение
Рак молочной железы (РМЖ) — наиболее распространенная злокачественная опухоль у женщин. В 2020 году в мире выявлено около 2,2 млн новых случаев РМЖ [1]. В России в 2019 году зарегистрировано 74 490 новых случаев, что составляет 20,9 % в структуре заболеваемости злокачественными новообразованиями у женщин [2]. Показатели смертности от РМЖ за последние годы снизились. Это обусловлено как ранней диагностикой, так и совершенствованием подходов в лекарственной терапии. Благодаря фундаментальным исследованиям в области биологии рака стало известно, что большинство злокачественных опухолей являются довольно гетерогенными, а их клиническое течение зависит от многих параметров, включая экспрессию различных онкогенов, разнообразных маркеров клетками первичной и метастатической опухоли — стволовых и адгезионных факторов, рецепторов роста и стероидных гормонов и др. [3–9]. Эти маркеры определяют различные свойства опухолевой клетки и многие из них важны при выборе лечебной тактики. Анализ их экспрессии позволяет оценить пролиферативный потенциал опухоли, установить ее гормонозависимость, определить чувствительность к таргетной, иммунотерапии и химиотерапии. Надо сказать, что предсказание эффективности лекарственной терапии является одной из главных задач в лечении РМЖ. На современном этапе выбор лекарственных средств и режимов терапии РМЖ должен основываться на биологических свойствах опухоли конкретного больного, что обусловливает индивидуальный терапевтический подход [10–15]. Поэтому на сегодняшний день для лучшего понимания молекулярных механизмов опухоли и более точного определения подтипов РМЖ важным становится разработка инновационных диагностических стратегий, учитывающих не только фенотип опухоли, но и особенности ее микроокружения, что влияет на качество противоопухолевого иммунного надзора [16][17].
Широко известно, что иммунная система для надзора за опухолью использует разнообразные клеточные и гуморальные факторы, которые в тесном симбиозе обеспечивают индукцию и реализацию противоопухолевого ответа [18]. В иммунном противоопухолевом ответе участвуют клетки как врожденного, так и приобретенного иммунитета, созревание и обучение которых проходит в центральных и периферических иммунорегуляторных органах [18–22]. Известно, что эффективность противоопухолевого ответа определяется существующим балансом различных популяций эффекторных иммунных клеток, инфильтрирующих опухоль, роль которых может меняться в зависимости от факторов опухолевой среды [23–25]. Иммунные клетки представлены опухоль-ассоциированными макрофагами, супрессорными клетками миелоидного происхождения, опухоль-инфильтрирующими лимфоцитами, среди которых подавляющее большинство составляют Т-клетки (рис. 1) [26–29]. Популяция Т-лимфоцитов неоднородна, присутствие тех или иных видов Т-клеток может вести либо к подавлению опухолевого роста, либо к прогрессии опухоли [30]. Поэтому изучение фенотипа Т-лимфоцитов при разных видах рака, в том числе при молекулярно-биологических подтипах РМЖ, вызывает большой интерес.
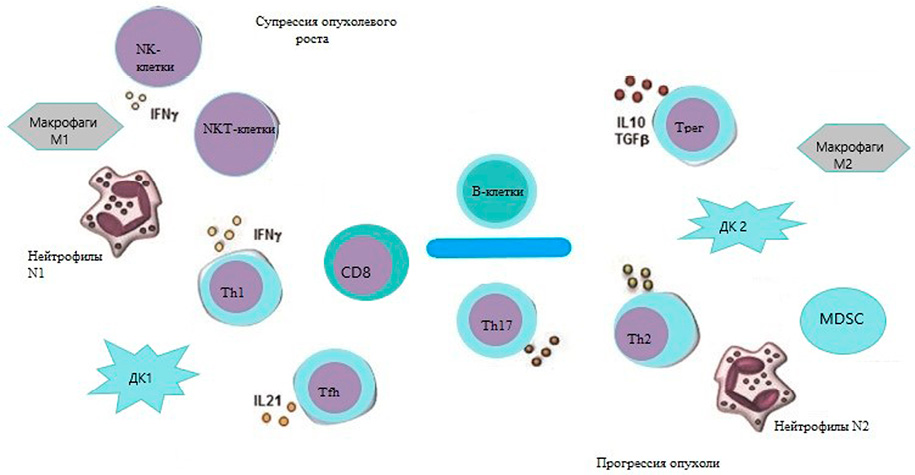
Рисунок 1. Опухоль-инфильтрирующие лимфоциты (Th — Т-хелперы, CD8 — Т-супрессоры, ДК — дендритные клетки, MDSC — супрессорные клетки миелоидного происхождения, NKT — натуральные T-клетки киллеры, Tрег — регуляторные T-клетки)
Figure 1. Tumour-infiltrating lymphocytes. (Th, T-helpers; CD8, T-suppressors; ДК, dendritic cells; MDSC, myeloid-derived suppressor cells; NKT, natural killer T-cells; Tрег, regulatory T-cells)
Интратуморальные Т-лимфоциты
Эффекторы противоопухолевого иммунитета, к которым относятся Т-клетки, широко изучаются уже многие десятилетия. Их роль впервые была продемонстрирована на мышиных моделях. Показано, что индуцированные ультрафиолетовым облучением злокачественные опухоли отторгаются у здоровых мышей, тогда как в отсутствие Т-клеток наблюдается их продолженный рост. Получены доказательства важной роли Т-клеток в противоопухолевом иммунном ответе у человека [10]. В эксперименте установлено, что Т-лимфоциты, выделенные из опухоли или полученные из крови больных раком, in vitro реагируют с аутологичными опухолевыми клетками. Положительные ответы на химиотерапию у больных раком с распространенными стадиями в половине случаев получены благодаря использованию адоптивного переноса опухоль-инфильтрирующих лимфоцитов, экспансия которых предварительно достигнута in vitro.
Многочисленные исследования по изучению инфильтрации опухоли Т-клетками, продемонстрировали, что общее количество инфильтрирующих опухоль Т-клеток не влияет на прогноз РМЖ [10]. Важную роль имеет инфильтрация опухоли субпопуляциями Т-лимфоцитов и в первую очередь цитотоксическими Т-клетками (CD8+) [18]. Следует отметить, что инфильтрирующие опухоль Т-клетки изучаются многими учеными и до сих пор нет единого мнения в отношении роли отдельных субпопуляций в клиническом течении разных видов злокачественных новообразований. Показано, что выраженное содержание цитотоксических Т-клеток (CD8+) в строме опухоли ассоциируется с лучшей выживаемостью, тогда как O. Kawai и соавт. утверждают, что только перитуморальная инфильтрация коррелирует с выживаемостью больных [31][32]. Цитотоксические Т-лимфоциты (CD8+), несомненно, эффективно опосредуют противоопухолевый иммунный ответ, и именно поэтому первоначально пристальное внимание уделяли преимущественно этой субпопуляции Т-клеток. В ходе исследований инфильтрирующих опухоль лимфоцитов обнаружилось, что они представлены не только CD8+ клетками, но и другими иммунными клетками, а также что их локация может иметь важное клиническое значение [33].
Характер инфильтрации опухоли. Клиническое значение интратуморальных лимфоцитов
На сегодняшний день установлено, что опухоль-инфильтрирующие Т-лимфоциты могут играть разнонаправленную роль: они могут подавлять опухолевый рост или способствовать прогрессии опухоли путем создания в микроокружении благоприятных условий и поддержания иммунорезистентных опухолевых клонов [33]. Инфильтрирующие опухоль лимфоциты могут располагаться в строме опухоли — это так называемые стромальные лимфоциты, или в опухолевых островках [31].
При разных молекулярно-биологических подтипах РМЖ содержание опухоль-инфильтрирующих лимфоцитов может различаться. В нескольких исследованиях установлено, что опухоли с отсутствием экспрессии рецепторов гормонов или с выраженной экспрессией рецептора пролиферативной активности Ki67 характеризуются выраженной лимфоцитарной инфильтрацией. Высокая плотность опухоль-инфильтрирующих лимфоцитов также отмечена при трижды негативном РМЖ. Выявлена корреляция количества опухоль-инфильтрирующих лимфоцитов с наличием опухолевых стволовых клеток и экспрессией маркеров эпителиально-мезенхимального перехода [34].
Большинство опухоль-инфильтрирующих лимфоцитов представлено Т-лимфоцитами, в то время как В-лимфоциты встречаются реже [34][35]. Наиболее изученными субпопуляциями являются зрелые Т-клетки (CD3+), цитотоксические CD8+ клетки и Т-хелперы (CD4+). Gobert и соавт. сообщают о присутствии в перитуморальных лимфоцитарных инфильтратах иммуносупрессивной субпопуляции Т-лимфоцитов — Foxp3+ клеток, что коррелирует с присутствием зрелых CD3+ клеток и дендритных клеток [36].
Интересные данные представлены в работе А. Cimino-Mathews, в которой сравнивается содержание и субпопуляционный состав инфильтрирующих опухоль лимфоцитов в первичной опухоли и метастатических очагах у 15 больных РМЖ. Оказалось, что инфильтрация CD3+, CD4+, CD8+, Foxp3+ и CD20+ клетками была менее выражена в метастатическом очаге по сравнению с первичной опухолью [34].
Фенотип инфильтрирующих опухоль Т-лимфоцитов имеет некоторые отличия в сравнении с популяциями лимфоцитов периферической крови. Зрелые CD3+ клетки имеют повышенную экспрессию маркеров активации CD69 и HLA-DR, а также рецепторов хемокинов (CCR4, CCR5 и CXCR3) [36].
Значительная доля исследований посвящена изучению прогностической роли опухоль-инфильтрирующих лимфоцитов в лечении РМЖ. Поскольку современная лекарственная терапия включает иммунотропные и таргетные препараты, предсказание их эффективности может быть крайне полезно [37]. Так, в исследовании Kawai и соавт. показано, что содержание опухоль-инфильтрирующих лимфоцитов до начала терапии было значительно выше у тех больных, у которых впоследствии регистрировался полный ответ на лечение [31]. Это было подтверждено и другими исследователями: в 40 % случаев достигнут полный ответ на лечение у больных РМЖ с выраженной инфильтрацией опухоли лимфоцитами [38][39].
M. Ono и соавт. изучили выраженность опухолевой инфильтрации у больных трижды негативным РМЖ, которые получали неоадъювантную химиотерапию. Выявлена статистически значимая связь между полным ответом на проводимое лечение и количеством опухоль-инфильтрирующих лимфоцитов [40].
В большинстве исследований изучение инфильтрации лимфоцитами выполняется без учета субпопуляционного состава, хотя это может иметь большое значение, поскольку позволит стратифицировать больных в разные группы с различным клиническим исходом. В работе, включающей больных РМЖ, получавших лечение антрациклином и таксанами, оценили отдельные популяции лимфоцитов. Оказалось, что полный ответ на лечение коррелировал с выраженным содержанием в опухоли субпопуляций CD3+ клеток [41]. Только у пациентов с высокими уровнями CD3+ клеток адъювантная терапия на основе антрациклинов была связана с увеличением безрецидивной выживаемости.
Другими исследователями в ходе многофакторного анализа показано, что выраженная инфильтрация опухоли Foxp3+, CD8+, CD4+ клетками была связана с полным ответом на лечение [42]. Однако только инфильтрация CD8+ клетками, по данным проведенного анализа, является независимым прогностическим фактором [39][42]. Прогностическая значимость опухоль-инфильтрирующих лимфоцитов была также подтверждена проспективно у более чем 300 больных РМЖ, включенных в исследование PREDICT, проводимое в рамках проекта Gepar Quinto. Однофакторный анализ установил, что полный ответ на лекарственную терапию коррелировал с выраженной инфильтрацией опухоли стромальными лимфоцитами, тогда как многофакторный анализ показал, что с полным ответом на лечение коррелировало присутствие выраженной пропорции интратуморальных лимфоцитов [43].
Возможность проведения биопсии опухоли до и после лечения у больных РМЖ, получающих неоадъювантную химиотерапию, дает уникальную возможность сравнения состава инфильтрирующих опухоль субпопуляций. Вместе с тем в случае наличия полного ответа на лечение провести данный анализ затруднительно, поскольку отсутствует достаточное количество материала [44]. В своей работе R. D. Schreiber и соавт. изучили образцы РМЖ после завершения неоадъювантной химиотерапии [33]. Установлена выраженная инфильтрация опухолевой ткани лейкоцитами миелоидного происхождения, включая нейтрофилы и тучные клетки. При этом отмечено, что инфильтрирующие опухоль лимфоциты имели активированный фенотип, наблюдалось более высокое соотношение CD8+/CD4+ и экспрессия гранзима [33].
Интересные данные получены группой ученых под руководством M. Ono. Авторы обнаружили, что увеличение содержания интратуморальных CD3+, стромальных CD3+ или CD56+ клеток, а также CD83+, CD1a+ дендритных клеток у больных РМЖ сопровождается снижением экспрессии фактора роста эндотелия сосудов (VEGF) и снижением количества моноцитов CD68+ [40].
Субпопуляционный состав инфильтрирующих опухоль лимфоцитов у больных РМЖ, которые получали неоадъювантную химиотерапию, изучался также Ladoire и соавт. [45][46]. В исследование были включены 56 больных. Авторы установили, что полный ответ на лечение был связан со значительным снижением пропорции Foxp3+ клеток, в то время как инфильтрация опухоли CD3+ и CD8+ клетками оставалась прежней. Также исследователи отметили, что выраженная инфильтрация CD8+ клетками и низкое содержание Foxp3+ клеток в опухолевой ткани после окончания лечения коррелировали с улучшением отдаленных результатов у больных РМЖ, что согласуется с данными анализа Seo A. N., которые указывают, что инфильтрация CD8+ клетками является независимым прогностическим фактором полного ответа на лечение [42].
Похожие результаты получены Liu и соавт., которые сообщили о связи между полным ответом на лечение и отсутствием в опухолевой ткани больных РМЖ интратуморальных Foxp3+ клеток [47]. Сохранение инфильтрации опухоли Foxp3+ клетками у больных после лечения ассоциировалось с плохим прогнозом, что также показано и другими исследователями [47][48].
Проведенное исследование по изучению Foxp3+ клеток у больных местнораспространенным РМЖ выявило, что, несмотря на высокую частоту полных ответов на лечение у пациентов с выраженной инфильтрацией Foxp3+ клетками до химиотерапии, общая выживаемость у них более короткая, чем у пациентов с невыраженной инфильтрацией данной популяцией клеток. Многофакторный регрессионный анализ Кокса показал, что плотность инфильтрации Foxp3+ клетками до химиотерапии была самым сильным предиктором выживаемости [49].
Таким образом, проведенные за последние десятилетия исследования субпопуляций лимфоцитов в ткани опухоли определенно расширили представления о противоопухолевом иммунном ответе и привели к более глубокому пониманию патогенетических взаимодействий организма и опухоли.
Собственное наблюдение
В Национальном медицинском исследовательском центре онкологии имени Н. Н. Блохина МЗ РФ изучение субпопуляций лимфоцитов в опухоли ведется довольно давно. В недавней работе изучены соотношения субпопуляций зрелых Т-лимфоцитов (CD3), хелперных лимфоцитов (CD4), В-лимфоцитов (CD20), активированных лимфоцитов (СD38) при люминальном и других молекулярных подтипах РМЖ. Исследование проведено у 96 больных люминальным РМЖ. У 37 (38,5 %) из них верифицирован подтип А; у 52 (54,2 %) — В-Her2-негативный подтип; у 7 (7,3 %) — В-Her2-позитивный подтип. В группу сравнения мы включили опухолевые образцы 21 больной: у 3 (14,3 %) из них верифицирован HER2+ подтип РМЖ; у 18 (85,7 %) — трижды негативный подтип РМЖ. Иммунофенотипирование опухоли проводилось на криостатных срезах методом иммунофлуоресценции. Криостатные срезы, помещенные на предметные стекла, фиксировали в течение 10 мин в ацетоне при температуре +4 °C. Затем отмывали в среде 199 (рН 7,2–7,4) и наносили моноклональные антитела. Инкубировали 30 минут, повторно отмывали и наносили ФИТЦ-меченные F (аb)2-фрагменты антисыворотки. После инкубации и отмывания препараты консервировали 50 % глицерином на физиологическом растворе. Готовые препараты закрывали покровными стеклами. Учет реакции выполняли на люминесцентном микроскопе Zeiss (Axioskop, Германия). Результаты исследования приведены в таблице 1.
|
Количество лимфоцитов |
Подтип РМЖ |
|||||
|
люминальный |
HER2+ |
трижды негативный |
||||
|
абс. |
% |
абс. |
% |
абс. |
% |
|
|
CD3 |
||||||
|
Отсутствуют / единичные |
40 |
65,6 |
1 |
33,3 |
4 |
40,0 |
|
Умеренное / выраженное |
21 |
34,4 |
2 |
66,7 |
6 |
60,0 |
|
Всего |
61 |
100 |
3 |
100 |
10 |
100 |
|
CD4 |
||||||
|
Отсутствуют / единичные |
40 |
67,8 |
1 |
33,3 |
4 |
40,0 |
|
Умеренное / выраженное |
19 |
32,2 |
1 |
66,7 |
6 |
60,0 |
|
Всего |
59 |
100 |
3 |
100 |
10 |
100 |
|
CD20 |
||||||
|
Отсутствуют / единичные |
56 |
94,9 |
3 |
100 |
8 |
80,0 |
|
Умеренное / выраженное |
3 |
5,1 |
2 |
20,0 |
||
|
Всего |
59 |
100 |
3 |
100 |
10 |
100 |
|
CD38 |
||||||
|
Отсутствуют / единичные |
49 |
81,7 |
3 |
100 |
6 |
60,0 |
|
Умеренное / выраженное |
11 |
18,3 |
4 |
40,0 |
||
|
Всего |
60 |
100 |
3 |
100 |
10 |
100 |
Таблица 1. Инфильтрация CD3, CD4, CD38, CD20 лимфоцитами при люминальном и других молекулярных подтипах РМЖ
Table 1. Infiltration by CD3, CD4, CD38 and CD20 lymphocytes in luminal and other breast cancer molecular subtypes
Оценка выраженности инфильтрации зрелыми CD3+ лимфоцитами показала, что при люминальном РМЖ почти в 70 % (n = 40) образцов определялись единичные инфильтрирующие опухоль CD3+ клетки, в то время как в 60,0–66,7 % HER2+ и трижды негативных опухолей отмечалось их умеренное или выраженное количество, однако статистически значимых различий не получено. Инфильтрация CD4+ клетками при люминальном подтипе также была незначительна (67,8 %, n = 40), и только треть образцов (32,2 %, n = 19) демонстрировали умеренную/выраженную степень инфильтрации. Инфильтрация плазматическими клетками (CD38+) и В-клетками (CD20+) имела схожий характер: в подавляющем количестве анализируемых образцов опухоли (60–100 %) при всех молекулярных подтипах антигенпозитивные клетки либо отсутствовали, либо были единичными. Таким образом, выполненный анализ уровня инфильтрации субпопуляциями CD3+, CD4+, CD38+, CD20+ лимфоцитов установил, что при люминальном раке выраженность инфильтрации меньше, чем при других подтипах, однако достоверной связи не обнаружено.
Заключение
РМЖ является гетерогенной злокачественной опухолью, характеризующейся экспрессией различных рецепторов и многообразием интратуморальных иммунных реакций, определяющих его клиническое течение и прогноз. Расширение представлений о роли опухоль-инфильтрирующих лимфоцитов при РМЖ является важным этапом на пути понимания взаимодействия опухоли и иммунной системы, что может внести вклад в совершенствование подходов иммунотерапии.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Информация о спонсорстве. Данная работа не финансировалась.
Список литературы
1. Ferlay J., Colombet M., Soerjomataram I., Parkin D.M., Piñeros M., Znaor A., et al. Cancer statistics for the year 2020: An overview. Int J Cancer. 2021 Apr 5. DOI: 10.1002/ijc.33588
2. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М.; 2019.
3. Crabtree J.S., Miele L. Breast cancer stem cells. Biomedicines. 2018;6(3):77. DOI: 10.3390/biomedicines6030077
4. Чулкова С.В., Тупицын Н.Н., Джуманазаров Т.М., Палладина А.Д., Купрышина Н.А., Чернышева О.А. и др. Обнаружение диссеминированных опухолевых клеток в костном мозге больных немелколеточным раком легкого. Российский биотерапевтический журнал. 2020;19(3):29–37. DOI: 10.17650/1726-9784-2020-19-3-29-37
5. Wimberly H., Brown J.R., Schalper K., Haack H., Silver M.R., Nixon C., et al. PD-L1 expression correlates with tumor-infi ltrating lymphocytes and response to neoadjuvant chemotherapy in breast cancer. Cancer Immunol Res. 2015;3(4):326–32. DOI: 10.1158/2326-6066.CIR-14- 0133
6. Чулкова С.В., Маркина И.Г., Антипова А.С., Грищенко Н.В., Пустынский И.В., Егорова А.В. и др. Роль стволовых опухолевых клеток в канцерогенезе и прогнозе меланомы. Вестник Российского научного центра рентгенорадиологии. 2018;18(4):100–16.
7. Рябчиков Д.А., Абдуллаева Э.И., Дудина И.А., Чулкова С.В., Денчик Д.А., Чхиквадзе Н.В. и др. Роль микро-РНК в канцерогенезе и прогнозе злокачественных новообразований молочной железы. Вестник Российского научного центра рентгенорадиологии. 2018;18(2):5.
8. Чулкова С.В. Биомаркеры стволовых клеток желудка. Вопросы биологической, медицинской и фармацевтической химии. 2018;21(10):11–7. DOI: 10.29296/25877313-2018-10-02
9. Chernysheva O., Markina I., Demidov L., Kupryshina N., Chulkova S., Palladina A., et al. Bone marrow involvement in melanoma. Potentials for detection of disseminated tumor cells and characterization of their subsets by fl ow cytometry. Cells. 2019;8(6):627. DOI: 10.3390/ cells8060627
10. Mao Y., Qu Q., Chen X., Huang O., Wu J., Shen K. Th e prognostic value of tumor-infi ltrating lymphocytes in breast cancer: a systematic review and meta-analysis. PLoS One. 2016;11(4):e0152500. DOI: 10.1371/ journal.pone.0152500
11. Титов К.С., Казаков А.М., Барышникова М.А., Рябчиков Д.А., Чулкова С.В., Зарьянов Д.А. Некоторые молекулярные и иммунологические факторы прогноза трижды негативного рака молочной железы. Онкогинекология. 2019;4(32):26–34. DOI: 10.52313/22278710_2019_4_26
12. Рябчиков Д.А., Воротников И.К., Талипов О.А., Чулкова С.В., Логинов В.И., Снеговой А.В. и др. Микро-РНК и их роль в патогенезе и диагностике рака молочной железы. Медицинский алфавит. 2020;8:12–5. DOI: 10.33667/2078-5631-2020-8-12-15
13. Liu X., Feng D., Liu D., Wang S., Yu X., Dai E., et al. Dissecting the origin of breast cancer subtype stem cell and the potential mechanism of malignant transformation. PLoS One. 2016;11(10):e0165001.7. DOI: 10.1371/journal.pone.0165001
14. Zhou J., Chen Q., Zou Y., Chen H., Qi L., Chen Y. Stem cells and cellular origins of breast cancer: updates in the rationale, controversies, and therapeutic implications. Front Oncol. 2019;9:820. DOI: 10.3389/ fonc.2019.00820
15. Чулкова С.В., Рябчиков Д.А., Дудина И.А., Казаков А.М., Егорова А.В., Титов К.С. и др. Перспективы использования микро-РНК в качестве диагностических и прогностических маркеров меланомы. Российский биотерапевтический журнал. 2019;18(4):51–6.
16. Denkert C., von Minckwitz G., Darb-Esfahani S., Lederer B., Heppner B.I., Weber K.E., et al. Tumour-infi ltrating lymphocytes and prognosis in diff erent subtypes of breast cancer: a pooled analysis of 3771 patients treated with neoadjuvant therapy. Lancet Oncol. 2018;19(1):40–50. DOI: 10.1016/S1470-2045(17)30904-X
17. Рябчиков Д.А., Безнос О.А., Дудина И.А., Воротников И.К., Денчик Д.А., Чулкова С.В. и др. Диссеминированные опухолевые клетки у пациентов с люминальным раком молочной железы. Российский биотерапевтический журнал. 2018;17(1):53–7. DOI: 10.17650/1726-9784-2018-17-1-53-57
18. Chang R.B., Beatty G.L. Th e interplay between innate and adaptive immunity in cancer shapes the productivity of cancer immunosurveillance. J Leukoc Biol. 2020;108(1):363–76. DOI: 10.1002/ JLB.3MIR0320-475R
19. Gerada Ch., Ryan K.M. Autophagy, the innate immune response and cancer. Mol Oncol. 2020;14(9):1913–29. DOI: 10.1002/1878- 0261.12774
20. Чулкова С.В., Стилиди И.С., Глухов Е.В., Гривцова Л.Ю., Неред С.Н., Тупицын Н.Н. Селезенка — периферический орган иммунной системы. Влияние спленэктомии на иммунный статус. Вестник РОНЦ им. Н. Н. Блохина РАМН. 2014;25(1–2(94)):21–5.
21. Sonnenberg G.F., Hepworth M.R. Functional interactions between innate lymphoid cells and adaptive immunity. Nat Rev Immunol. 2019;19(10):599–613. DOI: 10.1038/s41577-019-0194-8
22. Чулкова С.В., Шолохова Е.Н., Грищенко Н.В., Рябчиков Д.А., Гривцова Л.Ю., Базин И.С. и др. Ключевая роль популяций В1-лимфоцитов в иммунном ответе у больных раком желудка. Российский биотерапевтический журнал. 2018;17(4):64–70.
23. Martinez F.O., Sica A., Mantovani A., Locati M. Macrophage activation and polarization. Front Biosci. 2008;13:453–61. DOI: 10.2741/2692
24. Chaudhary B., Elkord E. Regulatory T cells in the tumor microenvironment and cancer progression: role and therapeutic targeting. Vaccines (Basel). 2016;4(3):28. DOI: 10.3390/vaccines4030028
25. Kim J.H., Kim B.S., Lee S.K. Regulatory T cells in tumor microenvironment and approach for anticancer immunotherapy. Immune Netw. 2020;20(1):e4. DOI: 10.4110/in.2020.20.e4
26. Gu-Trantien C., Loi S., Garaud S., Equeter C., Libin M., de Wind A., et al. CD4+ follicular helper T cell infi ltration predicts breast cancer survival. J Clin Invest. 2013;123(7):2873–92. DOI: 10.1172/JCI67428
27. Grzywa T.M., Sosnowska A., Matryba P., Rydzynska Z., Jasinski M., Nowis D., et al. Myeloid cell-derived arginase in cancer immune response. Front Immunol. 2020;11:938. DOI: 10.3389/fi mmu.2020.00938
28. Zhao X., Qu J., Sun Y., Wang J., Liu X., Wang F., et al. Prognostic signifi cance of tumor-associated macrophages in breast cancer: a meta-analysis of the literature. Oncotarget. 2017;8(18):30576–86. DOI: 10.18632/oncotarget.15736
29. Gao G., Wang Z., Qu X., Zhang Z. Prognostic value of tumor-infi ltrating lymphocytes in patients with triple-negative breast cancer: a systematic review and meta-analysis. BMC Cancer. 2020;20(1):179. DOI: 10.1186/s12885-020-6668-z
30. Shang B., Liu Y., Jiang S.J., Liu Y. Prognostic value of tumor-infi ltrating FoxP3+ regulatory T cells in cancers: a systematic review and metaanalysis. Sci Rep. 2015;5:15179. DOI: 10.1038/srep15179
31. Kawai O., Ishii G., Kubota K., Murata Y., Naito Y., Mizuno T., et al. Predominant infi ltration of macrophages and CD8(+) T Cells in cancer nests is a signifi cant predictor of survival in stage IV nonsmall cell lung cancer. Cancer. 2008;113(6):1387–95. DOI: 10.1002/cncr.23712
32. Hornychova H., Melichar B., Tomsova M., Mergancova J., Urminska H., Ryska A. Tumor-infi ltrating lymphocytes predict response to neoadjuvant chemotherapy in patients with breast carcinoma. Cancer Invest. 2008;26(10):1024–31. DOI: 10.1080/07357900802098165
33. Schreiber R.D., Old L.J., Smyth M.J. Cancer immunoediting: integrating immunity’s roles in cancer suppression and promotion. Science. 2011;331(6024):1565–70. DOI: 10.1126/science.1203486
34. Cimino-Mathews A., Ye X., Meeker A., Argani P., Emens L.A. Metastatic triple-negative breast cancers at fi rst relapse have fewer tumorinfi ltrating lymphocytes than their matched primary breast tumors: a pilot study. Hum Pathol. 2013;44(10):2055–63. DOI: 10.1016/j. humpath.2013.03.010
35. Ruff ell B., Au A., Rugo H.S., Esserman L.J., Hwang E.S., Coussens L.M. Leukocyte composition of human breast cancer. Proc Natl Acad Sci USA. 2012;109(8):2796–801. DOI: 10.1073/pnas.1104303108
36. Gobert M., Treilleux I., Bendriss-Vermare N., Bachelot T., GoddardLeon S., Arfi V., et al. Regulatory T cells recruited through CCL22/ CCR4 are selectively activated in lymphoid infi ltrates surrounding primary breast tumors and lead to an adverse clinical outcome. Cancer Res. 2009;69(5):2000–9. DOI: 10.1158/0008-5472.CAN-08-2360
37. Ismael G., Hegg R., Muehlbauer S., Heinzmann D., Lum B., Kim S.B., et al. Subcutaneous versus intravenous administration of (neo) adjuvant trastuzumab in patients with HER2-positive, clinical stage I-III breast cancer (HannaH study): a phase 3, open-label, multicentre, randomised trial. Lancet Oncol. 2012;13(9):869–78. DOI: 10.1016/ S1470-2045(12)70329-7
38. Denkert C., Loibl S., Noske A., Roller M., Müller B.M., Komor M., et al. Tumor-associated lymphocytes as an independent predictor of response to neoadjuvant chemotherapy in breast cancer. J Clin Oncol. 2010;28(1):105–13. DOI: 10.1200/JCO.2009.23.7370
39. Mahmoud S.M., Paish E.C., Powe D.G., Macmillan R.D., Grainge M.J., Lee A.H., et al. Tumor-infi ltrating CD8+ lymphocytes predict clinical outcome in breast cancer. J Clin Oncol. 2011;29(15):1949–55. DOI: 10.1200/JCO.2010.30.5037
40. Ono M., Tsuda H., Shimizu C., Yamamoto S., Shibata T., Yamamoto H., et al. Tumor-infi ltrating lymphocytes are correlated with response to neoadjuvant chemotherapy in triple-negative breast cancer. Breast Cancer Res Treat. 2012;132(3):793–805. DOI: 10.1007/s10549-011-1554-7
41. West N.R., Milne K., Truong P.T., Macpherson N., Nelson B.H., Watson P.H. Tumor-infi ltrating lymphocytes predict response to anthracycline-based chemotherapy in estrogen receptor-negative breast cancer. Breast Cancer Res. 2011;13(6):R126. DOI: 10.1186/bcr3072
42. Seo A.N., Lee H.J., Kim E.J., Kim H.J., Jang M.H., Lee H.E., et al. Tumour-infi ltrating CD8+ lymphocytes as an independent predictive factor for pathological complete response to primary systemic therapy in breast cancer. Br J Cancer. 2013;109(10):2705–13. DOI: 10.1038/ bjc.2013.634
43. Oda N., Shimazu K., Naoi Y., Morimoto K., Shimomura A., Shimoda M., et al. Intratumoral regulatory T cells as an independent predictive factor for pathological complete response to neoadjuvant paclitaxel followed by 5-FU/epirubicin/cyclophosphamide in breast cancer patients. Breast Cancer Res Treat. 2012;136(1):107–16. DOI: 10.1007/ s10549-012-2245-8
44. Issa-Nummer Y., Darb-Esfahani S., Loibl S., Kunz G., Nekljudova V., Schrader I., et al. Prospective validation of immunological infi ltrate for prediction of response to neoadjuvant chemotherapy in HER2-negative breast cancer — a substudy of the neoadjuvant GeparQuinto trial. PLoS One. 2013;8(12):e79775. DOI: 10.1371/journal.pone.0079775
45. Ladoire S., Mignot G., Dabakuyo S., Arnould L., Apetoh L., Rébé C., et al. In situ immune response aft er neoadjuvant chemotherapy for breast cancer predicts survival. J Pathol. 2011;224(3):389–400. DOI: 10.1002/ path.2866
46. Li Y., Tang J., Pan D.X., Sun L.D., Chen C., Liu Y., et al. Versatile imaging and therapeutic platform based on dual-band luminescent lanthanide nanoparticles toward tumor metastasis inhibition. ACS Nano. 2016;10(2):2766–73. DOI: 10.1021/acsnano.5b07873
47. Liu J., Huang L., Tian X., Chen X., Shao Y., Xie F., et al. Magnetic and fl uorescent Gd2 O3 :Yb3+/Ln3+ nanoparticles for simultaneous upconversion luminescence/MR dual modal imaging and NIR-induced photodynamic therapy. Int J Nanomedicine. 2016;12:1–14. DOI: 10.2147/ IJN.S118938
48. Zhou Y., Shao N., Aierken N., Xie C., Ye R., Qian X., et al. Prognostic value of tumor-infi ltrating Foxp3+ regulatory T cells in patients with breast cancer: a meta-analysis. J Cancer. 2017;8(19):4098–105. DOI: 10.7150/jca.21030
49. Demir L., Yigit S., Ellidokuz H., Erten C., Somali I., Kucukzeybek Y., et al. Predictive and prognostic factors in locally advanced breast cancer: eff ect of intratumoral FOXP3+ Tregs. Clin Exp Metastasis. 2013;30(8):1047–62. DOI: 10.1007/s10585-013-9602-9
Об авторах
Д. А. РябчиковРоссия
Рябчиков Денис Анатольевич, д.м.н., хирургическое отделение № 16
Москва
С. В. Чулкова
Россия
Чулкова Светлана Васильевна, к.м.н., доцент, лаборатория иммунологии гемопоэза, кафедра онкологии и лучевой терапии
Москва
Ф. А. Шамилов
Россия
Шамилов Фархад Азерович, к.м.н., хирургическое отделение № 16
Москва
Н. В. Чантурия
Россия
Чантурия Наили Валерьевна, кафедра онкологии факультета дополнительного профессионального образования, хирургическое отделение № 16
Москва
С. Д. Желтиков
Россия
Желтиков Сергей Дмитриевич, кафедра онкологии факультета дополнительного профессионального образования, хирургическое отделение № 16
Москва
Н. Н. Тупицын
Россия
Тупицын Николай Николаевич, д.м.н., профессор, лаборатория иммунологии гемопоэза
Москва
Рецензия
Для цитирования:
Рябчиков Д.А., Чулкова С.В., Шамилов Ф.А., Чантурия Н.В., Желтиков С.Д., Тупицын Н.Н. Субпопуляции интратуморальных эффекторных клеток при раке молочной железы (обзор литературы и представление собственных данных). Креативная хирургия и онкология. 2021;11(4):328-336. https://doi.org/10.24060/2076-3093-2021-11-4-328-336
For citation:
Ryabchikov D.A., Chulkova S.V., Shamilov F.A., Chanturiya N.V., Zheltikov S.D., Tupitsyn N.N. Intratumoural Effector Cell Subpopulations in Breast Cancer: a Literature Review and Own Data Report. Creative surgery and oncology. 2021;11(4):328-336. (In Russ.) https://doi.org/10.24060/2076-3093-2021-11-4-328-336
JATS XML


































