Перейти к:
Сравнительная характеристика различных способов изолированной химиоперфузии печени
https://doi.org/10.24060/2076-3093-2022-12-1-5-12
Аннотация
Введение. Метастатическое поражение печени является отдельной проблемой онкологии независимо от первичного злокачественного заболевания. Резекционная хирургия не всегда осуществима у таких пациентов. При множественном мелкоочаговом метастатическом поражении органа многообещающим является лечение методом изолированной химиоперфузии печени. Эта методика технически сложна, что ограничивает её изучение и внедрение в широкую клиническую практику. Разнообразие способов проведения изолированной химиоперфузии печени не позволяет однозначно оценивать накопленный мировой опыт и требует дальнейшего изучения. В процессе внедрения изолированной химиоперфузии печени важными вопросами являются: оптимальная хирургическая техника, способ контроля изоляции печени, поддержание физиологичного артериального и портального кровотока.
Материалы и методы. В исследовании принял участие 21 пациент в период с июня 2020 по декабрь 2021 г. Пациенты разделены на 3 проспективные группы: A) артерио-кавальная химиоперфузия печени, доступ через срединную лапаротомию, технический контроль полноты изоляции печени, B) артерио-кавальная химиоперфузия печени, доступ через J-лапаротомию, ICG-контроль полноты изоляции печени, C) артерио-порто-кавальная химиоперфузия печени, доступ через J-лапаротомию, ICG-контроль полноты изоляции печени. С целью оценки переносимости процедуры оценивались: длительность операции. послеоперационный койко-день в отделении интенсивной терапии, общий послеоперационный койко-день, показатели печеночного цитолиза, выраженность побочных эффектов химиопрепарата.
Результаты и обсуждение. Длительность операции сократилась с применением J-лапаротомии. Выраженность гематологической токсичности не различалась между группами A и B, однако значительно ниже в группе С. Длительность цитолитического синдрома статистически значимо снизилась в группе C при сравнении с группами A и B.
Заключение. Все примененные нами способы изолированной химиоперфузии печени безопасны для пациента. При контроле изоляции печени с применением ICG снижается вероятность утечки химиопрепарата в системный кровоток, что показывает меньшую гематологическую токсичность. Проведение артерио-портальной изолированной химиоперфузии физиологичнее других примененных способов и способствует снижению гепатотоксичности. Применение J-лапаротомии значительно сокращает время мобилизации печени и канюляции сосудов.
Ключевые слова
Для цитирования:
Каприн А.Д., Унгурян В.М., Петров Л.О., Иванов С.А., Назарова В.В., Побединцева Ю.А., Филимонов Е.В., Круглов Е.А. Сравнительная характеристика различных способов изолированной химиоперфузии печени. Креативная хирургия и онкология. 2022;12(1):5-12. https://doi.org/10.24060/2076-3093-2022-12-1-5-12
For citation:
Kaprin A.D., Unguryan V.M., Petrov L.O., Ivanov S.A., Nazarova V.V., Pobedintseva Yu.A., Filimonov E.V., Kruglov E.A. Comparative Assessment of Isolated Liver Chemoperfusion Techniques. Creative surgery and oncology. 2022;12(1):5-12. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-1-5-12
Введение
В настоящее время изолированное метастатическое поражение печени все чаще рассматривается в онкологии как комплексная медицинская проблема, вне контекста первичного злокачественного новообразования [1–4]. Так, по данным большого эпидемиологического иследования на основе данных SEER (Surveillance, Epidemiology, and End Results — программа Национального института рака США, собирает и публикует данные о заболеваемости и выживаемости пациентов на основании популяционного канцер-регистра США), у диагностированных в 2010–2015 гг. в США на момент постановки диагноза 5,4 % пациентов имели метастазы в печень. Наибольший процент пациентов с метастазами в печень на момент постановки диагноза приходится на рак поджелудочной железы (35,6 %), далее следуют рак толстой кишки (26,9 %), тонкой кишки (14,6 %), желудка (14,2 %) и пищевода (14,2 %). У женщин в возрасте 20–50 лет наиболее распространенным раком с метастазами в печень является рак молочной железы. У мужчин в возрасте 20–50 лет наиболее распространенным диагнозом с метастазами в печень является рак толстой кишки, за которым следуют рак прямой кишки, легких и поджелудочной железы. Одногодичная выживаемость всех пациентов с метастазами в печень составила 15,1 %, по сравнению с 24,0 % у пациентов с отдаленными метастазами в другие органы. Наличие метастазов в печени ассоциируется со снижением выживаемости, в особенности у пациентов с раком яичка, простаты, молочной железы, ануса, а также у пациентов с меланомой [2].
Учитывая обширность данной проблемы, концептуальный взгляд на изолированное метастатическое поражение печени способствует объединению специалистов, разрабатывающих и практикующих локальные методы лечения в отношении очагов в печени. Это способствует взаимному обогащению методик и развитию новых перспективных подходов к лечению данной обширной и сложной категории пациентов. Так, последние 10 лет взгляды на лечение больных множественными билобарными метастазами радикально пересматриваются, получили развитие локальные методы лечения [4][5]. В настоящее время к ним относят резекционную хирургию, радиочастотную абляцию, стереотаксическую лучевую терапию, трансартериальную химиоэмболизацию, трансартериальную радиоэмболизацию, радионуклидную терапию пептидными рецепторами, химиоинфузию в печеночную артерию, изолированную химиоперфузию печени (ИХП) [2]. Данные технологии используются начиная от лечебного воздействия при небольших локализованных опухолях, уменьшения размеров для подготовки к резекции и заканчивая локорегиональным контролем и паллиативным воздействием на прогрессирующее заболевание. Их использование дает лучший ответ опухоли на лечение, увеличение безрецидивной и общей выживаемости [4].
В целом хирургическое лечение в объеме резекции пораженной части печени дает лучший онкологический результат при условии физиологической возможности и своевременности вмешательства. Когда резекция печени невозможна из-за угрозы развития пострезекционной фатальной печеночной недостаточности, успешно применяются методы локального воздействия без физического удаления опухолевого очага [6].
По разным данным, локальные методы воздействия на печень (без использования ИХП) увеличивают медиану общей выживаемости. Так, при колоректальном раке — до 10–45 месяцев, нейроэндокринной карциноме — 28–95 месяцев, увеальной меланоме — 6–19 месяцев, раке молочной железы — 13–70 месяцев [4].
Однако локальные методы очагового воздействия малоэффективны, когда имеет место диффузное тотальное поражение печени: целенаправленное воздействие на наиболее крупные очаги не приносит значительной онкологической выгоды [6], так как метод не позволяет охватить всю паренхиму органа, когда предполагается диффузное микроскопическое поражение печени наравне с определяемыми одиночными очагами. В то же время при воздействии на весь объем печени при инфузии в собственную печеночную артерию общая доза и концентрация химиопрепарата ограничены его накоплением в системном кровотоке, а также исключается воздействие через портальный источник кровоснабжения опухоли, что характерно для некоторых типов роста метастазов [6]. Таких недостатков, как неполный охват тканей органа и накопление химиопрепарата в системном кровотоке, лишен метод ИХП, что выгодно отличает его на фоне упомянутых методов локального воздействия. По данным недавнего метаанализа, ИХП при увеальной меланоме дает один из самых высоких показателей медианы общей выживаемости — 17–24 мес. [5][7]. При этом метод ИХП технически и организационно более сложен, что ограничивает его изучение и широкое внедрение в клинической практике. Кумулятивный опыт, описанный в мировой литературе, составляет лишь около 800 случаев гетерогенными группами по 7–120 пациентов, с использованием различных реализаций методики, химиопрепаратов и их доз, при этом первичное заболевание также различается между группами, наибольшее количество ИХП проведено по поводу колоректального рака, увеальной меланомы и гепатоцеллюлярного рака [5][8].
Среди упомянутых различий реализации ИХП можно выделить следующие.
Артериальный, при котором перфузионный раствор цитостатика подается в собственную печеночную артерию, а эффлюент забирается из позадипеченочного отдела нижней полой вены, при этом кровоток по воротной вене перекрыт. Фактически этот способ подразумевается под ИХП, если не дается уточнений [9][10].
Артерио-портальный, при этом перфузионный раствор цитостатика подается в печеночную артерию и воротную вену, эффлюент забирается из позадипеченочного отдела нижней полой вены [11][12]. Описан способ, при котором в печеночную артерию медленно подается концентрированный цитостатик, который принимает участие в кава-портальной циркуляции перфузионного раствора, — попадая в эффлюент, цитостатик забирается из позадипеченочного отдела нижней полой вены и подается на перфузию в печень через воротную вену, смешиваясь в печеночных ацинусах с новой порцией цитостатика, введенного в печеночную артерию [13]. Авторы утверждают, что это снижает гипоксией индуцированное повреждение печени, и приводят примеры большей максимально переносимой долы цитостатика по сравнению с группами, где проводилось введение только в артерию [13].
Портальный, при котором перфузионный раствор цитостатика подается только в воротную вену, при этом кровоток по печеночной артерии перекрыт [12]. Способ ограничен нефизиологичностью, так как билиарная сеть кровоснабжается преимущественно из артериального русла, однако способ может применятся при редукции артериального кровоснабжения печени [12][14].
Ретроградный артерио-портальный, при котором перфузионный раствор цитостатика подается в печеночную артерию, а эффлюент забирается из воротной вены, кровоток по позадипеченочному отделу нижней полой вены при этом остановлен. Исследования на печени крыс показали одинаковую концентрацию цитостатика в опухоли при ретроградной и обычной ИХП, в то же время концентрация цитостатика в ткани печени снизилась на 80 % при ретроградной ИХП [15]. Этот способ был применен у 24 пациентов в варианте гипоксической ретроградной артерио-портальной ИХП, при этом ИХП не сопровождалась шунтирующим кава-кавальным кровообращением, а сопровождалась пережатием аорты тотчас ниже диафрагмы и длилась 25 минут [16]. Авторы сообщают об отсутствии отличий от общепринятой методики ИХП по основным параметрам и снижении кровопотери, частоты осложнений, а также нулевой летальности в серии [16].
Разнообразие способов проведения ИХП не позволяет однозначно оценивать накопленный мировой опыт и требует дальнейшего изучения для улучшения эффективности и безопасности этой методики. На наш взгляд, в процессе внедрения ИХП печени важными вопросами являются: оптимальная хирургическая техника, способ контроля полноты изоляции печени, поддержание физиологичного артериального и портального кровотока при осуществлении химиоперфузии.
Цель статьи. Сравнение непосредственных результатов различных способов подачи химиотерапевтического агента методом изолированной химиоперфузии печени.
Материалы и методы
Работа выполнена в период с июня 2020 по декабрь 2021 г. совместно со специалистами ФГБУ «НМИЦ радиологии» Минздрава России и ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России на клинической базе ОГБУЗ «Костромской онкологический диспансер». Все пациенты подписывали информированное добровольное согласие на процедуру до проведения операции. Исследование было одобрено решением локального этического комитета МРНЦ им. А.Ф. Цыба — выписка из протокола № 518 от 02.11.2020 года.
Критериями включения были: 1) возраст старше 18 лет, 2) гистологическое подтвержденние диагноза злокачественного новообразования, 3) статус ECOG 0–1, 4) общий объем поражения печени не должен превышать 50 % ее объема, 5) отсутствие экстрапеченочных метастазов.
За указанный период ИХП проведена 21 пациенту. Пациенты были разделены на 3 проспективные группы: A) артерио-кавальная ИХП, доступ через срединную лапаротомию, технический контроль полноты изоляции печени, B) артерио-кавальная ИХП, доступ через J-лапаротомию, ICG-контроль полноты изоляции печени, C) артерио-порто-кавальная ИХП, доступ через J-лапаротомию, ICG-контроль полноты изоляции печени. Схемы ИХП в группах A и B представлены на рисунке 1. Схема ИХП в группе C представлена на рисунке 2.
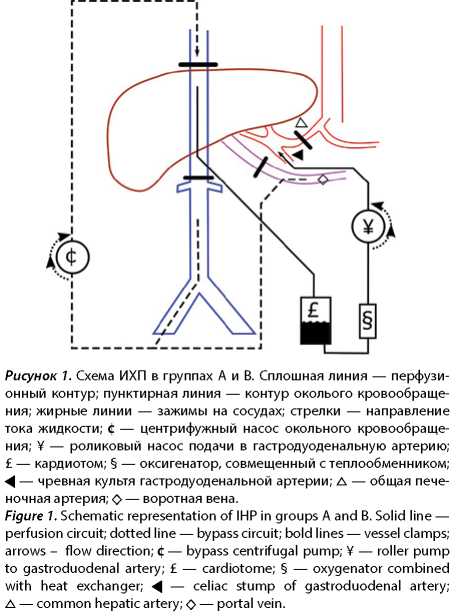
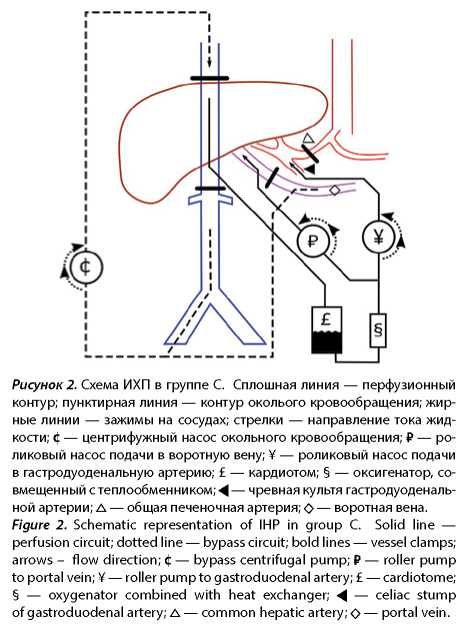
Характеристика групп пациентов приведена в таблице 1.
|
Группа, n |
A, 8 |
B, 8 |
C, 5 |
|
Пол, м/ж |
3/5 |
2/6 |
3/2 |
|
Возраст, |
48,8 |
53,6 |
54,0 |
|
ИМТ |
25,9 |
25,1 |
27,5 |
|
Первичная опухоль |
КРР 2 / УМ 6 |
УМ |
УМ |
|
Предшествующее лечение |
Нет — 3 ИТ — 2 ТАХЭ — 1 |
Нет — 4 ИТ — 2 ТАХЭ — 1 РЧА + ИТ — 1 |
Нет — 4 ИТ — 1 |
|
Лапаротомия |
Срединная |
J-лапаротомия |
J-лапаротомия |
|
Контроль изоляции печени |
Технический |
ICG-флуоресценция |
ICG-флуоресценция |
|
Способ подачи перфузата в печень |
Артериальный |
Артериальный |
Артериальный + Портальный |
Примечания: КРР — колоректальный рак, УМ — увеальная меланома, ИТ — иммуноонкологическая терапия, ТАХЭ — трансартериальная химиоэмболизация, РЧА - радиочастотная абляция.
Таблица 1. Характеристика групп пациентов
Table 1. Patient cohorts profile
Описание выполнения ИХП кратко приведено ниже. Под наркозом после достижения АСТ (activated clotting time, активированное время свертывания крови) 400–500 с посредством внутривенного введения гепарина пункционно чрескожно в яремную и бедренную вены устанавливали канюли для шунтирующего кровообращения, далее выполнялась лапаротомия. В группе А выполнялась тотальная срединная лапаротомия, в группах B и C выполнялась J-лапаротомия по Makuuchi, показавшая себя хорошо при обширных операциях на гепатопанкреатобилиарной зоне в терминах адекватности хирургического доступа и снижения послеоперационной морбидности. Нами был выбран данный доступ после детального изучения литературы [17][18]. Выполнялась профилактическая холецистэктомия в связи с высокой чувствительностью желчного пузыря к ишемии и свидетельством ряда авторов о холецистите вследствие гипертермии и вмешательств на артериях печени [12][19].
Далее проводилась правосторонняя медиальная висцеральная ротация по Cattel-Braasch, мобилизация печени и позадипеченочного отдела нижней полой вены от забрюшинного пространства и диафрагмы, при этом пересекались все притоки этого отдела нижней полой вены, визуализировались кавальное отверстие диафрагмы, ложе нижней полой вены (НПВ), устья почечных вен [9][20]. При мобилизации определено и отмечено сосудистыми обтяжками место перекрытия кровотока по нижней полой вене выше и ниже печеночных вен. Протокольно во всех группах проводился технический визуальный контроль полноты изоляции печени — отсутствие функционирующих притоков НПВ между сосудистыми обтяжками на НПВ.
Проводилась диссекция структур печеночно-двенадцатиперстной связки до селезеночной вены и гастродуоденальной артерии, правая желудочная артерия перевязывалась. Для порто-кавального шунтирования через кисетный шов канюлировалась воротная вена в направлении селезенки. Канюли в бедренной, воротной и яремной вене объединялись в шунтирующий печень кава-порто-кавальный контур с подачей венозной крови в яремную вену. Далее проводилось ишемическое прекондиционирование печени путем двукратного пережатия собственной печеночной артерии на 15 минут и интервалом 5 минут. Размещение канюли подачи перфузата в артериальное русло печени проводилось через чревную (краниальную) культю пересеченной гастродуоденальной артерии, мезентериальная культя перевязывалась у пациентов во всех трех группах. В случае наличия замещающих печеночных артерий проводилась артериотомия с установкой канюли в последнюю.
Канюля забора перфузата из НПВ устанавливалась краниальнее почечных вен на 2 см через кисетный шов на ретропеченочном отделе НПВ в направлении естественного тока крови. В группе С для одновременной подачи перфузата в портальное русло печени через кисетный шов канюлировалась воротная вена в направлении печени.
Канюли в гастродуоденальной артерии и НПВ объединяли магистралями в замкнутый перфузионный контур. Таким образом, забор крови осуществлялся из позадипеченочного отдела НПВ, которая далее через кардиотом, оксигенатор-теплообменник, при помощи роликового насоса подавалась в гастродуоденальную артерию. В группе C от магистрали к гастродуоденальной артерии после оксигенатора-теплообменника создавали ответвляющуюся магистраль для подачи крови в воротную вену, на этой магистрали использовался отдельный роликовый насос. Далее запускали работу обходного кровообращения в режиме параллельного кровообращения. Затем выполняли сосудистую изоляцию печени путем перекрытия кровотока по основным сосудам сосудистыми зажимами: 1) на НПВ поддиафрагмально краниальнее печеночных вен; 2) на НПВ краниальнее почечных вен; 3) на общую печеночную артерию; 4) на воротную вену тотчас проксимальней канюли (см. рис. 1). После этого запускался кровоток по перфузионному контуру. В группе А при удовлетворительной работе контура и пройденном техническом контроле изоляции печени в контур вводился химиопрепарат. В группах B и С перед введением препарата в контур вводился флуоресцентный краситель ICG. Если в магистралях обходного кровообращения флуоресценция не определялась, то в перфузионный контур вводился химиопрепарат (рис. 3 и 4). В ином случае перед введением химиопрепарата устранялись дефекты изоляции печени. Целевая длительность ИХП печени была 60 минут. После проведения ИХП печень отмывалась от химиоперфузата изотоническим раствором кристаллоидов и эритроцитарной массой, затем удалялись изолирующие зажимы. Канюли, установленные в брюшной полости, удалялись. Гепарин нейтрализовался раствором протамина сульфата под контролем ACT в диапазоне 100–200 с. После дренирования брюшной полости и ушивания лапаротомии удалялись яремная и бедренная канюли.
Искусственное кровообращение осуществлялось на оборудовании Stockert S5 (LivaNova/Sorin Group GmbH). Оксигенатор и канюли производства Medtronic plc.
В послеоперационном периоде пациенты находились под наблюдением в отделении интенсивной терапии, при стабилизации и готовности к физической реабилитации, положительной тенденции лабораторных и инструментальных исследований пациенты переводились в палату хирургического отделения. С целью общей оценки переносимости процедуры оценивались: послеоперационный койко-день в отделении интенсивной терапии, общий послеоперационный койко-день. Для определения выраженности влияния ИХП на паренхиму печени оценивались показатели печеночного цитолиза в первые и вторые послеоперационные сутки, а также длительность цитолитического синдрома. С целью оценки возможных неочевидных дефектов изоляции печени и возможного «лакунарного» депонирования цитостатика в сосудистом русле печени определяли выраженность побочных эффектов химиопрепарата, в частности длительность гематологической токсичности и потребность во введении филграстима.
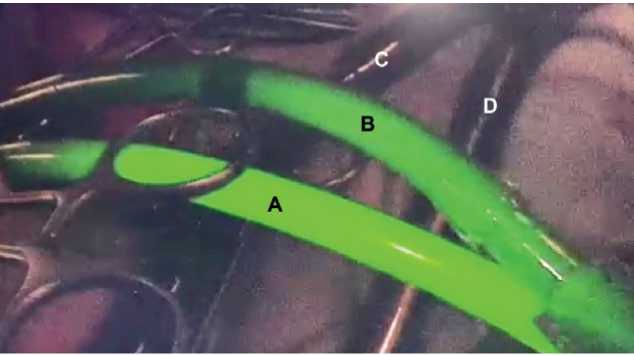
Рисунок 3. Пример ICG-контроля сосудистой изоляции печени в группе B. A — магистраль подачи перфузионного раствора в собственную печеночную артерию. B — магистраль забора перфузионного раствора от позадипеченочного отдела нижний полой вены. C — магистраль шунтирования портального кровотока. D — магистраль шунтирования кровотока нижней полой вены. Видно, что ICG не попадает в шунтирующий контур, оставаясь в перфузионном контуре
Figure 3. Example of ICG-guided vascular liver isolation in cohort B. A — perfusion delivery line to own hepatic artery. B — perfusion uptake line from retrohepatic inferior vena cava. C — portal blood flow bypass line. D — inferior vena cava blood flow bypass line. ICG not entering bypass circuit and remaining in perfusion circuit
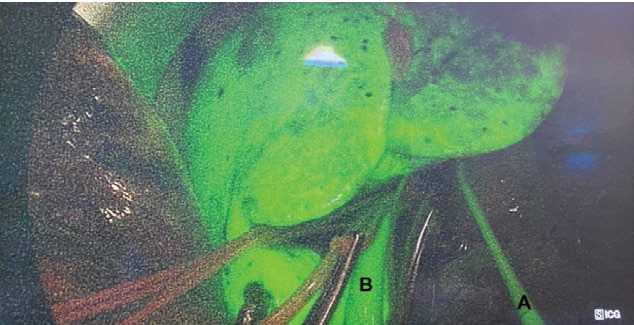
Рисунок 4. Пример ICG-прокрашивания паренхимы печени и магистралей перфузионного контура. A — магистраль подачи перфузионного раствора в собственную печеночную артерию. B — магистраль забора перфузионного раствора от позадипеченочного отдела нижний полой вены
Figure 4. Example of ICG-stained liver parenchyma and perfusion circuit. A — perfusion delivery line to own hepatic artery. B — perfusion uptake line from retrohepatic inferior vena cava
Результаты
Результаты трех групп сравнения представлены в таблице 2.
|
Группа сравнения |
A (n = 8) |
B (n = 8) |
C (n = 5) |
|
Длительность операции, мин |
351,9 |
332,5 |
322 |
|
Время сосудистой мобилизации печени*, мин |
69,2 |
49,1 |
41,6 |
|
Длительность перфузии, мин |
43,8 |
49,1 |
46,5 |
|
Осложнения по Clavien-Dindo (III–IV) |
1,12 |
0,12 |
0 |
|
Реанимационный |
9,1 |
2,4 |
2,6 |
|
Послеоперационный койко-день, дней |
19,8 |
18,7 |
13,6 |
|
АЛТ, АСТ 1 сутки, ед/мл |
560,6/916,4 |
628,0/863,8 |
609,0/441,8 |
|
АЛТ, АСТ 2 сутки, ед/мл |
403,0/604,0 |
788,3/613,9 |
623,0/259,0 |
|
Длительность цитолитического синдрома |
11,1 |
10,9 |
6 |
|
Длительность гематологической токсичности**, сут |
5,5 |
6,6 |
0,8 |
|
Общая доза филграстима [*30 млнЕД] (сут/доз) |
2,4 |
3 |
0,4 |
|
30-суточная летальность |
0 |
0 |
0 |
Примечание. * — Среднее время, затраченное на мобилизацию печени и НПВ от забрюшинного пространства и подготовку сосудов к канюляции. ** — Лейкопения менее 4×109/л.
Note. * — Mean times of liver and IFC mobilisation from retroperitoneum and vessels preparation for cannulation. ** — Leucopaenia < 4×109/L.
Таблица 2. Непосредственные результаты ИХП в группах сравнения
Table 2. Immediate ILC outcomes in comparison cohorts
Обсуждение
Средняя длительность оперативного вмешательства от
лапаротомии до ушивания послеоперационной раны планомерно сокращалась от группы к группе, однако эти различия статистически не значимы, хотя и отражают наше мнение, что выполнение вмешательства в каждой последующей группе пациентов было технически проще.
Среднее время, затрачиваемое на мобилизацию печени и НПВ от забрюшинного пространства и подготовку сосудов к канюляции, значительно сократилось, что в первую очередь мы объясняем внедрением более удобного доступа к зоне операционного действия — J-лапаротомии в группах В и С, оптимизацией алгоритма мобилизации и набором опыта членов операционной бригады.
Длительность перфузии не всегда достигала запланированных 60 минут по причине гемодинамической нестабильности пациента. Хотя данные различия между группами статистически не значимы и не связаны с техникой выполнения ИХП.
Наличие значимых (степень по Clavien-Dindo III–IV) послеоперационных осложнений коррелирует с длительностью реанимационного койко-дня, но не влияет на средний послеоперационный койко-день, поскольку чаще длительность последнего была связана с гематологической токсичностью, а не с тяжестью послеоперационного периода. Выраженность гематологической токсичности, оцененная по длительности лейкопении и потребности в поддержке филграстимом, не различалась между группами A и B, однако значительно ниже в группе С, что, возможно, связано с достижением лучшей изоляции печени. Так, внедрение ICG-контроля полноты изоляции печени позволило выявить у 5 пациентов недостаточную изоляцию печени и позволило выполнить ИХП более безопасно. В то же время проведение ICG-контроля и устранение дефектов изоляции удлиняет общее время операции, что объясняет отсутствие различий среднего времени операции между группами несмотря на оптимизацию хирургической техники в группах B и C.
Длительность цитолитического синдрома статистически значимо снизилась в группе C при сравнении с группами A и B. По нашему мнению, это связано с меньшим временем ишемии печени, которое сократилось вследствие более быстрой канюляции собственной печеночной артерии, а также за счет более физиологичной подачи оксигенированного перфузионного раствора — одновременно в печеночную артерию и в воротную вену.
В случаях анатомических аберраций — замещающих печеночных артерий, скомпрометированного артериального или портального русла — техническая сложность выполнения ИХП возрастает, однако в нашей серии была осуществима и безопасна.
Заключение
Наш анализ показал, что все примененные нами способы ИХП безопасны для пациента. При двойном контроле изоляции печени снижается вероятность утечки химиопрепарата в системный кровоток, что показывает меньшую гематологическую токсичность. Проведение артерио-портальной ИХП физиологичнее других примененных способов и способствует снижению гепатотоксичности. Применение J-лапаротомии значительно сокращает время мобилизации печени и канюляции сосудов, предоставляя хирургу лучший доступ.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Информация о спонсорстве. Данная работа не финансировалась.
Список литературы
1. Абдулаев М.А., Напольская Е.В., Цикоридзе М.Ю. Современное состояние проблемы малоинвазивных методов локального лечения метастазов колоректального рака в печени (обзор литературы). Онкологическая колопроктология. 2016:6(1):43-47. DOI:10.17650/2220-3478-2016-6-1-43-47.
2. Horn S.R., Stoltzfus K.C., Lehrer E.J., Dawson L.A., Tchelebi L., Gusani N.J., et al. Epidemiology of liver metastases. Cancer Epidemiol. 2020;67:101760. DOI: 10.1016/j.canep.2020.101760.
3. Jager M.J., Shields C.L., Cebulla C.M., Abdel-Rahman M.H., Grossniklaus H.E., Stern M.H., et al. Uveal melanoma. Nat Rev Dis Primers. 2020;6(1):24. DOI: 10.1038/s41572-020-0158-0.
4. Zane K.E., Cloyd J.M., Mumtaz K.S., Wadhwa V., Makary M.S. Metastatic disease to the liver: Locoregional therapy strategies and outcomes. World J Clin Oncol. 2021;12(9):725-745. DOI: 10.5306/wjco.v12.i9.725.
5. Bethlehem M.S., Katsarelias D., Olofsson Bagge R. Meta-analysis of isolated hepatic perfusion and percutaneous hepatic perfusion as a treatment for uveal melanoma liver metastases. Cancers (Basel). 2021;13(18):4726. DOI: 10.3390/cancers13184726.
6. Liao A., Mittal P., Lawson D.H., Yang J.J., Szalai E., Grossniklaus H.E. Radiologic and histopathologic correlation of different growth patterns of metastatic uveal melanoma to the liver. Ophthalmology. 2018;125(4):597-605. DOI: 10.1016/j.ophtha.2017.09.029.
7. Olofsson R., Cahlin C., All-Ericsson C., Hashimi F., Mattsson J., Rizell M., et al. Isolated hepatic perfusion for ocular melanoma metastasis: registry data suggests a survival benefit. Ann Surg Oncol. 2014;21(2):466-472. DOI: 10.1245/s10434-013-3304-z.
8. Каприн А.Д., Унгурян В.М., Петров Л.О., Иванов С.А., Побединцева Ю.А., Филимонов Е.В., и др. Непосредственные результаты лечения пациентов с метастатической увеальной меланомой методом изолированной химиоперфузии печени. Первый отечественный опыт. Медицинский совет. 2021;(20):117- 123. DOI: 10.21518/2079-701X-2021-20-117-123.
9. Reddy S.K., Kesmodel S.B., Alexander H.R. Jr. Isolated hepatic perfusion for patients with liver metastases. Ther Adv Med Oncol. 2014;6(4):180-194. DOI: 10.1177/1758834014529175.
10. Sigurdson E.R., Ridge J.A., Kemeny N., Daly J.M. Tumor and liver drug uptake following hepatic artery and portal vein infusion. J Clin Oncol. 1987;5(11):1836-1840. DOI: 10.1200/JCO.1987.5.11.1836.
11. Rothbarth J., Pijl M.E., Vahrmeijer A.L., Hartgrink H.H., Tijl F.G., Kuppen P.J., et al. Isolated hepatic perfusion with high-dose melphalan for the treatment of colorectal metastasis confined to the liver. Br J Surg. 2003;90(11):1391-1397. DOI: 10.1002/bjs.4308.
12. Facy O., Doussot A., Zinzindohoué F., Holl S., Rat P., Ortega Deballon P. Isolated hepatic perfusion: principles and results. J Visc Surg. 2014;151(Suppl. 1):S25-32. DOI: 10.1016/j.jviscsurg.2013.12.006.
13. van Iersel L.B., Verlaan M.R., Vahrmeijer A.L., van Persijn van Meerten E.L., Tijl F.G., Sparidans R.W., et al. Hepatic artery infusion of highdose melphalan at reduced flow during isolated hepatic perfusion for the treatment of colorectal metastases confined to the liver: a clinical and pharmacologic evaluation. Eur J Surg Oncol. 2007;33(7):874-881. DOI: 10.1016/j.ejso.2007.02.022.
14. Shaji M.J., Kumar K.Y.S., Nair K., Thankamony A., Krishnakumar L., Balakrishnan D., et al. Antegrade hepatic artery and portal vein perfusion versus portal vein perfusion alone in living donor liver transplantation: a randomized trial. Liver Transpl. 2019;25(9):1353-1362. DOI: 10.1002/lt.25455.
15. Rothbarth J., Sparidans R.W., Beijnen J.H., Schultze-Kool L.J., Putter H., van de Velde C.J., et al. Reduced liver uptake of arterially infused melphalan during retrograde rat liver perfusion with unaffected liver tumor uptake. J Pharmacol Exp Ther. 2002;303(2):736-740. DOI: 10.1124/jpet.102.037895.
16. Verhoef C., de Wilt J.H., Brunstein F., Marinelli A.W., van Etten B., Vermaas M., et al. Isolated hypoxic hepatic perfusion with retrograde outflow in patients with irresectable liver metastases; a new simplified technique in isolated hepatic perfusion. Ann Surg Oncol. 2008;15(5):1367-1374. DOI: 10.1245/s10434-007-9714-z.
17. Polat F., Atan A., Yeşil S., Dikmen K., Ünsal A. Modified Makuuchi incision in the surgical treatment of renal tumors: Initial results. Turk J Urol. 2019;45(6):467-470. DOI: 10.5152/tud.2019.68745.
18. Hempel S., Kalauch A., Oehme F., Wolk S., Welsch T., Weitz J., et al. Wound complications after primary and repeated midline, transverse and modified Makuuchi incision: A single-center experience in 696 patients. Medicine (Baltimore). 2021;100(20):e25989. DOI: 10.1097/MD.0000000000025989.
19. Cursio R., Gugenheim J. Ischemia-reperfusion injury and ischemictype biliary lesions following liver transplantation. J Transplant. 2012;2012:164329. DOI: 10.1155/2012/164329.
20. Cattell R.B., Braasch J.W. A technique for the exposure of the third and fourth portions of the duodenum. Surg Gynecol Obstet. 1960;111:378- 379. PMID: 13808480.
Об авторах
А. Д. КапринРоссия
д.м.н., профессор, академик РАН,
Москва
В. М. Унгурян
Россия
к.м.н.,
Кострома
Л. О. Петров
Россия
к.м.н., доцент, отделение лучевого и хирургического лечения заболеваний абдоминальной
области,
Обнинск
С. А. Иванов
Россия
д.м.н.,
Обнинск
В. В. Назарова
Россия
к.м.н., отделение онкодерматологии,
Москва
Ю. А. Побединцева
Россия
Е. В. Филимонов
Россия
отделение анестезиологии и реанимации,
Кострома
Е. А. Круглов
Россия
онкологическое отделение хирургических методов лечения № 1,
Кострома
Рецензия
Для цитирования:
Каприн А.Д., Унгурян В.М., Петров Л.О., Иванов С.А., Назарова В.В., Побединцева Ю.А., Филимонов Е.В., Круглов Е.А. Сравнительная характеристика различных способов изолированной химиоперфузии печени. Креативная хирургия и онкология. 2022;12(1):5-12. https://doi.org/10.24060/2076-3093-2022-12-1-5-12
For citation:
Kaprin A.D., Unguryan V.M., Petrov L.O., Ivanov S.A., Nazarova V.V., Pobedintseva Yu.A., Filimonov E.V., Kruglov E.A. Comparative Assessment of Isolated Liver Chemoperfusion Techniques. Creative surgery and oncology. 2022;12(1):5-12. (In Russ.) https://doi.org/10.24060/2076-3093-2022-12-1-5-12
JATS XML


































