Перейти к:
Робот-ассистированная хирургия при лечении послеоперационных стриктур нижней трети мочеточника
https://doi.org/10.24060/2076-3093-2023-3
Аннотация
Введение. Частота развития послеоперационных стриктур из-за ятрогенных повреждений мочеточника имеет тенденцию к увеличению. Для устранения стриктур выполняют реконструктивные операции открытым или лапароскопическим способами. Однако оба метода имеют недостатки. Роботическая хирургия позволяет эффективно проводить оперативное лечение стриктур нижней трети мочеточника.
Цель. Определение исходов робот-ассистированных реконструктивных операций при лечении послеоперационных стриктур нижней трети мочеточника.
Материалы и методы. Пяти пациенткам с послеоперационными стриктурами нижней трети мочеточника выполнялись реконструктивные робот-ассистированные операции. Определялись клинические и рентгенологические исходы в отдаленном послеоперационном периоде.
Результаты и обсуждение. Двум пациенткам проводились симультанные робот-ассистированные реконструктивные операции: робот-ассистированный уретероцистонеоанастомоз справа и операция Боари слева; робот-ассистированная операция Боари и разобщение посттравматического мочеточниково-влагалищного свища. В оставшихся трех случаях выполнялись робот-ассистированные операции Боари и уретероцистонеоанастомоз с Psoas-hitch. При проведении МСКТ-урографии через 3 месяца после операции во всех случаях данных за стриктуру мочеточника не получено.
Заключение. Робот-ассистированные реконструктивные операции на сегодня являются безопасным и эффективным способом лечения послеоперационных стриктур нижней трети мочеточника, позволяющим проведение симультанных операций.
Ключевые слова
Для цитирования:
Мосоян М.С., Шанава Г.Ш., Никулин Р.Е. Робот-ассистированная хирургия при лечении послеоперационных стриктур нижней трети мочеточника. Креативная хирургия и онкология. 2023;13(1):21-26. https://doi.org/10.24060/2076-3093-2023-3
For citation:
Mosoyan M.S., Shanava G.Sh., Nikulin R.E. Robot-Assisted Surgery in Treating Postoperative Strictures of Lower Third of Ureter. Creative surgery and oncology. 2023;13(1):21-26. (In Russ.) https://doi.org/10.24060/2076-3093-2023-3
ВВЕДЕНИЕ
Стриктуры мочеточника являются редкой патологией мочевыводящей системы. Однако частота встречаемости послеоперационных стриктур мочеточника имеет тенденцию к увеличению от 0,23 до 2,97 % [1]. Послеоперационные стриктуры верхних мочевыводящих путей возникают вследствие несвоевременно выявленных ятрогенных повреждений мочеточника. По статистике причинами интраоперационных уретеротравм в 64–82 % случаев являются гинекологические операции, в 15–26 % — колоректальные и в 11–30 % — урологические оперативные вмешательства [2]. Стриктуры мочеточника приводят к обструкции верхних мочевыводящих путей и являются причиной развития ряда осложнений: гидронефроза, пиелонефрита, формирования свищей. Все эти осложнения в дальнейшем приводят к прогрессирующему снижению функции почек [3][4]. В большинстве случаев посттравматические стриктуры мочеточника наблюдаются в нижней трети [2][5][6]. Радикальное лечение стриктур мочеточника требует проведения реконструктивных операций. На сегодняшний день существуют два вида хирургических вмешательств при лечении стриктур нижней трети мочеточника: операция Боари или уретероцистонеоанастомоз. Оба вида реконструктивных операций могут быть выполнены с использованием Hitch-psoas пластики [7–9]. Впервые А. Боари, итальянский хирург, описал технику формирования анастомоза мочеточника с лоскутом мочевого пузыря на собаке в 1896 году [10]. В эпоху, когда не были развиты эндоскопические методы лечения, применялись открытые реконструктивные операции мочеточника, в том числе и операция Боари. Впоследствии благодаря развитию эндовидеохирургии были разработаны и внедрены уретероцистонеоанастомоз и операция Боари лапароскопическим способом. Главными преимуществами эндовидеохирургического способа являются снижение продолжительности и интенсивности болевого синдрома в послеоперационном периоде, сокращение сроков госпитализации, а также улучшение косметических исходов [11]. Однако, несмотря на малоинвазивность лапароскопических реконструктивных операций при послеоперационных стриктурах нижней трети мочеточника, их выполнение остается технически сложным вследствие развития рубцового процесса, а также низкой степени свободы инструментов, что ограничивает их применение [12]. Появление роботической хирургии позволило преодолеть недостатки лапароскопической техники, сделав выполнение оперативных вмешательств при лечении стриктур нижней трети мочеточника более совершенным и эффективным [13].
Целью нашего исследования является определение исходов робот-ассистированных реконструктивных операций при лечении послеоперационных стриктур нижней трети мочеточника.
МЕТОДЫ И МАТЕРИАЛЫ
Ретроспективно оценивались результаты реконструктивных робот-ассистированных операций при лечении послеоперационных стриктур мочеточника. В ФГБУ «НМИЦ им. В. А. Алмазова» за период с октября 2018 по сентябрь 2022 года были госпитализированы 5 пациенток с послеоперационными стриктураминижней трети мочеточника, полученными в различных медицинских учреждениях страны. По механизму развития посттравматические стриктуры у 2-х пациенток возникли после гинекологических оперативных вмешательств и ещё у 3-х — после эндоскопических урологических операций. Среди них у одной пациентки помимо стриктуры мочеточника имелся посттравматический мочеточнико-влагалищный свищ. У 3-х пациенток до госпитализации в НМИЦ им. В. А. Алмазова были установлены нефростомические дренажи вследствие перенесенного ранее обструктивного пиелонефрита. У одной пациентки, перенесшей гинекологическую операцию, нефростомы имелись с обеих сторон. Еще у одной пациентки из-за интраоперационной стриктуры мочеточника проводилось дренирование мочеточниковым стентом.
Предоперационная диагностика включала физикальные, лабораторные и инструментальные методы исследования. Из инструментальных методов диагностики выполнялись ультразвуковое исследование (УЗИ) почек, мультиспиральная компьютерная томография — урография (МСКТ-урография) и диагностическая цистоуретероскопия.
Всем пациенткам для устранения стриктуры нижней трети мочеточника выполнялись реконструктивные робот-ассистированные операции. В двух случаях проводились симультанные операции: робот-ассистированный уретероцистонеоанастомоз справа и операция Боари слева, робот-ассистированная операция Боари и разобщение посттравматического мочеточниково-влагалищного свища. В оставшихся трех случаях двум пациенткам выполнена робот-ассистированная операция Боари, а третьей — робот-ассистированный уретероцистонеоанастомоз с Psoas-hitch. Дренирование верхних мочевыводящих путей осуществлялось установкой мочеточникового JJ-стента во время операции. В ходе пластики применялась рассасывающаяся лигатура (викрил 4/0).
Во всех случаях оперативные вмешательства проводились на хирургической системе Da Vinci Si. Операции осуществлялись трансперитонеальным доступом в положении пациенток на спине. После индукции эндотрахеального наркоза выполнялся лапароцентез в верхней параумбиликальной точке и накладывался карбоксиперитонеум. Троакары Da Vinci устанавливались в типичных местах.
РЕЗУЛЬТАТЫ
В анамнезе у 5 пациенток наблюдался обструктивный пиелонефрит, потребовавший дренирования верхних мочевыводящих путей до госпитализации в НМИЦ им. В. А. Алмазова. У пациентки с мочеточниково-влагалищным свищом отмечалось выделение мочи из влагалища. В ходе обследования по результатам МСКТ-урографии стриктуры нижней трети мочеточника были правосторонними у 2-х пациенток, левосторонними у 2-х (рис. 1) и двухсторонними у одной.
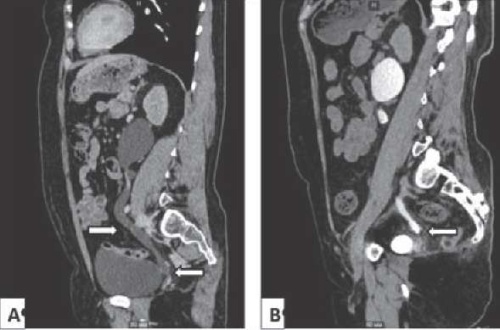
Рисунок 1. MСКТ-урография перед проведением оперативного вмешательства: А — через 7 минут после введения рентгеноконтрастного вещества; B — через 85 минут после введения рентгеноконтрастного вещества
Figure 1. MSCT urography before surgery: A — 7 minutes after introduction of X-ray contrast agent; B — 85 minutes after introduction of X-ray contrast agent
Оперативное лечение посттравматических стриктур во всех случаях начиналось с мобилизации нижней трети мочеточника. Рубцово измененная часть мочеточника иссекалась (рис. 2). Дистальный отдел мочеточника перевязывался рассасывающейся лигатурой (Викрил 4/0).
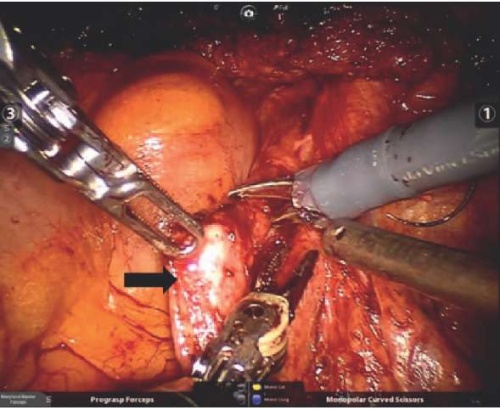
Рисунок 2. Выделение и иссечение рубцово измененной части мочеточника (указано черной стрелкой)
Figure 2. Isolation and excision of ureter scar part (black arrow)
Дальнейший ход операции определялся протяженностью посттравматической стриктуры мочеточника. Так, двум пациенткам с непротяженными стриктурами нижней трети мочеточника выполнялся уретероцистонеоанастомоз. Для устранения возможного натяжения мочеточника дополнительно производилась мобилизация и тракция в краниальном направлении мочевого пузыря с последующей его фиксацией к поясничной мышце по методу Рsoas-hitch. Одной пациентке, у которой имелись стриктуры с двух сторон, выполнены уретероцистонеоанастомоз справа и операция Боари слева.
Еще трем пациенткам, которые имели протяженные стриктуры, проводилась операция по Боари. Для этого при помощи робота-ассистента осуществлялась мобилизация переднебоковой стенки мочевого пузыря с соответствующей стриктуре мочеточника стороны. Из мочевого пузыря выкраивался лоскутнеобходимых размеров (рис. 3).
Культя мочеточника подводилась к лоскуту мочевого пузыря, и формировался анастомоз (рис. 4).
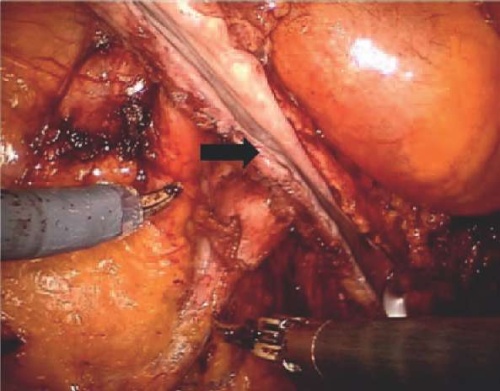
Рисунок 3. Формирование лоскута (черная стрелка) из переднебоковой стенки мочевого пузыря
Figure 3. Flap formation (black arrow) from bladder anterolateral wall
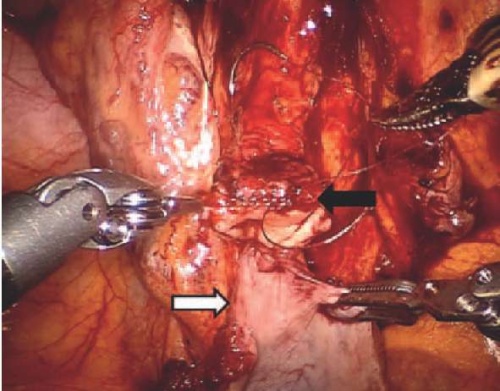
Рисунок 4. Формирование уретероцистонеоанастомоза между выкроенным лоскутом мочевого пузыря (белая стрелка) и здоровой тканью мочеточника (черная стрелка)
Figure 4. Uretero-cysto-neoanastomosis between bladder flap (white arrow) and sound ureteral tissue (black arrow)
Во всех случаях перед формированием анастомоза мочеточника с мочевым пузырем интраоперационно устанавливался мочеточниковый стент. После создания анастомоза герметичность мочевого пузыря определялась введением по уретральному катетеру 150 мл 0,9 % раствора NaCl. Операция заканчивалась установкой дренажа в малый таз. Ранее установленные нефростомические дренажи удалялись по окончании операции. Одной пациентке после этапа пластики по Боари выполнялась симультанная реконструктивная операция — разобщение мочеточниково-влагалищного свища.
Время операций зависело от объема оперативного вмешательства. Так, выполнение одностороннего уретероцистонеоанастомоза заняло 80 мин. Время выполнения операции Боари составило 90 минут. Время проведения симультанной операции Боари, с одной стороны, и уретероцистонеоанастомоза, с другой — 150 минут. На проведение симультанной операции Боари с разобщением мочеточниково-влагалищного свища потребовалось 185 минут. Объем кровопотери в 4 операциях не превышал 150 мл, а в одном случае составил 250 мл. Интраоперационных осложнений не было. Послеоперационный период во всех случаях протекал без осложнений. Дренаж из брюшной полости удалялся на 2–3-и сутки. Удаление уретрального катетера производилось на 7-е сутки, после проведения цистографии с использованием контрастного вещества (рис. 5).
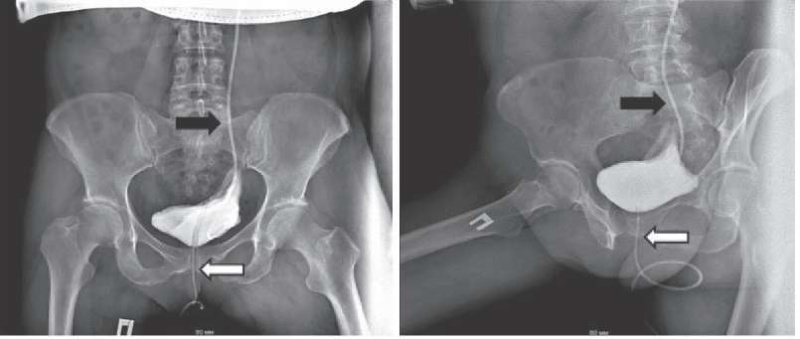
Рисунок 5. Цистография. В левом мочеточнике определяется мочеточниковый JJ-стент (черная стрелка), в мочевом пузыре — уретральный катетер (белая стрелка). Распространения контрастного вещества за пределы мочевого пузыря и области анастомоза не выявлено
Figure 5. Cystography. Ureteral JJ stent in left ureter (black arrow), urethral catheter in bladder (white arrow). No contrast agent beyond the bladder and anastomosis region
Сроки госпитализации составили от 8 до 12 суток. Спустя 1,5–2 месяца всем пациенткам производилось удаление мочеточникового стента, после чего клинических проявлений обструкции верхних мочевыводящих путей не наблюдалось. Через 3 месяца после оперативного вмешательства проводилась МСКТ-урография, по результатам которой во всех 5 случаях наблюдения данных за стриктуру мочеточника получено не было (рис. 6).
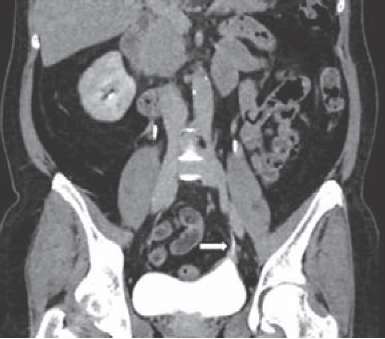
Рисунок 6. MСКТ-урография через 3 месяца после оперативного вмешательства (7-я минута)
Figure 6. MSCT urography 3 months after surgery (7th minute)
ОБСУЖДЕНИЕ
Лечение посттравматических стриктур мочеточника до последнего времени осуществлялось открытыми и лапароскопическими методами. Несмотря на эффективность открытых оперативных вмешательств, данная методика имеет ряд недостатков [14]. При проведении открытых реконструктивных операций в послеоперационном периоде требуется длительное применение обезболивающих препаратов, увеличиваются сроки пребывания пациента в стационаре. Большинство пациентов, особенно женского пола, испытывают психологический дискомфорт из-за протяженных послеоперационных рубцов. Лапароскопический метод, несмотря на преобладание над открытыми хирургическими вмешательствами, имеет ряд ограничений: сложность доступа к стриктуре мочеточника из-за рубцового процесса, ограниченность амплитуды эндоскопических инструментов, что затрудняет создание герметичного анастомоза [12].
Появление робот-ассистированной хирургии позволило объединить преимущества открытых и лапароскопических методик [15][16], благодаря чему появилась возможность проводить сложные и симультанные реконструктивные оперативные вмешательства при стриктурах мочеточника. В нашей статье предоставлен опыт проведения робот-ассистированных реконструктивных оперативных вмешательств при стриктурах нижней трети мочеточника, где 2 пациенткам выполнялись симультанные операции.
Подводя итог, следует отметить, что робот-ассистированные операции имеют для пациентов хороший косметический эффект и незначительный болевой синдром в послеоперационном периоде вследствие малоинвазивного доступа. Для оперирующего хирурга неоспоримыми преимуществами робот-ассистированных реконструктивных операций при лечении стриктур мочеточника являются возможность 3D-визуализации, высокая степень свободы инструментов, возможность комфортно накладывать интракорпоральные швы и устанавливать мочеточниковые стенты. Дальнейшие исследования могут полностью раскрыть бесспорные преимущества выполнения робот-ассистированных реконструктивных операций. Требуется длительный период наблюдения отдаленных результатов и большая выборка пациентов.
ЗАКЛЮЧЕНИЕ
Робот-ассистированные реконструктивные хирургические вмешательства являются безопасным и эффективным способом лечения посттравматических стриктур нижней трети мочеточника, позволяющим проведение симультанных реконструктивных операций. Единственным недостатком робот-ассистированных операций являются дороговизна и дефицит роботических хирургических систем.
Информация о конфликте интересов. Авторы заявили об отсутствии конфликта интересов.
Conflict of interest. The authors declare no conflict of interest.
Информация о спонсорстве. Данная работа не финансировалась.
Sponsorship Data. This work is not funded.
Статья написана к II Евразийскому конгрессу урологов 16–18 марта 2023 г., Уфа, Россия.
This article was prepared for the 2nd Eurasian Congress of Urologists, March 16–18, 2023, Ufa, Russia.
Список литературы
1. Xiong M., Zhu X., Chen D., Hossain M.A., Xie Y., Gou X., et al. Post ureteroscopic stone surgery ureteral strictures management: a retrospective study. Int Urol Nephrol. 2020;52:841–9. DOI: 10.1007/s11255-020-02375-4
2. Gild P., Kluth L.A., Vetterlein M.W., Engel O., Chun F.K.H., Fisch M. Adult iatrogenic ureteral injury and stricture–incidence and treatment strategies. Asian J Urol. 2018;5(2):101–6. DOI: 10.1016/j.ajur.2018.02.003
3. Carbonara U., Branche B., Cisu T., Crocerossa F., Guruli G., Grob M.B., et al. Robot-assisted ureteral reimplantation: a single-center comparative study. J Endourol. 2021;35(10):1504–11. DOI: 10.1089/end.2021.0083
4. Lo T.S., Wijaya T., Lo M., Kao C.C., Wu P.Y., Cortes E.F.M., et al. Clinical relevance and treatment selection of ureteral injury after cesarean section. Female Pelvic Med Reconstr Surg. 2016;22:303–6. DOI: 10.1097/SPV.0000000000000275
5. Ding G., Cheng S., Li X., Fang D., Yang K., Tang Q., et al. Experience managing distal ureteral strictures with Boari flap psoas hitch and comparison of open and laparoscopic procedures. Transl Androl Urol. 2021;10(1):56–65. DOI: 10.21037/tau-20-789
6. Лоран О.Б., Серегин А.В., Довлатов З.А. Оперативное лечение ятрогенных стриктур и облитераций нижней трети мочеточника у женщин. Экспериментальная и клиническая урология. 2015;(3):128–31.
7. Asghar A.M., Lee R.A., Yang K.K., Metro M., Eun D.D. Robot-assisted distal ureteral reconstruction for benign pathology: current state. Investig Clin Urol. 2020;61(1):23–32. DOI: 10.4111/icu.2020.61.S1.S23
8. Sagalovich D., Garisto J., Bertolo R., Yerram N., Dagenais J., Chavali J.S., et al. Minimally invasive management of ureteral distal strictures: robotic ureteroneocystostomy with a bilateral Boari flap. Urology. 2018;120:268. DOI: 10.1016/j.urology.2018.06.023
9. Franklin A., Pokala N., Jones C., Johans C., Strom K., Cummings L. Is the robotic approach feasible for repair of iatrogenic injuries of the lower ureter? World J Urol. 2016;34:1323–8. DOI: 10.1007/s00345-016-1768-8
10. Dunfield V.M. Boari operation in case of solitary kidney; treatment of obstruction of solitary ureter following hysterectomy. AMA Arch Surg. 1955;70:328–32. DOI: 10.1001/archsurg.1955.01270090006003
11. Колонтарев К.Б., Пушкарь Д.Ю., Раснер П.И., Рева И.А. Роботический уретероцистонеоанастомоз при травмах мочеточника: опыт четырех случаев. Медицинский совет. 2014;(19):46–9. DOI: 10.21518/2079-701X-2014-19-46-49
12. Strik C., Stommel M.W., Schipper L.J., van Goor H., Ten Broek R.P. Risk factors for future repeat abdominal surgery. Langenbecks Arch Surg. 2016;401:829–37. DOI: 10.1007/s00423-016-1414-3
13. Obiora D., Yang H., Gor R.A. Robotic assisted reconstruction for complications following urologic oncologic procedures. Transl Androl Urol. 2021;10(5):2272–9. DOI: 10.21037/tau.2020.03.15
14. Kozinn S.I., Canes D., Sorcini A., Moinzadeh A. Robotic versus open distal ureteral reconstruction and reimplantation for benign stricture disease. J Endourol. 2012;26(2):147–51. DOI: 10.1089/end.2011.0234
15. Singh M., Garg G., Sankhwar S. N., Kumar M. Laparoscopic ureteroneocystostomy for mid and lower ureteric strictures: Experience from a tertiary center. Urol Ann. 2018;10(3):243–48. DOI: 10.4103/UA.UA_137_17
16. Buffi N.M., Lughezzani G., Hurle R., Lazzeri M., Taverna G., Bozzini G., et al. Robot-assisted surgery for benign ureteral strictures: experience and outcomes from four tertiary care institutions. Eur Urol. 2017;71(6):945–51. DOI: 10.1016/j.eururo.2016.07.022
Об авторах
М. С. МосоянРоссия
Мосоян Мкртич Семенович — д.м.н., кафедра урологии с курсом роботической хирургии с клиникой, Центр роботической хирургии, кафедра урологии с курсом урологии с клиникой
Санкт-Петербург
Г. Ш. Шанава
Россия
Шанава Гоча Шахиевич — к.м.н., кафедра урологии с курсом роботической хирургии с клиникой
Санкт-Петербург
Р. Е. Никулин
Россия
Никулин Роман Евгеньевич — ординатор, кафедра
урологии с курсом роботической хирургии с клиникой
Санкт-Петербург
Рецензия
Для цитирования:
Мосоян М.С., Шанава Г.Ш., Никулин Р.Е. Робот-ассистированная хирургия при лечении послеоперационных стриктур нижней трети мочеточника. Креативная хирургия и онкология. 2023;13(1):21-26. https://doi.org/10.24060/2076-3093-2023-3
For citation:
Mosoyan M.S., Shanava G.Sh., Nikulin R.E. Robot-Assisted Surgery in Treating Postoperative Strictures of Lower Third of Ureter. Creative surgery and oncology. 2023;13(1):21-26. (In Russ.) https://doi.org/10.24060/2076-3093-2023-3
JATS XML


































