Перейти к:
Выживаемость пациентов с мышечно-инвазивным раком мочевого пузыря после робот-ассистированной радикальной цистэктомии с интракорпоральной деривацией мочи
https://doi.org/10.24060/2076-3093-2024-14-1-5-12
Аннотация
Ведение. Мировым стандартом лечения мышечно-инвазивного рака мочевого пузыря (РМП) выступает радикальная цистэктомия (РЦ) с тазовой лимфаденэктомией (ТЛАЭ). Данные ряда крупных исследований свидетельствуют о значительных послеоперационных осложнениях РЦ. В 2003 г. бригадой урологов под руководством M. Menon впервые были проведены серии робот-ассистированных РЦ (РАРЦ). В настоящее время появилась возможность оценивать выживаемость пациентов после РАРЦ.
Цель исследования: определение показателей общей (ОВ), опухоль-специфической (ОСВ) и безрецидивной выживаемости (БРВ) после РАРЦ с ТЛАЭ у пациентов с мышечно-инвазивным РМП, оперированных на базе одного центра.
Материалы и методы. За период 2018–2023 гг. в онкологическом отделении на базе Клиники ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава РФ было прооперировано 200 пациентов с мышечно-инвазивным РМП. Оперативная методика заключалась в выполнении РАРЦ с интракорпоральной деривацией мочи. Максимальный период наблюдения за пациентами ограничивался 36 месяцами. Проводился анализ выживаемости в общей когорте пациентов, а также после стратификации по статусу pN (+/–). С целью визуализации полученных результатов применялись кривые Kaplan-Meier.
Результаты и обсуждение. По истечении 36 месяцев ОВ среди всех прооперированных пациентов составила 48,25 %, ОСВ — 57,49 %, БРВ — 61,89 % (p = 0,0031, χ² = 11,325). Также наблюдается достоверно значимое уменьшение всех показателей выживаемости среди пациентов pN (+), p < 0,0001. В структуре группы pN (+) выявлено преобладание пациентов с повышенной стадией pT по сравнению с группой pN (–).
Заключение. По результатам анализа выживаемости после РАРЦ наблюдаются удовлетворительные отдаленные онкологические результаты. В структуре причин смертности после РАРЦ лидирующие позиции занимают поражение регионарных лимфатических узлов и повышенная стадия pT.
Ключевые слова
Для цитирования:
Павлов В.Н., Урманцев М.Ф., Бакеев М.Р. Выживаемость пациентов с мышечно-инвазивным раком мочевого пузыря после робот-ассистированной радикальной цистэктомии с интракорпоральной деривацией мочи. Креативная хирургия и онкология. 2024;14(1):5-12. https://doi.org/10.24060/2076-3093-2024-14-1-5-12
For citation:
Pavlov V.N., Urmantsev M.F., Bakeev M.R. Survival in patients with muscle-invasive bladder cancer after robot-assisted radical cystectomy with intracorporeal urinary derivation. Creative surgery and oncology. 2024;14(1):5-12. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-1-5-12
ВВЕДЕНИЕ
Ежегодно регистрируется более полумиллиона новых случаев рака мочевого пузыря (РМП). Согласно последним данным РМП является одним из десяти самых распространенных злокачественных новообразований в мире [1][2]. На момент постановки диагноза примерно у 25 % пациентов наблюдается мышечно-инвазивная форма РМП [3]. Общепризнанным мировым стандартом лечения мышечно-инвазивного РМП выступает радикальная цистэктомия (РЦ) с тазовой лимфаденэктомией (ТЛАЭ) с предшествующей неоадъювантной терапией. В то же время РЦ на протяжении последних десятилетий остается одной из самых тяжелых онкологических операций в урологической практике [4][5]. Последние рекомендации мировых онкологических и урологических сообществ представляют открытую РЦ (ОРЦ) в качестве приоритетного метода хирургического лечения пациентов с мышечно-инвазивным РМП и немышечно-инвазивным РМП высокого риска [6]. ОРЦ является хоть и трудоемким, но технически осуществимым оперативным вмешательством ввиду отсутствия дорогого материально-технического оснащения. Тем не менее данные ряда исследований, проведенных крупнейшими мировыми центрами с наибольшим опытом РЦ, свидетельствуют о значительных послеоперационных осложнениях данного оперативного вмешательства. Более 60 % пациентов, которым была проведена ОРЦ, имеют по крайней мере одно осложнение, а около 20 % пациентов сопровождают несколько жизнеугрожающих осложнений в послеоперационном периоде [7]. По причине неудовлетворительных хирургических показателей ОРЦ в 2003 г. бригадой урологов под руководством M. Menon впервые была проведена серия робот-ассистированных РЦ (РАРЦ) по поводу мышечно-инвазивного РМП у 14 мужчин и 3 женщин [8]. Демонстрируя качественные периоперационные результаты, РАРЦ стала постепенно использоваться в лечебной практике [9][10]. Также РАРЦ подвергалась сравнению с традиционной ОРЦ и лапароскопической РЦ (ЛРЦ) с целью выявления преимуществ данного метода и обоснования необходимости к более широкому его применению. РАРЦ продемонстрировала сопоставимые с другими методиками хирургические и ранние онкологические результаты, что позволило использовать робот-ассистированные вмешательства при РМП в рутинной клинической практике [11][12].
РАРЦ начиная с 2003 г. технически постоянно совершенствовалась и оптимизировалась. Ведущими мировыми клиниками была проведена серьезная работа с момента единичных вмешательств в составе клинических исследований до получения РАРЦ статуса метода выбора при мышечно-инвазивном РМП. Согласно данным ряда исследований, с 2004 по 2012 г. количество РАРЦ в структуре всех РЦ увеличилось в 30 раз (с 0,7 до 18,5 %) [13]. При выполнении РАРЦ серьезным вопросом всегда оставался выбор метода деривации мочи (уретерокутанеостома, илеокондуит, ортотопически/гетеротопически, континентно/инконтинентно), а также способ его выполнения (экстра/интракорпорально). Первые РАРЦ преимущественно выполнялись с экстракорпоральной деривацией мочи, так как интракорпоральное отведение технически труднее и требовало большего опыта. На данный момент все чаще отдают предпочтение интракорпоральной деривации мочи [14]. С 2005 по 2016 г. количество интракорпоральных отведений мочи возросло с 9 до 97 % [15].
В настоящее время лечение онкологических больных в урологии является мультидисциплинарным и комплексным. Помимо инновационных способов оперативного воздействия необходимы актуальные подходы в химио- и лучевой терапии. В клинической онкологии внедрение очередного метода лечения всегда сопровождается трудностями, вызванными невозможностью на начальных этапах достоверно оценить его эффективность. Существует множество критериев, позволяющих объективно отразить преимущества и недостатки выбранного способа лечения. По мере накопления опыта и количества оперированных пациентов появилась возможность оценивать отдаленные онкологические результаты после РАРЦ, входящего в многоэтапную структуру персонифицированного лечения. Наиболее значимыми, на наш взгляд, являются показатели общей, опухоль-специфической и безрецидивной выживаемости. Центры, имеющие наибольший опыт выполнения робот-ассистированных вмешательств, несут обязанность в многоплановом анализе своей работы. Такая необходимость обусловлена дороговизной высокотехнологичных методов медицинской помощи, которые требуют бóльших экономических затрат здравоохранения. Однако лучшие результаты лечения безоговорочно обосновывают потраченные ресурсы.
Цель исследования: определение показателей общей (ОСВ), опухоль-специфической (ОСВ) и безрецидивной выживаемости (БРВ) после РАРЦ с ТЛАЭ у пациентов с мышечно-инвазивным РМП, оперированных на базе одного центра.
МАТЕРИАЛЫ И МЕТОДЫ
За период 2018–2023 гг. в онкологическом отделении на базе Клиники ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава РФ было прооперировано 200 пациентов с диагнозом «мышечно-инвазивный РМП». На догоспитальном этапе проводился стандартный перечень лабораторно-инструментальной диагностики. Всем пациентам предварительно на основании гистологического анализа после проведенных трансуретральных резекций (ТУР)/ТУР-биопсий мочевого пузыря был выставлен диагноз мышечно-инвазивного РМП. Данных за отдаленные метастазы по результатам лабораторных и инструментальных методов диагностики не было ни у одного пациента. Среди пациентов с мышечно-инвазивным РМП были 164 мужчины и 36 женщин. Средний возраст пациентов составлял 67,3 ± 2,8 года. Распределение стадий РМП согласно cTNM на момент госпитализации до проведенного радикального оперативного лечения, а также степени дифференцировки опухоли по результатам гистологического исследования после трансуретральных резекций отражено в таблице 1. Неоадъювантная химиотерапия была выполнена у 193 пациентов (96,5 %), 7 пациентам (3,5 %) предоперационное лечение было противопоказано по причине снижения функции почек и хронической болезни почек.
Количество пациентов, n (%) | Средний возраст пациентов ± стандартное отклонение, лет | |
Клиническая стадия | ||
сT1 | 9 (4,5 %) | 66,4 ± 2,1 |
сT2 | 77 (38,5 %) | 65,8 ± 1,3 |
сT3 | 79 (39,5 %) | 67,9 ± 2,4 |
сT4 | 35 (17,5 %) | 69,1 ± 1,8 |
Степень дифференцировки по результатам гистологии после ТУР/ТУР-биопсии | ||
G1 | 13 (6,5 %) | 65,4 ± 1,9 |
G2 | 60 (30,0 %) | 66,3 ± 1,2 |
G3 | 127 (63,5 %) | 70,1 ± 0,7 |
Таблица 1. Характеристика опытной группы до оперативного лечения
Table 1. Characteristics of the experimental group prior to surgical treatment
Всем пациентам-мужчинам была показана радикальная цистэктомия. Деривация мочи выполнялась исключительно интракорпорально и состояла в выполнении методики по Bricker или Studer. Илеокондуит по Bricker был выполнен у 158 (96,3 %) мужчин, а ортотопический артифициальный мочевой пузырь по Studer — у 6 (3,7 %). Объем оперативного вмешательства для женщин заключался в передней тазовой экзентерации с интракорпоральным гетеротопическим отведением по Bricker. Обязательным этапом оперативного пособия являлась ТЛАЭ. Стандартная граница лимфодиссекции находилась на уровне бифуркации аорты, а в случае выраженного регионарного метастазирования лимфаденэктомия выполнялась до уровня нижней брыжеечной артерии. Удаленные лимфатические узлы составляли группы запирательных, наружных подвздошных, общих подвздошных, пресакральных, а в некоторых случаях параортальных и паракавальных. В дальнейшем операционный материал, состоящий из удаленного мочевого пузыря, дистальных отделов мочеточников и лимфатических узлов, отправлялся на патоморфологическое исследование с целью определения стадии злокачественного процесса в соответствии с классификацией pTNM и степени дифференцировки опухоли согласно классификации ВОЗ (1973 г.).
Максимальный период наблюдения за пациентами в данном исследовании ограничивался 36 месяцами. Послеоперационное наблюдение заключалось в фиксировании смерти при ее наличии, определении ее причины и времени возникновения рецидива заболевания при его наличии. По результатам гистологического исследования операционного материала пациенты были разделены на 2 группы. Первую группу составили пациенты с pN (+). а вторую — с pN (-). Нами проводился анализ выживаемости в общей когорте пациентов, а также после стратификации по статусу pN (+/-). С целью визуализации полученных результатов применялись кривые Kaplan-Meier. Статистический анализ проводился с применением программного обеспечения Statistica 10.0 («StatSoft Inc.», США). Сравнение данных проводили с использованием U-критерия Mann-Whitney и t-критерия Student. Для сравнения кривых выживаемости использовался логарифмический ранговый критерий. При обработке статистических данных уровень значимости считался достоверным при p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Средний период госпитализации для пациентов составил 12,0 ± 1,5 дня. По результатам патоморфологического исследования операционного материала папиллярная уротелиальная карцинома с инвазией в мышечный слой была диагностирована у 163 пациентов (81,5 %), аденокарцинома мочевого пузыря кишечного типа у 11 пациентов (5,5 %), картина цистита с выраженным лечебным патоморфозом у 26 пациентов (13 %). Среднее количество удаленных лимфатических узлов для всей когорты пациентов составило 21 ± 4,2 образца. Распределение пациентов по стадиям pT согласно результатам послеоперационного патоморфологического исследования и степени дифференцировки опухоли после оперативного вмешательства демонстрируются в таблице 2. На основании статуса pN все пациенты также были разделены на две группы (табл. 3). Для первой группы pN (+) среднее количество удаленных лимфатических узлов равнялось 20,0 ± 4,5, а для второй группы pN (-) — 19,0 ± 6,1.
После проведенного оперативного лечения наблюдалось увеличение пациентов с пониженной стадией в группах pT1 (было 4,5 % (cT1), стало 7 %) и pT2 (было 38,5 % (cT2), стало 41,5 %) и уменьшение пациентов в группе pT3 (было 39,5 % (cT3), стало 33,5 %), что обусловлено лекарственным патоморфозом после неоадъювантной химиотерапии. В группе pN (+) количество пациентов со стадией pT4–18 (47,3 %), pT3–15 (39,5 %), pT2–5 (13,2 %). В группе pN (-) количество пациентов со стадией pT4–18 (11,1 %), pT3–52 (32,1 %), pT2–78 (48,2 %), pT1–14 (8,6 %). По истечении 36 месяцев общая выживаемость (ОВ) среди всех прооперированных пациентов составила 48,25 %, безрецидивная выживаемость (БРВ) — 61,89 %, опухоль-специфическая выживаемость (ОСВ) — 57,49 %. Медиана для ОВ составила 29 месяцев. При сравнении полученных результатов и построении кривых выживаемости логарифмический ранговый критерий p = 0,0031, χ² = 11,325 (рис. 1).
В группе пациентов pN (+) по истечении 36 месяцев медиана выживаемости для ОВ — 7 месяцев, для ОСВ — 8 месяцев, для БРВ — 11 месяцев. При построении кривых выживаемости логарифмический ранговый критерий p = 0,16, χ² = 3,237 (рис. 2). В группе пациентов pN (-) по прошествии 36 месяцев медиана выживаемости не была достигнута ни по одному показателю. На момент последнего месяца наблюдения выживаемость для ОВ составила 54,16 %, для ОСВ — 66,9 %, для БРВ — 67,7 %. При построении кривых выживаемости логарифмический ранговый критерий p = 0,0097, χ² = 8,943 (рис. 3). При сравнении обеих групп наблюдается достоверно значимое уменьшение всех показателей выживаемости среди пациентов pN (+), p < 0,0001 (рис. 4). В структуре группы pN (+) также наблюдается преобладание пациентов с повышенной стадией pT по сравнению с группой pN (-) (p = 0,009). Наблюдается корреляция худших показателей ОВ, ОСВ и БРВ у пациентов с pN (+) и pT3–4 (p = 0,021).
Количество пациентов, n (%) | |
Патоморфологическая стадия | |
pT1 | 14 (7 %) |
pT2 | 83 (41,5 %) |
pT3 | 67 (33,5 %) |
pT4 | 36 (18 %) |
Степень дифференцировки | |
G1 | 5 (2,5 %) |
G2 | 43 (21,5 %) |
G3 | 149 (74,5 %) |
G4 | 3 (1,5 %) |
Таблица 2. Характеристика опытной группы после оперативного лечения
Table 2. Characteristics of the experimental group after surgical treatment
Статус pN | pT1, n (%) | pT2, n (%) | pT3, n (%) | pT4, n (%) | Количество пациентов в группе, n (%) |
1-я группа: pN (+) | 1 (0,5 %) | 2 (1 %) | 21 (10,5 %) | 14 (7 %) | 38 (19,0 %) |
2-я группа: pN (-) | 13 (6,5 %) | 81 (40,5 %) | 46 (23 %) | 22 (11 %) | 162 (81,0 %) |
Таблица 3. Распределение пациентов по статусу pN и pT, n общая = 200 (100 %)
Table 3. Distribution of patients by pN and pT status, n total = 200 (100%)
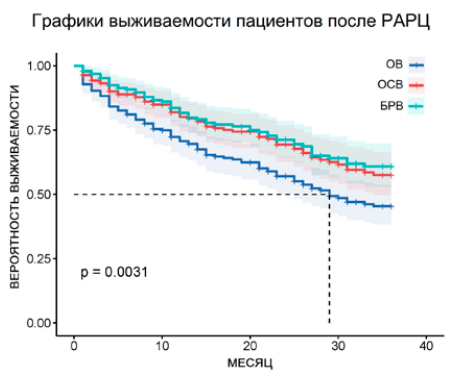
Рисунок 1. Графики выживаемости пациентов после РАРЦ, n = 200
Figure 1. Curves of patient survival after RARC, n = 200
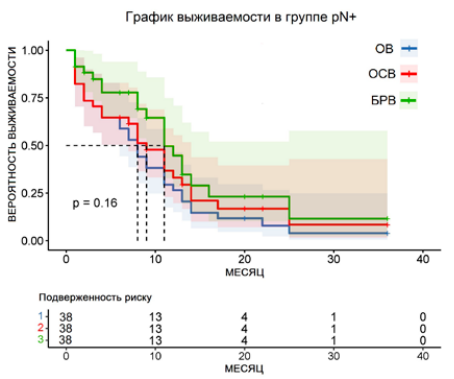
Рисунок 2. Графики выживаемости в группе pN (+), n = 38
Figure 2. Curves of patient survival in the pN (+) group, n = 38
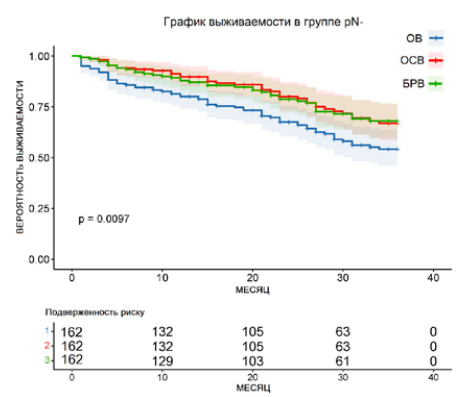
Рисунок 3. Графики выживаемости в группе pN (–), n = 162
Figure 3. Curves of patient survival in the pN (–) group, n = 162
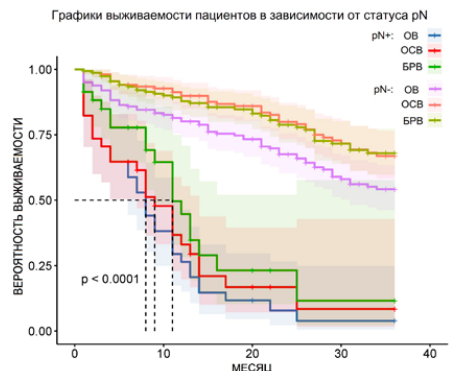
Рисунок 4. Сравнение выживаемости в группах pN (+) и pN (–), n = 200
Figure 4. Survival comparison between pN (+) and pN (–) groups, n = 200
ОБСУЖДЕНИЕ
Вопрос о выживаемости после радикальных методов лечения в онкологии всегда оставался предметом дискуссий. Достаточное количество факторов влияют на здоровье пациента в раннем и позднем послеоперационном периоде, за счет чего сравнение показателей выживаемости может быть затруднительным. Проведение исследований с большей численностью пациентов позволяет увеличить достоверность анализа. На сегодняшний день в мировой литературе имеется значительное количество работ, посвященных сравнению РАРЦ с ОРЦ и ЛРЦ. Зачастую исследователи ограничиваются сравнением ранних хирургических критериев, куда включают показатели времени операции, объема интраоперационной кровопотери, частоты гемотрансфузий, продолжительности послеоперационного пареза кишечника, среднему времени госпитализации [16–18]. Часть исследований содержит информацию о частотах послеоперационных 30-и 90-дневных осложнений, что, безусловно, позволяет более детально оценить РАРЦ в аспекте раннего улучшения качества жизни и скорейшего возвращения в социум [13][19][20]. Так, по данным систематического обзора Maibom et al. среди результатов всех методов РЦ малые осложнения возникают в 40,0 % (19,9–77,4 %) случаев на сроке 30 дней, и в 38,2 % (19,0–80,8 %) случаев на момент 90 дней наблюдения. Более серьезные осложнения возникают в 15,5 % (4,9–24,8 %) случаев в период 30 дней, и в 16,9 % (13,4–32,0 %) — за 90 дней. Наиболее частыми осложнениями выступают реакции со стороны желудочно-кишечного тракта (29,0 %) и инфекции (26,4 %) [21]. Среди ранних онкологических результатов ряд авторов сравнивают частоты положительного хирургического края и количество удаленных лимфатических узлов [22][23]. РАРЦ в большинстве представленных работ демонстрирует результаты сопоставимые или превосходящие ОРЦ и ЛРЦ.
Наибольший интерес представляют исследования, направленные на анализ многолетних результатов выживаемости, поскольку данные работы позволяют объективно оценить эффективность конкретного метода лечения. В работе под руководством Mortezavi et al. исследуются результаты лечения 3169 пациентов, перенесших радикальную цистэктомию, за период с 2011 по 2018 г. Авторы сравнивали несколько категорий ранних и отдаленных хирургических и онкологических показателей. За период наблюдения 889 пациентам была выполнена РАРЦ, а 2280 — ОРЦ. Медиана наблюдения составила 47 (28–71) месяцев. По истечении 5 лет наблюдения показатели смертности от РМП в группе ОРЦ составили 30,2 %, а в группе РАРЦ — 27,6 %. 5-летняя ОВ в группе ОРЦ составила 57,7 %, в группе РАРЦ — 61,4 %. 7-летняя ОВ в группе ОРЦ — 51,2 %, в группе РАРЦ — 58,2 % (p = 0,01) [23]. В систематическом обзоре Yuh et al. анализировались результаты 87 статей, в которых сравнивались хирургические, онкологические и патологические исходы после РАРЦ. Авторы отметили, что только в 6 работах период наблюдения за пациентами превышал 36 месяцев. При этом показатели 3-летней ОВ варьировали в пределах 61–80 %, ОСВ — 68–83 %, БРВ — 67–76 %. 5-летние показатели ОВ составили — 39–66 %, ОСВ — 66–80 %, БРВ — 53–74 % [24]. В работе Hussein et al. оценивались 10-летние результаты после проведенных РАРЦ в рамках Международного консорциума по роботизированной цистэктомии. Исследователи провели ретроспективный анализ 446 РАРЦ, проведенных десять и более лет назад. Неоадъювантную химиотерапию получили 10 % пациентов. Стадии pT3–4 наблюдались у 43 % пациентов, а pN (+) — у 24 % пациентов. Медиана наблюдения составила 5 лет. 10-летняя ОВ составила 35 %, ОСВ — 65 %, БРВ — 59 %. Авторы сделали вывод о худших показателях общей, опухоль-специфической и безрецидивной выживаемости у пациентов с pT3–4 и pN (+) [25]. В работе Venkatramani et al. пересматривались результаты выживаемости на основании данных исследования RAZOR (Randomized Open versus Robotic Cystectomy). Авторы изучили когорту пациентов после ОРЦ и РАРЦ и отобрали 302 случая для анализа выживаемости с построением кривых Kaplan—Meier. По результатам исследования было получено, что в группе РАРЦ 3-летний показатель ОВ составил 73,9 %, в группе ОРЦ — 68,5 % (p = 0,334). 3-летний показатель БРВ для РАРЦ составил — 68,4 %, для ОРЦ — 65,4 % (p = 0,600). Исследователи заявили о высокой онкологической эффективности РАРЦ и об отсутствии значимых различий с ОРЦ в 3-летних показателях выживаемости [26].
ЗАКЛЮЧЕНИЕ
РАРЦ является представителем современной безопасной и эффективной хирургии в структуре лечения пациентов с мышечно-инвазивным РМП и немышечно-инвазивным РМП высокого риска. За последние десятилетия наблюдается заметное увеличение количества выполняемых РАРЦ в мире. Такое явление вполне обоснованно по причине более удовлетворительных отдаленных онкологических результатов, чем после ОРЦ и ЛРЦ. Помимо доказанных преимуществ в интраоперационной эргономике хирурга, лучшими интра- и послеоперационными показателями стали долгосрочные результаты надежности данного метода. Благодаря совершенству высокотехнологичной роботизированной платформы и увеличению прецизионности вмешательства достигаются лучшие результаты лечения по сравнению с ОРЦ и ЛРЦ. Возможности робот-ассистированной хирургии при лечении агрессивных форм РМП, в сопоставлении с традиционными методиками, позволяют вывести РЦ из разряда инвалидизирующих операций. Более того, роботическая система позволяет выполнять этап ТЛАЭ с абсолютным соблюдением всех принципов радикальности, чего не всегда удается достичь при ОРЦ и ЛРЦ. Необходимо понимать, что для укрепления РАРЦ в качестве основополагающего подхода в лечении агрессивных форм РМП требуется усовершенствование существующих схем периоперационных химио- и лучевых терапий. Такая стратегия позволит в кратчайшие сроки улучшить качество оказываемой медицинской помощи онкоурологическим больным. В структуре причин снижения выживаемости после РАРЦ, как и после других методов РЦ, лидирующие позиции занимают наличие регионарного метастазирования с поражением лимфатических узлов и повышенная стадия pT по результатам послеоперационного патоморфологического исследования.
Список литературы
1. Richters A., Aben K.K.H., Kiemeney L.A.L.M. Th e global burden of urinary bladder cancer: an update. World J Urol. 2020;38(8):1895–904. DOI: 10.1007/s00345-019-02984-4
2. Lenis A.T., Lec P.M., Chamie K., Mshs M.D. Bladder cancer: a review. JAMA. 2020;324(19):1980–91. DOI: 10.1001/jama.2020.17598
3. Chang S.S., Bochner B.H., Chou R., Dreicer R., Kamat A.M., Lerner S.P., et al. Treatment of nonmetastatic muscle-invasive bladder cancer: American urological association/American society of clinical oncology/American society for radiation oncology/Society of urologic oncology clinical practice guideline summary. J Oncol Pract. 2017;13(9):621–5. DOI: 10.1200/JOP.2017.024919
4. Tan W.S., Lamb B.W., Tan M.Y., Ahmad I., Sridhar A., Nathan S., et al. In-depth critical analysis of complications following robot-assisted radical cystectomy with intracorporeal urinary diversion. Eur Urol Focus. 2017;3(2–3):273–9. DOI: 10.1016/j.euf.2016.06.002
5. van Hemelrijck M., Th orstenson A., Smith P., Adolfsson J., Akre O. Risk of in-hospital complications aft er radical cystectomy for urinary bladder carcinoma: population-based follow-up study of 7608 patients. BJU Int. 2013;112(8):1113–20. DOI: 10.1111/bju.12239
6. Alfred Witjes J., Lebret T., Compérat E.M., Cowan N.C., De Santis M., Bruins H.M., et al. Updated 2016 EAU Guidelines on muscle-invasive and metastatic bladder cancer. Eur Urol. 2017;71(3):462–75. DOI: 10.1016/j.eururo.2016.06.020
7. Parekh D.J., Reis I.M., Castle E.P., Gonzalgo M.L., Woods M.E., Svatek R.S., et al. Robot-assisted radical cystectomy versus open radical cystectomy in patients with bladder cancer (RAZOR): an open-label, randomised, phase 3, non-inferiority trial. Lancet. 2018;391(10139):2525–36. DOI: 10.1016/S0140-6736(18)30996-6
8. Menon M., Hemal A.K., Tewari A., Shrivastava A., Shoma A.M., El-Tabey N.A., et al. Nerve-sparing robot-assisted radical cystoprostatectomy and urinary diversion. BJU Int. 2003;92(3):232–6. DOI: 10.1046/j.1464-410x.2003.04329.x
9. Mitra A.P., Cai J., Miranda G., Bhanvadia S., Quinn D.I., Schuckman A.K., et al. Management trends and outcomes of patients undergoing radical cystectomy for urothelial carcinoma of the bladder: evolution of the university of Southern California experience over 3,347 cases. J Urol. 2022;207(2):302–13. DOI: 10.1097/JU.0000000000002242
10. Tamhankar A.S., Th urtle D., Hampson A., El-Taji O., Th urairaja R., Kelly J.D., et al. Radical cystectomy in England from 2013 to 2019 on 12,644 patients: an analysis of national trends and comparison of surgical approaches using Hospital Episode Statistics data. BJUI Compass. 2021;2(5):338–47. DOI: 10.1002/bco2.79
11. Liu H., Zhou Z., Yao H., Mao Q., Chu Y., Cui Y., et al. Robot-assisted radical cystectomy vs open radical cystectomy in patients with bladder cancer: a systematic review and meta-analysis of randomized controlled trials. World J Surg Oncol. 2023;21(1):240. DOI: 10.1186/s12957-023-03132-4
12. Riveros C., Ranganathan S., Nipper C., Lim K., Brooks M., Dursun F., et al. Open vs. robot-assisted radical cystectomy with extracorporeal or intracorporeal urinary diversion for bladder cancer A pairwise metaanalysis of outcomes and a network meta-analysis of complications. Can Urol Assoc J. 2023;17(3):E75–85. DOI: 10.5489/cuaj.8096
13. Tyritzis S.I., Collins J.W., Wiklund N.P. Th e current status of robotassisted cystectomy. Indian J Urol. 2018;34(2):101–9. DOI: 10.4103/iju.IJU_355_17
14. Wijburg C.J., Hannink G., Michels C.T.J., Weijerman P.C., Issa R., Tay A., et al. Learning curve analysis for intracorporeal robot-assisted radical cystectomy: results from the EAU Robotic urology section scientifi c working group. Eur Urol Open Sci. 2022;39:55–61. DOI: 10.1016/j.euros.2022.03.004
15. Hussein A.A., May P.R., Jing Z., Ahmed Y.E., Wijburg C.J., Canda A.E., et al. Outcomes of intracorporeal urinary diversion aft er robotassisted radical cystectomy: results from the International robotic cystectomy consortium. J Urol. 2018;199(5):1302–11. DOI: 10.1016/j.juro.2017.12.045
16. Han J.H., Ku J.H. Robot-assisted radical cystectomy: Where we are in 2023. Investig Clin Urol. 2023;64(2):107–17. DOI: 10.4111/icu.20220384
17. Martin A.S., Corcoran A.T. Contemporary techniques and outcomes of robotic assisted radical cystectomy with intracorporeal urinary diversion. Transl Androl Urol. 2021;10(5):2216–32. DOI: 10.21037/tau.2019.09.45
18. Павлов В.Н., Урманцев М.Ф., Бакеев М.Р. Успехи роботассистированной цистэктомии в лечении мышечно-инвазивного рака мочевого пузыря. Онкоурология. 2022;18(2):123–8. DOI: 10.17650/1726-9776-2022-18-2-123-128
19. Cacciamani G.E., Medina L., Lin-Brande M., Tafuri A., Lee R.S., Ghodoussipour S., et al. Timing, patterns and predictors of 90-day readmission rate aft er robotic radical cystectomy. J Urol. 2021;205(2):491–9. DOI: 10.1097/JU.0000000000001387
20. Павлов В.Н., Урманцев М.Ф., Бакеев М.Р. Робот-ассистированная радикальная цистэктомия с интракорпоральным формированием гетеротопического неоцистиса: опыт осложнений одного центра. Вестник урологии. 2023;11(2):92–8. DOI: 10.21886/2308-6424-2023-11-2-92-98
21. Maibom S.L., Joensen U.N., Poulsen A.M., Kehlet H., Brasso K., Røder M.A. Short-term morbidity and mortality following radical cystectomy: a systematic review. BMJ Open. 2021;11(4):e043266. DOI: 10.1136/bmjopen-2020-043266
22. Feng D., Liu S., Tang Y., Yang Y., Wei W., Han P. Comparison of perioperative and oncologic outcomes between robot-assisted and laparoscopic radical cystectomy for bladder cancer: a systematic review and updated meta-analysis. Int Urol Nephrol. 2020;52(7):1243–54. DOI: 10.1007/s11255-020-02406-0
23. Mortezavi A., Crippa A., Kotopouli M.I., Akre O., Wiklund P., Hosseini A. Association of open vs robot-assisted radical cystectomy with mortality and perioperative outcomes among patients with bladder cancer in Sweden. JAMA Netw Open. 2022;5(4):e228959. DOI: 10.1001/jamanetworkopen.2022.8959
24. Yuh B., Wilson T., Bochner B., Chan K., Palou J., Stenzl A., et al. Systematic review and cumulative analysis of oncologic and functional outcomes aft er robot-assisted radical cystectomy. Eur Urol. 2015;67(3):402–22. DOI: 10.1016/j.eururo.2014.12.008
25. Hussein A.A., Elsayed A.S., Aldhaam N.A., Jing Z., Osei J., Kaouk J., et al. Ten-year oncologic outcomes following robot-assisted radical cystectomy: results from the International robotic cystectomy consortium. J Urol. 2019;202(5):927–35. DOI: 10.1097/JU.0000000000000386
26. Venkatramani V., Reis I.M., Castle E.P., Gonzalgo M.L., Woods M.E., Svatek R.S., et al. Predictors of recurrence, and progression-free and overall survival following open versus robotic radical cystectomy: analysis from the RAZOR Trial with a 3-year followup. J Urol. 2020;203(3):522–9. DOI: 10.1097/JU.0000000000000565
Об авторах
В. Н. ПавловРоссия
Павлов Валентин Николаевич — д.м.н., профессор, академик РАН, кафедра урологии
Республика Башкортостан, Уфа
М. Ф. Урманцев
Россия
Урманцев Марат Фаязович — к.м.н., доцент, кафедра урологии
Республика Башкортостан, Уфа
М. Р. Бакеев
Россия
Бакеев Марат Радикович — студент 6-го курса
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Павлов В.Н., Урманцев М.Ф., Бакеев М.Р. Выживаемость пациентов с мышечно-инвазивным раком мочевого пузыря после робот-ассистированной радикальной цистэктомии с интракорпоральной деривацией мочи. Креативная хирургия и онкология. 2024;14(1):5-12. https://doi.org/10.24060/2076-3093-2024-14-1-5-12
For citation:
Pavlov V.N., Urmantsev M.F., Bakeev M.R. Survival in patients with muscle-invasive bladder cancer after robot-assisted radical cystectomy with intracorporeal urinary derivation. Creative surgery and oncology. 2024;14(1):5-12. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-1-5-12


































