Перейти к:
Стриктурирующая форма болезни Крона тонкой кишки (обзор литературы)
https://doi.org/10.24060/2076-3093-2024-14-1-52-59
Аннотация
У трети пациентов с болезнью Крона встречается изолированное поражение тонкой кишки, из которых у 10 % болезнь сразу проявляется стриктурирующей формой. У таких больных диагноз зачастую выставляется только на операционном столе на фоне осложнений. Более того, после резекции тонкой кишки стриктуры анастомоза развиваются в 80 % случаев. Интерес представляют данные зарубежных авторов о снижении количества рецидивов стриктур тонкой кишки после резекции у пациентов с максимальным иссечением прилежащей брыжейки. В связи с этим представляются актуальными исследования, посвященные возможной роли брыжейки тонкой кишки в патогенезе болезни Крона. Если это так, то оптимальным методом оперативного лечения является резекция стриктурированного участка тонкой кишки с максимальным иссечением брыжейки пораженного сегмента с наложением противобрыжеечного анастомоза по типу «бок в бок», исключая контакт анастомоза с оставшейся частью брыжейки. В статье представлен современный обзор литературы, посвященный патогенезу, особенностям диагностики, выбору метода лечения стриктурирующей формы болезни Крона тонкой кишки, и собственные фотоматериалы.
Ключевые слова
Для цитирования:
Аитова Л.Р., Гришина Е.Е., Сакаев Э.М., Щекин В.С. Стриктурирующая форма болезни Крона тонкой кишки (обзор литературы). Креативная хирургия и онкология. 2024;14(1):52-59. https://doi.org/10.24060/2076-3093-2024-14-1-52-59
For citation:
Aitova L.R., Grishina E.E., Sakaev E.M., Shchekin V.S. Stricturing Small Bowel Crohn’s Disease (Literature Review). Creative surgery and oncology. 2024;14(1):52-59. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-1-52-59
ВВЕДЕНИЕ
Болезнь Крона может поражать любой отдел желудочно-кишечного тракта, изолированное поражение тонкой кишки встречается в 27–30 % случаев [1]. Диагностика заболевания у таких пациентов до настоящего времени остается трудной задачей. У большинства больных на момент постановки диагноза наблюдается воспалительная форма болезни Крона, а приблизительно в 10 % случаев болезнь сразу проявляется в виде стриктуры тонкой кишки [2]. У 50 % пациентов развиваются стриктурирующие или пенетрирующие осложнения в течение первых 10 лет после постановки диагноза [3]. Необходимо отметить, что часто изолированное поражение тонкой кишки при болезни Крона протекает под маской различных гастроэнтерологических заболеваний. Зачастую данная патология диагностируется только на операционном столе на фоне уже резвившихся осложнений, и примерно 30–40 % пациентов нуждаются в повторной операции в течение 5–10 лет [4]. Причем было отмечено, что рецидив стриктуры возникает в непосредственной близости от анастомоза или на его месте. Это так называемые вторичные или анастомотические стриктуры. Частота рецидивов стриктуры без медикаментозной поддержки у оперированных больных составляет от 65 до 90 % в течение 12 месяцев и от 80 до 100 % в течение 3 лет [5].
Патофизиология болезни Крона. Роль брыжейки
Причины и патофизиология болезни Крона остаются не до конца изученными. Развитие данной патологии является результатом взаимодействия генетической предрасположенности, факторов окружающей среды и кишечной микрофлоры, что на фоне дефекта иммунного ответа приводит к активному, самоподдерживающемуся, не стихающему воспалению в слизисто-подслизистом слое кишки, результатом которого являются язвы и эрозии [6]. Первоначальное поражение начинается с инфильтрата вокруг крипт кишки. При этом изъязвление сначала развивается на поверхности слизистой оболочки, а затем вовлекаются более глубокие слои кишечной стенки. По мере прогрессирования воспаления формируются неказеозные гранулемы, захватывающие все слои кишечной стенки [7][8].
В последнее время в литературе все чаще появляются сообщения о значении брыжейки в развитии болезни Крона, представляющие мезентериальные изменения, подтвержденные данными магнитно-резонансной томографии, такие как выраженная васкуляризация брыжейки тонкой кишки, которые прослеживаются у пациентов до появления эндоскопических признаков поражения слизистой оболочки кишки [9].
Гистологически стриктурированная стенка кишки представляет собой двукратное утолщение за счет непропорциональных изменений внутри каждого слоя [10]. В результате эластичность стенки снижается примерно в 6 раз [11]. Известно, что включаются два основных параллельных процесса: расширение гладкомышечных слоев и процесс фиброзирования. В пораженных сегментах наблюдается повышенное отложение коллагена во всех слоях. Как правило, больше всего поражается подслизистый слой, который становится в 2–3 раза толще [12]. Тем не менее увеличение объема гладкомышечной ткани перевешивает увеличение коллагена; количественное расширение мышечного слоя больше способствует общему увеличению толщины кишечной стенки [13].
Основными гистологическими элементами брыжейки являются мезотелиальный покров и соединительнотканная сеть, в «ячейках» которой расположены популяции адипоцитов. На линии соприкосновения кишки и брыжейки брыжеечный мезотелий продолжается на кишку и входит в состав клеточного компонента серозного слоя последней. Далее соединительная ткань из серозной оболочки кишки переходит в соединительнотканные перегородки подлежащих слоев — мышечного и подслизистого, что свидетельствует о непрерывности соединительнотканных структур брыжейки и кишки. Место слияния стенки кишки и брыжейки называют «воротами» кишки, то есть это место входа и выхода сосудов. Выявленные при микроскопическом исследовании иссеченной брыжейки, прилежащей к стриктурированной кишке, фибросклероз сосудов с критическим стенозом просвета за счет продуктивно-фибробластического процесса в интима-медиа, выраженное разрастание подэнтотелиальной соединительнотканной основы за счет увеличения количества коллагеновых волокон и тонкоядерных фибробластов, а также значительная лимфоцитарная инфильтрация и отложение депозитов гемосидерина по периферии сосудов (рис. 1), которые затем обнаруживаются и в кишечной стенке, в теории способны объяснить патогенез трансмурального язвенного поражения стенки кишки при болезни Крона [14].
Также убедительным фактом вовлечения брыжейки тонкой кишки в воспалительный процесс при болезни Крона является гипертрофия адипоцитов брыжейки, когда воспаленный брыжеечный жир выходит за пределы своего нормального анатомического расположения, огибает поверхность прилегающей кишки и занимает более 50 % ее окружности (рис. 2).
Согласно некоторым исследованиям, степень жировой гипертрофии коррелирует с тяжестью воспаления в прилегающей кишке, гипертрофированные адипоциты являются главным источником провоспалительных цитокинов, а в случае наличия стриктуры расположение последней соответствует локализации гипертрофированного жира и так называемого «жирового обертывания» кишки [15–17].
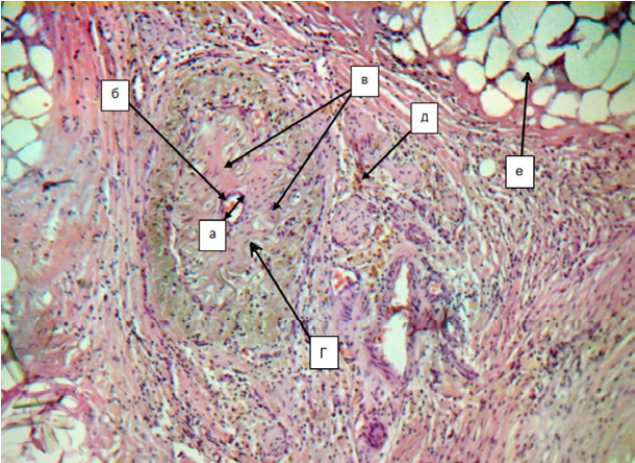
Рисунок 1. Микрофотография соединительнотканной перегородки брыжейки тонкой кишки, резецированной вместе со стриктурой при болезни Крона: Критическое сужение просвета артерии (а), двухслойный плоскоклеточный пролиферирующий эндотелий (б), утолщение субэндотелиальной соединительнотканной основы за счет разрастания коллагеновых волокон (в), тонкоядерные фибробласты (г), отложения гемосидерина в паравазальной области (д), гипертрофированные адипоциты (е). Окраска гематоксилин-эозином, ×100
Figure 1. Micrograph showing the connective tissue septum of small bowel mesentery resected together with a stricture in Crohn’s disease: Critical narrowing of the arterial lumen (a), two-layer squamous proliferating endothelium (б), thickening of the subendothelial connective tissue base due to the growth of collagen fibers (в), thin-nuclear fibroblasts (г), deposits of hemosiderin in the perivascular region (д), hypertrophic adipocytes (e). Hematoxylin-eosin staining, 100×
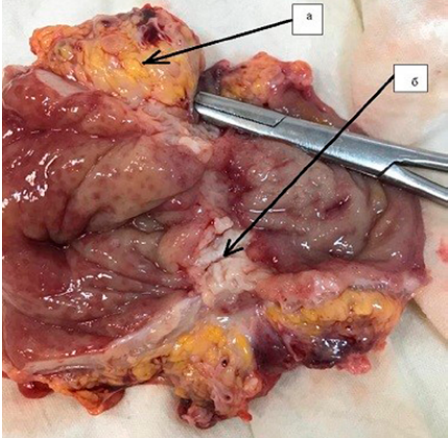
Рисунок 2. Макропрепарат резецированного участка тонкой кишки со стриктурой. Гипертрофированный брыжеечный жир (а), стриктура (б)
Figure 2. Resected section of the small bowel with a stricture. Hypertrophic mesenteric fat (a) and stricture (б)
Ранняя диагностика фиброзных стриктур
Стриктуры кишки при болезни Крона можно разделить на воспалительные, фиброзные и смешанные. Дифференциация состава стриктур, а именно относительных пропорций воспаления и фиброза, помогает принять решение о тактике лечения [18][19]. Противовоспалительная терапия необходима для пациентов со стриктурами, которые имеют преимущественно активное воспаление, тогда как фиброзные стриктуры подлежат как можно более раннему хирургическому лечению. Чувствительность рутинного пассажа бариевой взвеси по тонкой кишке для диагностики стриктур составляет всего 5 %. Эндоскопическая диагностика тонкой кишки ограничена поверхностным осмотром слизистой оболочки, недостаточной глубиной биопсии, риском ошибки из-за неоднородного распределения воспаления и фиброза в пределах участка стриктуры, а также невозможностью визуализации стриктур, находящихся за пределами досягаемости эндоскопа. Таким образом, компьютерная и магнитно-резонансная томография являются оптимальным методом диагностики стриктурирующей формы болезни Крона тонкой кишки (рис. 3).
Для определения степени фибротических и воспалительных изменений в стенке стриктурированной тонкой кишки перспективным методом считается магнитно-резонансная энтерография с контрастным усилением. Данный метод основан на повышенной васкуляризации воспалительного компонента стриктуры и пониженной васкуляризации фиброзного компонента кишечной стенки и, следовательно, неоднородном рисунке распределения контраста в тканях [20–23].
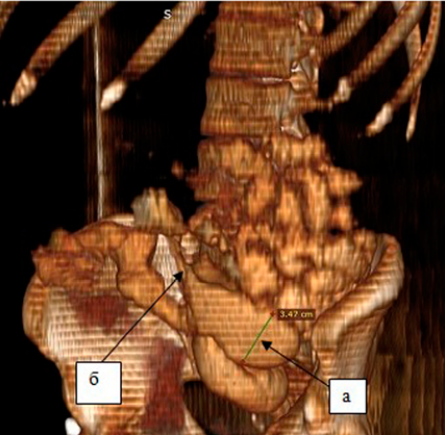
Рисунок 3. Компьютерная энтерография, переднебоковая проекция. Расширение престенотического отдела тонкой кишки до 3,47 см (а), стриктура терминального отдела подвздошной кишки (б)
Figure 3. Computed enterography, anterolateral view. Prestenotic small bowel dilatation up to 3.47 cm (a), stricture of the terminal ileum (б)
Варианты лечения стриктурирующей формы болезни Крона тонкой кишки
В настоящее время стриктуры тонкой кишки при болезни Крона являются основным показанием к операционному лечению [24]. Описаны случаи успешной эндоскопической баллонной дилатации как при первичных стриктурах, так и при стриктурах анастомоза. Однако для выполнения эндоскопической баллонной дилатации стриктура должна быть короткой (не более 5 см), прямой и доступной для колоноскопа [25][26]. Существуют и другие эндоскопические методы, такие как: установка стента, введение стероидов или инъекций ингибиторов фактора некроза опухоли в кишечную стенку, эндоскопическая стриктуротомия с помощью игольчатого ножа. Но они не могут быть рекомендованы для рутинной практики из-за ограниченных данных о ближайших и отдаленных результатах и сложности их выполнения [27–29]. Следует отметить, что сроки выполнения операции имеют большое значение. Раннее удаление стриктурированного участка тонкой кишки приводит к более длительной клинической ремиссии [30], снижению риска повторной операции [31] и снижению общего воздействия стероидов и биологической терапии на организм пациента [32]. Поэтому решение о хирургическом вмешательстве в более ранние сроки после диагностики стриктуры следует рассматривать как приоритетное.
Если операция считается необходимой, возникает вопрос: стриктуропластика или резекция? Стриктуропластика подходит для множественных стриктур. По данным литературы, описано более 15 способов стриктуропластики. Наиболее популярными остаются стриктуропластики по Heineke-Mikulic, Finney и Michelassi. Ту или иную методику применяют при стриктурах различной протяженности. Так, при стриктурах менее 10 см применяют стриктуропластику по Heineke-Mikulic, при стриктурах 10–25 см — стриктуропластику Finney. Нетрадиционные стриктуропластики, такие как стриктуропластика по Michelassi, применяют при более длинных стриктурах до 68 см [33].
Во всех трех видах стриктуропластика предполагает продольный разрез по противобрыжеечному краю, и в зависимости от типа применяется определенный метод наложения швов на стриктурированный участок. Несмотря на то что достоверно измерить протяженность стриктурированного сегмента может быть затруднительно, стриктуропластика не показана пациентам с длинными стриктурами (>68 см). Противопоказания к такого рода операциям включают множественные стриктуры или протяженные стриктуры в коротком сегменте кишки, стриктуры рядом с местом резекции, наличие абсцессов, перфораций, свищей. Стриктуропластика имеет такой же долгосрочный результат, как и резекция стриктурированного участка тонкой кишки, и особенно рекомендуется при множественных стриктурах, предшествующих длинносегментных резекциях, ранних рецидивах, синдроме короткой кишки и у истощенных больных [34].
В большинстве случаев основным методом оперативного лечения стриктурирующей формы болезни Крона остается резекция тонкой кишки с наложением анастомоза либо «конец в конец», либо «бок в бок». Консенсус ECCO по хирургическому лечению болезни Крона на основании нескольких метаанализов высказывается в пользу широкого анастомоза типа «бок в бок», так как диаметр анастомоза при болезни Крона имеет первостепенное значение в контексте прогнозируемых рецидивов стриктуры и фиброза анастомоза [35–37]. Рецидив стриктуры в месте анастомоза возникает у 80–90 % пациентов в течение 3 лет после операции, а от 30 до 40 % пациентам требуется повторная операция после первичной резекции [37]. Как правило, при резекции тонкой кишки на фоне болезни Крона утолщенная воспаленная брыжейка отсекается максимально близко к кишечной стенке из соображений минимизации риска кровотечения [38][39].
Учитывая последние данные о возможном участии брыжейки в патогенезе болезни Крона, операцией выбора представляется противобрыжеечный анастомоз с иссечением пораженного сегмента брыжейки. Частота повторных операций после резекции тонкой кишки с отключенным от брыжейки анастомозом составляет 2,9 % по данным некоторых зарубежных авторов [40][41]. Преимуществом данной методики является ширина анастомоза и его полная изоляция от брыжейки. Многие авторы признают безопасность такого анастомоза, а также значительное снижение случаев рецидива стриктуры и необходимости повторного оперативного лечения [42].
Методика наложения анастомоза заключается в следующем. Брыжейка кишки должна быть мобилизована в пределах пораженного сегмента с сохранением адекватной васкуляризации в зоне анастомоза. Пораженная часть кишки резецируется после прошивания приводящей и отводящей культей сшивающим аппаратом. Культи сшиваются вместе для создания опорного каркаса для размежевания анастомоза и брыжейки. Продольная энтеротомия выполняется с противобрыжеечной стороны, на расстоянии 1 см от линии швов между культями. Затем в поперечном направлении накладывается двухрядный ручной анастомоз по типу «бок в бок». Протяженность энтеротомии позволяет добиться просвета анастомоза приблизительно 7–8 см. В результате получается широкий анастомоз, а непосредственный контакт с брыжейкой отсутствует. Данный хирургический метод, конфигурация анастомоза и разобщение с брыжейкой патофизиологически объясняют весьма низкий процент послеоперационных рецидивов [43].
ЗАКЛЮЧЕНИЕ
Таким образом, современной стратегией лечения стриктурирующей формы болезни Крона тонкой кишки является как можно более раннее выявление стриктуры и резекция стриктурированного участка до развития осложнений. Стоит рассмотреть возможную первичную роль брыжейки в патогенезе заболевания и предпочесть наложение противобрыжеечного широкого анастомоза «бок в бок» с максимальным клиновидным иссечением прилегающей брыжейки с целью разобщения кишки с анастомозом и оставшейся брыжейкой.
Список литературы
1. Ranasinghe I.R., Hsu R. Crohn Disease. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2023 [cited 2023 Feb 20]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK436021/
2. Myrelid P., Soop M., George B.D. Surgical planning in penetrating abdominal Crohn’s disease. Front Surg. 2022;9:867830. DOI: 10.3389/fsurg.2022.867830
3. Hibiya S., Ohtsuka K., Takenaka K., Kawamoto A., Matsuyama Y., Udagawa Y., et al. Mucosal healing of small intestinal stricture is associated with improved prognosis post-dilation in Crohn’s disease. BMC Gastroenterol. 2022;22(1):218. DOI: 10.1186/s12876-022-02300-2
4. 2015 European Society of Coloproctology collaborating group. Risk factors for unfavourable postoperative outcome in patients with Crohn’s disease undergoing right hemicolectomy or ileocaecal resection An international audit by ESCP and S-ECCO. Colorectal Dis. 2017, Sep 15. DOI: 10.1111/codi.13889
5. Li Y., Mohan H., Lan N., Wu X., Zhou W., Gong J., et al. Mesenteric excision surgery or conservative limited resection in Crohn’s disease: study protocol for an international, multicenter, randomized controlled trial. Trials. 2020;21(1):210. DOI: 10.1186/s13063-020-4105-x
6. Головенко О.В., Хомерики С.Г., Иванова Е.В., Федоров Е.Д., Лоранская И.Д., Ситкин С.И. и др. Воспалительные заболевания кишечника. Клинические, эндоскопические, морфологические аспекты диагностики. Принципы современной терапии. М: Прима Принт, 2022.
7. Luglio G., Rispo A., Imperatore N., Giglio M.C., Amendola A., Tropeano F.P., et al. Surgical prevention of anastomotic recurrence by excluding mesentery in Crohn’s disease: The SuPREMe-CD Study — a randomized clinical trial. Ann Surg. 2020;272(2):2107. DOI: 10.1097/SLA.0000000000003821
8. Greuther T., Piller A., Fournier N., Safroneva E., Straumann A., Biedermann L., et al. Upper gastrointestinal involvement in Crohn’s disease: incidence, risk factors and course of the disease. J Crohn’s Colitis. 2018;12(12):1399409. DOI: 10.1093/ecco-jcc/jjy121
9. Desreumaux P., Ernst O., Geboes K., Gambiez L., Berrebi D., MüllerAlouf H., et al. Inflammatory alterations in mesenteric adipose tissue in Crohn’s disease. Gastroenterology. 1999;117(1):73–81. DOI: 10.1016/s0016-5085(99)70552-4
10. Zhang X., Ko H.M., Torres J., Panchal H.J., Cai Z., Wagner M., et al. Luminally polarized mural and vascular remodeling in ileal strictures of Crohn’s disease. Hum Pathol. 2018;79:42–9. DOI: 10.1016/j.humpath.2018.03.004
11. Alfredsson J., Wick M.J. Mechanism of fibrosis and stricture formation in Crohn’s disease. Scand J Immunol. 2020;92(6):e12990. DOI: 10.1111/sji.12990
12. Scheibe K., Kersten C., Schmied A., Vieth M., Primbs T., Carlé B., et al. Inhibiting interleukin 36 receptor signaling reduces fibrosis in mice with chronic intestinal inflammation. Gastroenterology. 2019;156(4):108297.e11. DOI: 10.1053/j.gastro.2018.11.029
13. Chen W., Lu C., Hirota C., Iacucci M., Ghosh S., Gui X. Smooth muscle hyperplasia/hypertrophy is the most prominent histological change in Crohn’s fibrostenosing bowel strictures: a semiquantitative analysis by using a novel histological grading scheme. J Crohns Colitis. 2017;11(1):92 - 104. DOI: 10.1093/ecco-jcc/jjw126
14. Yin Y., Zhu Z.X., Li Z., Chen Y.S., Zhu W.M. Role of mesenteric component in Crohn’s disease: A friend or foe? World J Gastrointest Surg. 2021;13(12):153649. DOI: 10.4240/wjgs.v13.i12.1536
15. Rivera E.D., Coffey J.C., Walsh D., Ehrenpreis E.D. The mesentery, systemic inflammation, and Crohn’s disease. Inflamm Bowel Dis. 2019;25(2):226 - 34. DOI: 10.1093/ibd/izy201
16. Crohn B.B., Ginzburg L., Oppenheimer G.D. Regional ileitis: a pathologic and clinical entity. JAMA. 1932;99(16):1323 - 9. DOI: 10.1001/jama.1932.02740680019005
17. Sheehan A.L., Warren B.F., Gear M.W., Shepherd N.A. Fat-wrapping in Crohn’s disease: pathological basis and relevance to surgical practice. Br J Surg. 1992;79(9):955–8. DOI: 10.1002/bjs.1800790934
18. Sleiman J., Chirra P., Gandhi N.S., Baker M.E., Lu C., Gordon I.O., et al. Crohn’s disease related strictures in cross-sectional imaging: More than meets the eye? United European Gastroenterol J. 2022;10(10):1167 - 78. DOI: 10.1002/ueg2.12326
19. Zhong Y.K., Lu B.L., Huang S.Y., Chen Y.J., Li Z.P., Rimola J., et al. Cross-sectional imaging for assessing intestinal fibrosis in Crohn’s disease. J Dig Dis. 2020;21(6):34250. DOI: 10.1111/1751-2980.12881
20. Демидова А.А., Данилов М.А., Леонтьев А.В., Абдулатипова З.М., Саакян Г.Г. Расширенная резекция брыжейки тонкой кишки при болезни Крона (обзор литературы). Наука молодых (Eruditio Juvenium). 2022;10(2):213 - 24. DOI: 10.23888/HMJ2022102213-224
21. Seastedt K.P., Trencheva K., Michelassi F., Alsaleh D., Milsom J.W., Sonoda T., et al. Accuracy of CT enterography and magnetic resonance enterography imaging to detect lesions preoperatively in patients undergoing surgery for Crohn’s disease. Dis Colon Rectum. 2014;57(12):1364–70. DOI: 10.1097/DCR.0000000000000244
22. Pous-Serrano S., Frasson M., Palasí Giménez R., Sanchez-Jordá G., Pamies-Guilabert J., Llavador Ros M., et al. Accuracy of magnetic resonance enterography in the preoperative assessment of patients with Crohn’s disease of the small bowel. Colorectal Dis. 2017;19(5):O126–33. DOI: 10.1111/codi.13613
23. Taylor S.A., Mallett S., Bhatnagar G., Morris S., Quinn L., Tomini F., et al. Magnetic resonance enterography compared with ultrasonography in newly diagnosed and relapsing Crohn’s disease patients: the METRIC diagnostic accuracy study. Health Technol Assess. 2019;23(42):1–162. DOI: 10.3310/hta23420
24. Rieder F., Zimmermann E.M., Remzi F.H., Sandborn W.J. Crohn’s disease complicated by strictures: a systematic review. Gut. 2013;62(7):1072–84. DOI: 10.1136/gutjnl-2012-304353
25. Bettenworth D., Gustavsson A., Atreja A., Lopez R., Tysk C., van Assche G., et al. A pooled analysis of efficacy, safety, and long-term outcome of endoscopic balloon dilation therapy for patients with stricturing Crohn’s disease. Inflamm Bowel Dis. 2017;23(1):133 - 42. DOI: 10.1097/MIB.0000000000000988
26. Taida T., Nakagawa T., Ohta Y., Hamanaka S., Okimoto K., Saito K., et al. Long-term outcome of endoscopic balloon dilatation for strictures in patients with Crohn’s disease. Digestion. 2018;98(1):26–32. DOI: 10.1159/000486591
27. Lu C., Holubar S.D., Rieder F. How I approach the management of stricturing Crohn’s disease. Am J Gastroenterol. 2019;114(8):1181 - 4. DOI: 10.14309/ajg.0000000000000199
28. Lan N., Shen B. Endoscopic stricturotomy with needle knife in the treatment of strictures from inflammatory bowel disease. Inflamm Bowel Dis. 2017;23(4):50213. DOI: 10.1097/MIB.0000000000001044
29. Navaneethan U., Lourdusamy D. Endoscopic stricturotomy and strictureplasty. Gastrointest Endosc Clin N Am. 2022;32(4):687 - 97. DOI: 10.1016/j.giec.2022.05.002
30. Aratari A., Papi C., Leandro G., Viscido A., Capurso L., Caprilli R. Early versus late surgery for ileo-caecal Crohn’s disease. Aliment Pharmacol Ther. 2007;26(10):1303–12. DOI: 10.1111/j.1365-2036.2007.03515.x
31. Latella G., Cocco A., Angelucci E., Viscido A., Bacci S., Necozione S., et al. Clinical course of Crohn’s disease first diagnosed at surgery for acute abdomen. Dig Liver Dis. 2009;41(4):269–76. DOI: 10.1016/j.dld.2008.09.010
32. Golovics P.A., Lakatos L., Nagy A., Pandur T., Szita I., Balogh M., et al. Is early limited surgery associated with a more benign disease course in Crohn’s disease? World J Gastroenterol. 2013;19(43):7701–10. DOI: 10.3748/wjg.v19.i43.7701
33. Fousekis F.S., Mitselos I.V., Tepelenis K., Pappas-Gogos G., Katsanos K.H., Lianos G.D., et al. Medical, endoscopic and surgical management of stricturing Crohn’s disease: current clinical practice. J Clin Med. 2022;11(9):2366. DOI: 10.3390/jcm11092366
34. Chandrasinghe P. Surgical management of small bowel Crohn’s disease. Front Surg. 2022;9:759668. DOI: 10.3389/fsurg.2022.759668
35. Bemelman W.A., Warusavitarne J., Sampietro G.M., Serclova Z., Zmora O., Luglio G., et al. ECCO-ESCP Consensus on surgery for Crohn’s disease. J Crohns Colitis. 2018;12(1):1–16. DOI: 10.1093/ecco-jcc/jjx061
36. Simillis C., Purkayastha S., Yamamoto T., Strong S.A., Darzi A.W., Tekkis P.P. A meta-analysis comparing conventional end-to-end anastomosis vs. other anastomotic configurations after resection in Crohn’s disease. Dis Colon Rectum. 2007;50(10):1674–87. DOI: 10.1007/s10350-007-9011-8
37. Guo Z., Li Y., Zhu W., Gong J., Li N., Li J. Comparing outcomes between side-to-side anastomosis and other anastomotic configurations after intestinal resection for patients with Crohn’s disease: a meta-analysis. World J Surg. 2013;37(4):893–901. DOI: 10.1007/s00268-013-1928-6
38. Sehgal R., Coffey J.C. Historical development of mesenteric anatomy provides a universally applicable anatomic paradigm for complete/total mesocolic excision. Gastroenterol Rep (Oxf). 2014;2(4):245–50. DOI: 10.1093/gastro/gou046
39. Culligan K., Walsh S., Dunne C., Walsh M., Ryan S., Quondamatteo F., et al. The mesocolon: a histological and electron microscopic characterization of the mesenteric attachment of the colon prior to and after surgical mobilization. Ann Surg. 2014;260(6):1048–56. DOI: 10.1097/SLA.0000000000000323
40. Landerholm K., Reali C., Mortensen N.J., Travis S.P.L., Guy R.J., George B.D. Short- and long-term outcomes of strictureplasty for obstructive Crohn’s disease. Colorectal Dis. 2020;22(9):115968. DOI: 10.1111/codi.15013
41. Coffey C.J., Kiernan M.G., Sahebally S.M., Jarrar A., Burke J.P., Kiely P.A., et al. Inclusion of the mesentery in ileocolic resection for Crohn’s disease is associated with reduced surgical recurrence. J Crohns Colitis. 2018;12(10):1139 - 50. DOI: 10.1093/ecco-jcc/jjx187
42. Luglio G., Kono T. Surgical techniques and risk of postoperative recurrence in CD: a game changer. Inflamm Intest Dis. 2021;7(1):217. DOI: 10.1159/000515372
43. Peltrini R., Greco P.A., Manfreda A., Luglio G., Bucci L. Kono-S anastomosis after intestinal resection for Crohn’s disease. Updates Surg. 2020;72(2):33540. DOI: 10.1007/s13304-019-00700-w
Об авторах
Л. Р. АитоваРоссия
Аитова Лилия Ринатовна — к.м.н., кафедра факультетской хирургии
Уфа
Е. Е. Гришина
Россия
Гришина Елена Евгеньевна — к.м.н., кафедра факультетской хирургии
Уфа
Э. М. Сакаев
Россия
Сакаев Эрнест Маратович — к.м.н., кафедра факультетской хирургии
Уфа
В. С. Щекин
Россия
Щекин Влас Сергеевич — к.м.н., научно-морфологическая лаборатория
Уфа
Рецензия
Для цитирования:
Аитова Л.Р., Гришина Е.Е., Сакаев Э.М., Щекин В.С. Стриктурирующая форма болезни Крона тонкой кишки (обзор литературы). Креативная хирургия и онкология. 2024;14(1):52-59. https://doi.org/10.24060/2076-3093-2024-14-1-52-59
For citation:
Aitova L.R., Grishina E.E., Sakaev E.M., Shchekin V.S. Stricturing Small Bowel Crohn’s Disease (Literature Review). Creative surgery and oncology. 2024;14(1):52-59. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-1-52-59
JATS XML


































